En Çok Okunanlar
Özet
Amaç: Staphylococcus aureus, yaygın metisilin direnci nedeniyle önemli bir sağlık sorunu olmaya devam etmektedir. Bu çalışmada, Ocak 2016-Kasım 2019 tarihleri arasında, laboratuvarımıza gönderilen çeşitli klinik örneklerinden izole edilen S. aureus suşlarının çeşitli antibiyotiklere duyarlılıklarının belirlenmesi amaçlanmıştır.
Yöntemler: Çalışmamızda 100 metisiline dirençli S. aureus (MRSA) ve 100 metisiline duyarlı S. aureus (MSSA) suşunun vankomisin, teikoplanin ve linezolide duyarlılıklarının belirlenmesi için gradyan test şeritleri kullanılmış, diğer antibiyotiklerin duyarlılıkları ise otomatize sistemle belirlenmiş ve Avrupa Antimikrobiyal Duyarlılık Testi Komitesi (The European Committee on Antimicrobial Susceptibility Testing – EUCAST) rehberine göre değerlendirilmiştir
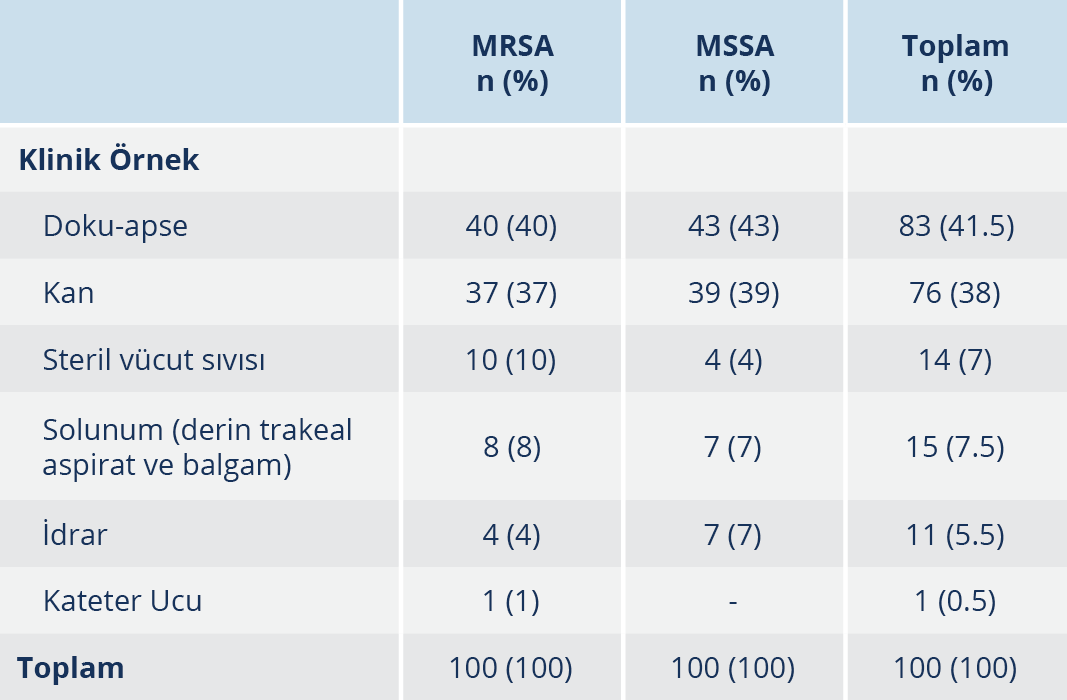
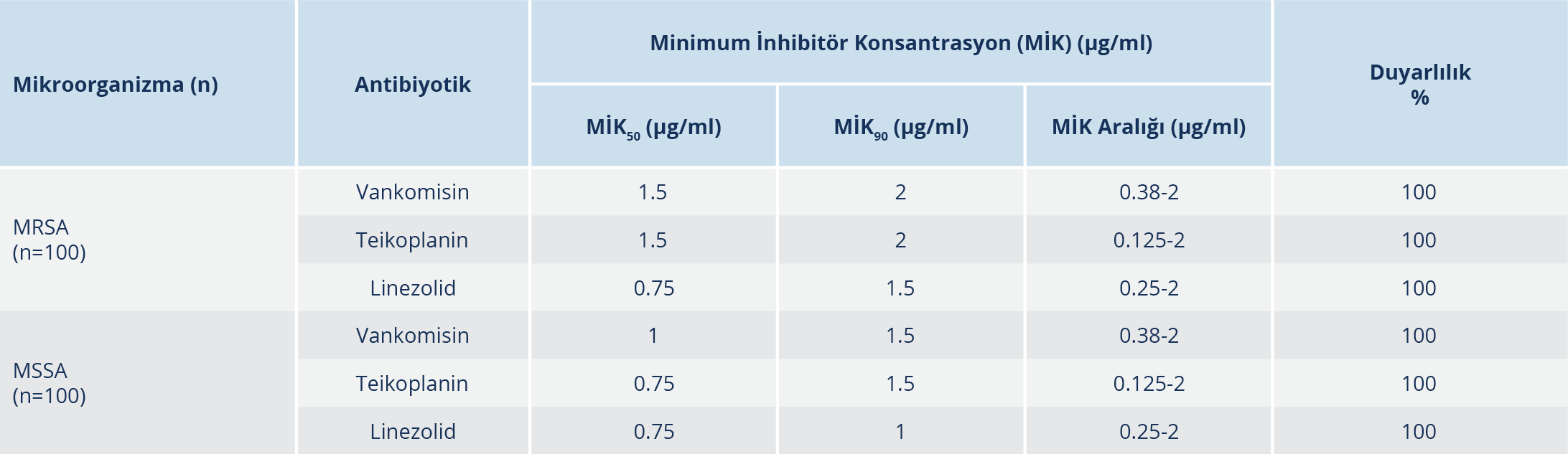
Bulgular: Çalışmaya alınan MRSA suşlarının %75’i yatan, MSSA suşlarının %66’sı yatan hastalara ait örneklerden izole edilmiş olup MRSA suşlarının %40’ı, MSSA suşlarının %21’i yoğun bakım kökenlidir. Suşların izole edildiği klinik örnekler sıklık sırasıyla doku-apse (%41.5), kan (%38), steril vücut sıvısı (%7), derin trakeal aspirat ve balgam (%7.5), idrar (%5.5), kateter ucu (%0.5) örnekleridir. Çalışmamızda vankomisine, teikoplanine ve linezolide dirençli S. aureus suşuna rastlanmamıştır. Vankomisin, teikoplanin ve linezolid için sırasıyla MİK50/MİK90 değerleri, MSSA suşlarında 1/1.5 µg/ml, 0.75/1.5 µg/ml, 0.75/1 µg/ml ve MRSA suşlarında ise 1.5/2 µg/ml, 1.5/2 µg/ml, 0.75/1.5 µg/ml olarak bulunmuştur. MİK90 değerleri esas alındığında MRSA suşlarında linezolid, vankomisine göre 1.3, teikoplanine göre 2 kat daha etkin; MSSA suşlarında ise linezolid, vankomisine ve teikoplanine göre 1.5’ar kat daha etkin bulunmuştur. MRSA suşlarında daptomisin, tigesiklin, kotrimoksazol ve fusidik asid dışındaki tüm ajanlara karşı yüksek direnç oranları saptanmıştır. MSSA suşlarında ise tüm antibiyotiklerin oldukça etkin olduğu izlenmiştir.
Sonuç: Glikopeptidlere karşı MSSA izolatlarının belirlenen MİK değerlerinin, MRSA izolatlarının MİK değerlerine yakın değerlerde saptanması gelecekte direnç gelişimi olasılığının artacağını düşündürmüştür. MİK90 değerlerine göre linezolid glikopeptid ajanlardan daha etkin bulunmuştur. MSSA suşlarında tüm antibiyotikler oldukça etkin iken MRSA suşlarında antibiyotiklerin daha dikkatli kullanılması gerektiği bulunmuştur.
GİRİŞ
Staphylococcus aureus, bakteriyemi, infektif endokardit, deri ve yumuşak doku infeksiyonlarının ve osteoartriküler infeksiyonların başlıca etkeni olup hem toplum kaynaklı hem de hastane kaynaklı infeksiyonlara yol açabilmektedir (1). Bu bakteri modern antibiyotik çağının başından bu yana antistafilokokal ilaçların tümüne karşı ilerleyici bir direnç geliştirme yeteneği sergilemiştir (2,3). Stafilokokların metisilin ve diğer penisilinaza dirençli penisilinlerin kullanımını takiben birçok antimikrobiyale karşı zamanla çoklu ilaç direnci kazanması, stafilokok infeksiyonlarının tedavi seçeneklerini daraltmaktadır (4).
Metisiline dirençli S. aureus (MRSA) suşları, tüm β-laktamlara dirençli olmasının yanı sıra makrolidler, kinolonlar, tetrasiklinler, linkozamidler ve aminoglikozidlere de direnç gösterebilmektedir (5,6). MRSA’nın etken olduğu invazif infeksiyonların tedavisinde glikopeptid grubu antibiyotiklerin, özellikle vankomisinin sık kullanımı sonucunda; vankomisine orta düzeyde duyarlı (VISA), heterojen orta düzeyde duyarlı (hVISA) ve dirençli (VRSA) S. aureus suşlarının ortaya çıktığı bildirilmektedir (7). Diğer yandan, teikoplanin direncinin vankomisine göre daha çabuk geliştiği, disk difüzyon yöntemiyle yeterince saptanamadığı ve dolayısıyla minimal inhibitor konsantrasyonu (MİK) belirlemenin gerekliliği de ortaya çıkmıştır (8).
Oksazolidinon grubunun üyesi olan linezolid, ribozomun 50S alt ünitesine bağlanarak protein sentezinin başlamasını inhibe etmekte ve Gram-pozitif bakterilerin etken olduğu infeksiyonların tedavisinde yaygın olarak kullanılmaktadır (9). Bu yaygın kullanımla birlikte linezolide karşı etkinlik azalması ve/veya direnç gelişimi, buna bağlı olarak da tedavi başarısızlıkları bildirilmektedir (10).
Çalışmamızda özellikle MRSA infeksiyonlarında başlıca tedavi ajanı olan vankomisin, teikoplanin ve linezolidin minimal inhibitör konsantrasyonu (MİK) değerlerinin belirlenmesi, hastanemizin klinik örneklerinden soyutlanan S. aureus izolatlarının antimikrobiyal ajanlara karşı in vitro etkinliklerinin saptanarak hastanemizde S.aureus’un etken olduğu infeksiyonlarda uygulanacak tedavi yaklaşımına yardımcı olunması amaçlanmıştır.
YÖNTEMLER
Ocak 2016-Kasım 2019 tarihleri arasında hastanemizin Tıbbi Mikrobiyoloji Laboratuvarında, yatarak ve ayaktan tedavi edilen hastaların çeşitli klinik örneklerinden izole edilen MRSA ve metisiline duyarlı S. aureus (MSSA) suşları çalışmaya dahil edilmiştir. Örnek sayısı daha fazla olmasına rağmen, gradyan test yöntemi 100 MRSA ve 100 MSSA suşu olmak üzere toplam 200 hastada çalışılabilmiş ve hastaya ait sadece bir suş çalışmaya dahil edilmiştir.
Kan kültürleri BACTEC 9240 (Becton Dickinson Co., Diagnostic Instrument System, Sparks, MD, ABD) tam otomatik kan kültürü cihazında çalışılmıştır. Otomatize kan kültürü cihazında üreme saptanan şişelerden MacConkey agar, çikolatamsı agar ve %5 koyun kanlı agara pasaj yapılmıştır. İdrar, derin trakeal aspirat, balgam, doku-apse, kateter ucu, steril sıvıların kültürleri materyaline göre ve usulüne uygun olarak standart mikrobiyolojik teknikler kullanılarak değerlendirilmiştir (11). Koyun kanlı agarda, S. aureus olduğu düşünülen β-hemoliz oluşturan kolonilerden, katalaz- ve koagülaz-pozitif (Plasmatec, Rapid Latex Test, Birleşik Krallık) olanlar işleme alınmış ve otomatik identifikasyon sistemi (Phoenix™ 100, Becton Dickinson Co., Diagnostic Instrument System, Sparks, MD, ABD) ile kesin tanımlama yapılmıştır. S. aureus suşlarında vankomisin, teikoplanin, linezolid duyarlılıkları, üretici firmanın önerileri doğrultusunda gradyan test şeritleri (E-Test® bioMérieux, Marcy l’Etoile, Fransa) kullanılarak çalışılmıştır. Bu amaçla tüm suşların koyun kanlı agardaki pasajlarından 0.5 McFarland bulanıklığında bakteri süspansiyonları hazırlanmış ve Mueller-Hinton agara (Becton Dickinson Co., Sparks, MD, ABD) yayılarak besiyeri üzerine E-test® şeritleri yerleştirilmiştir. 35°C’de 24 saat inkübasyon sonrasında inhibisyon zonlarının E-test® şeridini kestiği noktadaki MİK değerleri kaydedilmiş; elde edilen MİK değerleri Avrupa Antimikrobiyal Duyarlılık Testi Komitesi (The European Committee on Antimicrobial Susceptibility Testing – EUCAST)’nin Staphylococcus spp. için önerdiği sınır değerler kullanılarak yorumlanmıştır (12). Buna göre, S. aureus için, vankomisin, teikoplanin ve linezolid MİK değerleri sırasıyla, ≤2 µg/ml, ≤2 µg/ml, ≤4 µg/ml olanlar duyarlı, ≥2 µg/ml, ≥2 µg/ml, ≥4 µg/ml olanlar dirençli olarak kabul edilmiştir. Diğer antibiyotiklerin duyarlılıkları otomatize sistemle yapılmış ve EUCAST önerilerine göre değerlendirilmiştir. Kontrol suşu olarak S. aureus ATCC 29213 kullanılmıştır.
BULGULAR
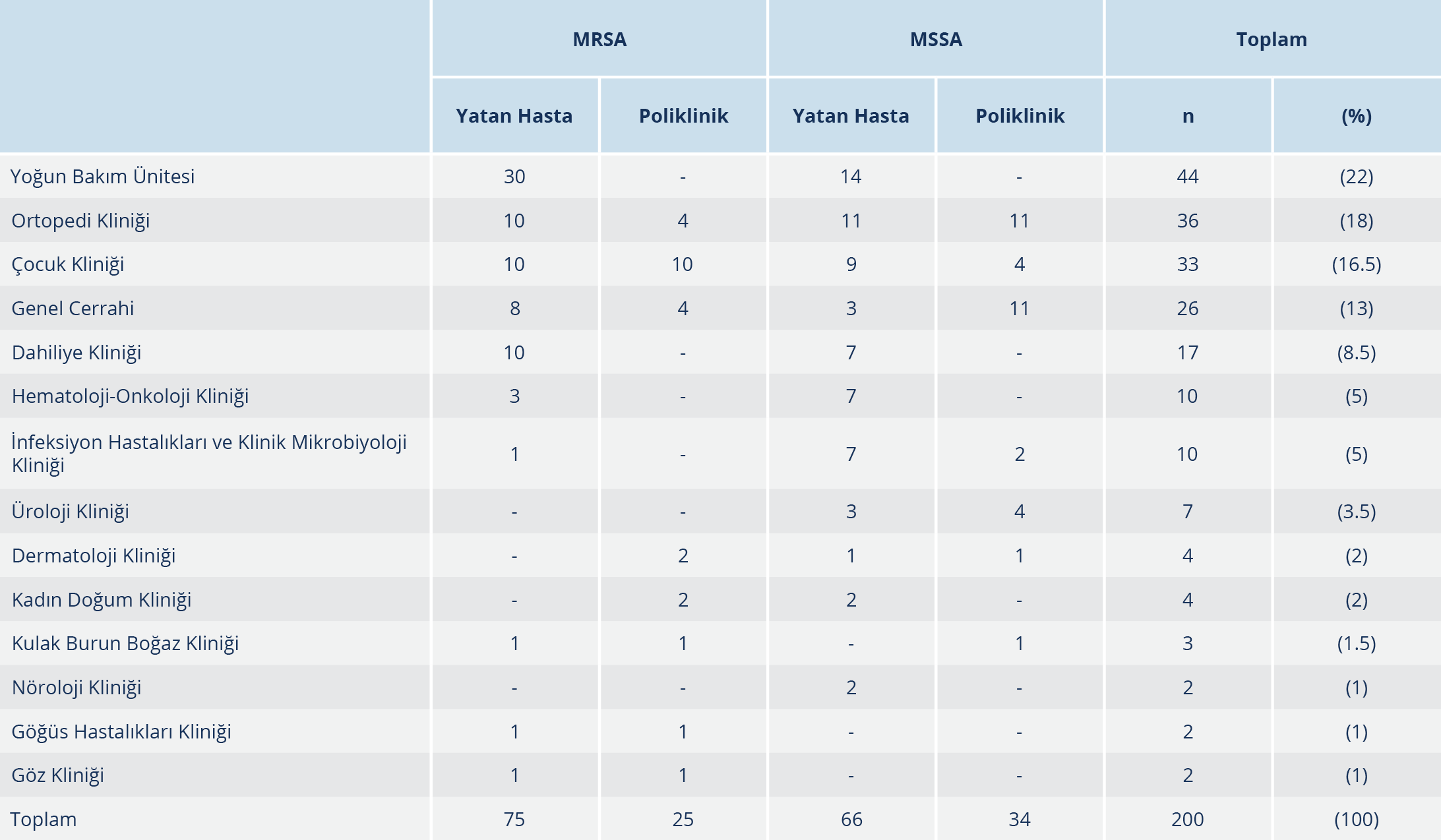
Çalışmaya alınan MRSA suşlarının %75’i ve MSSA suşlarının %66’sı yatan hastalara ait örneklerden izole edilmiştir. MRSA izolatlarının %43’ü kadın, %57’si erkek; MSSA izolatlarının %46’si kadın, %54’ü erkek hastalardan soyutlanmıştır. Klinik örneklerinden MRSA ve MSSA izole edilen kadın hastaların yaş ortalaması sırasıyla 42.78 ile 48.08; erkek hastaların yaş ortalaması 41.50 ile 45.13 olarak saptanmıştır. Çocuk kliniği (%16.5) dışında gelen örnekler erişkin hastalara aittir (Tablo 1). İzolatlar sıklıkla yatan hastalardan izole edilmiş olup MRSA suşlarının %40’ı, MSSA suşlarının ise %21’i yoğun bakım kökenlidir. MRSA ve MSSA suşlarının izole edildikleri bölümlere göre dağılımı Tablo 1’de gösterilmiştir. Kökenlerin izole edildiği örneklerin sıklıkla doku-apse (%41.5) ve kan (%38) örneği olduğu saptanmıştır. MRSA ve MSSA suşlarının izole edildikleri örneklere göre dağılımı Tablo 2’de verilmiştir.
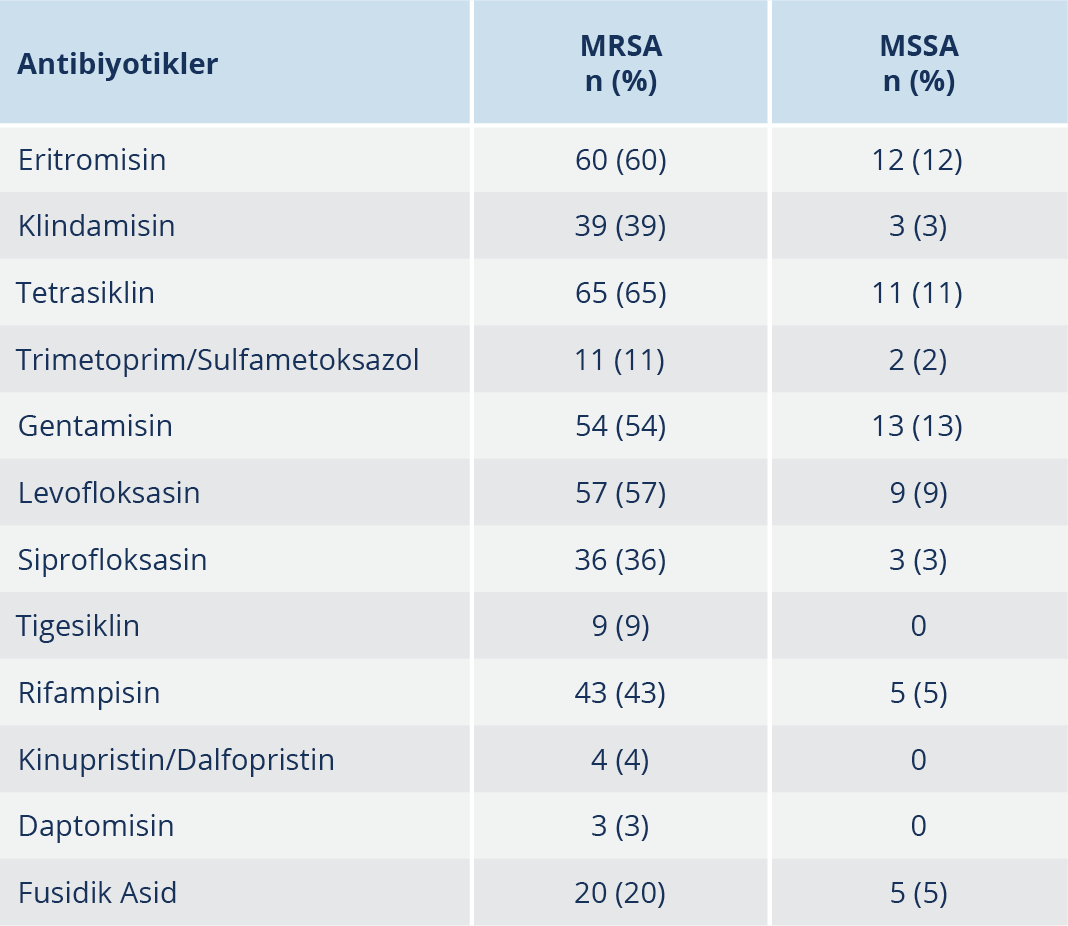
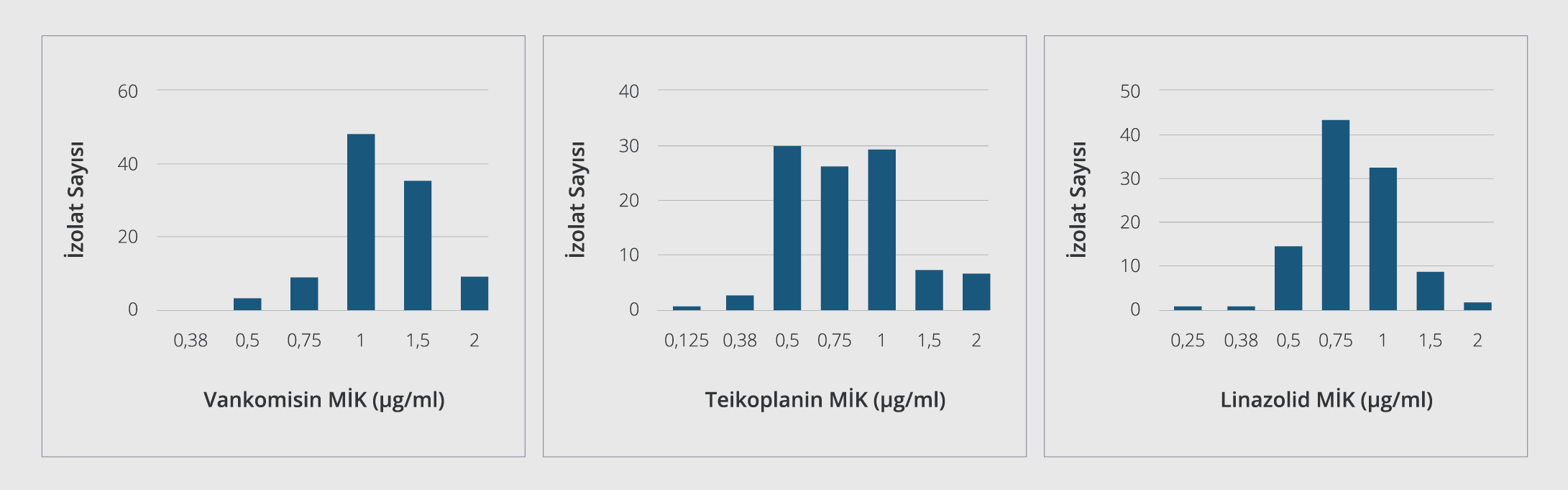
Çalışmamızda gradyan testle vankomisin, teikoplanin ve linezolid dirençli S. aureus suşuna rastlanmamıştır. Otomatize sistemle 7 MRSA izolatında teikoplanin dirençli bulunmuş, ancak gradyan testle duyarlı saptanmıştır. Vankomisin, teikoplanin ve linezolid için MİK50 ve MİK90 değerleri Tablo 3’te belirtilmiştir. MRSA ve MSSA izolatlarının vankomisin, teikoplanin ve linezolid MİK değeri dağılımları Şekil 1 ve Şekil 2’de gösterilmiştir. MİK90 değerleri esas alındığında MRSA suşlarında linezolidin vankomisine göre 1.3, teikoplanine göre 2 kat daha etkin; MSSA suşlarında ise linezolidin vankomisine ve teikoplanine göre 1.5’ar kat daha etkin olduğu bulunmuştur. Diğer antibiyotiklerin etkinliğine bakıldığında (Tablo 4); MRSA suşlarında daptomisin, tigesiklin, kotrimoksazol ve kısmen fusidik asid dışındaki tüm ajanlara karşı yüksek direnç oranları saptanmıştır. MSSA suşlarında ise tüm antibiyotiklerin oldukça etkin olduğu izlenmiştir.
İRDELEME
Günümüzde S. aureus, tüm dünyada başlıca hastane kaynaklı patojenler arasında yer almaktadır. Özellikle de MRSA suşları, MSSA suşlarıyla karşılaştırıldığında daha uzun hastanede yatış süresi ve daha yüksek mortaliteyle seyreden infeksiyonlara yol açmaları sebebiyle önemli bir sorun olmaya devam etmektedir (1). Çalışmamıza dahil edilen S. aureus suşları sıklıkla yatan hastalardan izole edilmiş olup MRSA suşlarının %40’ı, MSSA suşlarının %21’i yoğun bakım kökenlidir. Uzun süreli hastanede yatış, ileri yaş, altta yatan hastalıklar, malignite, önceden antibiyotik kullanımı ve en önemlisi uygulanan invazif işlemler bu bakterilerle gelişen infeksiyonlarda başlıca risk faktörleridir (2). Literatür bilgileriyle uyumlu olarak çalışmamızda S. aureus izolasyonları yatan hastalarda, ayakta hastalara oranla yüksek oranda görülmüş ve girişimsel işlem yapılan servislerde yatan hastalarda daha sıklıkla S. aureus izole edilmiştir. Çalışmamızda ülkemizdeki çalışmalarla benzer şekilde, hem MRSA hem de MSSA suşları en sıklıkla yara (%41.5) ve kan (%8) kaynaklı örneklerden oluşmuştur (13-16).
Metisiline direncin yaygınlaşmasıyla birlikte MRSA’ya bağlı invazif infeksiyonlu hastaların tedavisinde vankomisin sıklıkla kullanılmaya başlamıştır. Buna bağlı olarak son yıllarda dünyanın değişik bölgelerinden ve ülkemizden dirençli izolatların varlığı rapor edilmektedir (5,16,17). Çalışmamızda, MRSA ve MSSA izolatlarında vankomisin direnci saptanmamış olup MİK50, MİK90 değerleri ve MİK aralıkları sırasıyla MRSA için 1.5/2, 0.38-2 µg/ml; MSSA için 1/1.5, 0.38-2 µg/ml şeklinde izlenmiştir. Çelikbilek ve arkadaşları (18)’nın Ankara’dan bildirdikleri çalışmalarında MRSA suşlarında MİK50, MİK90 değerlerini ve MİK aralıklarını vankomisin için 1/1.5 ve 0.25-3.00 µg/ml; Hoşbul ve arkadaşları (4) sırasıyla 1.5/2, 0.5-3 µg/ml şeklinde bildirmişlerdir. Yenişehirli ve arkadaşları (13) Tokat’tan sırasıyla 1.5/1, 0.5-2 şeklinde; Bayındır Bilman ve Çiçek (19) İzmir’den 0.25/0.5, 0.125-1 şeklinde belirlemişlerdir. Çıkman ve arkadaşları (20) çok merkezli çalışmalarında bu oranları 1.5/2, 0.38-4 µg/ml şeklinde saptamışlardır. Çalışmamızda da MİK50/ MİK90 değerleri çok merkezli çalışmalarla benzer ama son yıllarda bildirilen çalışmalardan yüksek bulunmuştur. Ulusal Antimikrobiyal Direnç Sürveyans Sistemi (UAMDSS) 2016 ve Orta Asya ve Avrupa Antimikrobiyal Direnç Sürveyansı (Central Asian and European Surveillance of Antimicrobial Resistance – CAESAR) 2019 verilerinde ülkemizde MRSA suşlarında vankomisin direnci bildirilmemiştir (21,22). MİK50, MİK90 değerleri ve MİK aralıkları farklı bölgelerde, farklı hastanelerde ve farklı zamanlarda farklı bulunabilmektedir. Fakat çalışmamızdan farklı olarak ülkemizde MRSA izolatında %21.3 gibi oranlarda heterojen vankomisine orta duyarlı S. aureus (hVISA) varlığı tespit edilen çalışmalar da bildirilmeye devam etmektedir (23). Bu izolatlarının rutin antimikrobiyal duyarlılık testleriyle belirlenememesi ve vankomisinin oldukça yaygın kullanılması, ülkemizde belirli aralıklarla azalmış vankomisin duyarlılığının araştırılmasını gerekli kılmaktadır (23). Çalışmamızda MSSA izolatlarında saptanan MİK50/MİK90 değerlerinin (1 µg/ml/1.5 µg/ml) MRSA değerlerine yakın bulunması, MİK aralığının MRSA için bulunanlarla eşit saptanması (0.38-2 µg/ml) ve MSSA izolatlarının MİK 1µg/ml ve 1.5 µg/ml değerlerinde yoğunlaşması metisiline duyarlı izolatlarda MİK değerlerinin yükseldiğini göstermektedir. Vankomisin MİK değerleri yüksek suşlarla infekte hastaların tedavi başarılarının düşük olduğu ve mortalitenin yükseldiği bilinmektedir. Ayrıca VISA suşlarının vankomisin tedavisi sırasında ortaya çıkabildiği unutulmamalıdır (13). Vankomisin MİK değerlerinde saptanan yükselmenin hastanemiz için gelecekte sorun olabileceği düşünülmektedir.
Teikoplanin, etki mekanizması olarak vankomisine benzemesi ve düşük yan etki göstermesiyle vankomisine alternatif olarak kullanılan bir glikopeptiddir. MRSA tedavisinde uzun süreli kullanım durumunda teikoplanine direnç gelişebildiğine dair yayınlar vardır (8). Çalışmamızda ülkemiz sürveyans verileriyle uyumlu olarak teikoplanine direnç saptanmamıştır (22). Teikoplanin MİK50, MİK90 değerleri ve MİK aralıkları sırasıyla MRSA için 1.5/2, 0.125-2 µg/ml; MSSA için 0.75/1.5, 0.125-2 µg/ml saptanmıştır. Bu değerler Yenişehirli ve arkadaşları (13)’nın çalışmalarıyla benzer bulunurken Çelikbilek ve arkadaşları (18), Hoşbul ve arkadaşları (4) ve Çıkman ve arkadaşları (20)’nın çalışmalarından düşük bulunmuştur. Bu değerler hastanemizde teikoplaninin vankomisine nazaran daha az kullanılmasına bağlı olabileceğiyle ilişkilendirilmiştir.
Linezolid, özellikle MRSA kaynaklı deri ve yumuşak doku infeksiyonlarının ve toplum/hastane kökenli pnömoni infeksiyonlarının tedavisinde farklı etki mekanizmasıyla, kısa süreli güvenli kullanımıyla vankomisin direncinin artmasını engelleme amacıyla kullanılabilen bir ajandır (15). Her ne kadar günümüzde yurtdışındaki bazı çalışmalarda linezolide dirençli MRSA suşları gösterilmişse de (24), ülkemizde ve bizim çalışmamızda MRSA suşlarında linezolid direncine rastlanmamıştır (10,15,21). Çalışmamızda linezolid MİK50/MİK90 değerleri MRSA için 0.75/1.5 µg/ml, MSSA için 0.75/1 µg/ml; MİK değer aralıkları 0.25-2 µg/ml olarak bulunmuştur. Ülkemizden bildirilen 2011 yılındaki çalışmada (18) bulunan MİK50/MİK90 değerleri oldukça düşük iken yıllar içerisinde bildirilen çalışmalarda bu değerlerin değişen oranlarda ama daha yüksek bulunduğu, MİK aralığının ise değişebildiği gözlemlenmiştir (4,13,20). Çalışmamızda MRSA ve MSSA’larda aynı MİK aralığının saptanması ve MSSA izolatlarının MRSA izolatlarında olduğu gibi aynı MİK değerlerinde yoğunlaşması, izolatlarımızın linezolid MİK artışının metisilin direncinden bağımsız olarak yükselebildiğini düşündürmüştür. Ülkemizdeki çeşitli çalışmalarda çalışmamıza benzer şekilde linezolid direnci saptanmamıştır (13,20,25,26). Ulusal sürveyans verilerimizde ve CAESAR 2019 verilerinde de ülkemizde MRSA suşlarında linezolid direnci bildirilmemiştir (21,22). Amerika Birleşik Devletleri (ABD)’nde gerçekleştirilen geniş çaplı bir sürveyans çalışmasında MSSA suşlarında linezolid direncine rastlanmazken MRSA suşlarında %0.1 oranında direnç tespit edilmiştir (27). Avrupa Antimikrobiyal Direnç Sürveyans Ağı (European Antimicrobial Resistance Surveillance Network – EARS-Net) 2015 raporunda Avrupa ülkelerinde de benzer şekilde S. aureus suşlarında linezolid direnci %0.1 olarak bildirilmiştir (28).
Daptomisin, hem üreme fazındaki, hem de durağan fazdaki Gram-pozitif bakterilere etkili siklik bir lipopeptiddir (18). Çalışmamızda MRSA izolatlarında daptomisin direnci %3 ve kinupristin/dalfopristin direnci %4 olarak saptanmış, glikopeptidler ve linezolidden sonraki en etkili antibiyotikler olarak tespit edilmişlerdir. Uluslararası çalışmalarda daptomisin direncine bağlı tedavi başarısızlığı bildirilmeye başlamıştır (29). Yenişehirli ve arkadaşları, daptomisine direnci %2 olarak bildirirken diğer çalışmalarda direnç bildirilmemiştir (18,20,30,31). Ülkemizde klinik kullanımı olmayan kinupristin/dalfopristin direncine rastlanmamıştır (13,15,20).
Çalışmamızda kotrimoksazol direnç oranları MRSA izolatlarında %11, MSSA izolatlarında %2 olarak tespit edilmiştir. Ülkemizde yapılan farklı çalışmalarda MRSA için %4-74, MSSA için %1-89 arasında bildirilmiştir (25,26,30,32). MRSA izolatları için bile saptanan düşük oranlardaki direnç, yaşamsal risk taşımayan S. aureus infeksiyonlarının ampirik tedavisinde kotrimoksazolün alternatif bir antibiyotik olarak kullanılabileceğini göstermektedir.
Fusidik asid, S. aureus’ların etken olduğu özellikle deri, yumuşak doku, kemik ve eklem infeksiyonlarında glikopeptidlere alternatif olarak kullanılabilen bir antibiyotiktir (26). Ülkemizde yapılan çalışmalarda, fusidik asid direnci MRSA izolatları için %3-20, MSSA için %3-7 arasında bildirilmiştir (15,26,30). Çalışmamızda saptanan fusidik asid direnci MRSA suşlarında %20 ile ülkemiz çalışmalarından daha yüksek iken, MSSA suşlarında %5 ile benzer bulunmuştur. Bu nedenle glikopeptid direncinin önlenmesi için kullanılan fusidik asidin MRSA infeksiyonlarında daha dikkatli kullanılması gerektiği sonucuna varılmıştır.
“Tigecycline Evaluation and Surveillance Trial” (TEST) çalışmasında tigesiklinin hem Gram-pozitif hem de Gram-negatif bakteriler için çok yüksek antibakteriyel etkiye sahip olduğu bildirilmiştir (33). Çalışmamızda MSSA suşlarında tigesikline direnç saptanmazken MRSA suşlarında %9 direnç saptanmıştır. Ülkemizde tigesiklinin kullanıma girdiği ilk yıllarda, hastalarda kullanım söz konusu olmadığı durumlarda da direnç bildirimi olmuştur (31). Son yıllardaki çalışmalarda, direnç saptanmayan çalışmalar olmakla birlikte farklı oranlarda direnç bildirilen çalışmalarda mevcuttur (5,14,30,34). Çalışmamızdaki yüksek tigesiklin direnci, bu ajanın hastanemizdeki kullanımında dikkatli olunması gerektiğini göstermektedir.
Kinolonlar geniş antibakteriyel spektrumları, gastrointestinal sistemden iyi emilimi ve iyi doku dağılımı nedeniyle geniş bir kullanım alanına sahiptir (25). Çalışmamızda MRSA suşlarında siprofloksasin ve levofloksasin direnci %36 ve %57, MSSA suşlarında ise %3 ve %9 olarak bulunmuştur. Ülkemizde yapılan farklı çalışmalarda siprofloksasin direnci MRSA suşlarında %35-70, MSSA suşlarında %4-7 olarak bildirilmiştir (15,25,26). MRSA suşlarında ulusal sürveyans verilerimizde %14.5, CAESAR 2019 verilerinde ise ülkemizde %14 florokinolon direnci bildirilmiştir (21,22). Hastanemizde kinolonlar MSSA izolatlarında iyi bir alternatif iken MRSA izolatlarında oldukça dirençli bulunduğundan kullanılması önerilmemektedir. Ayrıca çalışmamızdaki MRSA izolatlarında gentamisin, rifampisin, eritromisin, klindamisin ve tetrasikline karşı oldukça yüksek direnç oranları saptanması nedeniyle bu suşlarda kullanılması önerilmemekte, MSSA suşlarında ise bu ajanlar hâlâ iyi bir alternatif olarak gözükmektedir.
Sonuç olarak, çalışmamızda vankomisin, teikoplanin, linezolide karşı MRSA ve MSSA izolatlarında direnç saptanmamıştır. Ancak, MSSA izolatlarının glikopeptidlere karşı belirlenen MİK değerlerinin, MRSA izolatlarının MİK değerlerine yakın değerlerde saptanması gelecekte direnç gelişimi olasılığının artacağını düşündürmüş, MİK değerlerinin düzenli olarak takip edilmesinin gerekliliğini göstermiştir. Linezolid MİK90 değerlerine göre glikopeptid ajanlardan daha etkin bulunmuştur. Ancak linezolide karşı MİK yükselmesine dikkat edilmesi gerekmektedir. Ayrıca diğer antibiyotikler MSSA suşlarında oldukça etkin iken MRSA suşlarında daha dikkatli kullanılması gerektiği düşünülmektedir. Otomatize sistemlerle glikopeptid veya linezolide dirençli saptanan S. aureus izolatları mutlaka referans bir yöntemle doğrulanmalıdır. Gerekli infeksiyon kontrol önlemleriyle birlikte hastane direnç profillerinin düzenli olarak takip edilmesi, tedavi seçeneklerinin güncellenmesi ve hastanelerin kısıtlı antibiyotik kullanım politikalarının daha sıkı uygulanması vurgulanmaktadır.
Çıkar çatışması
Yazarlar, herhangi bir çıkar çatışması bildirmemiştir.
Referanslar
- Lakhundi S, Zhang K. Methicillin-resistant Staphylococcus aureus: Molecular characterization, evolution, and epidemiology. Clin Microbiol Rev. 2018; 31(4): e00020-18.
- David MZ, Daum RS. Community-associated methicillin-resistant Staphylococcus aureus: Epidemiology and clinical consequences of an emerging epidemic. Clin Microbiol Rev. 2010; 23(3): 616-87.
- Uzun B, Karataş Şener AG, Güngör S, Afşar İ, Yüksel Ergin Ö, Demirci M. Staphylococcus aureus suşlarındaki metisilin direncinin belirlenmesinde sefoksitin disk difüzyon testi, otomatize sistem ve kromojenik besiyerinin karşılaştırılması. Mikrobiyol Bül. 2013; 47(1): 11-8.
- Hoşbul T, Bektöre B, Yalçın B, Selek B, Özyurt M. Yatan hastalardan izole edilen MRSA suşlarında vankomisin, teikoplanin ve linezolid antibiyotiklerin minimum inhibitör konsantrasyonu değerlerinin E-test yöntemi ile araştırılması. 2012; 17(2): 68-74.
- Öksüz L, Gürler N. Susceptibility of clinical methicillin-resistant Staphylococci isolates to new antibiotics. J Infect Dev Ctries. 2013; 7(11): 825-31.
- Uzun B, Güngör S, Pektaş B, et al. Klinik stafilokok izolatlarında makrolid-linkozamid-streptogramin B (MLSB) direnç fenotipleri ve telitromisin etkinliğinin araştırılması. Mikrobiyol Bül. 2014; 48(3): 469-76.
- Tarai B, Das P, Kumar D. Recurrent challenges for clinicians: emergence of methicillin-resistant Staphylococcus aureus, vancomycin resistance, and current treatment options. J Lab Physicians. 2013; 5(2): 71-8.
- Cepeda J, Hayman S, Whitehouse T, et al. Teicoplanin resistance in methicillin-resistant Staphylococcus aureus in intensive care unit. J Antimicrob Chemother. 2003; 52(3): 533-4.
- Park HJ, Kim SH, Kim MJ, et al. Efficacy of linezolid-based salvage therapy compared with glycopeptide-based therapy in patients with persistent methicillin-resistant Staphylococcus aureus bacteremia. J Infect. 2012; 65(6): 505-12.
- Baysallar M, Kilic A, Aydogan H, Cilli F, Doganci L. Linezolid and quinupristin/dalfopristin resistance in vancomycin-resistant enterococci and methicillin-resistant Staphylococcus aureus prior to clinical use in Turkey. Int J Antimicrob Agents. 2004; 23(5): 510-2.
- Isenberg HD, Garcia LS, eds. Clinical Microbiology Procedures Handbook. 3rd ed. Washington, DC: ASM Press, 2010.
- European Committee on Antimicrobial Susceptibility Testing. Breakpoint tables for interpretation of MICs and zone diameters. Version 6.0 [İnternet]. Basel, Switzerland: EUCAST [erişim 1 Ocak 2021]. http://www.eucast.org/clinical_breakpoints/.
- Yenişehirli G, Yenişehirli A, Bulut Y, Bulut N. Metisiline dirençli Staphylococcus aureus izolatlarının vankomisin, teikoplanin, linezolid, kinupristin-dalfopristin ve daptomisine in vitro duyarlılıkları. Ankem Derg. 2015; 29(1): 21-5.
- Küçükateş E, Gültekin N. Yoğun bakım ünitelerinde yatan hastalardan elde edilen Metisiline dirençli Staphylococcus aureus suşlarında tigesiklin etkinliğinin araştırılması. Haseki Tıp Bülteni. 2017; 55(1): 52-5.
- Coşkun MV, Alper Y, Uyanık MH, Yazgı H. Metisiline dirençli Staphylococcus aureus suşlarının fusidik asid ve diğer β-laktam dışı antibiyotiklere duyarlılığı. Klimik Derg. 2019; 32(1): 52-6.
- Dilworth TJ, Sliwinski J, Ryan K, Dodd M, Mercier RC. Evaluation of vancomycin in combination with piperacillin-tazobactam or oxacillin against clinical methicillin-resistant Staphylococcus aureus isolates and vancomycin-intermediate S. aureus isolates in vitro. Antimicrob Agents Chemother. 2014; 58(2): 1028-33.
- Gardete S, Tomasz A. Mechanisms of vancomycin resistance in Staphylococcus aureus. J Clin Invest. 2014; 124(7): 2836-40.
- Çelikbilek N, Özdem B, Gürelik FÇ, Güvenman S, Güner HR, Açıkgöz ZC. Metisiline dirençli Staphylococcus aureus izolatlarının vankomisin, teikoplanin, linezolid ve daptomisine in vitro duyarlılıkları. Mikrobiyol Bül. 2011; 45(3): 512-8.
- Bayındır Bilman F, Çiçek B. Kan kültürlerinden izole edilmiş metisiline dirençli Staphylococcus aureus ve koagülaz negatif stafilakok suşlarının seftarolin, linezolid ve vankomisin in vitro duyarlılığının değerlendirilmesi. Türk Mikrobiyol Cem Derg. 2019; 49(1): 35-40.
- Çıkman A, Aydın M, Gülhan B, et al. Metisiline dirençli Staphylococcus aureus izolatlarının antibiyotik direnci ve azalmış vankomisin duyarlılığının araştırılması: Çok merkezli bir çalışma. Mikrobiyol Bül. 2015; 49(2): 240-8.
- Central Asian and European Surveillance of Antimicrobial Resistance Annual Report 2019 [İnternet]. Geneva: World Health Organization [erişim 1 Ocak 2021]. https://www.euro.who.int/__data/assets/pdf_file/0003/418863/53373-WHO-CAESAR-annual-report-2019.pdf.
- Ulusal Antimikrobiyal Direnç Sürveyans Sistemi 2016 Yıllık Raporu [İnternet]. Ankara: T.C. Sağlık Bakanlığı Türkiye Halk Sağlığı Kurumu [erişim 1 Ocak 2021]. https://hsgm.saglik.gov.tr/depo/birimler/Mikrobiyoloji_Referans_Laboratuvarlari_ve_Biyolojik_Urunler_DB/uamdss/yillik_raporlar/UAMDSS_2016_Rapor.pdf
- Mirza HC, Sancak B, Gür D. The prevalence of vancomycin-intermediate Staphylococcus aureus and heterogeneous VISA Among methicillin-resistant strains isolated from pediatric population in a Turkish university hospital. Microb Drug Resist. 2015; 21(5): 537-44.
- Antonelli A, D’Andrea MM, Galano A, et al. Linezolid-resistant cfr-positive MRSA, Italy. J Antimicrob Chemother. 2016; 71(8): 2349-51.
- Güngör S, Karaayak Uzun B, Gül Yurtsever S, Baran N. Kan kültürlerinden izole edilen Staphyloccocus aureus suşlarında antibiyotiklere direnç. Ankem Derg. 2012; 26(4): 171-5.
- Arıcı N, Aksaray S. Klinik örneklerden izole edilen Staphylococcus aureus suşlarının metisilin direncinin belirlenmesi ve antibiyotik duyarlılıklarının araştırılması. Ankem Derg. 2019; 33(2): 70-6.
- Flamm RK, Mendes RE, Hogan PA, Streit JM, Ross JE, Jones RN. Linezolid surveillance results for the United States (LEADER Surveillance Program 2014). Antimicrob Agents Chemother. 2016; 60(4): 2273-80.
- European Centre for Disease Prevention and Control. Surveillance Report: Antimicrobial resistance surveillance in Europe 2015. Annual Report of the European Antimicrobial Resistance Surveillance Network (EARS-Net) [İnternet]. Stockholm: ECDC [erişim 1 Ocak 2021]. https://www.ecdc.europa.eu/sites/default/files/media/en/publications/Publications/antimicrobial-resistance-europe-2015.pdf.
- van Hal SJ, Paterson DL, Gosbell IB. Emergence of daptomycin resistance following vancomycin-unresponsive Staphylococcus aureus bacteraemia in a daptomycin-naïve patient–a review of the literature. Eur J Clin Microbiol Infect Dis. 2011; 30(5): 603-10.
- Özel Y, Büyükzengin KB, Yavuz MT. Klinik örneklerden izole edilen metisiline dirençli ve duyarlı Staphylococcus aureus suşlarının antibiyotik direnç profilinin araştırılması. Ankem Derg. 2017; 31(2): 41-7.
- Öksüz L, Gürler N. Klinik örneklerden izole edilen metisiline dirençli stafilokok suşlarının son yıllarda kullanıma giren antibiyotiklere in-vitro duyarlılık sonuçları. Ankem Derg 2009; 23(2): 71-7.
- Yüksekkaya Ş, Opuş A, İren Güvenç H, et al. 2009-2013 yılları arasında Konya Eğitim ve Araştırma Hastanesi’nde kan kültüründen izole edilen Staphylococcus aureus suşlarının antimikrobiyal ajanlara duyarlılıklarının değerlendirilmesi. Ankem Derg. 2017; 31(1): 1-6.
- Bouchillon SK, Iredell JR, Barkham T, Lee K, Dowzicky MJ. Comparative in vitro activity of tigecycline and other antimicrobials against Gram-negative and Gram-positive organisms collected from the Asia-Pacific Rim as part of the Tigecycline Evaluation and Surveillance Trial (TEST). Int J Antimicrob Agents. 2009; 33(2): 130-6.
- Cesur S, Irmak H, Şimşek H, et al. Türkiye’de yedi ildeki hastanelerin yoğun bakım ünitelerinden izole edilen MRSA suşlarında VISA-VRSA araştırılması ve antibiyotik duyarlılık durumlarının saptanması. Mikrobiyol Bül. 2012; 46(3): 352-8.