En Çok Okunanlar
Özet
Amaç: Pseudomonas aeruginosa, hastane infeksiyonlarında en sık görülen ve çoklu direnç geliştirebilen fırsatçı patojenlerden biridir. Kuzey Kıbrıs’ta son yıllarda izlenen antibiyotik direnç oranlarıyla ilgili veriler çok kısıtlıdır. Bu çalışmada, klinik örneklerden izole edilen P. aeruginosa suşlarının antibiyotik direnç profillerinin belirlenmesi ve antibiyotik kullanım politikalarına katkıda bulunulması amaçlanmıştır.
Yöntemler: Eylül 2016-Ekim 2019 tarihleri arasında Mikrobiyoloji Laboratuvarına çeşitli kliniklerden gönderilen toplam 504 P. aeruginosa suşu retrospektif olarak incelenmiştir. Laboratuvarımıza gönderilen örneklerin, %5 koyun kanlı agar ve “eosin-methylene blue” agara ekimi yapılmıştır. Bakteri tanımlaması ve antibiyotik duyarlılık testleri için BD Phoenix™ 100 (Becton Dickinson Co., Sparks, Maryland, ABD) otomatik bakteri tanımlama sistemi kullanılmıştır. Antimikrobiyal duyarlılıkları “European Committee on Antimicrobial Susceptibility Testing” (EUCAST) standartlarına göre saptanmıştır.
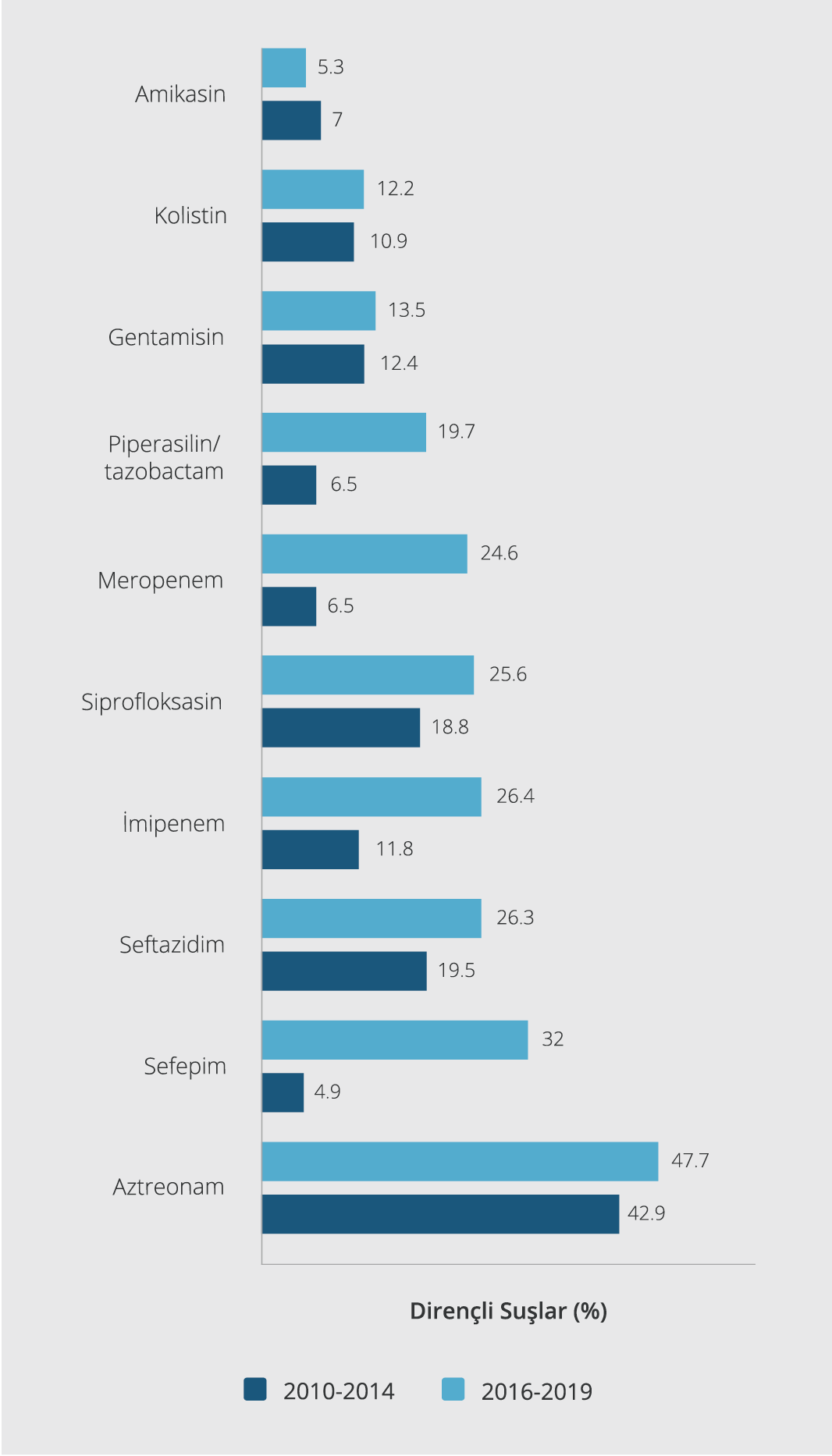
Bulgular: İzole edilen P. aeruginosa suşlarının %37.3, %17.9, %17.9 oranlarında sırasıyla idrar, derin trakeal aspirat ve apse/yara materyali örneklerinden izole edildiği görülmüştür. Bölümlere göre en sık (%35.9) yoğun bakım servisinden gönderilen örneklerde saptanmıştır. P. aeruginosa infeksiyonu en fazla >65 yaş grubunda (%49.6) ve yatan hastalarda (%70.8) izlenmiştir. Antibiyotiklere direnç oranları; aztreonam için %47.7, sefepim için %32, seftazidim için %26.3, imipenem için %26.4, siprofloksasin için %25.6, meropenem için %24.6, piperasilin-tazobaktam için %19.7, gentamisin için %13.5, kolistin için %12.2 ve amikasin için %5.3 olarak tespit edilmiş, çoklu ilaç direnç oranı %19.2 olarak belirlenmiştir. Hastanemizin 2010-2014 verileriyle karşılaştırıldığında, ülkemizde son üç yılda P. aeruginosa suşlarında sefepim, seftazidim, siprofloksasin, piperasilin-tazobaktam ve karbapenem direncinde önemli bir artış gözlenmiştir.
Sonuçlar: Çalışmamızda en yüksek direnç aztreonam ve sefepime karşı saptanırken, en duyarlı antibiyotikler kolistin ve amikasin olarak tespit edilmiştir. Hastanemizde elde edilen sonuçların infeksiyonların ampirik tedavisine ve akılcı antibiyotik kullanım politikalarının oluşturulmasına katkı sağlayacağını düşünmekteyiz.
GİRİŞ
Bakterilerin antibiyotiklere direnç geliştirmesi son yıllarda dünya çapında morbidite ve mortaliteyi artıran ciddi bir sorun haline gelmiştir (1). Pseudomonas aeruginosa, özellikle hastane kaynaklı infeksiyonlarda ve geniş spektrumlu antibiyotik kullanımının, invazif uygulamaların ve hasta-sağlık personelinin temas sıklığının daha çok olduğu yoğun bakım ünitelerinde önemli bir tehdit etkeni olarak görülmektedir (2). İnsan flora elemanlarından biri olan P. aeruginosa, bağışıklık sistemi baskılanmış hastalarda üriner sistem, solunum sistemi, yanık, göz ve yara infeksiyonlarına neden olabilen fırsatçı bir patojendir. P. aeruginosa dünya genelinde nozokomiyal infeksiyonların %10-15’inden sorumludur (3). Dünya Sağlık Örgütü (DSÖ) tarafından 2017 yılında yayınlanan raporda, insan sağlığını tehdit eden ve tedavide yeni antibiyotiklere ihtiyaç duyulan en kritik patojenler listesinin başında karbapeneme dirençli P. aeruginosa olduğu vurgulanmıştır (4).
P. aeruginosa birçok antibiyotiğe doğal olarak dirençlidir. Bunun yanı sıra hem toplum hem de hastanelerde yanlış ve uygun olmayan antibiyotik kullanımı, direnç gelişimini artırmakta, hastanelerdeki yoğun antibiyotik baskısıyla birlikte dirençli suşların ortaya çıkmasına ve yayılmasına neden olmaktadır (5). Duyarlı izolatların tedavi sonrasında direnç kazanması ve P. aeruginosa suşlarında çoklu ilaç direnci (ÇİD) gelişmesi infeksiyonların tedavisini gittikçe zorlaştırmaktadır. Antipsödomonal penisilinler ve sefalosporinler, aminoglikozidler, florokinolonlar ve karbapenemler gibi sınırlı sayıdaki antibiyotiğin P. aeruginosa’ya etkili olması nedeniyle, bu ilaçlara karşı gelişen direnç oranlarının takibi ve kontrolü önem taşımaktadır. P. aeruginosa suşlarının duyarlılık oranları farklı ülkeler, bölgeler, hastaneler, hatta farklı hastane servisleri arasında farklılık göstermektedir (6). Bu nedenle direnç paternlerinin rutin olarak takip edilmesi ve tedavilerin yerel epidemiyolojik veriler ışığında antibiyotik duyarlılık testleri yapılarak uygulanması gerekmektedir. Özellikle ampirik tedavi verilmesi gereken durumlarda, bölge veya hastanede yapılmış direnç dağılımı çalışmalarının dikkate alınmasının tedavinin başarısında rol oynadığı bilinmektedir.
Kuzey Kıbrıs’ta hastane ve toplum kökenli bakteriyel patojenlerin antibiyotik direnç profilleri hakkında çok az veri bulunmaktadır. Ülke çapında aktif sürveyans çalışmaları yapılmadığından bölge ve hastane bazında dirençli bakteri prevalansı bilinmemekle birlikte, toplumda sirküle eden suşlar ve bu suşların taşıdığı direnç genleri henüz karakterize edilmemiştir. P. aeruginosa tedavisinde kullanılan antimikrobiyal ajanlara karşı oluşan direnç gelişimiyle ilgili bilgilerin güncellenmesi yönünden yeni verilere ihtiyaç duyulmaktadır. Bu çalışmada, Kuzey Kıbrıs’ta bulunan bir hastanenin Mikrobiyoloji Laboratuvarına, Eylül 2016-Ekim 2019 tarihleri arasında çeşitli poliklinik ve kliniklerden gönderilen örneklerden izole edilen P. aeruginosa suşlarının, kullanılan antibiyotiklere direnç oranlarının tespit edilmesi ve bu konudaki literatüre ve ampirik tedavi modelleri oluşturulmasına katkıda bulunulması amaçlanmıştır.
YÖNTEMLER
Çalışmamızda, hastanemizin Mikrobiyoloji Laboratuvarında Eylül 2016-Ekim 2019 tarihleri arasında çeşitli klinik numunelerden izole edilen 504 P. aeruginosa suşu retrospektif olarak değerlendirmeye alınmıştır. Laboratuvarımıza gelen örnekler rutin olarak kanlı ve “eosin methylene blue” (EMB) agara ekilmiş ve aerobik ortamda 24-48 saat 35-37°C’de inkübe edilmiştir. Üreme gözlenen örneklerin identifikasyon ve antibiyotik duyarlılık testleri BD Phoenix™ 100 (BD Diagnostic Instrument Systems, Becton Dickinson Co., Sparks, Maryland, ABD) tam otomatize bakteri tanımlama sistemi tarafından, “European Committee on Antimicrobial Susceptibility Testing” (EUCAST) kriterlerine göre belirlenmiştir. Besiyerlerinde üreyen suşlardan üretici firmanın önerileri doğrultusunda 0.45-0.55 McFarland süspansiyonları hazırlanıp, Phoenix NMIC/ID-400 ve UNMIC/ID-401 panellerinde çalışılmıştır. İzole edilen P. aeruginosa suşlarında amikasin, aztreonam, sefepim, seftazidim, siprofloksasin, gentamisin, kolistin, imipenem, meropenem ve piperasilin/tazobaktam antibiyotik duyarlılıkları dikkate alınmıştır. Orta duyarlı olarak belirlenen izolatlar dirençli olarak kabul edilmiştir. Aynı hastaya ait tekrarlayan izolatlar çalışma dışı tutulmuştur.
P. aeruginosa suşları başta yıllar olmak üzere, geldiği hastane servis/polikliniği, örnek türü, başvuru türü (yatan/ayaktan), cinsiyet ve yaş gibi demografik özellikler kullanılarak kıyaslanmıştır. İstatistiksel analizler SPSS for Windows. Version 15.0 (Statistical Package for the Social Sciences, SPSS Inc., Chicago, IL, ABD) programıyla Pearson χ2 testi kullanılarak yapılmıştır. Kullanılan testler için p<0.05 değeri istatistiksel olarak anlamlı kabul edilmiştir. 2016-2019 yılları için elde edilen antimikrobiyal direnç verileri, 2010-2014 yılları arasında hastanemizde elde edilen verilerle (7) karşılaştırılmıştır.
BULGULAR
Çeşitli kültür örneklerinden (idrar, balgam, derin trakeal aspirat, kan, kateter ucu, apse/yara materyali, beyin omurilik sıvısı, bronş lavaj, üretral akıntı) izole edilen ve infeksiyon etkeni olarak kabul edilen toplam 504 P. aeruginosa suşu çalışmaya dahil edilmiştir. İncelenen suş sayısı Eylül 2016-Eylül 2017 tarihleri arasında 154 (%30.6), Ekim 2017-Eylül 2018 arasında 174 (%34.5) ve Ekim 2018-Ekim 2019 arasında ise 176 (%34.9) idi. Hastalar başvuru türüne göre değerlendirildiğinde, 357 (%70.8)’sinin yatan, 147 (%29.2)’sinin ise ayaktan hasta olduğu belirlenmiştir. Yaşları 0-96 arasında değişen hastalardan 263 (%52.2)’ünün erkek, 241 (%47.8)’inin ise kadın olduğu tespit edilmiştir. Hastaların yaş gruplarına göre dağılımında >65 grubunda 250 (%49.6), 45-65 grubunda 135 (%26.8), 15-44 grubunda 67 (%13.3) ve <15 grubunda 52 (%10.3) hasta olduğu görülmüştür.
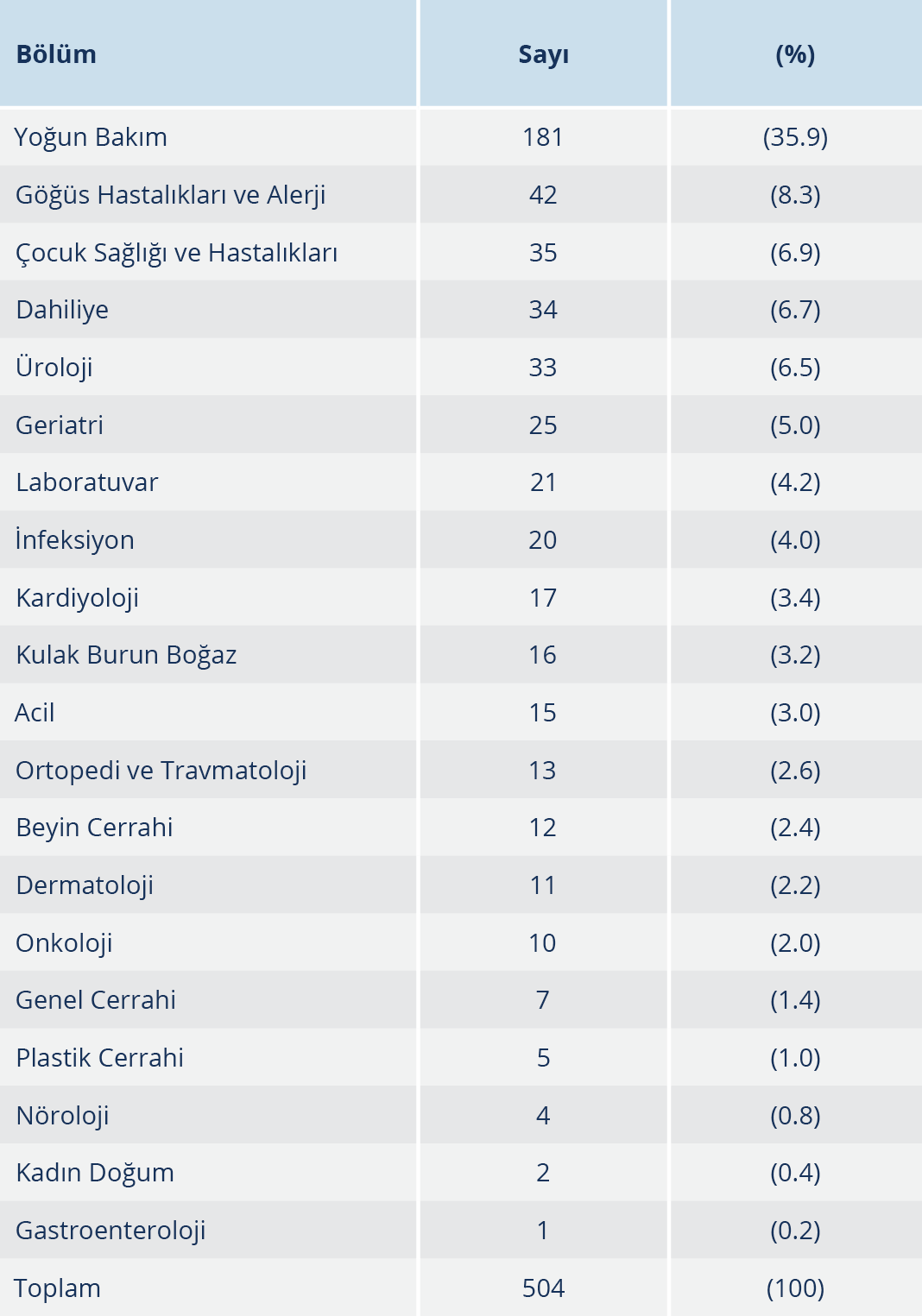
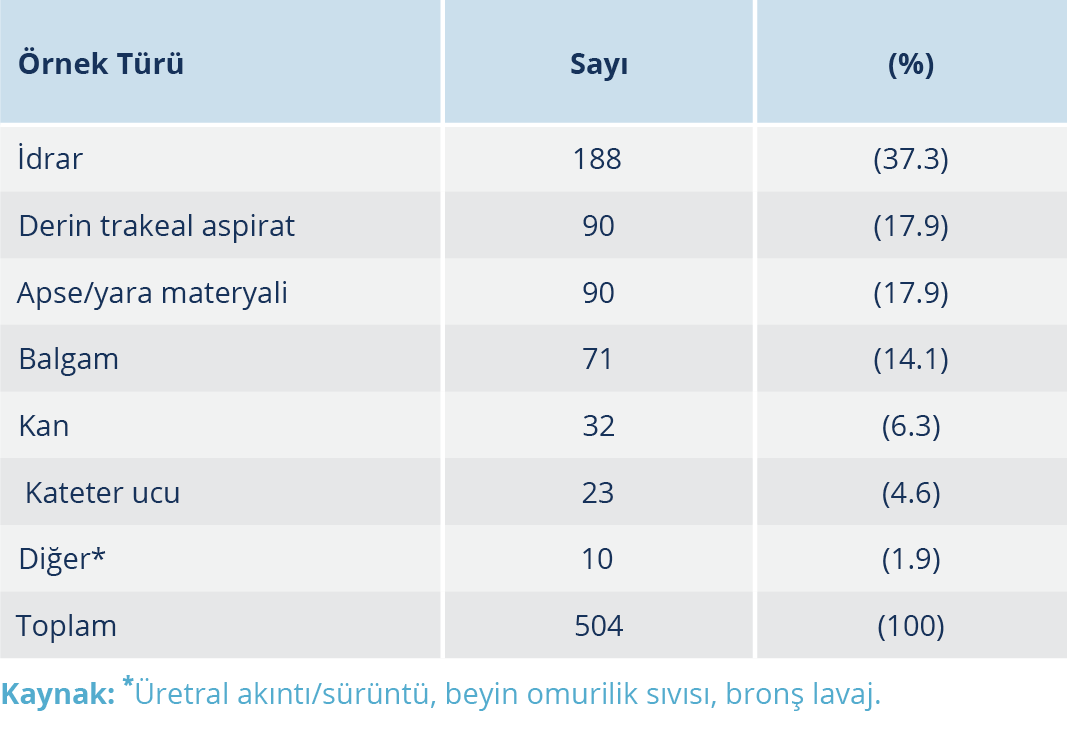
P. aeruginosa suşlarının izole edildiği örneklerin en sık gönderildiği bölümler %35.9 oranıyla yoğun bakım servisi ve %8.3 oranıyla göğüs hastalıkları ve alerji servisi olarak belirlenmiştir. Suşların izole edildiği örneklerin gönderildiği kliniklere göre dağılımı Tablo 1’de gösterilmiştir. Suşların %37.3 oranıyla büyük bir çoğunluğu idrar, %17.9’u derin trakeal aspirat, %17.9’u apse/yara materyali, %14.1’i balgam, %6.3’ü kan, %4.6’sı kateter ucu ve %1.9’u diğer (üretral akıntı/sürüntü, beyin omurilik sıvısı ve bronş lavaj) kültürlerinden izole edilmiştir. Suşların izole edildiği örnek türlerine göre dağılımı Tablo 2’de gösterilmiştir.
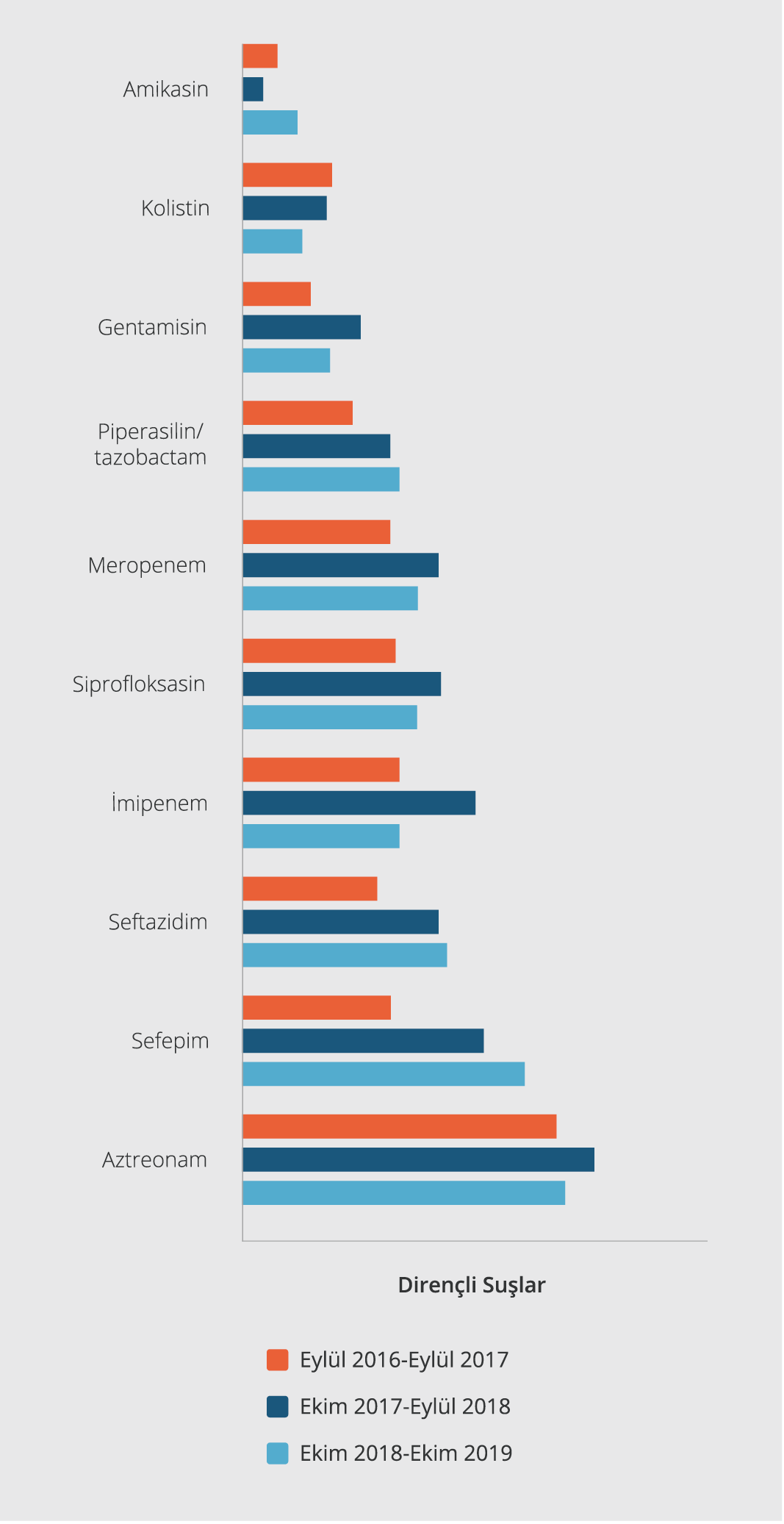
Şekil 2. P. aeruginosa suşlarının 2010-2014 ve 2016-2019 yılları içerisinde izlenen direnç profilleri karşılaştırılması.
Antibiyotik direnç profilleri değerlendirildiğinde, hastanemizde en yüksek direnç aztreonam (%47.7) ve sefepim (%32) antibiyotiklerinde görülmüştür. Suşların antibiyotik duyarlılıkları incelendiğinde ise çalışmaya alınan suşlar en çok amikasin (%94.7), kolistin (%87.8) ve gentamisine (%86.5) duyarlı bulunmuştur. Test edilen tüm antibiyotiklere direnç durumu Tablo 3’te gösterilmiştir. Yıllara göre P. aeruginosa antimikrobiyal direnç oranları değerlendirildiğinde, sefepim direncinin her yıl istatistiksel olarak anlamlı düzeyde arttığı gözlenmiştir (p<0.05; p=0.011). Bunun yanı sıra, imipenem direncinde Eylül 2016-Eylül 2018 tarihleri arasında artış görülürken, Ekim 2018-Ekim 2019 döneminde ise anlamlı bir düşüş saptanmıştır (p<0.05). Seftazidim ve piperasilin/tazobaktam direnci sırasıyla %26.3 ve %19.7 olarak saptanmış, her yıl artış olmasına rağmen istatistiksel olarak anlamlı bulunmamıştır (sırasıyla p>0.05). Aztreonam, siprofloksasin, meropenem ve gentamisin direnci incelendiğinde ise, 2016-2018 yılları arasında artış, 2018-2019 yılları arasında ise bir düşüş görülmesine rağmen istatistiksel olarak anlamlı bulunmamıştır (sırasıyla p>0.05). P. aeruginosa suşlarının yıllara göre antimikrobiyallere direnç oranları Şekil 1’de verilmiştir.
Çalışmamızda elde ettiğimiz 2016-2019 verileri, hastanemizde 2010-2014 yılları arasında klinik örneklerden izole edilen 186 P. aeruginosa suşunun antibiyotik direnç verileriyle (7) karşılaştırılmıştır. Analiz sonuçları değerlendirildiğinde, son üç yılda özellikle imipenem (%11.8’den %26.4’e), meropenem (%6.5’ten 24.6’ya), sefepim (%4.9’dan %32’ye), piperasilin/tazobaktam (%6.5’ten 19.7’ye), seftazidim (19.5’ten 26.3’e) ve siprofloksasin (18.8’den 25.6’ya) direncinde önemli bir artış saptanmıştır. Hastanemizde son üç yılda izole edilen suşların kolistin, amikasin, gentamisin ve aztreonam duyarlılıklarında, önceki yıllara göre, önemli bir değişiklik izlenmemiştir. P. aeruginosa suşlarının 2010-2014 ve 2016-2019 yılları içerisinde izlenen direnç paternlerinin karşılaştırılması Şekil 2’de gösterilmiştir.
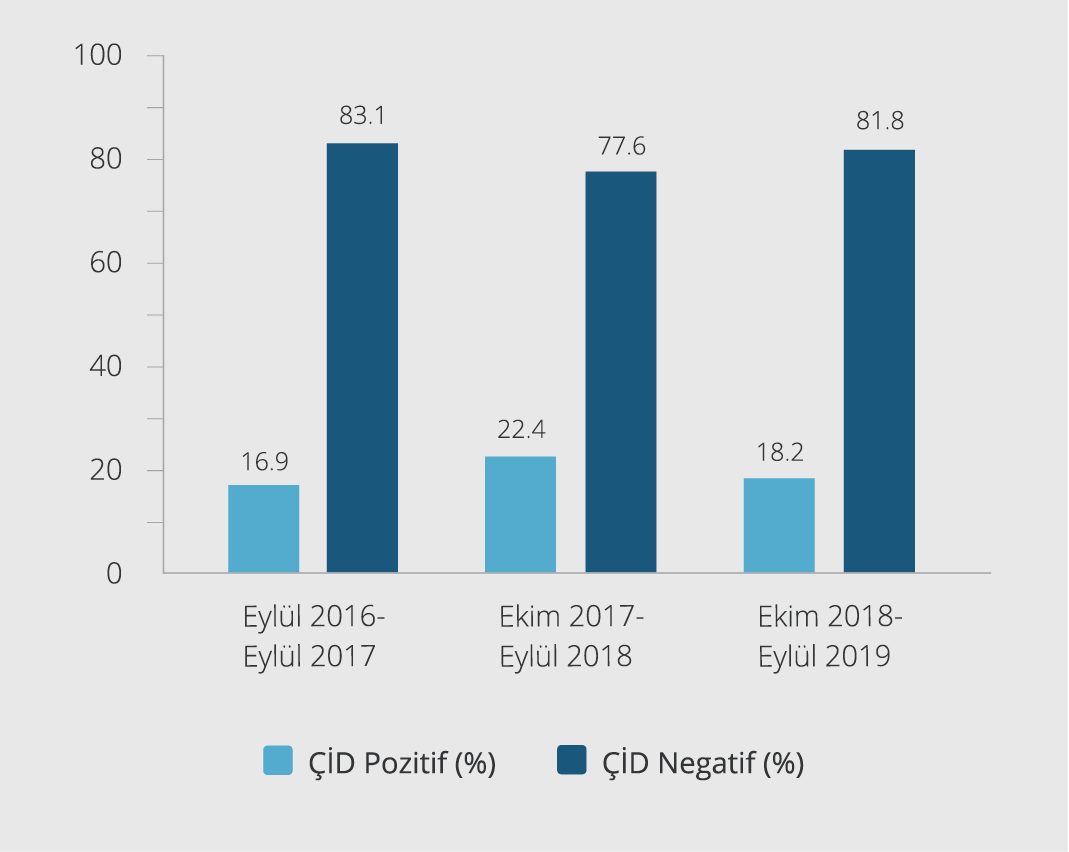
Çalışmamızın verileri ÇİD profilleri açısından değerlendirildiğinde, 2016-2019 yılları arasında ÇİD P. aeruginosa oranı %19.2 olarak belirlenmiştir. Eylül 2016-Ekim 2017 arasında ÇİD P. aeruginosa oranı %16.9, Ekim 2017-Eylül 2018 arasında %22.4, ve Ekim 2018-Eylül 2019 arasında %18.2 olarak saptanmıştır. Yıllar arasında izlenen ÇİD P. aeruginosa oranları Şekil 3’te gösterilmiştir.
İRDELEME
Dirençli hastane infeksiyonları etkeni Gram-negatif patojenler arasında P. aeruginosa, son yıllarda antibiyotiklere çoklu direnç göstererek klinisyenlerin tedavi seçeneklerini giderek azaltmaktadır (8,9). Kuzey Kıbrıs genelinde aktif sürveyans yapılmamakla birlikte, hastanelerde ve toplumda sirküle eden infeksiyon etkenlerinin direnç profilleri hakkında literatürde yeterli veri bulunmamaktadır. Bu nedenle çalışmamızda, hastanemizde son üç yılda izole edilen P. aeruginosa izolatlarında görülen direnç oranları incelenmiştir.
P. aeruginosa infeksiyonlarında etkenin izole edildiği örnek türlerini inceleyen çalışmalarda, P. aeruginosa suşlarınının %38.2-60.6 oranında solunum yolu, %18-27.8 idrar, %5.3-22 kan ve %6.3-18 apse/yara kaynaklı olduğu gösterilmiştir (10-12). Bu çalışmada ise, 504 P. aeruginosa suşunun %37.3’ü idrar, %17.9’u derin trakeal aspirat, %17.9’u apse/yara materyali, %14.1’i balgam, %6.3’ü kan, %4.6’sı kateter ucu ve %1.9’u diğer materyal (üretral akıntı/sürüntü, beyin omurilik sıvısı ve bronş lavaj) kültürlerinden izole edilmiştir.
Türkiye’de daha önce yapılan sürveyans çalışmalarında, antimikrobiyal duyarlılık oranlarında hastanelerdeki antibiyotik kullanım politikalarına ve hastane servislerine göre değişiklik gösteren bir tablo ortaya konulmuştur. 2007-2019 yılları arası yapılan antibiyotik direnç oranları değerlendirmelerinde, β-laktam antibiyotiklerinden sefepim, seftazidim, piperasilin/tazobaktam, aztreonam, imipenem ve meropenem direnci sırasıyla %10.4-45, %8.5-42, %5.2-53, %7.8-33.3, %7.8-53.1 ve %23.9-54.1 olarak bildirilmiştir (13-20). Özellikle yoğun bakım ünitelerinde yatan hastalardan izole edilen P. aeruginosa suşlarında direnç oranlarının daha yüksek olduğu belirlenmiştir (21). Çalışmamızda ise, 2016-2019 yılları arasında hastane kliniklerimizde izlenen hastalarda β-laktam antibiyotik direnci paternleri sefepim, seftazidim, piperasilin/tazobaktam, aztreonam, imipenem ve meropenem için sırasıyla %32, %26.3, %19.7, %47.7, %26.4 ve %24.6 olarak saptanmıştır. Özellikle yıllar içinde direnç dağılımı incelendiğinde, sefepim direncinde bu süreçte her yıl artış olduğu görülmüştür. Sefepim, hastanemizde nadir kullanılmakla birlikte %32 oranında en dirençli ikinci antibiyotik olarak tespit edilmiştir. Aztreonam ise ülkemizde son yıllarda P. aeruginosa tedavisinde kullanılmayan bir antibiyotiktir. Çalışmaya alınan suşlarda görülen %47.7 aztreonam direncinin, Pseudomonas türlerinde görülen plazmid kontrolündeki genişlemiş spektrumlu β-laktamaz (GSBL) ve kromozomal indüklenebilir β-laktamaz (IBL) sentezini indükleyebilen ve tedavide aktif kullanımda olan diğer antibiyotik gruplarından kaynaklı olduğu düşünülmektedir.
P. aeruginosa infeksiyonları tedavisinde en etkin β-laktam grubu antibiyotikler olarak bilinen karbapenemlere dünya çapında duyarlılık azalması rapor edilmiştir (22-24). Çalışma verilerimiz incelendiğinde, izolatların imipenem direncinde 2016-2018 yılları arasında artış, fakat 2018-2019 yılında anlamlı bir düşüş saptanmıştır. Buna rağmen, Kuzey Kıbrıs’ta 2010-2014 yılları arasındaki hastanemizdeki direnç profillerini rapor eden çalışma verileriyle 2016-2019 çalışma sonuçlarımız karşılaştırıldığında, son üç yılda imipenem ve meropenem direncinde, sırasıyla %11.8’den %26.4’e ve %6.5’den %24.7’ye, önemli bir artış olduğu gözlenmiştir (7).
Kinolon grubu antibiyotikler P. aeruginosa infeksiyonlarının tedavisinde tek başlarına veya diğer antibiyotiklerle kombinasyon tedavisi şeklinde kullanılmaktadır. Türkiye genelinde yapılan bazı çalışmalarda siprofloksasin için direnç oranı %7.2-47 olarak bildirilmiştir (25). Çalışmamızda hastanemizin siprofloksasin direnci %25.6 olarak belirlenmiş, 2016-2018 yılları arasında artış gözlemlenmesine rağmen istatistiksel olarak anlamlı bulunmamıştır. Ruh ve arkadaşları (7)’nın Kuzey Kıbrıs’ta 2016’da yaptıkları araştırmayla karşılaştırıldığında 2010-2014 yıllarında saptanan %18.8 oranıyla siprofloksasin direncinde ülkemizde son üç yılda bir artış tespit edilmiştir.
Türkiye’de aminoglikozid direnci prevalansına yönelik yapılan çalışmalar, Gram-negatif bakterilerde aminoglikozidlere karşı direncin düşük oranlarda olduğunu ortaya koymuştur. Aminoglikozid duyarlılığına yönelik ülkede yapılan çalışmalar incelendiğinde Behçet ve arkadaşları (26) amikasine %11.6, gentamisine %19.7 oranında direnç saptamışlardır. Benzer veriler Say Coşkun ve Coşkun (16)’un 2018 yılında yapmış olduğu araştırmada %19 ve %30, Tümer ve arkadaşları (11)’nın 2015’teki sonuçlarına göre %12 ve %28.8 amikasin ve gentamisin direnci olarak belirtilmiştir. Çalışmamızda ise amikasin ve gentamisin direnç profilleri %5.3 ve %13.5 olarak saptanmış ve amikasinin, diğer incelemelere paralel olarak, hastanemizde izole edilen suşların en duyarlı olduğu antibiyotikler arasında olduğu tespit edilmiştir (27,28). 2016-2019 yılları arasında direnç paternlerinde istatistiksel olarak anlamlı bir artış gözlemlenmediği gibi, 2010-2014 verileriyle karşılaştırıldığında da önemli bir direnç artışı eğilimi olmadığı görülmüştür.
Kolistin, özellikle dirençli organizmaların etken olduğu infeksiyonların tedavisinde etkili olan, fakat ciddi nefrotoksik yan etkiye sahip bir ajandır. Yan etkilerine rağmen, alternatif seçeneklerin olmamasından dolayı günümüzde tedavide kullanılmaktadır. Çalışmamızda incelediğimiz 504 P. aeruginosa suşunun 55 (%12.2)’inde kolistin direnci saptanmıştır. Bu oran Türkiye’den ve dünyadan bildirilen direnç oranlarının üzerindedir. Durmaz ve arkadaşları (29)’nın 2015 yılında yaptığı çalışmada P.aeruginosa suşlarında kolistin direnci %7, Uğur ve Genç (14)’in 2019’da yaptığı çalışmada bu oran %5 ve Demirel (30)’in yine 2019’da yayımladığı çalışmada %7 olarak bildirilmiştir. Ruh ve arkadaşları (7)’nın Kuzey Kıbrıs’ta 2016 yılında yaptıkları araştırma verileriyle (7) karşılaştırıldığında 2010-2014 yılları arasında %10.9 oranında seyreden kolistin direncinde ülkemizde son üç yılda önemli bir artış tespit edilmemiştir. Kuzey Kıbrıs’ta 2014-2015 yılları arası klinik örneklerde antibiyotik direncini inceleyen bir diğer çalışmada ise, P.aeruginosa suşlarında kolistin direnci %13.3 olarak belirtilmiştir (31). “Clinical and Laboratory Standards Institute” (CLSE)-EUCAST polimiksin eşik değer belirleme çalışma grubu, kolistin duyarlılığının belirlenmesi için sıvı mikrodilüsyon yöntemini referans yöntem olarak belirlemiştir (32). Kolistin duyarlılığının bu yöntem kullanılarak teyit edilmemesi çalışmamızın kısıtlılığıdır.
Hastane ve toplum kökenli infeksiyonların tedavisinde antibiyotik duyarlılık testlerinin ve sürveyans verilerinin önemi tüm dünyada yapılan araştırmalarda belirtildiği gibi çalışmamız verileriyle de açıkça ortaya konmuştur. Antibiyotik direncinin ülkeler, şehirler, hastaneler ve hatta hastane servisleri arasında ve yıldan yıla değişiklik gösterebileceği göz önünde bulundurulmalı ve her merkezde aktif sürveyans uygulanmalıdır. Çalışmamızda P. aeruginosa suşlarının izole edildiği örneklerin en sık gönderildiği bölüm yoğun bakım servisi olarak belirlenmiştir.
Sonuç olarak, hastanemizde izole edilen suşların en duyarlı olduğu antibiyotikler kolistin ve amikasin olarak saptanmıştır. Ülkemizde son üç yılda, 2010-2014 direnç oranlarıyla karşılaştırıldığında, hastane ve toplum kökenli P. aeruginosa suşlarında sefepim, seftazidim, siprofloksasin, piperasilin/tazobaktam ve karbapenem direncinde önemli bir artış gözlenmiştir. Artan dirençli infeksiyonların kontrolünde, hastanemiz infeksiyon kontrol komitesi tarafınca uygulamaya alınan personel hizmet içi eğitimi, izolasyon tedbirleri ve antibiyotik tüketim verilerinin takibi gibi uygulamaların önemli bir rolü bulunmaktadır. 1 Nisan 2016 tarihi itibariyle Kuzey Kıbrıs’ta reçetesiz antibiyotik kullanımının engellenmesine yönelik çıkarılan kanun olmakla birlikte, günümüzde irrasyonel antibiyotik kullanımı devam etmektedir. Hastane İnfeksiyon Kontrol Komitesi dirençli infeksiyonların kontrolüne yönelik çalışmalarını sürdürmesine rağmen, Kuzey Kıbrıs Türk Cumhuriyeti Sağlık Bakanlığı nezdinde denetim yapılmamasından dolayı halen reçetesiz antibiyotik temin etmek mümkündür. Bu gibi sürveyans çalışmalarının Kuzey Kıbrıs’ta faaliyet gösteren her hastanede yapılması gerektiği, buna ek olarak direnç gelişimine yol açan genetik mekanizmaların araştırılmasının ülkemizde antibiyotik kullanım politikalarına katkı sağlayacağı ve antibiyotik direnci kontrolünde rol oynayacağı kanaatindeyiz.
Çıkar çatışması
Yazarlar, herhangi bir çıkar çatışması bildirmemiştir.
Referanslar
- Elaldı N. Ufuktaki yeni antibiyotikler, 2015. Flora. 2015; 20(1): 1-9.
- Özmen E, Geyik M. F., Uluğ M, Çelen M. K., Hoşoğlu S., Ayaz C. Yatan hastalardan izole edilen Gram negatif bakteriler ve antibiyotik dirençlerinin değerlendirilmesi. Düzce Tıp Derg. 2010, 12(3): 32-9.
- Akduman Alaşehir E, Karadeniz A, Balıkçı A, Eren Topkaya A. Klinik örneklerinden izole edilen Pseudomonas aeruginosa suşlarının antibiyotik duyarlılıkları. Maltepe Tıp Derg. 2013; 5(3): 12-6.
- World Health Organization. Global Priority List of Antibiotic-Resistant Bacteria to Guide Research, Discovery, and Development of New Antibiotics [İnternet]. Geneva: WHO [erişim 1 Ocak 2021]. https://www.who.int/medicines/publications/global-priority-list-antibiotic-resistant-bacteria/en/.
- Berktaş M, Çıkman A, Parlak M. Yaman G, Güdücüoğlu H. Nozokomiyal kökenli Pseudomonas aeruginosa izolatlarında antibiyotiklere direnç. Van Tıp Derg. 2011; 18(4): 192-6.
- Kuster SP, Ruef C, Zbinden R, et al. Stratification of cumulative antibiograms in hospitals for hospital unit, specimen type, isolate sequence and duration of hospital stay. J Antimicrob Chemother. 2008; 62(6): 1451-61.
- Ruh E, Gazi U, Güvenir M, Süer K, Çakır N. Kuzey Kıbrıs’taki bir üniversite hastanesinden izole edilen Pseudomonas aeruginosa, Acinetobacter baumannii ve Klebsiella pneumoniae bakterilerinin antibiyotik direnç oranları. Türk Hijyen ve Deneysel Biyoloji Dergisi. 2016; 73(4): 333-44.
- Pérez A, Gato E, Pérez-Llarena J, et al. High incidence of MDR and XDR Pseudomonas aeruginosa isolates obtained from patients with ventilator-associated pneumonia in Greece, Italy and Spain as part of the MagicBullet clinical trial. J Antimicrob Chemother. 2019; 74(5): 1244-52.
- Peng Y, Shi J, Bu T, et al. Alarming and increasing prevalence of multidrug-resistant Pseudomonas aeruginosa among healthcare-associated infections in China: A meta-analysis of cross-sectional studies. J Glob Antimicrob Resist. 2015; 3(3): 155-60.
- Kal Çakmaklıoğulları E, Kuru C. Pseudomonas aeruginosa suşlarının antibiyotik duyarlılıkları: Farklı örnek türlerinde değerlendirme. Ankem Derg. 2019; 33(2): 37-42.
- Tümer S, Kirişci Ö, Özkaya E, Calışkan A. Çeşitli klinik örneklerden izole edilen Pseudomonas aeruginosa suşlarının antibiyotik duyarlılıkları. Ankem Derg. 2015; 29(3): 99-104.
- Demirdal T, Şen P, Yula E, Kaya S, Nemli SA, Demirci M. Yoğun bakım ünitelerinden izole edilen Pseudomonas aeruginosa suşlarının direnç profilleri: Beş yıllık değerlendirme. Ortadoğu Medical Journal. 2017; 9(3): 108-12.
- Esenkaya Taşbent F, Doğan M, Feyzioğlu B, Baykan M. Çeşitli klinik örneklerden izole edilen Pseudomonas türlerinin antibiyotiklere direnci. Türk Mikrobiyol Cem Derg. 2013; 43(4): 138-43.
- Uğur M, Genç S. Yoğun bakım ünitelerinden izole edilen Acinetobacter baumannii ve Pseudomonas aeruginosa suşlarının üç yıllık direnç profili. Turk J Intensive Care. 2019; 17: 130-137.
- Ekincioğlu P, Perçin D. Klinik Pseudomonas aeruginosa izolatlarının antibiyotiklere duyarlılık durumu. Sağlık Bilimleri Dergisi. 2013; 22(2) 141-9.
- Şay Coşkun US, Coşkun G. Klinik örneklerden izole edilen Pseudomonas aeruginosa suşlarının antibiyotik direnç durumunun belirlenmesi. Flora. 2013; 18(4): 175-180.
- Yapıcı O, Akgüneş A, Akgül S, Ekinci B, Saygılı Pekintürk N. Pseudomonas aeruginosa suşlarının direnç durumunun yıllar içindeki değişimi. Muğla Sıtkı Koçman Üniversitesi Tıp Dergisi. 2018; 5(1): 1-4.
- Karagöz G, Kadanalı A, Dede B, Çomoğlu Ş, Babacan Altuğ S. Pseudomonas aeruginosa suşlarının antibiyotik direnci ve son iki yıldaki değişiminin değerlendirilmesi. Haydarpaşa Numune Eğitim ve Araştırma Hastanesi Tıp Dergisi 2013; 53(3): 164-7.
- Duman Y, Kuzucu Ç, Kaysadu H, Tekerekoğlu MS. Bir yıllık sürede izole edilen Pseudomonas aeruginosa suşlarının antibiyotik duyarlılığının araştırılması: Kesitsel bir çalışma. İnönü Üniversitesi Sağlık Bilimleri Dergisi. 2012; 1(1): 41-5.
- Ekşi F, Bayram A, Balcı İ, Özer G. Pseudomonas aeruginosa suşlarında indüklenebilir beta-laktamaz aktivitesinin ve antibiyotiklere direncin araştırılması. Türk Mikrobiyol Cem Derg. 2007; 37(3): 142-6.
- Dursun A, Özsoylu S, Kılıç H, Ulu Kılıç A. Akyıldız BN. Çocuk yoğun bakım ünitesinde yatan hastalardan izole edilen Pseudomonas aeruginosa, Klebsiella pneumoniae ve Acinetobacter baumannii suşlarının antibiyotik duyarlılıkları. Turk J Intensive Care. 2018; 16: 109-14.
- Kostyanev T, Vilken T, Lammens C, Timbermont L, Van’t Veen A, Goossens H. Detection and prevalence of carbapenem-resistant Gram-negative bacteria among European laboratories in the COMBACTE network: A COMBACTE LAB-Net survey. Int J Antimicrob Agents. 2019; 53(3): 268-74.
- Mendes RE, Mendoza M, Banga Singh KK, et al. Regional resistance surveillance program results for 12 Asia-Pacific nations (2011). Antimicrob Agents Chemother. 2013; 57(11): 5721-6.
- Cai B, Echols R, Magee G, et al. Prevalence of carbapenem-resistant Gram-negative infections in the United States predominated by Acinetobacter baumannii and Pseudomonas aeruginosa. Open Forum Infect Dis. 2017; 4(3): ofx176.
- Varışlı AN, Aksoy A, Baran I, Aksu N. Klinik örneklerden izole edilen Pseudomonas aeruginosa suşlarının yıllara göre antibiyotik direnci. Türk Hijyen ve Deneysel Biyoloji Dergisi. 2017; 74(3): 229-36.
- Behçet M, Avcıoğlu F, Karabörk Ş, Kurtoğlu MG. Çeşitli klinik örneklerden izole edilen Pseudomonas aeruginosa suşlarının antimikrobiyal direnç oranları: üç yıllık değerlendirme. Ankem Derg. 2019; 33(2): 43-8.
- Karakeçe E, Terzi HA, Çiftci İH. Pseudomonas aeruginosa izolatlarının antibiyotik duyarlılıklarının değerlendirmesi. Göztepe Tıp Dergisi. 2014; 29(1): 20-3.
- Kılınç Ç, Güçkan R, Kahveci M, Kayhan Y, Pirhan Y, Özalp T. Kan kültürlerinde üreyen Gram negatif izolatların dağılımı ve antibiyotik direnç profilleri. Int J Basic Clin Med. 2015; 3(3): 125-30.
- Durmaz S, Özer TT. Klinik örneklerden izole edilen Pseudomonas aeruginosa suşlarında antibiyotik direnci. Abant Med J. 2015;4(3):239-42.
- Demirel A. Özel bir hastanede Gram-negatif bakteri izolatlarında antibiyotik direncinin değerlendirilmesi. Bakırköy Tıp Dergisi. 2019; 15: 292-8.
- Ullah N, Güler E, Güvenir M, Arıkan A, Süer HK. Isolation, identification, and antibiotic susceptibility patterns of Pseudomonas aeruginosa strains from various clinical samples in a university hospital in Northern Cyprus. Cyprus J Med Sci. 2019; 4(3): 225-8.
- European Committee on Antimicrobial Susceptibility Testing. Recommendations for MIC determination of colistin (polymyxin E) as recommended by the joint CLSI-EUCAST Polymyxin Breakpoints Working Group [İnternet]. Basel: EUCAST [erişim 1 Ocak 2021]. http://www.eucast.org/fileadmin/src/media/PDFs/EUCAST_files/General_documents/Recommendations_for_MIC_determination_of_colistin_March_2016.pdf