En Çok Okunanlar
Özet
Amaç: Granülomatöz mastit (GM), memenin nadir görülen kronik inflamatuar bir hastalığıdır. Non-laktasyonel mastitin en sık rastlanılan türü olan GM’de, etyolojik rolü olan bakteriler tam olarak bilinmemektedir.
Yöntemler: Çalışmamız, Ocak 2015-Ocak 2016 tarihleri arasında, İstanbul Üniversitesi-Cerrahpaşa, Cerrahpaşa Tıp Fakültesi Hastanesi Genel Cerrahi Anabilim Dalı Meme Polikliniği ve Acil Cerrahi Servisi’ne başvuran ve klinik muayeneleri ile histopatolojik inceleme sonuçlarına göre GM tanısı almış, 46 hastaya ait doku ve/veya apse örnekleri ile gerçekleştirilmiştir. Örneklerden izole edilen aerop bakteriler konvansiyonel yöntemlerin yanı sıra BD Phoenix (Becton, Dickinson Company, Maryland, ABD) cihazıyla, anaerop bakteriler ise API 20A (bioMérieux, Marcy l’Etoile, Fransa) kitiyle tanımlanmıştır. Ayrıca Gram boyamada bakteri görüldüğü halde kültürde üreme olmayan örneklerden bakteri tanımlaması 16S rRNA’nın PCR amplifikasyonu ile yapılmıştır. Bakterilerin antimikrobiyal duyarlılıkları disk difüzyon ve gradyan test metotlarıyla belirlenmiştir. Sonuçlar EUCAST 2016 kriterlerine göre değerlendirilmiştir.
Bulgular: Araştırmamızın kültür sonuçları değerlendirildiğinde; 20 (%43.7) hastada üreme saptanırken, 26 (%56.5) hastada üreme saptanmamıştır. Gram pozitif çomaklardan Corynebacterium türleri 46 hastanın 12 (%26.1)’sinde görülmüştür. 46 hastanın 7 (%15.2)’sinde C. kroppenstedtii, 3 (%6.5)’ünde C. urealyticum, 2 (%4.3)’sinde C. amycolatum üremiştir. Gram pozitif diplokoklardan S. aureus’un 46 hastamızın 2 (%4.3)’sinde ürediği, Gram negatif çomaklardan Klebsiella spp. ve Proteus spp.’nin 1’er hastada ürediği saptanmıştır. Hastalarımızda üreyen anaerop bakterilerin dağılımını incelediğimizde ise en fazla Peptostreptococcus spp. (3 örnek, %6.5) ve B. fragilis (2 örnek, %4.3) üremiştir. Üreme saptadığımız 20 hasta örneğinin 6 (%30)’sında farklı bakteri türleri birlikte üremiştir. Gram boyamada bakteri görüldüğü halde kültürlerde bakteri üremesine rastlanmayan 46 hastamızın 19’unun cerahat örneğinde yapılan 16S rRNA’nın PZR amplifikasyonu sonucunda; en fazla C. kroppenstedtii (3 örnek) ve S. epidermidis (3 örnek); anaerop bakterilerden ise 1’er örnekte Peptostreptococcaceae bacterium, Cutibacterium spp., C. acnes ve B. breve izole edilmiştir.
Sonuçlar: İnfeksiyona neden olan bakterilerde direnç gelişimine yol açabilecek geniş spektrumlu antibiyotikleri içeren empirik tedavi protokollerinin uygulanmasından ziyade aerop/anaerop etkenlerin belirlenerek etkene spesifik tedavi uygulanmasının anlamlı olacağı kanısındayız. Özellikle etkenlerin üretilmesinde güçlükler yaşanan GM’li olgularda Gram pozitif çomaklara (Corynebacterium türlerine) etkili penisilin, vankomisin ve linezolid gibi yağ dokuya penetrasyonu güçlü olan antibiyotiklerin tedaviye eklenmesi yararlı olacaktır.
GİRİŞ
Mastitler, memenin inflamasyonu ile seyreden infeksiyöz ya da noninfeksiyöz hastalıklar olup genellikle kadınları etkiler (1). Mastitler; laktasyonel mastit, non-laktasyonel mastit ve meme apsesi olmak üzere üç grupta incelenmektedir. Non-laktasyonel mastit; santral veya subareolar infeksiyon, periferal infeksiyon ve granülomatöz infeksiyon olmak üzere üç gruba ayrılır (1). İnfeksiyöz olmayan mastit (non-laktasyonel mastit), memenin lobüllerinde genişleme ile seyreden ve nedeni henüz kesin olarak belirlenememiş bir mastit türüdür. Özellikle GM bu grupta en sık rastlanan kliniktir. Sarkoidoz, histoplazmoz, Wegener granülomatozu, bruselloz ve tifo gibi hastalıklarda GM gelişebilmektedir. En sık rastlanan ve patogenezi belirsiz olan GM tipi idiyopatik GM olup otoimmün hastalıklarla beraber görülebileceği belirtilmiştir (2). Toplumumuzda GM’li hastalar; memede ağrılı kitle, apse oluşumu, fistül, meme başında çekilme gibi şikayetlerle hastaneye başvurmaktadır ve başlangıçta olgular çoğunlukla meme kanseri ile karışabilmektedir. GM’li hastalarda, memede gelişen apse odaklarından izole edilen etkenlerin patolojiye sekonder olarak eklendiği ileri sürülmektedir (1).
Non-laktasyonel mastitin en sık rastlanılan türü olan GM’de, etyolojik rolü olan bakteriler tam olarak bilinmemektedir. Araştırmalarda başta Corynebacterium türleri olmak üzere, Escherichia coli, bifidobakteriler, anaerobik streptokoklar, Clostridium türleri etkenler arasında gösterilmiştir (3).
Ayrıca güncel çalışmalarda, nikotinin direkt veya indirekt olarak subareolar meme kanallarına zarar verdiği ve zarar görmüş dokuların aerop ve anaerop bakteri infeksiyonlarına daha açık olduğu öne sürülmüştür. Sigaranın aynı zamanda in vivo ve in vitro olarak Gram pozitif bakteri üremesini baskıladığı dolayısıyla GM etyolojisinde rol alan Gram-negatif aerobik ve anaerobik bakterilerin aşırı üremesine neden olduğu öne sürülmüştür (2, 3).
Granülomatöz mastite neden olan bakteriyel etkenlerin tanısı, hastalığın tedavisi ve takibi açısından büyük önem taşımaktadır. Granülomatöz mastit tanısı almış hastaların, apse ve doku örneklerinde bakterilerin tanımlanması için öncelikle aerop ve anaerop kültür yöntemleri kullanılmaktadır (1). Ancak birçok kaynakta belirtildiği gibi, etkenlerin konvansiyonel bakteriyolojik tekniklerle izolasyonunda her zaman başarı sağlanamadığı için, günümüzde moleküler yöntemlerden [polimeraz zincir reaksiyonu (PZR), multipleks PZR, gerçek zamanlı PZR] de yararlanılmaktadır (1, 3, 4).
Granülomatöz mastit tedavi edilmediği takdirde hastalarda meme apseleri ve geniş meme dokusu nekrozları gelişebilmektedir. Tüberküloz dışı bakteriyel mastitli hastalara uygulanan tedaviler, merkezden merkeze değişebilmekle birlikte genel olarak apse drenajı uygulanmakta ve empirik olarak da penisilin, sefalosporinler, beta-laktam inhibitörleri ve klindamisin kullanılmaktadır (5). Bunun yanı sıra, son yapılan çalışmalarda sağlıklı annelerin sütlerinden izole edilen bazı Lactobacillus türlerinin (Lactobacillus salivarus, Lactobacillus gasseri) tedavide kullanıldığı ve olumlu yanıtlar alındığı bildirilmiştir (5). Ayrıca etki mekanizmaları tam olarak bilinmemekle beraber özellikle GM’lerin tedavisinde steroidler de kullanılmaktadır (6).
YÖNTEMLER
- Çalışmamızda örnek alımından, bakteri türlerinin PZR ile tanımlanmasına kadar gerçekleştirilen adımlar aşağıda belirtilmiştir:
- Hastalara ait bilgilerin yer aldığı formların doldurulması,
- Hastalardan örneklerin alınması ve laboratuvara taşınması,
- Besiyerlerine ekim yapılması, aerop/anaerop ortamların sağlanması ve inkübasyonu,
- Üretilen bakterilerin tanımlanması,
- Kültürde üretilen bakterilerin antimikrobik maddelere dirençlerinin belirlenmesi,
- Gram boyamasında bakteri görüldüğü halde kültürlerde bakteri üretilemeyen örneklerin PZR ile incelenmesi.
Hasta Formlarının Doldurulması
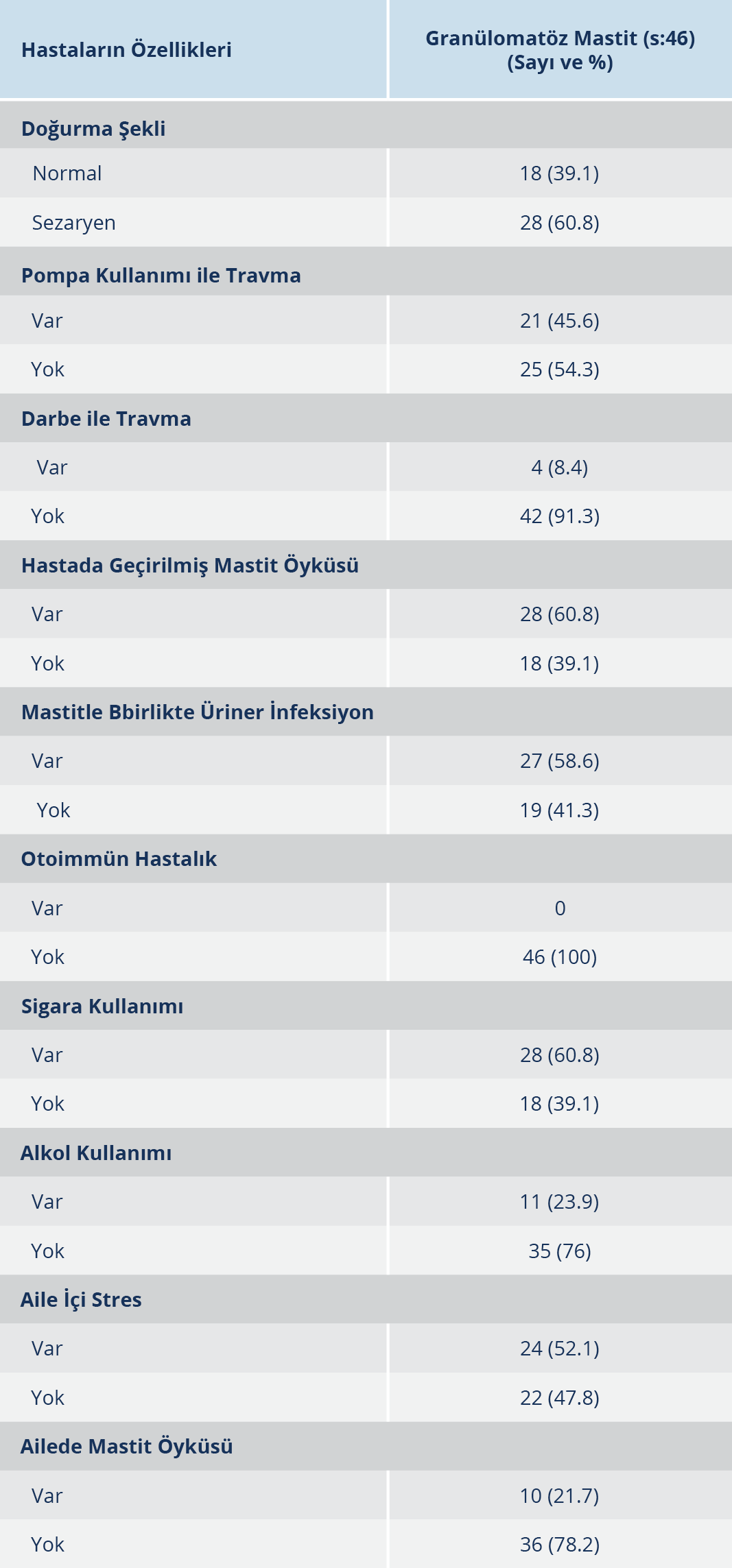
Çalışmamızda İstanbul Üniversitesi-Cerrahpaşa Girişimsel Olmayan Klinik Araştırmalar Etik Kurulu Yönergesi’ne göre hastaların yasal temsilcilerinin bilgilendirilmiş onayları alındı. Genel Cerrahi Meme Polikliniği’ne gelen mastitli hastalara ait bilgilerin yer aldığı formlar dolduruldu. Bu formlarda, çalışmaya dahil edilen hastaların; yaş, doğurma şekli ve kaçıncı doğumları olduğu, emzirme süreleri, emzirme döneminde pompa kullanılıp kullanılmadıkları, mastite bağlı süt miktarındaki değişim, apsenin başlangıç tarihi, apsenin tahmini nedeni, sigara ve alkol kullanımı, aile içi stres durumları, yakın zamanda geçirilmiş ya da var olan önemli hastalıkları, kullanmakta oldukları antibiyotik veya diğer ilaçlar, üriner sistem infeksiyonu geçirip geçirmedikleri, ailede mastit öyküsü varlığı sorgulandı. Hekimin klinik tanısına göre mastitin (laktasyonel/non-laktasyonel) tipi kaydedildi.
Çalışma Grubu ve Materyalin Toplanması
Araştırmamız, Ocak 2015-Ocak 2016 tarihleri arasında, İstanbul Üniversitesi-Cerrahpaşa, Cerrahpaşa Tıp Fakültesi Genel Cerrahi Anabilim Dalı Meme Polikliniği ve Acil Cerrahi Servisi’ne başvurmuş; klinik muayenelerinde periareolar bölgede ciltte eritem, meme başında şişkinlik, sertlik, akıntı varlığı tespit edilmesi üzerine meme dokularından alınan örneklerin histopatolojik incelemesi sonucuna göre GM tanısı almış, 46 erişkin hastaya ait örnekle gerçekleştirilmiştir. Üçü doku biyopsisi ve 43’ü iğne aspirasyonu ile alınan cerahat örneği olmak üzere toplam 46 örnekle gerçekleştirilen bu araştırmada, her hasta için bir örnek incelemeye dahil edilmiştir.
Çalışmaya dahil olacak hastalar için temel kriterlerimiz; erişkin olmalarının yanı sıra örneklerinin histopatolojik incelemesinde yoğun inflamatuar reaksiyon ve hastalığın karakteristik özelliği olan non-kazeifiye granülomların görülmesi sonucu GM tanısı almış olmalarıdır (1, 6, 7). Laktasyonel mastit, tüberküloz mastit ve meme kanseri tanısı almış hastaların yanı sıra son 72 saatte antibiyotik kullananlar çalışmamızdan dışlanmıştır.
Genel cerrahi meme polikliniğine başvuran mastitli hastalardan örnekler alınmadan önce, cerrahi hekimleri tarafından örnek alınacak bölgenin cilt antisepsisi povidon iyot içeren Betadix %7.5 SCRUB (Naturel Medikal, Türkiye) ile sağlanmıştır. Alınan cerahat örnekleri zaman kaybetmeden laboratuvara getirilmiş; doku biyopsileri ise Cary-Blair taşıma besiyerine alınarak laboratuvara ulaştırılmıştır.
Kültür ve Antimikrobiyal Duyarlılıkların Belirlenmesi
Alınan örnekler aerop ve anaerop bakterilerin varlığı yönünden, Gram boyama yapılarak incelenmiştir. Aerop kültürler için, kanlı agar, çikolatamsı agar ve MacConkey agar besiyeri; anaerop kültürler için %5 koyun kanı ve menadion ile zenginleştirilmiş Schaedler agar, zenginleştirilmiş Schaedler agar ile hazırlanmış kanamisin-vankomisinli agar besiyeri, fenil-etil alkollü agar besiyeri ve sodyum tiyoglikolatlı sıvı besiyeri kullanılmıştır. Anaerobik ortam GasPak ile sağlanmıştır.
Aerop ve anaerop bakterilerin tanımlanmasında standard klinik mikrobiyoloji laboratuvarı yöntemleri kullanılmış olup gerek duyulması halinde aerop bakterilerin tanısı için BD Phoenix (Becton, Dickinson Company, Maryland, ABD) cihazından; anaerop bakteriler içinse API 20A (bioMérieux, Marcy l’Etoile, Fransa) kitinden yararlanılmıştır. Üretilen aerop bakterilerin antibiyotiklere duyarlılıkları, cinse spesifik olan antibiyotik diskleri kullanılarak, Mueller-Hinton agar besiyerlerinde Kirby-Bauer disk difüzyon yöntemi ile; anaerop bakterilerin antibiyotiklere duyarlılıkları ise gradyan test ile saptanmıştır.
Aerop ve Anaerop Bakterilerin Tanısında Kullanılan Moleküler Yöntemler
Hasta antibiyotik tedavisi altında olmadığı halde örneklerden hazırlanan Gram boyamalarda görülen bakterilerin üretilememesi durumunda, ileri araştırmalar için cins ya da tür spesifik bakteri primerleri kullanılarak muhtemel patojen bakterilerin belirlenmesine yönelik 16S rRNA analizi yapılmıştır. PZR amplifikasyon ürünleri elde edildikten sonra, çalışma izolatlarımızın 16S gen bölgesinin saflaştırılması ve baz dizi analizi, 4 farklı oligonükleotit primeri ile ABI 3730XL DNA “Analyzer” (Applied Biosystems, CA, ABD) cihazı ile üretici firma direktifleri doğrultusunda okunmuş ve kromatogramları alınmıştır. ABI formatındaki kromatogram dosyaları FASTA formatına dönüştürüldükten sonra “Sequencher version 4.10.1 sequence analysis software” (Gene Codes, Ann Harbor, ABD), MEGA 4.1 (megasoftware.net) programı ve “FinchTV chromatogram viewer” (Geospize, ABD) kullanılarak karşılaştırmalı ve manuel olarak dört farklı primerden elde edilen diziler birleştirilmiş ve 16S rRNA dizileri elde edilmiştir (8). Dört farklı primer [(27F – 5’ AGAGTTTGATCTGGCTCAG-3’, bağlandığı bölge 8-27. bazlar); (MG3f- 5’ CAGCAGCCGCGGTAATAC-3’, bağlandığı bölge 52-536. bazlar); (MG5f- 5’ AAACTCAAAGGAATTGACGG-3’, bağlandığı bölge 907-926. bazlar); (1525R – 5’AAGGAGGTGWTCCARCC-3’, bağlandığı bölge 1544-1525. bazlar)] kullanılarak hazırlanan 1446–1515 nt uzunluğundaki 16S rRNA gen FASTA dizileri analizlerde kullanılmıştır (8).
DNA dizilerinin, biyoenformatik programlar tarafından okunması için belli standard formatlar oluşturulmuştur ve bunların en yaygını FASTA dizileridir (8).
Elde edilen 16S rRNA konsensüs diziler, MEGA 4.1 programı kullanılarak Amerika Birleşik Devletleri Ulusal Biyoteknoloji Bilgi Merkezi (NCBI- The National Center for Biotechnology Information, U.S. National Library of Medicine) ve Leibniz Enstitüsü Alman Mikroorganizmalar ve Hücre Kültürleri Koleksiyonu (DSMZ – Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH) gibi gen bankalarında bulunan referans bakteri FASTA dizileri ile blast analizi yapılarak karşılaştırılmış ve benzerlikleri kıyaslanarak bakteri isimlendirmeleri gerçekleştirilmiştir (9) (Şekil 1-2).
İstatistiksel Analiz
Çalışmamızda tanımlayıcı değerlerin saptanmasında “IBM SPSS Statistics for Windows, Version 21.0” (Armonk, NY, ABD) kullanıldı. Nicel değişkenler ortalama standard sapma; kategorik değişkenler ise kişi sayısı ve % olarak verildi.
BULGULAR
Araştırmamıza dahil ettiğimiz GM’li hastaların yaş aralığı 23 ile 55 arasında ve ortalaması 34.5 olup sosyodemografik özelliklerinin dağılımı Tablo 1’de verilmiştir.
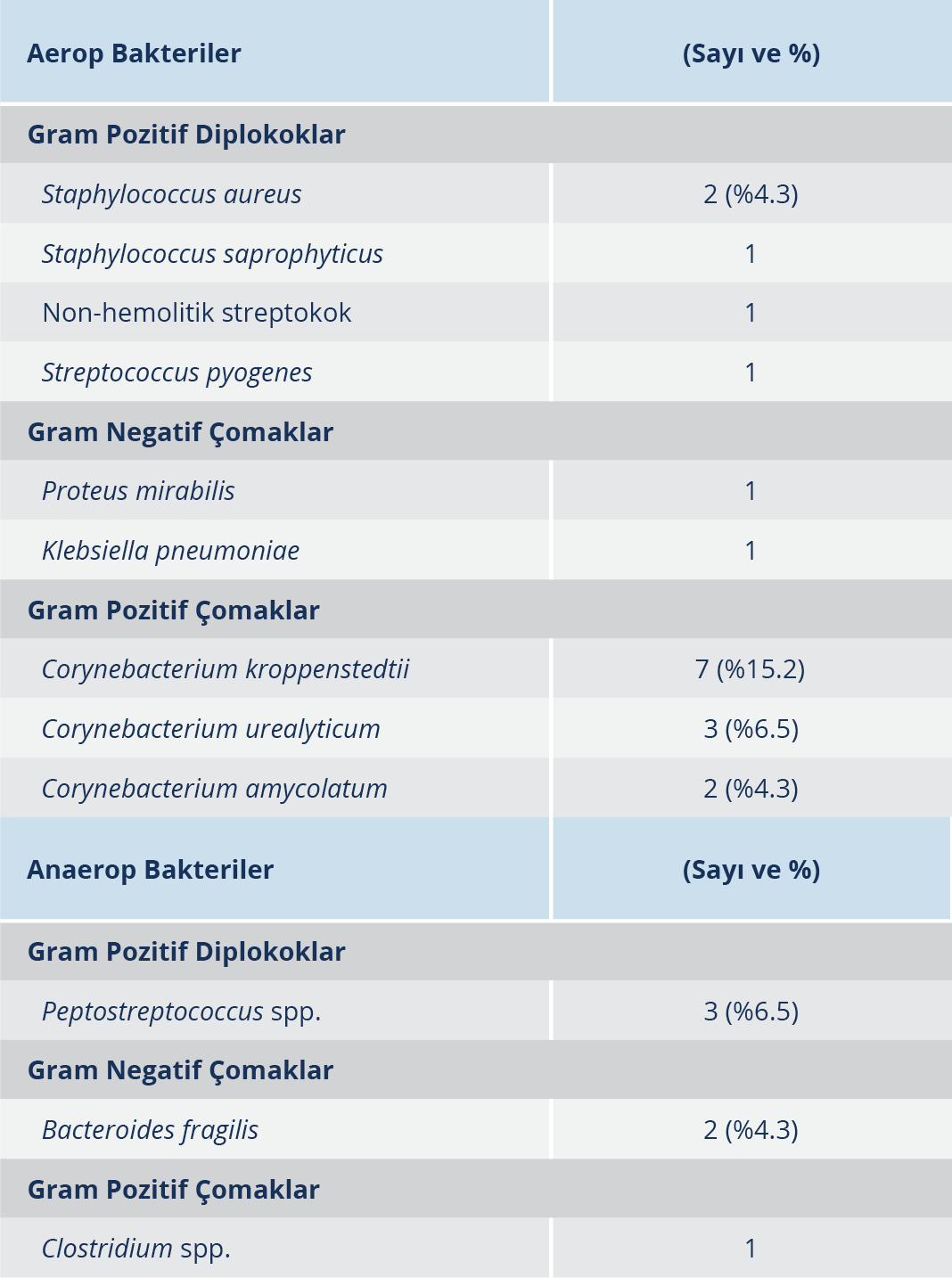
Hastaların kültür sonuçları değerlendirildiğinde 20 (%43.7)’sinde üreme görülürken 26 (%56.5)’sında üreme saptanmamıştır. Gram pozitif çomaklardan Corynebacterium türlerinin, 46 hastanın 12 (%26.1)’sinde üremesi dikkati çekmiştir. Hastaların 7 (%15.2)’sinde Corynebacterium kroppenstedtii, 3 (%6.5)’ünde C. urealyticum, 2 (%4.3)’ sinde C. amycolatum üremiştir. Gram pozitif diplokoklardan Staphylococcus aureus’un hastalardan 2 (%4.3)’sinde; Staphylococcus saprophyticus, Streptococcus pyogenes ve non-hemolitik streptokok türlerinin ayrı ayrı yalnızca 1’er hastada; ve Gram negatif çomaklardan Klebsiella spp. ve Proteus spp.’ nin de yine 1’er hastada ürediği saptanmıştır (Tablo 2). Hastalarımızda üreyen anaerop bakterilerin dağılımını incelediğimizde 3 (%6.5) örnekle en fazla Peptostreptococcus spp. ürediği dikkati çekmiştir. Ayrıca 2 (%4.3) hastada Bacteroides fragilis, 1 hastada Clostridium spp. üremiştir. (Tablo 2).
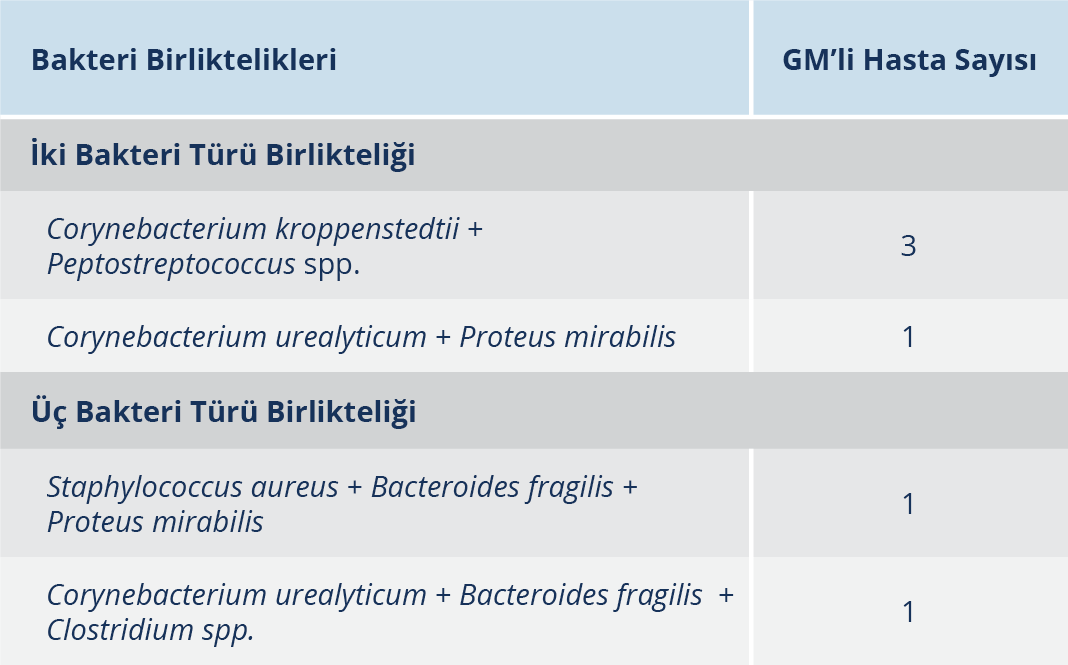
Araştırmamızda, üreme saptadığımız 20 GM’li hasta örneğinin 6 (%30)’sında farklı bakteri türleri birlikte üremiştir (Tablo 3).
Bakteri üremesi görülmeyen 26 hasta örneğinin 19 (%73)’unda direkt Gram boyamada polimorf nüveli lökositlerle birlikte bakteriler görüldüğünden, örnekler moleküler yöntemlerle ileri incelemeye alınmıştır.
GM’li hastalarda üreyen aerop bakterilerin antibiyotiklere direnç durumlarını belirlemek için yaptığımız disk difüzyon yöntemi sonuçları, EUCAST 2016 dokümanına göre değerlendirilmiştir (10). Buna göre Gram pozitif diplokoklardan, metisiline duyarlı Staphylococcus aureus (MSSA) suşlarında eritromisin direnci 2 suşta, klindamisin ve linezolid direnci 1’er suşta saptanmıştır. Metisiline duyarlı Staphylococcus saprophyticus suşu ise klindamisine ve eritromisine dirençli olarak bulunmuştur. İzole edilen 1 non-hemolitik streptokok suşu; penisiline, amoksisilin/klavulonik aside, klindamisine, eritromisine ve trimetoprim/sülfametoksazola dirençli olarak tespit edilmiştir. Diğer bir streptokok türü olan Streptococcus pyogenes suşunda, eritromisin direnci saptanmıştır. İzole edilen Proteus spp. suşunda; ampisilin, seftriakson ve trimetoprim/sülfametoksazol direnci görülmüştür. İzole edilen 1 Klebsiella spp. suşu ise trimetoprim/sülfametoksazol ve siprofloksasine dirençli olarak bulunmuştur. Aerop Gram pozitif çomaklardan üretebildiğimiz tek tür olan Corynebacterium spp. suşlarında, siprofloksasin direncine 5 suşta, klindamisin direncine 3 suşta rastlanmış; buna karşın penisilin, gentamisin, vankomisin ve linezolid direnci hiçbir suşta saptanmamıştır.
Çalışmamızda, GM’li hastalarda üreyen anaerop bakterilere karşı, antibiyotiklerin MİK değerlerini belirlemek için yaptığımız gradyan test sonuçları da EUCAST 2016 dokümanına göre değerlendirilmiştir (10). Buna göre izole edilen Peptostreptococcus spp. suşlarından tümünün amoksisilin/klavulonik asit, imipenem ve klindamisine duyarlı olduğu; 1’inin penisiline, 1’inin metronidazola ve 1’inin sefoksitine dirençli suşlar olduğu saptanmıştır. İzole edilen 2 Bacteroides fragilis suşu, amoksisilin/klavulonik asit, imipenem, klindamisin ve metronidazole duyarlı; penisiline ve sefoksitine dirençli bulunmuştur. Benzer şekilde, izole edilen diğer bir anaerop Gram pozitif çomak olan 1 Clostridium spp. suşu da penisiline, amoksisilin/klavulonik asit, imipenem, klindamisin, metronidazol ve sefoksitine duyarlı bulunmuştur.
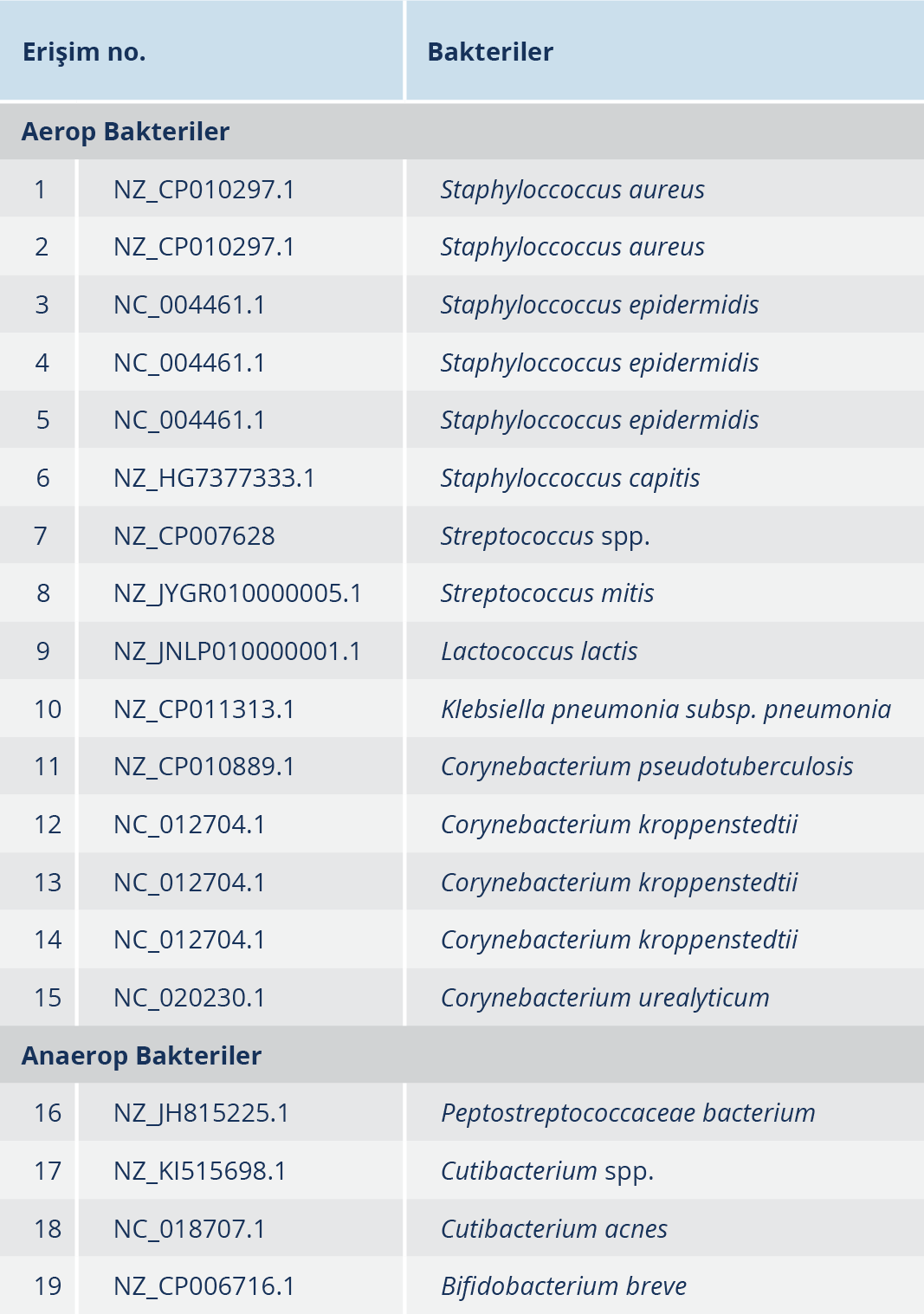
Tablo 4. BI 3730XL Cihazında Kromatogramlardan Elde Edilen FASTA Dizilerinin NCBI ve DSMZ Veri Bankaları Kontrolü Sonrası Oluşturulmuş Sonuçları
GM’li 46 hastamızın 19’unda direkt Gram boyamada bakteri görüldüğü halde, yapılan kültürlerde bakteri üremesine rastlanmamıştır. Kültürlerde bakterilerin üretilemediği 19 cerahat örneğinden yapılan 16S rRNA’nın PZR amplifikasyonu sonucunda elde edilen bakteri DNA’larının FASTA dizilerine göre 2 örnekte Staphyloccoccus aureus, 3 örnekte Staphyloccoccus epidermidis, 3 örnekte Corynebacterium kroppenstedtii ve 1’er örnekte Staphyloccoccus capitis, Streptococcus spp., Streptococcus mitis, Lactococcus lactis, Klebsiella pneumoniae, Corynebacterium pseudotuberculosis ve Corynebacterium urealyticum izole edilmiştir. Anaerop bakterilerden ise 1’er örnekte Peptostreptococcaceae bacterium Cutibacterium spp., Cutibacterium acnes ve Bifidobacterium breve izole edilmiştir. Moleküler yöntemlerle yapılan çalışmalara dahil edilen her bir örnekte yalnızca bir tür saptanabilmiştir (Tablo 4). 16S rRNA’nın PZR amplifikasyonu sonucunda elde edilen bakteri DNA’larının FASTA dizilerine göre bakteri türlerinin saptanmasında kullanılan bakteri genomlarından; Staphylococcus epidermidis ATCC 12228 genomu ve Corynebacterium kroppenstedtii DSM 44385 genomu Şekil 1 ve 2’de yer gösterilmiştir.
TARTIŞMA
Ülkemizde GM’li hastaların kliniğine yönelik oldukça fazla araştırma olmasına rağmen infeksiyona neden olan mikroorganizmaların oranına ve tür dağılımına yönelik araştırma yok denecek kadar azdır
Ülkemizin bulunduğu coğrafi konumun yanı sıra, beslenme alışkanlıkları, kadınların doğum yapma sayısı, kadının aile içindeki ve çalışan kadın olarak toplumdaki yeri göz önünde bulundurulduğunda, GM tanısı almış hastaların yaş ortalamalarının bilinmesi, toplumumuzda mastitli hastaların yaş ortalamalarında görülebilecek değişimlerin izlenebilmesi açısından önem taşımaktadır.
Araştırmamıza dahil edilen GM’li 46 hastanın yaş ortalaması 34.5’tur. Bulgularımıza benzer şekilde Kok ve arkadaşları (11), 2010 yılında yayınladıkları araştırmalarında 43 GM tanısı almış hastada yaş ortalamasını 34 olarak bildirmiştir. Ülkemizde, Akbulut ve arkadaşları (12), 2011 yılında GM’li hastalar ile yaptıkları çalışmada yaş ortalamasını 33.2 olarak saptarken Parlakgümüş ve arkadaşları (13) 2012 yılında 36 olarak saptamıştır.
Araştırmamızda, GM’li hastaların 28 (%60.8)’inde önceden geçirilmiş mastit öyküsü tespit edilmiştir. Ammari ve arkadaşları (14), 2002 yılında gerçekleştirdikleri çalışmada, 29 GM’li hastadan 4 (%11)’ünün önceden geçirilmiş mastit öyküsü bulunduğunu bildirmiştir. Bu sonuçlara göre araştırmamıza dahil olan mastitli hastalarda diğer uluslararası verilere göre daha yüksek oranda önceden geçirilmiş bir mastit öyküsü olduğu dikkati çekmektedir. Bu durumun; ülkemizde gerçekleşen doğum sayısı, tedavideki aksamalar ve buna bağlı gelişen nükslerle ilişkili olabileceği görüşündeyiz.
Araştırmamıza dahil edilen hastaların sigara kullanımının %60.8 olarak oldukça yüksek bir oranda olduğu tespit edilmiştir. Ülkemizde gerçekleştirilen üç farklı çalışmada ise bu oran %37.5, %19 ve %35 olarak bildirilmiştir (13, 15, 16). Çalışmamızda saptanan yüksek sigara kullanım oranı, kaynaklarda bildirilen oranların oldukça üstündedir.
GM’li hastalarımızın örneklerinde en sık üretilen aerop bakterinin Corynebacterium türleri olduğu dikkati çekmektedir. Bunu Staphylococcus aureus ve Enterobacteriaceae ailesinden Proteus mirabilis ve Klebsiella pneumoniae takip etmektedir. Yine araştırma sonuçlarımıza göre hasta grubumuzda en sık üretilen anaerop bakteri Peptostreptococcus spp. olup bunu Bacteroides fragilis izlemektedir. Ayrıca, Clostridium spp.’nin de etkenler arasında bulunduğu gösterilmiştir.
GM etyolojisinde bakterilerin rolünü araştıran kaynaklarda, mastitli bölgeden alınan doku veya cerahat örneklerinin gerek konvansiyonel yöntemlerle gerekse moleküler yöntemlerle, Corynebacterium türlerinin ve özellikle C. kroppenstedii’nin diğer bakterilere göre çok daha yüksek sıklıkta izole edilmesi dikkat çekmiştir. Deri mikrobiyotası üyeleri arasında bulunan bu bakterilerin etken mi yoksa kontaminant mı olduğu tartışılırken; bu bakterinin etyolojideki rolü incelenmeye değer bulunduğu için pek çok çalışma GM ile Corynebacterium spp. ilişkisine yer vermiştir. Özellikle, örneğin alınma şekli yüzeyel akıntıdan “swap” ile değil de doku biyopsisi veya iğne aspirasyonu olduğunda, Gram boyamada polimorf nüveli lökositlele birlikte görülen bakterilerin kültürde üretilmesi halinde bunların etken olma olasılığının çok daha yüksek olduğuna değinilmiştir. S. epidermidis ve S. aureus’un yanı sıra başta C. striatum olmak üzere bazı Corynebacterium türlerinin biyofilm oluşturduğu belirlendikten sonra lipofilik bir doku içinde bu bakterilerin davranışları da ayrıca merak konusu olmuştur (17, 18).
Corynebacterium türlerinin GM’li olgulardaki varlığı birçok araştırmacının dikkatini çekmiş ancak üretimde başarı sağlanamadığı bildirilmiştir (19-24). Flèche-Matéos ve arkadaşları (19), GM’li bir olguda direkt Gram boyamada bakteri görülmediği halde Corynebacterium kropenstedii’nin ürediğini belirtmiştir. Paviour ve arkadaşları (20), 15 mastitli hastadan üretilen 19 Corynebacterium türünü bildirmiş ve bunların 14’ünün Corynebacterium kropenstedii, 2’sinin C. tuberculostearicum ve 3 ünün C. amycolatum olduğunu belirtmiştir.
Araştırmamızda en sık üreyen bakterinin Corynebacterium spp. olduğu belirlenmiştir. PZR ile yapılan araştırmalarımız sonucunda da hastalarda, 5 Corynebacterium DNA’sı saptanmış olup hasta grubumuzun 17 (%36.9)’sinde Corynebacterium tespit edilmiştir. Taylor ve arkadaşlarının (21), gen sekanslama yöntemi ile gerçekleştirdikleri çalışmada, 34 GM’li hasta örneğinin 24 (%70.6)’ünde lipofilik Corynebacterium spp. izole ettikleri bildirilmiştir. GM’li hastalarımızda, saptanan Corynebacterium türleri arasında C. pseudotuberculosis, C. kroppenstedtii ve C. urealyticum’un yer aldığı görülmektedir. Taylor ve arkadaşları (21) çalışmalarında, GM’li hastalarda C. kropenstedii oranını %41 olarak tespit etmiştir. Ang ve arkadaşları (22), çalışmalarında C. accolens türünü bir GM’li hastadan izole ettiklerini bildirmiştir. Bizim araştırmamızda ise gerek kültürle gerekse PZR ile saptayabildiğimiz Corynebacterium türleri arasında C. accolens türüne rastlanmamıştır. Ülkemizde GM’li olgulardan alınan cerahatlerde Corynebacterium varlığını gösteren iki araştırma bulunmaktadır. Parlakgümüş ve arkadaşları (13), 28 granülomatöz mastit tanısı almış hastadan alınan örneklerden üretilen suşlardan 1’inin difteroid basil olduğunu belirtmiş ancak tür tanımına gidememiştir (13). Özaydın ve arkadaşları (23) ise, GM’li 1 olguda Corynebacterium amycolatum üretmiştir.
Araştırmamızda, GM’li olgularda ikinci sıklıkta üretilen bakteri Staphylococcus aureus olup bunu streptokoklar izlemektedir. Oran ve arkadaşları (16), 11 GM’li hastadan aldıkları cerahat örneklerinin 5 (%45)’inde S. aureus’u, 3 (%27)’ünde Streptococcus spp’yi izole ettiklerini belirtmiştir. Olgularımızda S. aureus dışında, kültürle S. epidermidis saptamamıza rağmen PZR yöntemiyle 3 örnekte S. epidermidis varlığını belirledik. Bu oran, S. aureus oranımız gibi Sandhu ve arkadaşlarının (13) %25 ve Parlakgümüş ve arkadaşlarının (25) %14.3 olan S. epidermidis oranından düşüktür.
S. saprophyticus, insanda özellikle idrar yolu epiteline tutunabilme özelliği ile bilinen bir bakteridir ve idrar yolu infeksiyonlarına neden olduğu bildirilmiştir (26). S. saprophyticus saptadığımız 1 hastamızın mastit sırasında üriner sistem infeksiyonu geçiriyor olması bizim için oldukça ilginç ve bulgumuzu destekleyici bir veri olmuştur. Araştırmamızda, cerrahi hekimlerin örnek alınacak bölgenin cilt antisepsisi için povidon iyot içeren Betadix %7.5 SCRUM (Naturel Medikal, Türkiye) kullanarak deri dezenfeksiyonuna özen gösterdiği ve böylece flora bakterilerinin örneğe kontaminasyonunun titizlikle önlendiğini bildiğimizden; üreyen bakterilerin deriden kontamine olma olasılığı düşünülmemiştir. Hasta grubumuzda, 1 S. saprophyticus suşu üretilmiş ve 1 S. capitis DNA’sı PZR ile saptanmıştır. Ayrıca kültürle 1 S. pyogenes suşu üretilmiş ve PZR ile 1 S. mitis DNA’sı ve türü kesin olarak tanımlanamayan bir Streptococcus spp. DNA’sı saptanmıştır.
Hasta grubumuzda saptadığımız diğer bakteriler Enterobacteriaceae ailesinde yer alan Klebsiella ve Proteus’tur. GM’li olgularda bu bakterilerin varlığına sık olmamakla birlikte değinilmiştir (25, 27).
Hasta örnekleri ile gerçekleştirdiğimiz anaerop kültürler sonucunda; anaerop Gram pozitif diplokoklardan Peptostreptococcus spp., anaerop Gram negatif çomaklardan Bacteroides fragilis ve anaerop Gram pozitif çomaklardan Clostridium spp. izole edilmiştir. Hastalarımızda (3 olgu), anaerop kültür ile en sık üretebildiğimiz bakteri Peptostreptococcus spp.’dir. Bunu %4.3 oranında saptadığımız Bacteroides fragilis izlemektedir. Paviour ve arkadaşlarının (14) yanı sıra Ammari ve arkadaşları (20), GM’li hastalarda benzer şekilde sıklıkla Peptostreptococcus spp. izole ettiklerini ve bunu B. fragilisin izlediğini göstermiştir.
Araştırmamızda, gerçekleştirdiğimiz aerop ve anaerop kültürlerin sonucunda; yalnızca bir bakteri türü üreyen örneklerin yanı sıra birden fazla bakteri türünün bir arada ürediğini gözlediğimiz örneklere de rastladık. En sık rastladığımız bakteri birlikteliği hasta örneklerinin üçünde saptadığımız Corynebacterium spp. ve Peptostreptococcus spp. birlikteliğidir. Mastitli olguların sunulduğu diğer uluslararası çalışmalarda da bakteri birlikteliği bizim bulgularımıza benzer şekilde gösterilmiştir (20, 21, 25). Bu nedenle, saptadığımız bu bakteri birlikteliklerinin, tedavide uygulanacak antibiyotiklerin düzenlenmesi için önemli bir veri olacağı kanaatindeyiz.
Granülomatöz mastitli hastalardan alınan örneklerde üreyen bakterilerin büyük bölümünün cilt mikrobiyotası bakterileri arasında olması, izole edilen bakterilerin etken olup olmadığı konusunda tartışmalara neden olmuştur. Birçok kaynakta örnek alımının, rehberlerde belirtilen şekle uygun olarak deri dezenfeksiyonu sağlandıktan sonra, doku biyopsisi veya iğne aspirasyonu şeklinde yapıldığı belirtilmekte ve üretilen bakterilerin cilt mikrobiyotasına ait bakteriler olması halinde dahi henüz bu bakterilerin etyolojideki rolü kesin olarak açıklanamadığından, klinikte antibiyotik tedavisine gidilmektedir (28-32).
Günümüzde, laktasyonel mastitlerin etyolojisinde rolü olan bakterilerin bilinmesine ve tedavide çoğunlukla başarı sağlanmasına karşın; non-laktasyonel mastitlerin önemli bir bölümünü teşkil eden GM’lerin patogenezi ve etyolojisi kesin olarak bilinmemektedir. Tedavi yanıtında yaşanan güçlükler ve sıkça karşılaşılan nüksler nedeni ile bu hasta grubunda elde edilen her verinin üstünde durulmaya değer olduğu belirtilmektedir. Bakterilerin, GM etyolojisinde birincil rolü olduğunu gösteren çalışmaların yanı sıra, bu bakterilerin sekonder olarak klinik tabloya eklendiğini belirten çalışmaların da bulunması, primer neden düzelmedikçe antibakteriyel tedavi ile kalıcı başarı sağlanamayacağını ve nükslerle karşılaşılacağını göstermektedir. Diğer yandan son yıllarda yapılan çalışmalarda; özellikle granüloma içinde bulunan lipid vakuollerinde, Corynebacterium spp.’nin dikkat çekici oranlarda bulunması sonucunda daha iyi bir antibiyotik penetrasyonu sağlanması ve iyi bir doku konsantrasyonuna ulaşılması amacıyla lipofilik antibiyotiklerle uzun süreli tedaviler önerilmektedir (30, 31). Tedavi protokollerinin henüz tartışmalı olması tedavi yanıtında güçlüklere neden olan diğer önemli bir faktör olarak karşımıza çıkmaktadır (33-35).
Mastit tedavisinde kesin çözüme ulaşmak ya da nükslerin önüne geçebilmek için dikkat edilecek önemli noktalardan biri etkene yönelik antibiyotik kullanımını tercih etmektir. Dirençli suşların ortaya çıkmasında uygulanan antibiyotik politikalarının rolünün büyük olduğu düşünüldüğünde; etkenlerin saptanması ve antimikrobiyal duyarlılıklarının belirlenmesi, aşırı ve kontrolsüz antibiyotik kullanımının önlenmesi açısından önem taşımaktadır (33-36). Mastit tedavisinde, geniş spektrumlu antibiyotiklerin yaygın kullanımının, infeksiyona neden olan etkenlerde antibiyotik direnç oranlarının artışına neden olduğu ve amoksisilin/klavulonik asit gibi kombine antibiyotik kullanımlarından olabildiğince kaçınılması gerektiği önerilmiştir (24, 25).
Hasta örneklerinden izole ettiğimiz; 2 MRSA suşunda penisilin, seftriakson ve amoksisilin/klavulonik asit direncine, Staphylococcus saprophyticus suşunda klindamisin ve eritromisin direncine, Streptococcus pyogenes suşunda eritromisin direncine ve Corynebacterium spp. suşlarında siprofloksasin direncine rastlanmıştır. İzole edilen 1 non-hemolitik streptokok suşu, penisilin, amoksisilin/klavulonik asit, klindamisin, eritromisin ve trimetoprim/sülfametoksazole; Proteus mirabilis suşu, ampisilin, seftriakson, trimetoprim/sülfametoksazole; ve izole edilen Klebsiella spp. suşu ise trimetoprim/sülfametoksazol ve siprofloksasine dirençli olarak saptanmıştır. Bulgularımız ulusal ve uluslararası çalışmalarda belirtilen direnç oranları ile örtüşmektedir (16, 19, 22, 26, 36).
Örneklerimizden ürettiğimiz Peptostreptococcus spp. suşlarından tümünün amoksisilin/klavulonik asit, imipenem ve klindamisine duyarlı olduğu, 1’inin penisiline, 1’inin metronidazol ve 1’inin sefoksitine dirençli suşlar olduğu saptanmıştır. Anaerop bakterilerde, antimikrobiyal direncin hızla arttığı pek çok çalışmada belirtilmektedir (37-40). Özellikle penisilin direncindeki artışın penisilinaz ve beta-laktamaz oluşturan anaeroplarda korkutucu düzeyde arttığı öne sürülmektedir (38). Peptostreptococcus spp.’de penisilin MİK değerlerinin 8 mg/L’ye ulaştığını belirten çalışmalar bulunmaktadır (37). Bu durum bir beta-laktam antibiyotik olan sefoksitini de kapsamaktadır. Peptostreptococcus spp. için uluslararası çalışmalarda klindamisin direncinin %10’a kadar ulaştığı bildirilmiştir (38). Ülkemizde ise peptostreptokokların antimikrobiyal direncine değinen güncel bir araştırma bulunmamaktadır. Kornea apselerinden izole edilen Peptostreptococcus anaerobius suşlarında %13.3 oranında klindamisin direnci saptandığını belirten ulusal bir yayınla bizim araştırmamızda saptadığımız %11.1’lik direnç uyuşmaktadır (39).
Bacteroides fragilis grubu bakteriler, beta-laktamaz yapan ve klinik kullanımdaki antibiyotiklere yüksek oranda direnç geliştiren bakteriler olarak bilinmektedir. Araştırmamızda ürettiğimiz 2 B. fragilis suşunun, penisilin ve sefoksitine dirençli olduğu belirlenmiştir. Brook ve arkadaşları (38) araştırmalarında, sefoksitin dirençli Bacteroides fragilis kökenlerinde MİK değerinin 64 mg/L’nin üzerinde olduğuna ve %4 – %25 arasında değişen bir sefoksitin direncine işaret etmiştir. Ülkemizde, Bacteroides fragilis kökenlerinin güncel sefoksitin direncine değinen bir araştırma bulunmamaktadır. Ancak penisilin dirençli B. fragilis’lerde MİK değerinin 256 mg/L’ye kadar ulaştığı belirtilmektedir (40).
Araştırmamız süresince GM’li 19 hastanın örneğinde Gram boyamasında bakteriler görüldüğü halde kültürde üreme olmadığı saptanmıştır. GM’li hastalarda kültürde üremelerin olmadığı birçok çalışmada belirtilmiştir (20-22). Bu nedenle son yıllarda, moleküler yöntemleri kullanan araştırmalar dikkati çekmektedir. Taylor ve arkadaşları (21), 16S rRNA gen analizi ile GM’li olguların 14’ünde Corynebacterium kroppenstedtii saptamıştır. Paviour ve arkadaşları (20) ise kültürde ürettikleri 19 Corynebacterium izolatının tür tanımını 16S rRNA gen analizi ile gerçekleştirmiş;14’ünün Corynebacterium kroppenstedtii, 2’sinin Corynebacterium tuberculostearicum ve 3’ünün Corynebacterium amycolatum olduğunu tespit etmiştir (20). Çalışmamızda da, direkt Gram boyamada Gram pozitif çomak saptadığımız ancak kültürde bakteri üretemediğimiz 5 örneğin 3’ünde Corynebacterium kroppenstedtii, 1’inde Corynebacterium uralyticum ve diğer 1’inde Corynebacterium pseudotuberculosis’i 16S rRNA gen analizi ile saptadık. Ayrıca,16S rRNA’nın PZR amplifikasyonu sonucunda elde edilen bakteri DNA’larının FASTA dizilerine göre 1 örnekte Lactococcus lactis izole edilmiştir. Uluslararası literatürde insandan izole edildiğini belirten bir kaynağa rastlanmamıştır. Hayvan mastitlerinde ise gittikçe önemi artan yaygın patojen olarak bildirilmiştir (41). Ülkemizde non-laktasyonel mastitli olgularda PZR ile bakteri saptayan herhangi bir çalışmaya rastlamadığımız gibi; mastitli olgularda, Bifidobacterium brevi varlığını gösteren ulusal ya da uluslararası hiçbir çalışmaya da rastlamadık.
Granülomatöz mastitin bir alt grubu olarak bilinen ve sıklıkla görülen tüberküloz mastitli hastaların çalışma grubumuzdan dışlanması, nadir de olsa GM’li hastalarda etken olarak rastlanabilen virüs ve mantarların araştırmamıza dahil edilmemesi ve az sayıda hasta ile çalışılması nedeniyle sınırlı veri elde edilmiş olması bu araştırmanın en önemli kısıtlılıkları olarak belirlenmiştir.
Sonuç olarak, infeksiyona neden olan bakterilerde direnç gelişimine yol açabilecek geniş spektrumlu antibiyotikleri içeren empirik tedavi protokollerinin uygulanmasından ziyade aerop/anaerop etkenlerin belirlenerek etkene spesifik tedavi uygulanmasının anlamlı olacağı kanısındayız. Özellikle etkenlerin üretilmesinde güçlükler yaşanan GM’li olgularda, Gram pozitif çomaklara (Corynebacterium türlerine) etkili penisilin, vankomisin ve linezolid gibi yağ dokuya penetrasyonu güçlü olan antibiyotiklerin tedaviye eklenmesi yararlı olacaktır.
Hasta Onamı
Hastalardan bilgilendirilmiş onam formu alınmıştır.
Etik Kurul Kararı
Çalışma için T.C. İstanbul Üniversitesi Cerrahpaşa Tıp Fakültesi Dekanlığı Klinik Araştırmalar Etik Kurulu’ndan 06 Kasım 2014 tarih ve 235851 karar numarasıyla onay alınmıştır.
Danışman Değerlendirmesi
Bağımsız dış danışman.
Yazar Katkıları
Fikir/Kavram – H.B.T.; Tasarım – H.B.T., E.G., M.V., V.Ç., B.M., Z.T.; Denetleme – H.B.T., Z.T.; Kaynak ve Fon Sağlama – H.B.T., Z.T., E.G., M.V., V.Ç., B.M., N.K.; Malzemeler/Hastalar – H.B.T., Z.T., E.G., M.V., V.Ç., F.D., Y.K., B.M.; Veri Toplama ve/veya İşleme – Z.T., M.V., M.D., S.V., B.M.; Analiz ve/veya Yorum – H.B.T., B.S.K., Z.T., M.V., M.D., S.V.; Literatür Taraması – Z.T., M.V., H.Ö.D.; Makale Yazımı – H.B.T., Z.T., M.V., B.M., E.G., V.Ç., F.D., S.V., M.D., Y.K., H.Ö.D., N.K., B.S.K.; Eleştirel İnceleme – H.B.T., Z.T., M.V., B.M., E.G., V.Ç., F.D., S.V., M.D., Y.K., H.Ö.D., N.K., B.S.K.
Çıkar Çatışması
Yazarlar herhangi bir çıkar çatışması bildirmemiştir.
Finansal Destek
Bu çalışma 2015 yılında İstanbul Üniversitesi Bilimsel Araştırma Projeleri Birimi tarafından desteklenmiştir. (Proje ID: 2378 / 48735)
Sunulduğu Bilimsel Etkinlik
02-05 Mart 2016 tarihinde Hindistan’ın Haydarabad kentinde düzenlenen 17. Uluslararası İnfeksiyon Hastalıkları Kongresi (17th International Congress on Infectious Diseases – ICID)’nde poster olarak sunulmuştur.
Teşekkür
İstanbul Üniversitesi Bilimsel Araştırma Projeleri Birimi’ne verilen destek için teşekkür ederiz.
Referanslar
- Şen-Oran E, Özkan-Gürdal S, Soybir GR. Mastitler. J Breast Health. 2013;9(1):1-4.
- Asoglu O, Ozmen V, Karanlık H, et al. Feasibility of surgical management in patients with granulomatous mastitis. Breast J. 2005;11(2):108-14. [CrossRef]
- Dixon JM, Khan LR. Treatment of breast infection. BMJ. 2011;342-d396. [CrossRef]
- Kvist LJ. Toward a clarification of the concept of mastitis as used in empirical studies of breast inflammation during lactation. J Hum Lact. 2010;26(1):53-9. [CrossRef]
- Arroyo R, Martín V, Maldonado A, Jiménez E, Fernández L, Rodríguez JM. Treatment of infectious mastitis during lactation: antibiotics versus oral administration of Lactobacilli isolated from breast milk. Clin Infect Dis. 2010;50(12):1551-8. [CrossRef]
- Mızraklı T. Granülomatöz mastit tanılı hastalarda tanı ve tedavi yaklaşımı. [Tıpta uzmanlık tezi]. İstanbul Üniversitesi, Cerrahpaşa Tıp Fakültesi; 2012.
- Sabel M. Essentials of the Breast Disease. 5th ed. Philadelphia: Mosby Elsevier; 2009:83-90.
- Kumar S, Nei M, Dudley J, Tamura K. MEGA: A biologist-centric software for evolutionary analysis of DNA and protein sequences. Brief Bioinform. 2008;9(4):299-306. [CrossRef]
- The National Center for Biotechnology Information, U.S. National Library of Medicine Databases [İnternet]. [erişim 09 Ocak 2021] http://www.ncbi.nlm.nih.gov
- Breakpoint tables for interpretation of MICs and zone diameters. Version 6.0, 2016 [İnternet]. The European Committee on Antimicrobial Susceptibility Testing. [erişim 06 Ocak 2021]. http://www.eucast.org
- Kok KYY, Telisinghe PU. Granulomatous mastitis: presentation, treatment and outcome in 43 patients. Surgeon. 2010;8(4):197-201. [CrossRef]
- Akbulut S, Arikanoglu Z, Senol A, et al. Is methotrexate an acceptable treatment in the management of idiopathic granulomatous mastitis? Arch Gynecol Obstet. 2011; 284(5):1189-95. [CrossRef]
- Parlakgümüş A, Yıldırım S, Bolat F, et al. Comparison of conservative therapy with steroids and surgical treatment for idiopathic granulomatous mastitis: Our clinical experience. Turk J Surg. 2012;28:134-8. [CrossRef]
- Ammari FF, Yaghan RJ, Omari AK. Periductal mastitis. Clinical characteristics and outcome. Saudi Med J. 2002;23(7):819-22.
- Ocal K, Dag A, Turkmenoglu O, Kara T, Seyit H, Konca K. Granulomatous mastitis: clinical, pathological features, and management. Breast J. 2010;16(2):176-82. [CrossRef]
- Şen-Oran E, Özkan-Gürdal S, Yankol Y, et al. Management of idiopathic granulomatous mastitis diagnosed by core biopsy: a retrospective multicenter study. Breast J. 2013;19(4):411-8. [CrossRef]
- Williams M, McClintock A, Bourassa L, Laya M. Treatment of granulomatous mastitis: Is there a role for antibiotics? Eur J Breast Health. 2021;17(3):239-46. [CrossRef]
- Leal S, Jones M, Gilligan P. Clinical significance of commensal Gram-positive rods routinely isolated from patient samples. J Clin Microbiol. 2016;54(12):2928–36. [CrossRef]
- Le Flèche-Matéos A, Berthet N, Lomprez F, et al. Recurrent breast abscesses due to Corynebacterium kroppenstedtii, a human pathogen uncommon in Caucasian women. Case Rep Infect Dis. 2012;2012:120968. [CrossRef]
- Paviour S, Musaad S, Roberts S, et al. Corynebacterium species isolated from patients with mastitis. Clin Infect Dis. 2002;35(11):1434-40. [CrossRef]
- Taylor GB, Paviour SD, Musaad S, Jones WO, Holland DJ. A clinicopathological review of 34 cases of inflammatory breast disease showing an association between corynebacteria infection and granulomatous mastitis. Pathology. 2003;35:109-19.
- Ang LM, Brown H. Corynebacterium accolens isolated from breast abscess: possible association with granulomatous mastitis. J Clin Microbiol. 2007;45:1666-8. [CrossRef]
- Özaydın İ, Yıldırım M, Şahin İ, Doğan S. Recurrent breast abscess caused by Corynebacterium amycolatum: A case report. Turk J Med Sci. 2009;39(1):147-9.
- Leborgne F. Treatment of breast abscesses with sonographically guided aspiration, irrigation, and instillation of antibiotics. AJR Am J Roentgenol. 2003;181(4):1089-91. [CrossRef]
- Sandhu GS, Gill HS, Sandhu GK, Gill GP, Gill AK. Bacteriology in breast abscesses. Sch J App Med Sci. 2014;2(4):1469-72.
- Huebner J, Goldmann DA. Coagulase-negative Staphylococci: Role as pathogens. Annu Rev Med. 1999;50: 223-36. [CrossRef]
- Ramalingam K, Srivastaa A, Vuthaluru S, Dhar A, Chaudhry R. Duct ectasia and periductal mastitis in Indian women. Indian J Surg. 2015;77(3):957-62 [CrossRef]
- Janoff EN, Musher DM. Streptococcus pneumoniae. In: Mandell GL, Bennett JE, Dolin R, eds. Mandell, Douglas, and Bennett’s Principles and Practice of Infectious Diseases. 8th ed. Philadelphia, PA: Elsevier/Saunders, 2014: 2279-80.
- Funke G, Graevenitz A, Clarridge J, Bernard K. Clinical microbiology of coryneform bacteria. Clin Microbiol Rev.1997;10(1):125-59. [CrossRef]
- Johnson MG, Leal S, Plongla R, Leone PA, Gilligan PH. The brief case: Recurrent granulomatous mastitis due to Corynebacterium kroppenstedtii. J Clin Microbiol. 2016;54(8):1938-41. [CrossRef]
- Dobinson HC, Anderson TP, Chambers ST, Doogue MP, Seaward L, Werno AM. Antimicrobial treatment options for granulomatous mastitis caused by Corynebacterium species. J Clin Microbiol. 2015;53(9):2895-9. [CrossRef]
- Angelopoulou A, Field D, Ryan CA, Stanton C, Hill C, Ross RP. The microbiology and treatment of human mastitis. Med Microbiol Immunol. 2018;207(2):83-94. [CrossRef]
- Nair CG, Hiran, Jacob P, Menon RR, Misha. Inflammatory diseases of the non-lactating female breast. Int J Surg. 2015;13:8-11. [CrossRef]
- Bharat A, Gao F, Aft RL, Gillanders WE, Eberlein TJ, Margenthaler JA. Predictors of primary breast abscesses and recurrence. World J Surg. 2009;33(12):2582-6. [CrossRef]
- Kvist LJ, Larsson BW, Hall-Lord ML, Steen A, Schalén C. The role of bacteria in lactational mastitis and some considerations of the use of antibiotic treatment. Int Breastfeed J. 2008;7:3-6. [CrossRef]
- Kataria K, Srivastava A, Dhar A. Management of lactational mastitis and breast abscesses: review of current knowledge and practice. Indian J Surg. 2013;75(6): 430-5. [CrossRef]
- Öztürkeri H, Düztaş O, Kocabeyoğlu Ö, Erdemoğlu A, Emekdaş G. Üriner infeksiyon etkeni Corynebacterium urealyticum ve Corynebacterium jeikeum’un idrar kültürlerinden izolasyon sıklığı ve antibiyotiklere duyarlılıkları. ANKEM Derg. 1999;13(4):474-8.
- Brook I, Wexler HM, Goldstein EJ. Antianaerobic antimicrobials: spectrum and susceptibility testing. Clin Microbiol Rev. 2013;26(3):526-46. [CrossRef]
- Bahar-Tokman H, Iskeleli G, Güngördü-Dalar Z, et al. Prevalence and antimicrobial susceptibilities of anaerobic bacteria isolated from perforated corneal ulcers by culture and multiplex PCR: An evaluation in cases with keratitis and endophthalmitis. Clin Lab. 2014;60(11):1879-86. [CrossRef]
- Bahar H, Altındaş M, Sarıbaş S, Altınkum S, Torun MM. Anaerobic microbiology of diabetic patients foot ulcers: a retrospective study of 180 cases. Cerrahpasa Med Rev. 2007;15(1):19-22.
- Wyder AB, Boss R, Naskova J, Kaufmann T, Steiner A, Graber HU. Streptococcus spp. and related bacteria: their identification and their pathogenic potential for chronic mastitis – a molecular approach. Res Vet Sci. 2011;91(3):349-57. [CrossRef]