En Çok Okunanlar
Özet
Amaç: Kolistin, karbapenem dirençli Gram-negatif bakteriler ile gelişen infeksiyonların tedavisinde kullanılan son seçenek antibiyotiktir. Kolistin duyarlılığının doğru olarak saptanması bu infeksiyonların tedavisinde önem arz eder. Kolistin duyarlılık testi için referans yöntem sıvı mikrodilüsyon olmakla birlikte uygulama zorluğu nedeniyle rutin laboratuvarlarda kullanımı sınırlıdır. Bu nedenle kullanımı kolay ve doğruluk oranı yüksek bir teste ihtiyaç vardır. Bu çalışmada, kolistin duyarlılığının saptanmasında sıvı mikrodilüsyon (SMD) referans yöntemini temel alan iki ticari test (Sensititre™ ve MIC-COL) ve kolistin agar tarama plağı yönteminin, referans yöntem ile performansının karşılaştırılması ve rutin laboratuvar pratiğinde kullanıma uygunluklarının araştırılması hedeflenmiştir.
Yöntemler: Çalışma kapsamında, karbapenem dirençli Klebsiella spp. (n=93), Acinetobacter baumannii-calcoaceticus kompleksi (n=83) ve Pseudomonas spp. (n=42) izolatlarında yöntemlerin performansı değerlendirilmiştir.
Bulgular: SMD yöntemiyle 218 izolatın 42 (%19.3)’sinde [K. pneumoniae (n=26), Acinetobacter baumannii-calcoaceticus kompleksi (n=9), P. aeruginosa (n=6), K. aerogenes (n=1)] kolistin direnci saptanmıştır. Sensititre™ (Thermo Fisher Scientific, Cleveland, ABD) paneli, MIC COL (Diagnostics Inc., Galanta, Slovakya) testi ve kolistin tarama plağı yöntemleri ile referans yöntemin kategorik uyum oranları sırasıyla %94.9, %96.3 ve 95.9 / 93.6 (24/48 saat) olarak belirlenmiştir. İki ticari testin temel uyum oranları, tüm izolatlar için %87’in üzerinde bulunmuştur. P. aeruginosa izolatlarında test edilen tüm yöntemlerde uyum oranları daha düşük saptanmıştır. Çok büyük hata oranları Acinetobacter baumannii-calcoaceticus kompleksi ve P. aeruginosa izolatlarında yüksek bulunmuştur.
Sonuçlar: Klebsiella spp. izolatlarında, ek ekipman ve tecrübe gerektirmeyen SMD yöntemi temelli ticari sistemlerin ve kolistin agar tarama plağının rutinde kullanılabileceği, ancak nonfermantatif basillerde bu yöntemlerle iyi sonuçlar alınsa da referans metot olan sıvı mikrodilüsyon ile konfirme edilmesi gerektiği düşünülmüştür.
GİRİŞ
Kolistin, Gram-negatif bakterilere karşı geniş spektrumlu aktiviteye sahip polipeptid bir antibiyotiktir. Nefrotoksik ve nörotoksik yan etkileri nedeniyle geçmişte kullanımı sınırlandırılmıştır. Son yıllarda, çoklu ve yaygın ilaç direnci gösteren Gram-negatiflerin prevalansının artması nedeniyle bu bakteriler ile gelişen infeksiyonlarda son seçenek antibiyotik olarak kolistin kullanımı artmıştır (1). Fakat kullanımının artmasına bağlı olarak bakterilerde kolistin direncinde artış meydana gelmiştir. Yapılan çalışmalarda çoklu ilaç direncine sahip Klebsiella pneumoniae, Acinetobacter baumannii-calcoaceticus kompleksi ve Pseudomonas aeruginosa izolatlarında %13-43 arasında kolistin direnci bildirilmiştir (2). Karbapenem dirençli bakteriler için yeni antibiyotikler kullanım onayı alsa da maliyetlerinin yüksek olması kullanımlarını sınırlandırmakta ve kolistin kullanımına ihtiyaç duyulmaktadır (3). Kolistin kullanımına duyulan ihtiyaç arttıkça kolistin duyarlılık testleri önem kazanmıştır. Ayrıca, çoklu ilaç dirençli Gram-negatif bakteriyel infeksiyonlarda in vitro kolistin direnç testlerinin sonuçları uygun antibiyoterapi için çok önemlidir (2).
Avrupa Antimikrobiyal Duyarlılık Testi Komitesi (EUCAST- European Committee on Antimicrobial Susceptibility Testing) ve Klinik ve Laboratuvar Standardları Enstitüsü (CLSI – Clinical and Laboratory Standards Institute) kolistin duyarlılık testi için ISO 20776-1:2019 sıvı mikrodilüsyon (SMD) referans yönteminin kullanılmasını önermektedir (4, 5). Fakat söz konusu yöntemin rutin laboratuvar pratiğinde uygulanması, yoğun emek gerektirmesi ve uzun sürmesi nedeniyle zordur (2). CLSI’nin yaptığı bir çalışmada, Enterobacterales, P. aeruginosa ve A. baumannii’de, kolistin sıvı disk elüsyon yöntemi (KSDE) ve kolistin agar test (KAT) yöntemi değerlendirilmiş olup SMD ile uyumları yüksek, hata oranları düşük bulunmuştur (6). Bu bulgular doğrultusunda güncel CLSI Rehberi, kolistin duyarlılığının saptanmasında SMD yöntemine ek olarak KSDE ve KAT yöntemlerinin kabul edilebilir olduğunu belirtmektedir (5). Laboratuvarlarda, antibiyotik duyarlılık testleri için sıklıkla kullanılan VITEK® 2 (bioMérieux, Marcy l’Etoile, Fransa), MicroScan (Siemens AG FWB, Almanya) ya da BD Phoenix (Becton Dickinson, Sparks, MD, ABD) gibi otomatize sistemlerin sonuçları “çok büyük hata” (ÇBH) oranları nedeniyle güvenilir bulunmamaktadır (7-9). Disk difüzyon ve gradyan testler, kolistin moleküllerinin agara difüzyonunun zayıf olmasına bağlı olarak yüksek oranda yanlış duyarlı sonuçlar alınmasına neden olmaktadır. Bu nedenle kullanılması önerilmemektedir (2, 8). SMD yöntemini temel alan, kullanımı kolay çeşitli ticari paneller geliştirilmiştir. Yapılan çalışmalarda bu panellerin SMD yöntemi ile uyumu genellikle yüksek bulunmaktadır (9-12). Son yıllarda, Nordmann ve arkadaşları (13) tarafından Gram-negatif bakteri kolonilerinden ve klinik örneklerden intrinsik ya da kazanılmış kolistin direncini saptamaya yönelik SuperPolymyxin™ agar tarama plağı geliştirilmiş olup duyarlılığı %72.7-100, özgüllüğü %88.9-100 arasında tespit edilmiştir (13).
Çalışmamızda, bir üniversite hastanesinde çeşitli klinik örneklerde saptanan karbapenem dirençli Gram-negatif basillerde, kolistin direncinin tespit edilmesinde; Sensititre™ (Thermo Fisher Scientific, Cleveland, ABD) paneli, MIC COL (Diagnostics, Galanta, Slovakya) testi ve kolistin agar tarama plağının performanslarının SMD yöntemi ile karşılaştırılması; yöntemlerin rutin kullanım açısından uygunluklarının yanı sıra avantaj ve dezavantajlarının belirlenmesi amaçlanmıştır.
GEREÇ VE YÖNTEMLER
Bakteri İzolatları
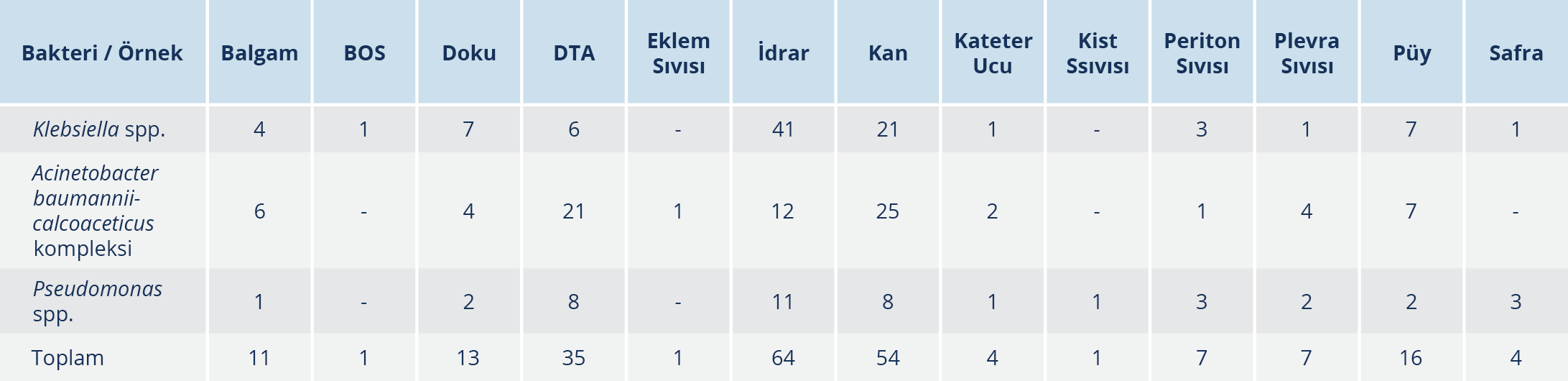
Çalışmaya, 1 Ocak 2020 ve 31 Ekim 2020 tarihleri arasında hastanemizin Klinik Mikrobiyoloji Laboratuvarı’na gelen çeşitli klinik örneklerden izole edilen karbapenem dirençli 218 Gram-negatif basil [K. pneumoniae (n=91), Klebsiella aerogenes (n=1), Klebsiella oxytoca (n=1), A. baumannii-calcoaceticus kompleksi (n=83), P. aeruginosa (n=41), Pseudomonas putida (n=1)] dahil edilmiştir. Her hastadan yalnızca bir izolat çalışmaya alınmıştır. Çalışmaya dahil edilen bakterilerin izole edildikleri örnek türüne göre dağılımı Tablo 1’de gösterilmiştir.
Çalışmaya dahil edilen bakteriler; Gram boyama, oksidaz testi, katalaz testi gibi konvansiyonel yöntemler ve matriksle desteklenmiş lazer dezorpsiyon iyonizasyon uçuş zamanı kütle spektrometrisi (MALDI-TOF-MS) sistemiyle (Bruker, Almanya) tanımlanmıştır. Karbapenem direnci; Klebsiella spp. ve Pseudomonas spp. izolatlarında, BD Phoenix M50 (Becton Dickinson, Sparks, MD, ABD) otomatize sistemi ve Etest® (bioMérieux, Marcy l’Etoile, Fransa ) yöntemi ile belirlenirken A. baumannii-calcoaceticus kompleksi izolatlarında EUCAST disk difüzyon yöntemi kullanılmıştır.
In Vitro Kolistin Duyarlılık Testleri
Kolistin minimum inhibitör konsantrasyon değerleri, ISO 20776-1:2019 SMD referans yöntemi kullanılarak belirlenmiştir (14). Ticari sıvı mikrodilüsyon panelleri olan Sensititre™ ve MIC COL, üretici firma talimatlarına göre hazırlanmıştır. Nordmann ve arkadaşları (13) tarafından kolistin direncini taramak için geliştirilen SuperPolymyxin™ agar tarama plağına benzer şekilde 3.5 µg/ml konsantrasyonda kolistin içeren eozin metilen mavisi (EMB) agarı laboratuvarımızda hazırlanmıştır (11). Kolistin direnci, daha önce Jayol ve arkadaşlarının (12) tanımladığı şekilde araştırılmıştır. Test edilecek bakteri 0.5 McFarland standardına ayarlanarak süspansiyon haline getirilmiş ve %0.9 NaCl içinde 1/10 oranında dilüe edilmiştir. Dilüsyondan, 10 mikrolitre alınarak agar yüzeyine inoküle edilmiştir. Plaklar 37 oC’lik etüvde aerobik koşullarda inkübe edilmiştir.
Sıvı mikrodilüsyon panelleri; 35±1 oC’de aerobik atmosferde, 16-20 saat inkübasyon sonunda görsel olarak okunmuştur. Üreme kontrol kuyucuğunda üreme olan ve atlamalı üreme olmayan (bir kuyucukta üreme olmazken daha yüksek konsantrasyonda antibiyotik içeren kuyucukta üreme olması) testler geçerli kabul edilmiştir. SMD yöntemi ve Sensititre™ panelinde üreme, kuyucuklarda bulanıklık oluşması ile değerlendirilmiştir. Kolorimetrik bir yöntem olan MIC COL testinde ise üreme, kuyucuklardaki rengin maviden pembeye değişimi ile belirlenmiştir. EUCAST 2021, v.11.0 “breakpoint table” sınır değerleri doğrultusunda, minimum inhibitör konsantrasyonu (MİK) değeri ≤2 µg/ml olan izolatlar duyarlı, >2 µg/ml olan izolatlar ise dirençli olarak değerlendirilmiştir (4). Kolistin tarama agarına yapılan ekimler sonucundaki üremeler 24. ve 48. saatlerde görsel olarak değerlendirilmiştir. Üreme olması izolatın kolistine dirençli olduğu, üreme olmaması ise kolistine duyarlı olduğu şeklinde yorumlanmıştır. Kalite kontrol için tüm deneylerde; E. coli ATCC 25922, P. aeruginosa ATCC 27853 ve E. coli NCTC 13846 (mcr-1 pozitif) izolatları kullanılmıştır.
Sonuçların Analizi
Her iki ticari sistemin referans yöntem ile temel uyum (TU) ve kategorik uyum (KU) oranları ISO standardları temel alınarak belirlenmiştir (14). KU, test edilen yöntemin referans yöntemle aynı duyarlılık kategorisinde sonuç vermesi [örtüşen (S, R) kategorik sonuç sayısı]; TU ise belirlenen MİK değerinin referans yönteme göre ±1 dilüsyonda olması olarak tanımlanmıştır. TU hesaplanırken, referans yöntem ve ticari panellerin konsantrasyon aralığındaki farklılıklar nedeniyle en yüksek ve en düşük MİK değerleri uyumlu kabul edilmiştir. Testlerin “çok büyük hata” (ÇBH) ve “büyük hata” (BH) oranları hesaplanmıştır. ÇBH referans yöntem ile dirençli bulunan bir izolatın test edilen yöntem ile duyarlı bulunması; BH ise referans yöntem ile duyarlı bulunan bir izolatın test edilen yöntem ile dirençli bulunması olarak tanımlanmıştır (15).
Çalışmamız, Hacettepe Üniversitesi Girişimsel Olmayan Klinik Araştırmalar Etik Kurulu tarafından 20.10.2020 tarih ve 16969557-1526 sayılı karar ile onaylanmıştır.
BULGULAR
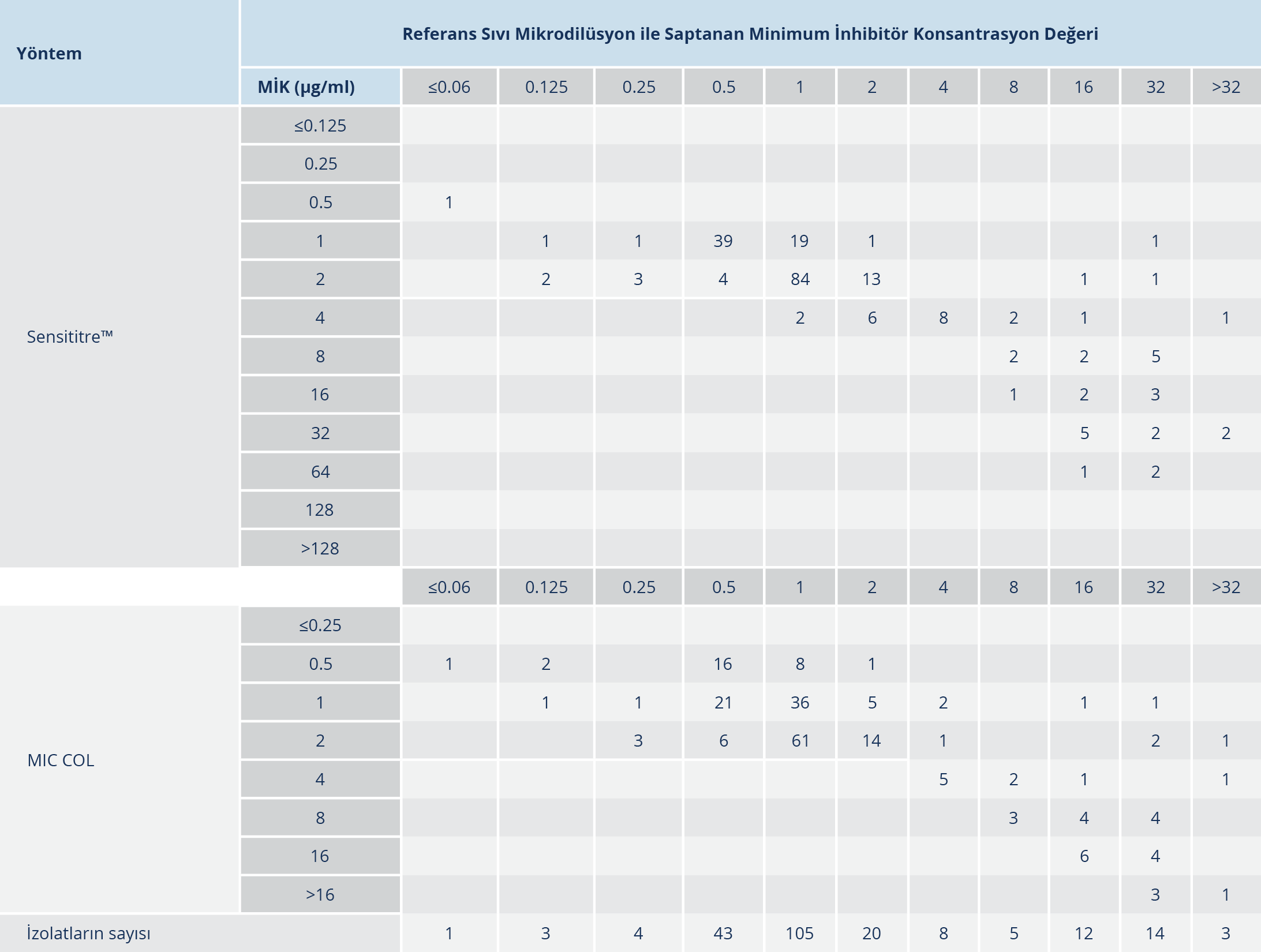
Tablo 3. Sıvı Mikrodilüsyon Yöntemleri ile Saptanan Minimum İnhibitör Konsantrasyon
Değerlerinin Dağılımı
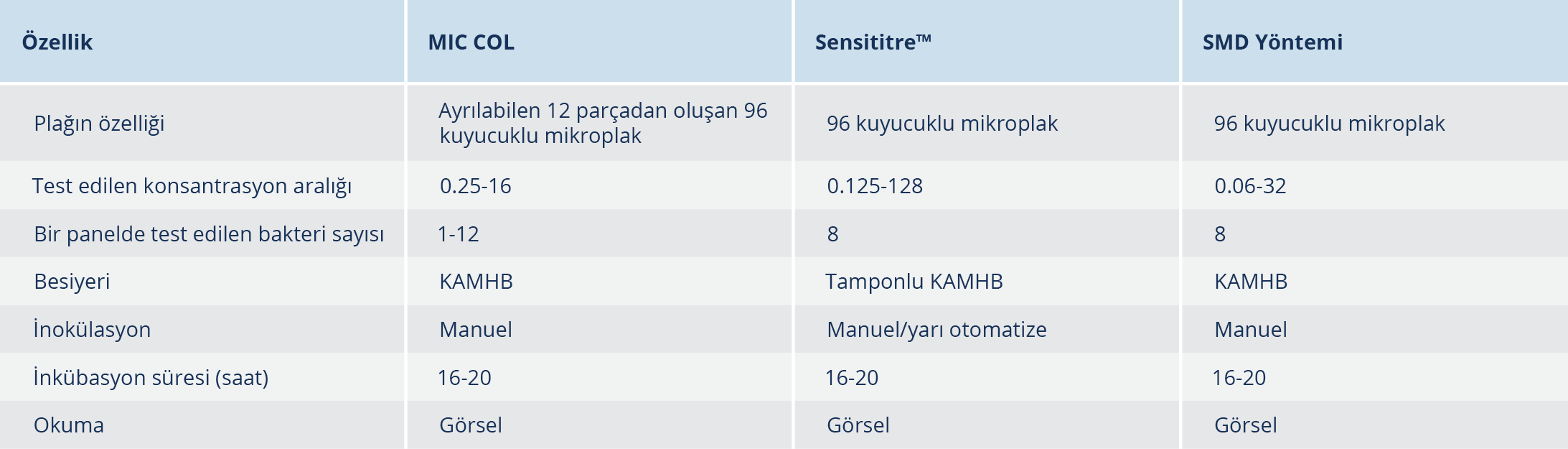
In vitro kolistin duyarlılık testinde kullanılan ticari panellerin (Sensititre™ ve MIC COL) ve SMD yönteminin genel özellikleri Tablo 2’de gösterilmiştir. SMD yöntemiyle 218 izolatın 42 (%19.3)’si [K. pneumoniae (n=26), A. baumannii-calcoaceticus kompleksi (n=9), P. aeruginosa (n=6), K. aerogenes (n=1)] kolistine dirençli bulunmuştur. SMD, Sensititre™ ve MIC COL yöntemleri ile elde edilen kolistin MİK dağılımları Tablo 3’te verilmiştir.
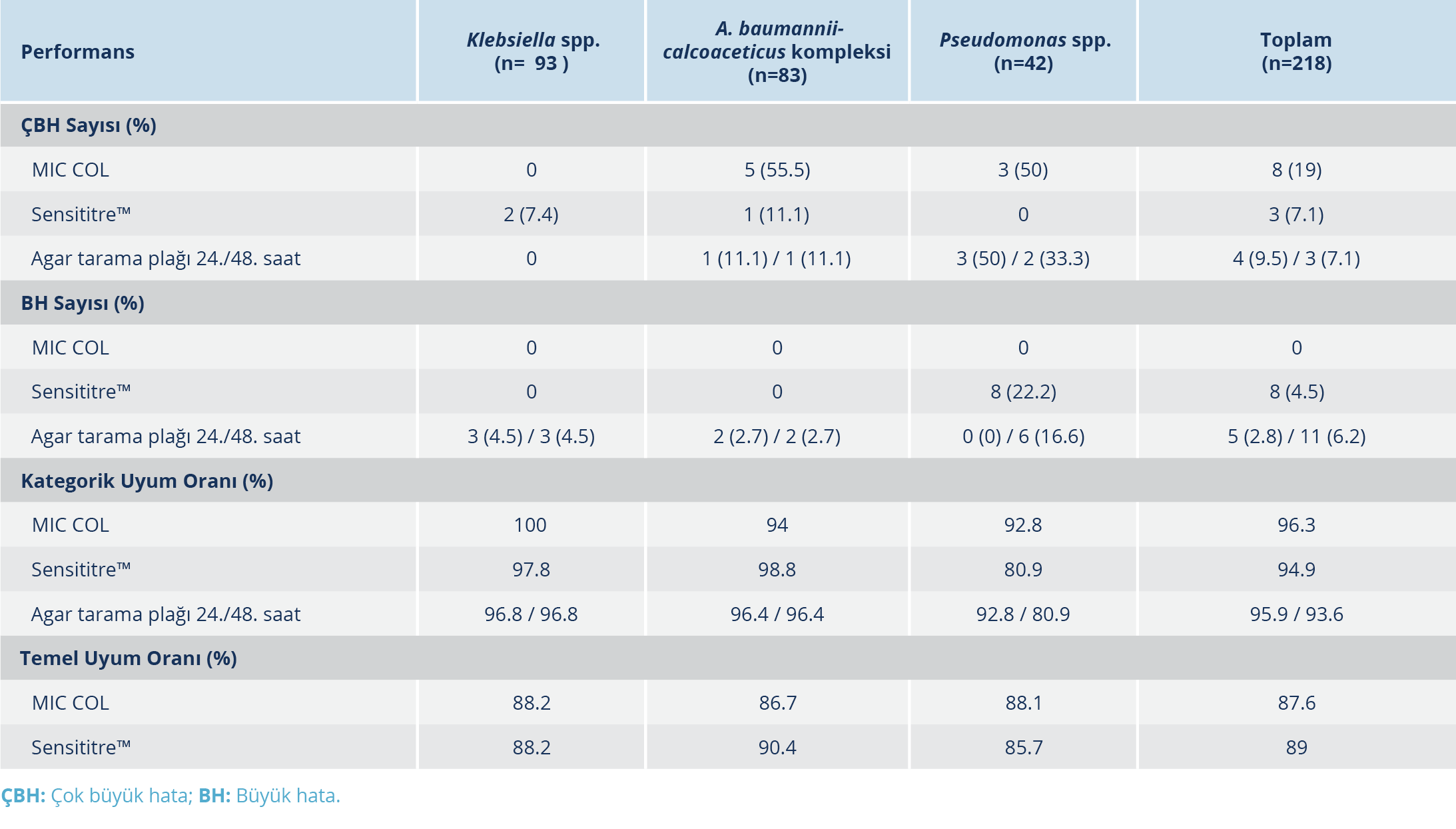
Test edilen yöntemlerin; KU, TU, ÇBH ve BH oranları hesaplanarak referans yönteme göre performansı Tablo 4’te gösterilmiştir. TU yalnızca sıvı mikrodilüsyon temelli yöntemler için hesaplanmıştır. Ticari panellerin TU oranları tüm izolatlar için %85’in üzerinde bulunmuştur. Klebsiella spp., A. baumannii-calcoaceticus kompleksi ve Pseudomonas spp. için Sensititre™ panelinin SMD yöntemi ile TU oranı sırasıyla %88.2, %90.4 ve %85.7; MIC COL testinin SMD yöntemi ile TU oranı ise %88.2, % 86.7 ve % 88.1 olarak tespit edilmiştir. MIC COL testi ile beş A. baumannii-calcoaceticus kompleksi ve üç Pseudomonas spp. izolatında ÇBH tespit edilmiştir. Sensititre™ yöntemiyle ise iki Klebsiella spp. ve bir A. baumannii-calcoaceticus kompleksi izolatında ÇBH saptanmıştır.
Pseudomonas spp. dışındaki izolatlarda tüm yöntemlerin, SMD yöntemi ile KU oranları %90’ın üzerinde saptanmıştır. Pseudomonas spp. izolatlarında; MIC COL, Sensititre™ ve agar tarama testi 24/48 saat KU’ları sırasıyla %92.8, %80.9, %92.8 / %80.9 bulunmuştur. Agar tarama testinin 24 ve 48 saatlik sonuçları karşılaştırıldığında 48. saatte değerlendirme yapmanın P. aeruginosa’da ÇBH oranını azalttığı ancak BH oranını arttırdığı tespit edilmiştir.
İRDELEME
Kolistin, özellikle karbapeneme dirençli Gram-negatif bakteri infeksiyonlarının tedavisinde kullanılan antibiyotiklerden biridir. Artan kolistin kullanımı, kazanılmış kolistin direnci artışına neden olmuştur (17-19). Kolistine duyarlılık testlerinde en önemli güçlük duyarlılığın belirlenmesindeki sorunlardır. Referans yöntem olarak sıvı mikrodilüsyon önerilmektedir; ancak bu yöntemin, uygulanmasındaki zorluklardan dolayı, rutinde kullanımı sınırlıdır. Sıvı mikrodilüsyon temelli, pratik uygulaması kolay birçok ticari ürün kullanıma girmiştir.
EUCAST Geliştirme Laboratuvarı’nın 75 Gram-negatif bakteri ile yaptığı çalışmada Sensititre™ panelinin sıvı mikrodilüsyon ile KU oranı %95, TU oranı %96 bulunmuştur. Bu çalışmada Sensititre™ panelinin BH oranı %10.2 iken ÇBH saptanmamıştır (10). Jayol ve arkadaşları (11), 185 Gram-negatif bakteride Sensititre™ panelinin KU oranını %97.8, ÇBH oranını %3 bulmuştur. Chew ve arkadaşlarının (20) araştırmasında, 76 Enterobacterales izolatında Sensititre™ panelinin KU oranı %90.1, TU oranı %89.5, ÇBH oranı %4, BH oranı %11.8 saptanmıştır. Yusuf ve arkadaşlarının (12), 70 gram negatif bakteri ile yaptıkları çalışmada Sensititre™ panelinin sıvı mikrodilüsyon ile KU oranı %93, TU oranı %87, ÇBH oranı %14.7 saptanmıştır. Türkiye’de Kansak ve arkadaşlarının (21) yaptığı çalışmada 38 K. pneumoniae izolatında Sensititre™ panelinin KU oranı %97, TU oranı %74 bulunmuştur. Çalışmamızda karbapenem dirençli Gram-negatif bakterilerde Sensititre™ panelinin referans yöntem ile KU oranı %94.9, TU oranı %89 oranlarında saptanırken; ÇBH ve BH oranları sırası ile %7.1 ve %4.5 olarak tespit edilmiştir.
Çalışmamızda Sensititre™ paneli ile BH sadece P. aeruginosa izolatında saptanmış olup bu izolatlar incelendiğinde, MİK değerlerinin 4 µg/ml olduğu ve referans yöntemle arasında ±1 ya da ±2 dilüsyon olduğu tespit edilmiştir. MİK değeri sınır değere yaklaştıkça ÇBH ya da BH oranlarının arttığı diğer çalışmalarda da rapor edilmiştir (10). Bunun bir nedeni rehberlerde kolistin sınır değerlerinde orta (“intermediate”) kategorinin olmamasıdır. EUCAST 2021, v. 11.0 “breakpoint table”ın son versiyonunda kolistin sınır değerleri değişmemekle birlikte, P. aeruginosa’da MİK=4 değeri teknik belirsizlik alanı olarak güncellenmiştir. EUCAST bu durumda testin aynı yöntemle veya farklı bir yöntemle tekrarlanmasını önermektedir. Çalışmamızda bu izolatların testleri tekrarlanmış ancak MİK değerleri aynı bulunmuştur.
MIC COL testinde, mikroplaklar ayrılabilen şeritlerden oluşmaktadır. Test edilecek izolat sayısı kadar şerit mikroplaktan ayrılarak, izolat sayısının belli bir sayıya ulaşmasını beklemeden ve gecikme olmadan çalışılabilmesi bir avantaj oluşturmaktadır. MIC COL testinin kolorimetrik bir yöntem olması değerlendirmede kolaylık sağlamaktadır. Fakat diğer kolorimetrik yöntemlerde de olduğu gibi ara renkler değerlendirmede zorluk oluşturabilmektedir. Literatürde ticari MIC COL testinin değerlendirildiği çalışma sayısı sınırlıdır. Bosacka ve arkadaşlarının (22) yaptıkları çalışmada MIC COL testinin SMD yöntemiyle KU oranı Enterobacterales’de %100 olarak saptanırken bu oran nonfermentatif bakterilerde %83.3 olarak tespit edilmiştir. Aynı çalışmada MIC COL testine ek olarak, MIC-Strip Colistin (Merlin, Almanya), Microlatest MIC Colistin (Erba Lachema, Çek Cumhuriyeti), Sensitest Colistin (Liofilchem, İtalya), Phoenix (Becton Dickinson, ABD) and WalkAway (Beckman Coulter, ABD) yöntemleri değerlendirilmiş ve nonfermentatif basiller için TU oranlarının %33.3 – % 66.7 arasında değiştiği belirtilmiştir (22). Bu çalışmaya benzer olarak bizim çalışmamızda Klebsiella spp.’de yüksek TU ve KU oranları saptanırken ÇBH ve BH saptanmamıştır. Pseudomonas spp. ve A. baumannii-calcoaceticus kompleksi izolatlarında KU, TU ve ÇBH oranları sırasıyla %92.8 / %94, %88.1 / %86.7 ve %50 / %55.5 olarak saptanmıştır. Çalışmamızda MIC COL testinin, Bosacka ve arkadaşlarının (22) çalışmalarına benzer şekilde, Klebsiella spp.’de kullanılmasının uygun olduğu saptanmış olmakla birlikte nonfermentatif basillerde ÇBH oranlarının yüksekliği nedeniyle dikkatli kullanılmalıdır.
Klebsiella spp. izolatlarında, MIC COL ve Sensititre™ yöntemlerinin KU oranları kabul edilebilir olmakla birlikte, TU oranları %88.2 olarak saptanmıştır. A. baumannii- calcoaceticus kompleksi izolatlarında da KU oranları kabul edilebilir olarak tespit edilmiştir. Sensititre™ aynı anda sekiz izolatın kolistin duyarlılığının çalışılması için tasarlanmış bir mikroplaktır. Bu nedenle yüksek örnek sayısına sahip laboratuvarlar için tercih edilebilir. Sensititre™ panelinin MIC COL’a göre test ettiği konsantrasyon aralığının daha geniş olması da bir avantajdır.
Germ ve arkadaşlarının (23) “in-house” olarak hazırlanmış olduğu SuperPolymyxin agar ve 700 Enterobacterales izolatı ile yaptıkları çalışmada, agarın kolistin direncini saptamadaki duyarlılığı % 87.5 ve özgüllüğü %99.5 olarak tespit edilmiştir. Jayol ve arkadaşlarının (16) yaptığı bir çalışmada ise ticari SuperPolymyxin™ agarın, E. coli ve K. pneumoniae izolatlarında kolistin direncini saptamada duyarlılığı ve özgüllüğü %100 bulunurken; P. aeruginosa izolatlarında duyarlılık ve özgüllük sırası ile %100, %88.9; A. baumannii izolatlarında ise sırasıyla %92.3, %100 oranlarında bulunmuştur. Çalışmamızda kullandığımız SuperPolymyxin™ agar ile aynı konsantrasyonda kolistin içeren kolistin agar tarama plağının test edilen izolatlarda referans yöntem ile KU oranı yüksek bulunmuştur. Fakat Pseudomonas spp.’de ÇBH ve BH oranının da yüksek olduğu saptanmıştır. Kolistin agar tarama plağı uygulaması basit ve pratik bir yöntemdir. Ancak MİK değeri saptanamaması gibi bir dezavantajı bulunmaktadır.
Çalışmamızda, Karbapenem dirençli Gram negatif bakterilerde kolistin duyarlılığının saptanması amacıyla ticari Sensititre™, MIC COL ve kolistin agar tarama plağı sonuçları SMD yöntemiyle karşılaştırılmıştır. Test ettiğimiz yöntemlerin KU oranlarının kabul edilebilir sınırlarda olduğu (>%90), ancak nonfermentatif bakterilerde ÇBH ve BH oranlarının yüksek olduğu saptanmıştır. Özellikle nonfermentatif bakterilerde uygunsuz kolistin tedavisine sebep olmamak için kolistin duyarlılığının bu yöntemler ile belirlenmesinde daha dikkatli olunması, sonuçların referans metotla doğrulanması gerekmektedir.
Hasta Onamı
Çalışma kapsamında, hastalardan izole edilen bakteri izolatları kullanıldığı için hasta onamı alınmamıştır.
Etik Kurul Kararı
Çalışma için Hacettepe Üniversitesi Girişimsel Olmayan Klinik Araştırmalar Etik Kurulu’ndan 20.10.2020 tarih ve 16969557-1526 karar numarasıyla onay alınmıştır.
Danışman Değerlendirmesi
Bağımsız dış danışman.
Yazar Katkıları
Fikir/Kavram – G.H., M. D. Ç.; Tasarım – G.H., M. D. Ç.; Denetleme – G. H.; Kaynak ve Fon Sağlama – G. H.; Malzemeler/Hastalar – G.H., M. D. Ç.; Veri Toplama ve/veya İşleme – G.H., M. D. Ç.; Analiz ve/veya Yorum – G.H., M. D. Ç.; Literatür Taraması – G.H., M. D. Ç.; Makale Yazımı – M. D. Ç.; Eleştirel İnceleme – G. H.
Çıkar Çatışması
Yazarlar herhangi bir çıkar çatışması bildirmemiştir.
Finansal Destek
Yazarlar finansal destek beyan etmemiştir.
Referanslar
- Poirel L, Jayol A, Nordmann P. Polymyxins: Antibacterial activity, susceptibility testing, and resistance mechanisms encoded by plasmids or chromosomes. Clin Microbiol Rev. 2017;30(2):557-96. [CrossRef]
- Satlin MJ. The search for a practical method for colistin susceptibility testing: Have we found it by going back to the future? J Clin Microbiol. 2019;57(2):e01608-18. [CrossRef]
- Wright H, Bonomo RA, Paterson DL. New agents for the treatment of infections with Gram-negative bacteria: restoring the miracle or false dawn? Clin Microbiol Infect. 2017;23(10):704-12. [CrossRef]
- Breakpoint tables for interpretation of MICs and zone diameters. Version 11.0. [İnternet]. EUCAST. [erişim 22 Mayıs 2021]. www.eucast.org/fileadmin/src/media/PDFs/EUCAST_files/Breakpoint_tables/v_11.0_Breakpoint_Tables.pdf
- Clinical and Laboratory Standards Institute (CLSI). Performance Standards for Antimicrobial Susceptibility Testing. 31st ed. CLSI supplement M100 (ISBN 978-1-68440-104-8 [Print]; ISBN 978-1-68440-105-5 [Electronic]). Clinical and Laboratory Standards Institute, USA, 2021.
- Humphries RM, Green DA, Schuetz AN, Bergman Y, Lewis S, Yee R, et al. Multicenter evaluation of colistin broth disk elution and colistin agar test: a report from the Clinical and Laboratory Standards Institute. J Clin Microbiol. 2019;57(11):e01269-19. [CrossRef]
- Dafopoulou K, Zarkotou O, Dimitroulia E, et al. Comparative evaluation of colistin susceptibility testing methods among Carbapenem-nonsusceptible Klebsiella pneumoniae and Acinetobacter baumannii clinical isolates. Antimicrob Agents Chemother. 2015;59(8):4625-30. [CrossRef]
- Vourli S, Dafopoulou K, Vrioni G, Tsakris A, Pournaras S. Evaluation of two automated systems for colistin susceptibility testing of carbapenem-resistant Acinetobacter baumannii clinical isolates. J Antimicrob Chemother. 2017;72(9):2528-30. [CrossRef]
- Pfennigwerth N, Kaminski A, Korte-Berwanger M, et al. Evaluation of six commercial products for colistin susceptibility testing in Enterobacterales. Clin Microbiol and Infect. 2019;25(11):1385-9. [CrossRef]
- Matuschek E, Ahman J, Webster C, Kahlmeter G. Antimicrobial susceptibility testing of colistin – evaluation of seven commercial MIC products against standard broth microdilution for Escherichia coli, Klebsiella pneumoniae, Pseudomonas aeruginosa, and Acinetobacter spp. Clin Microbiol Infect. 2018;24(8):865-70. [CrossRef]
- Jayol A, Nordmann P, Andre C, Poirel L, Dubois V. Evaluation of three broth microdilution systems to determine colistin susceptibility of Gram-negative bacilli. J Antimicrob Chemother. 2018;73(5):1272-8. [CrossRef]
- Yusuf E, van Westreenen M, Goessens W, Croughs P. The accuracy of four commercial broth microdilution tests in the determination of the minimum inhibitory concentration of colistin. Ann Clin Microbiol Antimicrob. 2020;19(1):42. [CrossRef]
- Nordmann P, Jayol A, Poirel L. A universal culture medium for screening Polymyxin-resistant Gram-negative isolates. J Clin Microbiol. 2016;54(5):1395-9. [CrossRef]
- International Organization for Standardization (ISO). ISO 20776-1:2019 Susceptibility testing of infectious agents and evaluation of performance of antimicrobial susceptibility test devices — Part 1: Broth micro-dilution reference method for testing the in vitro activity of antimicrobial agents against rapidly growing aerobic bacteria involved in infectious diseases. Technical Committee ISO/TC 212, 2019.
- International Organization for Standardization (ISO). ISO 20776-2:2007 Clinical laboratory testing and in vitro diagnostic test systems — Susceptibility testing of infectious agents and evaluation of performance of antimicrobial susceptibility test devices — Part 2: Evaluation of antimicrobial susceptibility test devices. Technical Committee ISO/TC 212, 2007.
- Jayol A, Poirel L, Andre C, Dubois V, Nordmann P. Detection of colistin-resistant Gram-negative rods by using the SuperPolymyxin medium. Diagn Microbiol Infect Dis. 2018;92(2):95-101. [CrossRef]
- Srinivas P, Rivard K. Polymyxin resistance in Gram-negative pathogens. Curr Infect Dis Rep. 2017;19(11):38. [CrossRef]
- Dolejska M, Papagiannitsis CC. Plasmid-mediated resistance is going wild. Plasmid. 2018;99:99-111. [CrossRef]
- Ayoub Moubareck C. Polymyxins and bacterial membranes: a review of antibacterial activity and mechanisms of resistance. Membranes (Basel). 2020;10(8). [CrossRef]
- Chew KL, La M-V, Lin RTP, Teo JWP. Colistin and Polymyxin B susceptibility testing for carbapenem-resistant and mcr-positive Enterobacteriaceae: comparison of sensititre, MicroScan, Vitek 2, and Etest with broth microdilution. J Clin Microbiol. 2017;55(9):2609-16. [CrossRef]
- Kansak N, Aslan M, Adaleti R, Aksaray S. Klebsiella pneumoniae izolatlarında sıvı mikrodilüsyon temelli iki ticari sistemin referans mikrodilüsyon yöntemine göre değerlendirilmesi . Mikrobiyol Bul. 2020;54(4):606-12. [CrossRef]
- Bosacka K, Kozińska A, Stefaniuk E, et al. [İnternet]. Colistin antimicrobial susceptibility testing of Gram-negative bacteria – evaluation of tests available in Poland [Abstract]. In: Abstracts of 28th ECCMID European Congress of Clinical Microbiology and Infectious Disease (Madrid, Spain, April 21-24, 2018). [erişim 22 Mayıs 2021]. https://www.escmid.org/escmid_publications/escmid_elibrary/?q=Bosacka+K&id=2173&L=0&x=28&y=20
- Germ J, Seme K, Cerar Kišek T, et al. Evaluation of a novel epidemiological screening approach for detection of colistin resistant human Enterobacteriaceae isolates using a selective SuperPolymyxin medium. J Microbiol Methods. 2019;160:117-23. [CrossRef]