En Çok Okunanlar
Özet
Amaç: Hepatit B virusu (HBV) kronik hepatit, siroz ve hepatoselüler karsinoma (HSK) yol açan önemli bir sağlık sorunudur. Bu çalışmada, kronik hepatit B (KHB) tanısı ile izlenen hastalarda kullanılan antiviral ilaçların etkinliğinin ve yan etkilerinin karşılaştırılması planlandı.
Yöntemler: Kliniğimizde KHB tanısı ile takip ve tedavi edilen 572 hasta retrospektif olarak değerlendirildi.
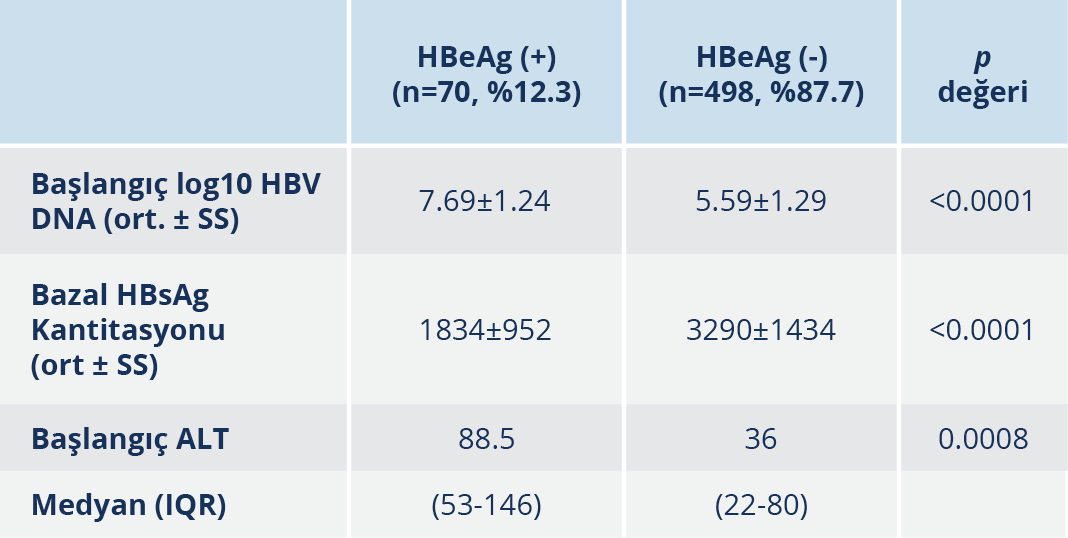
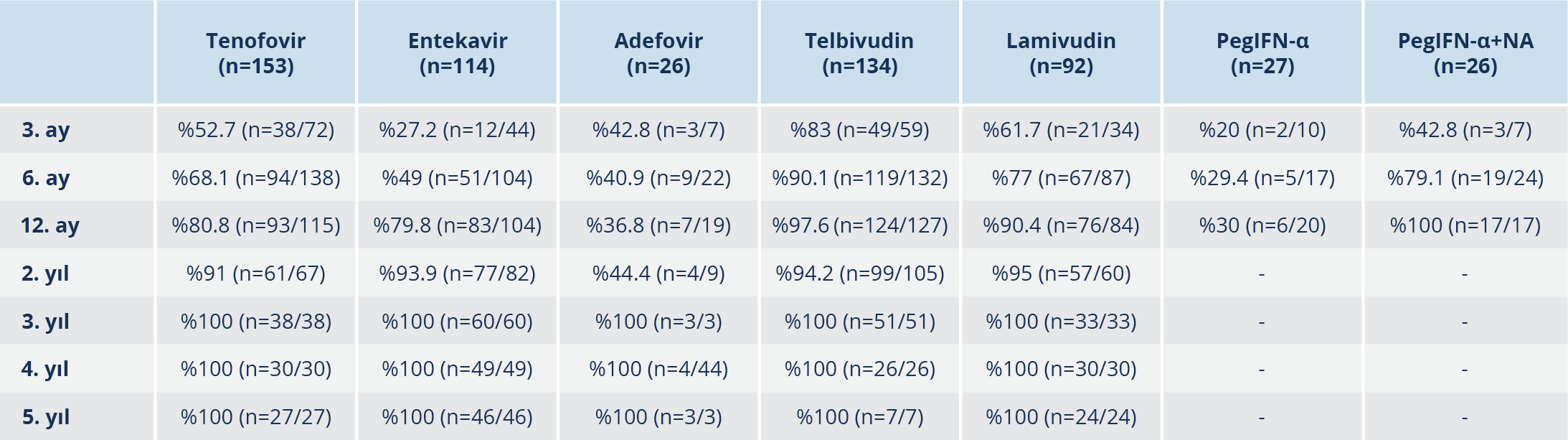
Bulgular: Beş yüz yetmiş iki hastanın %56.5’i erkek, %43.5’i ise kadındı. Hastaların yaş ortalaması 43.4±12.4’tü. Yüz elli üç (%26.8) tenofovir disoproksil fumarat (TDF), 134 (%23.4) telbivudin (LdT), 114 (%20) entekavir (ETV), 92 (%16) lamivudin (LAM), 26 (%4.5) adefovir (ADV), 27 (%4.7) pegile interferon alfa (PEG-IFN-α), 26 (%4.6) pegile interferon alfa ve nükleoz(t)id analoğu (PEG-IFN-α+NA) kullanımı mevcuttu. Yaş, cinsiyet oranı, fibrozis skoru, histolojik aktivite indeksi (HAİ) skoru, başlangıç trombosit, “international normalized ratio” (INR) ve “alpha-fetoprotein” (AFP) değerleri açısından tedavi grupları arasında anlamlı fark yoktu (p>0.05). Beş yüz altmış sekiz hastanın 70 (%12.3)’i HBeAg (+) ve 498 (%87.7)’i HBeAg (-) idi. Birinci yıl sonu virolojik yanıt oranları LdT’de %92.5, LAM’da %82.6, ETV’de %72.8, TDF’de %60.7, ADV’de %26.9, PEG-IFN-α’da %22.2, PEG-IFN-α+NA’da %65.3 olarak bulundu. Hastaların %23.8’inde tedavi değişikliği olup %76.3’ünde TDF’ye geçilmişti. LAM’da %43.5, LdT’de %13.4, ETV’de %7, TDF’de %0.6 oranında virolojik kırılma gözlendi. Tedavi değişikliği olmadan 3, 4 ve 5. yıl sonunda TDF, ETV, LdT, ADV ve LAM tedavisi devam eden hastaların tümünde HBV DNA negatifti. On üç hastada (%2.3) HBsAg klirensi gelişti. Hastaların 169 (%29.5)’unda en az bir yan etki olup en sık yan etki PEG-IFN-α+NA (%92.3) ve PEG-IFN-α (77.8) grubundaydı. En sık görülen yan etkiler; LAM’da amilaz (%3.2), LdT’de kreatin fosfokinaz (CPK) (%27.6) ve TDF’de CPK (%3.2) artışı olarak saptandı.
Sonuçlar: Virolojik yanıt oranı en düşük olan ve en sık yan etki görülen ilaç PEG-IFN-α olup kullanımı seçili hasta grupları ile sınırlı kalmalıdır. Yan etki görülme ve direnç gelişme oranları en düşük tedaviler TDF ve ETV olarak bulunmuştur. Yüksek virolojik yanıt oranları da dikkate alındığında KHB tedavisinde TDF ve ETV tercih edilmelidir. Tüm tedaviler değerlendirildiğinde, HBsAg kaybı ve kür oranları yetersizdir.
GİRİŞ
Hepatit B virusu (HBV), karaciğer hastalıklarının başlıca nedeni olup karaciğerin akut veya kronik inflamasyonuna neden olarak, kronik hepatit, siroz ve hepatoselüler karsinoma (HSK) yol açan önemli sağlık sorunlarından biridir. Dünya Sağlık Örgütü (DSÖ) verilerine göre 2019’da 296 milyon insanın KHB infeksiyonu ile yaşadığı, aynı yıl HBV kaynaklı siroz ve HSK nedeniyle 820 bin ölümün gerçekleştiği ve her yıl 1.5 milyon yeni infeksiyon olduğu tahmin edilmektedir (1).
Kronik HBV infeksiyonu olan hastalar için tedavinin asıl amacı hastalığın ilerlemesini ve HSK gelişimini önleyerek hayatta kalmayı sağlamak ve yaşam kalitesini iyileştirmektir. Antiviral tedavinin diğer hedefleri, anneden bebeğe bulaşmayı ve hepatit B’nin yeniden aktivasyonunu önlemek, HBV ile ilişkili ekstrahepatik bulguları önlemek ve tedavi etmektir (2). Günümüzde, KHB tedavisinde kullanılan onaylı ilaçlar; antiviral, antiproliferatif ve immünomodülatör etkili subkutan uygulanan interferon-alfa (IFN-α) ve PEG-IFN-α; oral antiviraller olan nükleoz(t)id analogları (NA), lamivudin (LAM), entekavir (ETV), telbivudin (LdT), adefovir (ADV), tenofovir disoproksil fumarat (TDF) ve tenofovir alafenamid (TAF)’tir. Ancak söz konusu ilaçlar, HBV reverse transkriptazı inhibe ederek HBV replikasyonunu baskılamalarına, karaciğerdeki inflamasyonu azaltmalarına, hastalığın progresyonunu yavaşlatmalarına ve karaciğer hastalığının remisyonunu sağlamalarına rağmen KHB için henüz virusun eradikasyonunu sağlayacak küratif bir tedavi bulunamamıştır (3, 4).
Bu çalışmada, KHB tanısı ile en az 6 ay tedavi alıp izlenen hastaların kullandıkları antiviral ilaçların etkinlik ve yan etkilerinin karşılaştırılarak değerlendirilmesi amaçlanmıştır.
YÖNTEMLER
Kliniğimizde, Ocak 2005- Kasım 2017 tarihleri arasında KHB tanısı ile takip edilen, 6 aydan uzun süreli HBsAg pozitifliği olan, tedavi başlangıcında HBV DNA 104 kopya/ml olan, karaciğer histolojisi Ishak evre ≥2 veya HAİ ≥6 olan, daha önce tedavi almamış (naif) ve en az 6 aydır antiviral tedavi alan, 18-80 yaş aralığında 572 hasta retrospektif olarak değerlendirildi. Çalışmaya üniversite etik kurulundan onay alındıktan sonra (2018/1341 nolu karar) başlandı. Hastaların KHB tanısı, Avrupa Karaciğer Araştırmaları Derneği (European Association fort he Study of Liver – EASL)’nin 2017 Klinik Uygulama Kılavuzu kriterlerine uygun olarak serolojik ve patolojik olarak konuldu (2). Hamile, altta yatan immün sistem bozukluğuna yol açan kronik bir hastalığa, malignite veya kolajen doku hastalığına sahip, insan immün yetmezlik virusu (HIV) koinfeksiyonu, immünsüpresif veya steroid tedavisi alacağı için KHB’ye yönelik antiviral profilaksi başlanmış, KHB dışında karaciğer hastalığına neden olacak hastalıkları bulunan (HCV veya HDV pozitifliğinin olması, otoimmün hepatit, vs.), tanı anında HSK’nin eşlik ettiği dekompanse karaciğer sirozlu ve KHB tedavisini düzenli kullanmayan bireyler çalışmaya dahil edilmedi. Hepatit B hasta takip dosyaları ve hastane otomasyon sisteminde bulunan; cinsiyete, yaşa, antiviral tedavi süresine, karaciğer biyopsisinde fibrozis ve HAİ sonuçlarına, uygulanan antiviral tedavi türüne, tedavi öncesi aspartat aminotransferaz (AST), alanin aminotransferaz (ALT), trombosit, INR, kreatinin, AFP, HBV DNA, HBsAg, HBeAg düzeylerine, tedavinin 3. 6. ve 12. aylarındaki HBV DNA düzeylerine ve ilaç yan etkilerine dair takip bilgileri kaydedildi.
İstatistiksel analizler için “SAS 9.4 University Edition” (“SAS Institute, Cary, NC”) programı kullanıldı. Tüm değişkenler için tanımlayıcı istatistikler verildi. Kategorik değişkenler için frekans ve yüzde değerleri; sayısal değişkenler için ortalama ± standard sapma veya medyan (Q1-Q3) değerleri verildi. Kategorik değişkenlerin karşılaştırılmasında χ² testi, sayısal değişkenlerin karşılaştırılmasında Student t testi, ANOVA, Mann-Whitney U ve Kruskal-Wallis testlerinden faydalanıldı. Tedavi gruplarında HBV DNA değişiminin karşılaştırılması için karma etki modeli kullanıldı. p<0.05 istatistiksel olarak anlamlı kabul edildi.
BULGULAR
Beş yüz yetmiş iki hastanın 323 (%56.5)’ü erkek, 249(% 43.5)’u kadındı. Hastaların yaş ortalaması 43.4 ±12.4 yıldı. Yüz elli üç (%26.8) TDF, 134 (%23.4) LdT, 114 (%20) ETV, 92 (%16) LAM, 26 (%4.5) ADV, 27 (%4.7) PEG-IFN-α, 26 (%4.6) PEG-IFN-α+NA kullanımı mevcuttu. Çalışmaya alınan hastaların tedavi türlerine göre demografik ve başlangıç verileri Tablo 1’de gösterilmiştir. Tedavi türlerine göre cinsiyet dağılımının benzer olduğu (p=0.77) ancak PEG-IFN-α +NA grubunda yaş ortalamasının diğerlerine kıyasla anlamlı olarak daha düşük olduğu tespit edildi (p=0.0005). Tüm hastaların, başlangıç fibrozis skorları ortalaması 2.3±0.8, HAİ ortalaması 8.2±2.6 bulundu ve tedavi türleri ile fibrozis skoru ortalaması arasında istatistiksel olarak anlamlı fark saptanmadı (p=0.14). Hastaların başlangıç ALT ve AST (U/L) değerleri medyan olarak sırası ile 39 (23.5-91) ve 31 (22-56) olup başlangıç ALT değeri LdT grubunda diğer tedavi türlerine göre anlamlı olarak düşük bulundu (p<0.0001); diğer tedaviler arasında istatistiksel olarak anlamlı fark saptanmadı. Hastaların başlangıç trombosit değerleri ortalaması 226 460±63 840/mm3, başlangıç INR değerleri ortalaması 1±0.1, başlangıç AFP (IU/mL) değerleri medyan 2.2 (1.6-3.5) bulundu. Yaş, cinsiyet, fibrozis skoru, HAİ skoru, başlangıç trombosit, INR, AFP değerleri açısından tedavi grupları arasında istatistiksel anlamlı fark bulunmadı (p>0.05).
Hastaların başlangıç HBV DNA (kopya/ml) ortalaması 71 573 590 ± 221 752 936 iken, LdT ve LAM grubunda, başlangıç HBV DNA düzeyi ortalaması ve log10 HBV DNA ortalama düzeyi diğer tedavilere göre istatistiksel anlamlı olarak düşük bulundu (p<0.0001). HBeAg durumuna bakılmış olan 568 hastanın 70 (%12.3)’i HBeAg (+), 498 (%87.7)’i HBeAg (-) idi. HBeAg’ ye göre tedavi öncesi virolojik ve biyokimyasal değerlerin kıyaslanması Tablo 2’de gösterilmiştir.
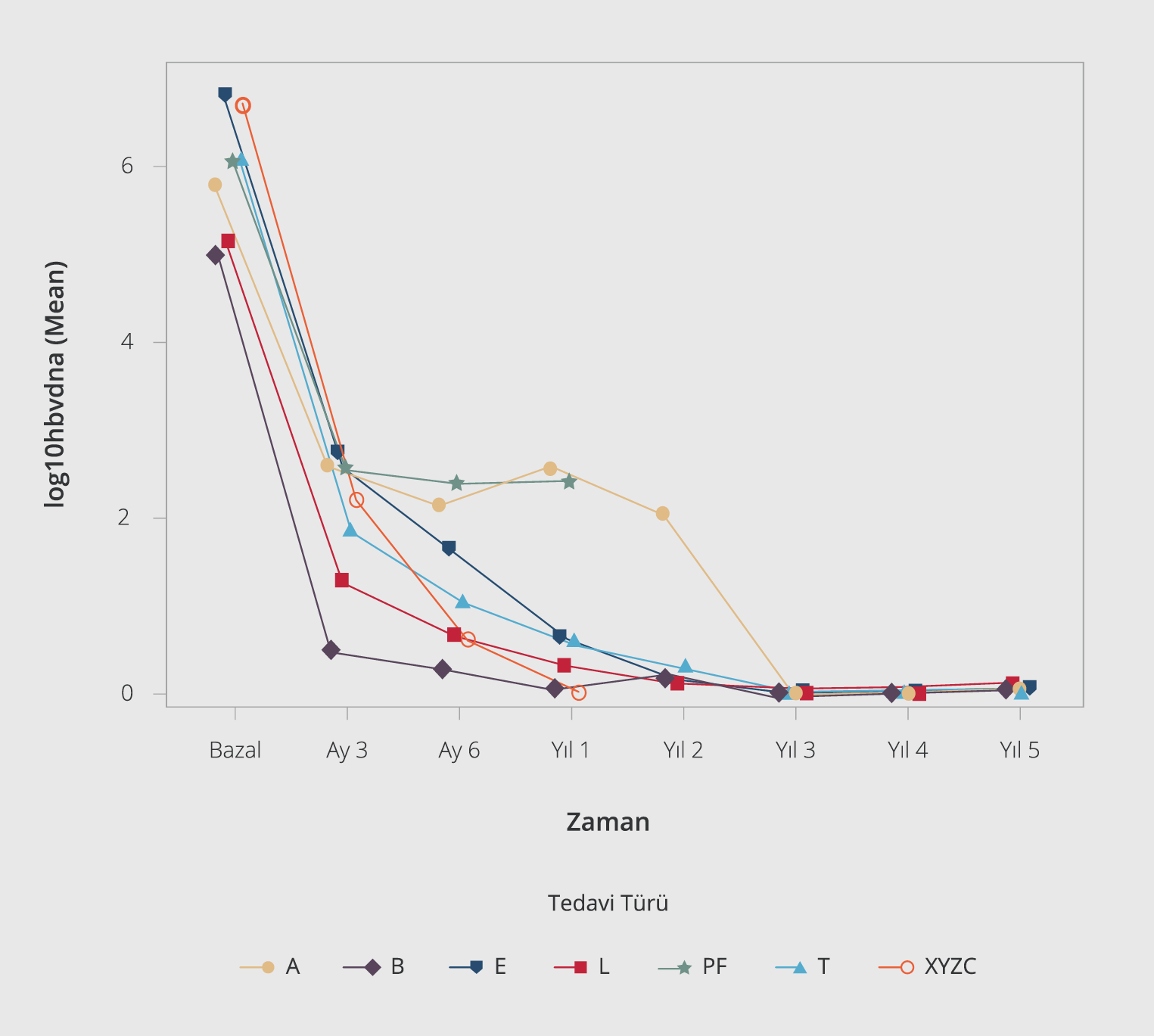
Şekil 1. Tedavi türlerine göre HBV DNA seyri.
A: Adefovir, B: Telbivudin, E: Entekavir, L: Lamivudin, T: Tenofovir
PF: PEG-IFN-α, XYZC: PEG-IFN-α+NA
Tedavi grupları arasında HBV DNA’nın zaman içerisindeki seyrinin farklı olduğu görüldü (p<0.0001). En hızlı HBV DNA düşüşünün TDF ve ETV’de olduğu, ADV grubunda diğer gruplara göre HBV DNA’daki düşüşün daha geç olduğu ve PEG-IFN-α+NA tedavisinde virolojik yanıtın PEG-IFN-α monoterapisine kıyasla daha kısa süre içinde olduğu Şekil 1’de; tedavi türlerine göre virolojik yanıt oranları Tablo 3’te gösterilmiştir.
Başlangıçta HBeAg (+) olan 70 hastanın 15 (%21.4)’inde takipte HBeAg serokonversiyonu olup en sık %50 ile PEG-IFN-α tespit edildi. TDF’de %14.3 (4/28), ETV’de %36.3 (8/22), ADV’de %25 (1/4) oranında HBeAg serokonversiyonu saptandı. PEG-IFN-α+NA, LdT ve LAM kullanan hastalarda serokonversiyon saptanmadı.
Hastaların takibinde %2.3 (13/572) HBsAg klirensi olup tamamı HBeAg (-) idi. PEG-IFN-α+NA’da %11.5 (3/26), LAM’da %4.3 (4/92), PEG- IFN-α’da %3.7 (1/27), LdT’de %2.2 (3/134), ETV’de %0.9 (1/114), TDF’de %0.7 (1/153) HBsAg klirensi görüldü. Tedavinin 12. ayı sonunda PEG-IFN-α+LAM tedavisi alan bir hastada HBsAg klirensi gelişti. PEG-IFN-α içeren bir tedavi alırken HBsAg klirensinin ortalama 57. ayda olduğu, klirensin IFN tedavisi sonlandıktan aylar sonra geliştiği gözlendi.
Hastaların 136 (%23.8)’sında takiplerde tedavi değişikliği olup 103 (%76.3)’ünde TDF’nin tercih edildiği görüldü. En çok tedavi değişikliği yapılan hasta grubu 48 (%52) hasta ile LAM grubuydu. Kırk (%43.4) LAM, 18 (%13.4) LdT, 8 (%7) ETV, 1 (%0.6) TDF kullanan hastada virolojik kırılma düşünülerek tedavi değişimi yapıldı. TDF kullanımı sırasında virolojik kırılma görülen hasta sorgulandığında, ilacını düzensiz kullandığı öğrenildi. Başlangıç HBV DNA düzeyi ≥10⁷ kopya/ml, fibrozis skorları ≥4, HAİ skorları ≥14 olan 3 hastada HSK geliştiği görüldü.
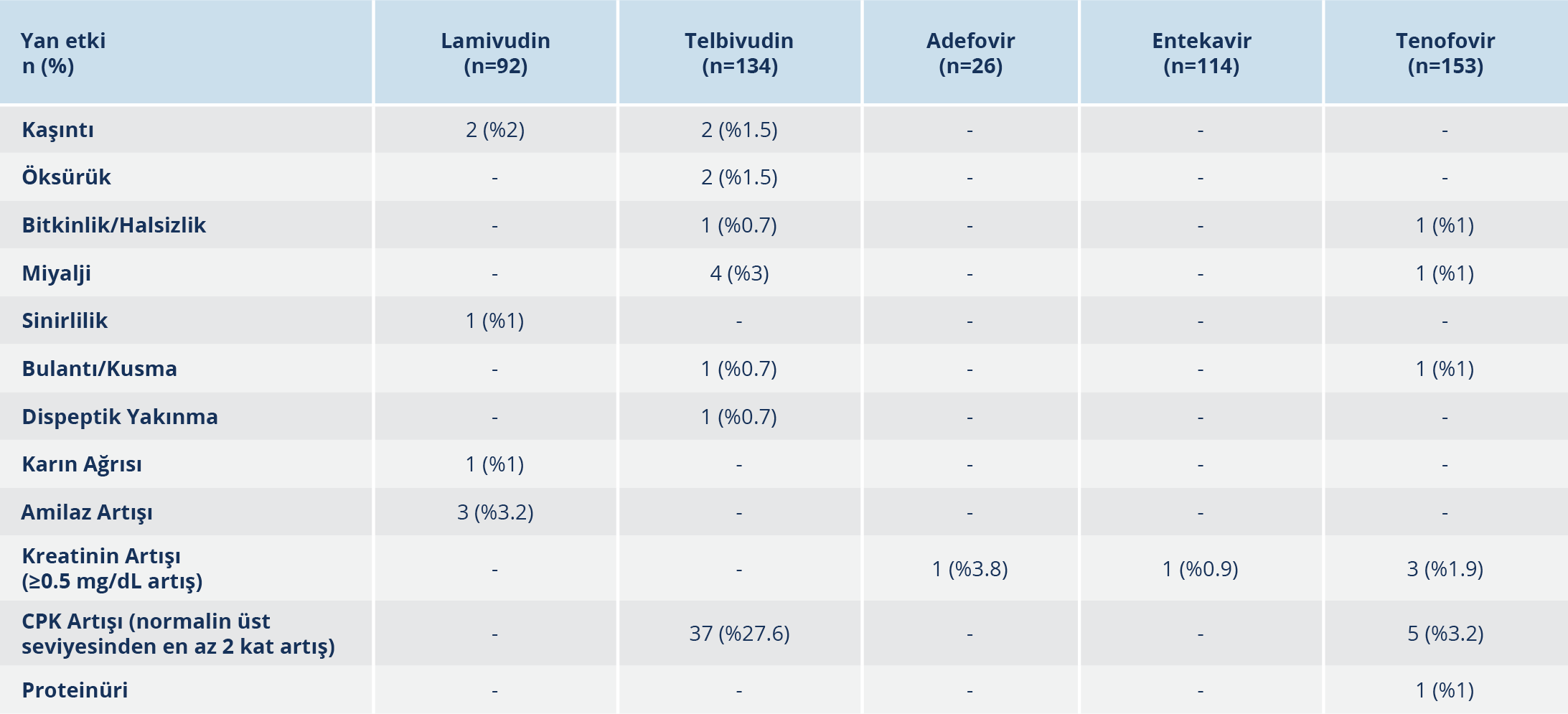
Hastaların 169 (%29.5)’unda en az bir yan etki olup, en az yan etki TDF’de %7.8 (12/153) ve ETV’de %7.9 (9/114) oranında görüldü; bu iki grup arasında yan etki açısından istatistiksel olarak anlamlı fark bulunmadı (p>0.05). Tedavi esnasında en az bir yan etki, PEG-IFN-α+NA’da %92.3, PEG-IFN-α’da %77.8, LAM’da %47.8, LdT’de %40.3, ADV’de %19.2 oranlarında tespit edildi.
Çalışmamızda yan etki görülme oranı en yüksek olan grup PEG-IFN-α+NA olup en sık görülen yan etki %73 ile miyalji, bitkinlik/halsizlik; %69.2 ile kilo kaybı, sinirlilik, saç dökülmesi; %65.3 ile ateş, artralji, baş ağrısı ve unutkanlıktı. PEG-IFN-α kullanan hastalarda en sık görülen yan etkiler %44.5 ile miyalji, baş ağrısı, bitkinlik/halsizlik; %40.7 ile titreme, ateş, artralji, uykusuzluk, kaşıntı, saç dökülmesi olup yan etki nedeni ile bir hastada tedavi sonlandırıldı.
NA’larla görülen yan etkiler Tablo 4’te gösterilmiştir. Tedavi öncesi kreatinin seviyesi normalin üstünde olan LdT kullanan bir hastanın takiplerde kreatinin seviyesi normale geriledi. LdT kullananlarda rabdomiyoliz gibi ciddi bir toksisite görülmedi.
ADV kullanan bir ve ETV kullanan bir hastada kreatinin artışı (serum kreatinin düzeyi ≥0.5 mg/dL artış) olup bu hastalarda LdT tedavisine geçildi. ETV alan bu hastanın çoklu ilaç kullanımı olup kreatinin artışının diğer ilaçlara da bağlı olabileceği düşünüldü.
TDF kullanırken kreatinin artışı olan iki hastada, halsizlik ve CPK artışı olan bir hastada, bulantı-kusma nedeni ile bir hastada ve miyalji şikayeti ile bir hastada ETV tedavisine geçildi. TDF kullanan tüm hastalarda kalsiyum ve fosfor değerleri normal sınırlardaydı. Çalışmamızda hiçbir hastada laktik asidoz görülmedi.
İRDELEME
Günümüzde kullanılan bütün tedavilerin amacı HBV DNA’nın baskılanmasıdır (2). Literatürdeki yayınların çoğunun, TDF ve ETV’deki virolojik yanıt oranlarını değerlendirdiği görülmüştür. Cunha-Silva ve arkadaşları (5) bir yıllık tedavi sonunda LAM, ETV ve TDF tedavileri ile negatif viral yük oranlarını sırasıyla %56, %75 ve %75; iki yılın sonunda %86, %90.6 ve %92.9 oranında bulmuştur. Başarır ve arkadaşları (6) ise bu oranları sırasıyla %76, %88 ve %75 olarak saptamış ve üç ilaç arasında virolojik yanıt açısından farklılık tespit etmemiştir. Güzelbulut ve arkadaşları (7) birinci yıl yanıtlarını, TDF’de %95, ETV’de %87.5 ile yüksek oranda bulmuşken; Bilge ve arkadaşları (8) 48 haftalık tedavi başarısını TDF’de %72.3, ETV’de %69 bulmuştur. Çalışmamızda, birinci yıl yanıtlarının en yüksek oranda LdT’de (%92.5) ve ikinci yıl virolojik yanıt oranlarının LAM’da %95, LdT’de %94.2, ETV’de %93.4, TDF’de %91 olduğu tespit edilmiş; tedavilerin 3, 4 ve 5. yıl sonuçlarında tedavi değişikliği yapılmadan TDF, ETV, LdT, ADV ve LAM tedavisi devam eden hastaların tümünde HBV DNA’nın negatif olduğu görülmüştür.
KHB tedavisinde, tedaviye yanıtın izlenmesinde önemli parametrelerden biri de HBeAg (+) hastalarda HBeAg’nin kaybolarak anti-HBe gelişmesidir (9). HBeAg serokonversiyonu, literatürde %20-40 arasında değişmektedir (10, 11). Çalışmamızda HBeAg serokonversiyonu en yüksek oranda PEG-IFN-α grubunda olup tüm hastalarda %21.4 oranında görülmüştür.
HBsAg serokonversiyonu dünya çapında düşük kalmaktadır (12, 13). ETV veya TDF tedavisinin ilk yılında HBeAg negatif KHB hastalarının hiçbirinde HBsAg kaybı olmamış ve çok az sayıda hastada (~%1) uzun dönem (8 yıl) tedavi sırasında bu sonlanım noktasına ulaşılabilmiştir (2). Lok ve arkadaşlarının (14) çalışmasında, bir yıllık tedavi sonrası HBsAg kaybı PEG-IFN ile %3 oranında olurken bu oran LAM kullananlarda %1, ADV ve LdT kullananlarda %0, ETV kullananlarda %2, TDF tedavisi alanlarda %3.2 oranında bildirilmiştir. Çalışmamızda hastaların %2.3’ünde HBsAg klirensi görülmüş olup TDF (%0.7) ve ETV (%0.9)’deki klirens oranlarının literatüre göre düşük oranda olduğu tespit edilmiştir. Ancak tedavisi devam eden hastalarda yıllar içinde bu oranların yükseleceği düşünülmektedir.
Kim ve arkadaşlarının (15) 2016 yılında yayınladığı 2829 hastayı içeren meta-analiz sonuçlarında; HBeAg (+) ve HBeAg (-) hastalarda PEG-IFN-α+LAM kombinasyon tedavisinde PEG-IFN-α monoterapisine kıyasla daha iyi virolojik ve biyokimyasal yanıtlar elde edilmiştir. Çalışmamızda da virolojik yanıt, HBeAg serokonversiyonu ve HBsAg serokonversiyonu oranları PEG-IFN-α+NA tedavisinde daha yüksek oranlarda bulunmuştur.
KHB tedavisinin uzun süreli başarısı için, antiviral ajanların hızlı, tam ve kalıcı viral süpresyonu sağlaması ve direncin yüksek bir bariyerine sahip olması gerekir. LAM ile tedavi sırasında erken dönemde ilaç direnci ortaya çıkar, uzun süreli tedavi ile sıklığı artar ve 5 yıl sonra yaklaşık %80’e ulaşır (16). Literatürde HBeAg negatif KHB hastalarında 5 yıllık takipte tedaviye direnç oranlarının TDF’de %0, ETV’de <%1, LAM’da %70 oranında olduğu bildirilmiştir (17). Çalışmamızda ilaç direnci düşünülerek tedavi değişimi yapılan hastaların oranı en yüksek LAM’da (%43.5) bulunmuştur. Takip süremiz boyunca LdT’de %13.4, ETV’de %7, TDF’de %0.65 oranında virolojik kırılma gözlenmiş olmakla birlikte genotipik direnç çalışması yapılamadığı için gerçek direnç oranları belirlenememiştir.
ETV ve TDF, NA’larla daha önce tedavi başarısızlığı olan hastalarda tercih edilmektedir (18). Çalışmamızda da tedavisi değiştirilen hastalarda en çok tercih edilen yeni tedaviler ETV ve TDF olmuştur.
IFN’nin zor tolere edilmesi ve belirgin yan etki profili nedeni ile kullanımının sınırlı kalmasına rağmen, oral antiviraller de uzun süreli kullanımı zorunlu kılması ve direnç ortaya çıkarması nedeniyle dezavantajlıdır. (19). IFN injeksiyonu, tipik olarak ateş (%20-30), baş ağrısı (%40-50) ve miyaljiyi (%20-30) içeren influenza benzeri semptomlara neden olabilir (20). Çalışmamızda da PEG-IFN-α tedavileri ile en sık görülen yan etkiler sırasıyla miyalji, bitkinlik/halsizlik, baş ağrısı, ateş ve titreme olmuştur.
Uzun süreli tedavi için antiviral ilaçların iyi tolere edilmesi gereklidir. Tescil III fazı çalışmaları sırasında, NA’ların tümü iyi tolere edilebilirlik ve genellikle uygun emniyet profilleri göstermiştir. Bununla birlikte, uzun vadeli tedavide, çeşitli hematolojik bozukluklar, periferik nöropati, iskelet ve kardiyak miyopati, pankreatit, karaciğer yetmezliği ve laktik asidoz gibi bazı potansiyel yan etkiler tespit edilmiştir (21).
Buti ve arkadaşlarının (22) çalışmasında, TDF kullanan 389 hastadan 2 (%0.5)’sinin ilaç ilişkili yan etki (halsizlik, karın ağrısı, dikkat bozukluğu, baş dönmesi, osteoporoz, kreatinin artışı) nedeniyle ilacı bıraktığı; hastaların %1.3’ünde ilaç ilişkili ciddi yan etkilerin (akut pankreatit, osteopeni, osteoporoz, böbrek yetmezliği, ALT artışı) görüldüğü; %1.5’inde serum kreatinin artışı ve %1.3’ünde fosfat düzeyinin <2 mg/dl olduğu belirtilmiştir. Marcellin ve arkadaşlarının (23) çalışmasında ise 5 yıl TDF alan hastaların %1’inde kreatinin artışı görülmüştür. Çalışmamızda TDF alan hastalarda akut pankreatit, böbrek yetmezliği, ALT artışı görülmemiştir. En sık görülen yan etki CPK artışı (%3.2) ve kreatinin artışı (%1.9); en nadir görülen yan etkiler ise miyalji, halsizlik, bulantı ve kusma olmuştur. Tüm hasta takiplerinde kalsiyum ve fosfor düzeylerinin normal sınırlarda olduğu görülmüştür. Çalışmamızda TDF kullanan hastaların %1.9’unda serum kreatinin düzeylerinde artış meydana gelmiş ve bu hastaların ikisinde tedavi ETV ile değiştirilmiştir. Ayrıca yan etki oranları açısından TDF ve ETV arasında istatistiksel olarak anlamlı fark saptanmamıştır.
Hadziyannis ve arkadaşları (24), ADV alan hastalarda 5 yıllık takipte serum kreatinin artışını, plasebo grubuna kıyasla %3-4 arasında fazla bulmuştur. Çalışmamızda da ADV’nin bu yan etkisi benzer şekilde %3.8 oranında bulunmuştur.
LdT’nin, eGFR’yi düzeltebileceği ve ADV verilen hastalarda nefrotoksisiteyi önleyebileceği şeklinde bir gözlem vardır (25). Çalışmamızda bir hastada, tedavi öncesi kreatinin seviyesi normalin üstünde iken LdT tedavisi altında kreatinin seviyesinde 0.3 mg/dL azalma olduğu görülmüştür. KHB tedavisi için kullanılan tüm NA’lar böbrek yoluyla atıldığından böbrek yetmezliği durumunda doz ayarlamaları gereklidir.
Sonuç olarak, çalışmamızda TDF, LdT ve ETV KHB’de en sık kullanılan tedaviler olarak tespit edilmiştir. Birinci yıl sonunda en yüksek virolojik yanıt oranı LdT’de bulunmuştur. LdT yüksek düzeyde virolojik yanıt ile ilişkili olmakla birlikte olgu sayısının azlığı ve sadece viral yükü düşük hastalarda kullanılmış olması bu değerlendirmeyi yapmayı kısıtlayan faktörlerdir. Virolojik yanıt oranı en düşük olan ve en sık yan etki görülen ilaç PEG-IFN-α olarak bulunmuş olup kullanımı seçili hasta grupları ile sınırlı kalmalıdır. Yan etki görülme ve direnç gelişme oranları en düşük tedaviler TDF ve ETV olarak bulunmuştur. Ayrıca, yan etki oranları açısından TDF ve ETV arasında anlamlı fark tespit edilmemiştir. Yüksek virolojik yanıt oranları da dikkate alındığında KHB tedavisinde TDF ve ETV tercih edilmelidir. Tüm tedaviler değerlendirildiğinde, HBsAg kaybı ve kür oranları yetersizdir. Bu nedenle yeni tedavi stratejileri üzerinde daha çok çalışma yapılması gereklidir.
Hasta Onamı
Retrospektif dosya taraması şeklinde bir çalışma olduğu için hasta onamı alınmamıştır.
Etik Kurul Kararı
Çalışma için Necmettin Erbakan Üniversitesi Meram Tıp Fakültesi Etik Kurulu’ndan 11 Mayıs 2018 tarih ve 2018/1341 karar numarasıyla onay alınmıştır.
Danışman Değerlendirmesi
Bağımsız dış danışman.
Yazar Katkıları
Fikir/Kavram – R.B., M.B.; Tasarım – R.B.; E.K.K., B.K., İ.E., M.B.; Denetleme – R.B., M.B.; Kaynak ve Fon Sağlama – R.B., E.K.K., B.K., İ.E. M.B.; Malzemeler/Hastalar – R.B., E.K.K., B.K., İ.E. M.B.; Veri Toplama ve/veya İşleme – R.B.; Analiz ve/veya Yorum – R.B., E.K.K., M.B.; Literatür Taraması – R.B., E.K.K., B.K., İ.E., M.B.; Makale Yazımı – R.B., E.K.K., M.B.; Eleştirel İnceleme – R.B., E.K.K., B.K., İ.E., M.B.
Çıkar Çatışması
Yazarlar herhangi bir çıkar çatışması bildirmemiştir.
Finansal Destek
Yazarlar finansal destek beyan etmemiştir.
Sunulduğu Bilimsel Etkinlik
10-11 Nisan 2021 tarihinde düzenlenen 6. Uluslararası Tıp ve Sağlık Bilimleri Araştırmaları Kongresi (UTSAK)’nde bildiri olarak sunulmuştur.
Referanslar
- Hepatitis B [Internet]. World Health Organization. [erişim 27 Temmuz 2021]. https://www.who.int/news-room/fact-sheets/detail/hepatitis-b
- European Association for the Study of the Liver. EASL 2017 clinical practice guidelines on the management of hepatitis B virus infection. J Hepatol. 2017;67(2):370-98. [CrossRef]
- Bertoletti A, Gehring AJ. Immune therapeutic strategies in chronic hepatitis B virus infection: virus or inflammation control? PLos Pathog. 2013; 9(12):e1003784. [CrossRef]
- Uhl P, Fricker G, Haberkorn U, Mier W. Current status in the therapy of liver diseases. Int J Mol Sci. 2014;15(5):7500-12. [CrossRef]
- Cunha-Silva M, Marinho FR, Oliveira PF, et al. Retrospective analysis of hepatitis B virus chronic infection in 247 patients: clinical stages, response to treatment and poor prognostic factors. Braz J Infect Dis. 2017;21(4):441-7.[CrossRef]
- Başarır İ, İlikhan S, Harmandar F, Soyaltın UE, Aydemir S, Üstündağ Y. Kronik aktif hepatit B tanılı hastalarımızın tedavi yanıtlarının değerlendirilmesi. Turk J Gastroenterol. 2013;12(2):58-65. [CrossRef]
- Güzelbulut F, Ovünç AO, Çetinkaya ZA, et al. Comparison of the efficacy of entecavir and tenofovir in chronic hepatitis B. Hepatogastroenterology. 2012;59(114):477-80. [CrossRef]
- Bilge Ü, An BK, Gümürdülü Y, Soylu A, Akin MS. Comparison of the efficacy of tenofovir and entecavir for the treatment of nucleos(t)ide-naive patients with chronic hepatitis B. Turk J Gastroenterol. 2012;23(3):247-52.
- Liaw YF, Leung N, Kao JH, et al. Asian-Pacific consensus statement on the management of chronic hepatitis B: a 2008 update. Hepatol Int. 2008;2:263-83. [CrossRef]
- Dusheiko G. Treatment of HBeAg positive chronic patients: interferon or nucleoside analogues. Liver Int. 2013;33:137-50. [CrossRef]
- Lampertico P, Maini M, Papatheodoridis G. Optimal management of hepatitis B virus infection – EASL Special Conference. J Hepatol. 2015;63:1238-53. [CrossRef]
- Boettler T, Thimme R. Antiviral therapy in hepatitis B virus associated liver cirrhosis. Dig Dis. 2015;33(4):608-12. [CrossRef]
- Terrault NA, Bzowej N, Chang KM, Hwang JP, Jonas MM, Murad MH. AASLD guidelines for treatment of chronic hepatitis B. Hepatology. 2016;63(1):261-83. [CrossRef]
- Lok AS, McMahon BJ. Chronic Hepatitis B: update 2009. Hepatology. 2009;50(3):661-2. [CrossRef]
- Kim V, Abreu RM, Nakagawa DM, Baldassare RM, Carrilho FJ, Ono SK. Pegylated interferon alfa for chronic hepatitis B: systematic review and meta-analysis. J Viral Hepat. 2016;23(3):154-69. [CrossRef]
- Zoulim F, Locarnini S. Hepatitis B virus resistance to nucleos(t)ide analogues. Gastroenterology. 2009;137(5):1593-608. [CrossRef]
- European Association for the Study of the Liver. EASL clinical practice guidelines: Management of chronic hepatitis B virus infection. J Hepatol. 2012; 57(1):167-85. [CrossRef]
- Reijnders JG, Deterding K, Petersen J, et al.; VIRGIL Surveillance Study Group. Antiviral effect of entecavir in chronic hepatitis B: influence of prior exposure to nucleos(t)ide analogues. J Hepatol. 2010;52(4):493-500. [CrossRef]
- Sonneveld MJ, Rijckborst V, Boucher CAB, et al. Prediction of sustained response to peginterferon alfa 2-b for HBe-Ag positive chronic hepatitis B using on treatment hepatitis B surface antigen decline. Hepatology. 2010;52(4):1251-7. [CrossRef]
- McHutchison JG, Lawitz EJ, Shiffman ML, et al.; IDEAL Study Team. Peginterferon alfa-2b or alfa-2a with ribavirin for treatment of hepatitis C infection. N Engl J Med. 2009;361(6):580-93. [CrossRef]
- Fontana RJ. Side effects of long-term oral antiviral therapy for hepatitis B. Hepatology. 2009;49(5):185-95. [CrossRef]
- Buti M, Tsai N, Petersen J, et al. Seven-year efficacy and safety of treatment with tenofovir disoproxil fumarate for chronic hepatitis B virus infection. Dig Dis Sci. 2015;60(5):1457-64. [CrossRef]
- Marcellin P, Gane E, Buti M, et al. Regression of cirrhosis during treatment with tenofovir disoproxil fumarate for chronic hepatitis B: a 5-year open-label follow-up study. Lancet. 2013;381(9865):468-75. [CrossRef]
- Hadziyannis SJ, Tassopoulos NC, Heathcote EJ, et al. Long-term therapy with adefovir dipivoxil for HBeAg-negative chronic hepatitis B. N Engl J Med. 2005;352(26):2673-81. [CrossRef]
- Li X, Zhong C, Yang S, et al. [Influence of adefovir dipivoxil or telbivudine monotherapy on renal function of patients with chronic hepatitis B]. Nan Fang Yi Ke Da Xue Bao. 2012;32(6):826-9. Chinese.