En Çok Okunanlar
Özet
Amaç: Bu çalışmada, hidroksiklorokin ve/veya favipiravir alan COVID-19 hastalarında, tedavi bitiminden sonra alınan orofarengeal ve nazofarengeal sürüntülerde polimeraz zincir reaksiyonu (“polymerase chain reaction – PCR”) negatifleşmesi durumunun değerlendirilmesi amaçlandı.
Yöntemler: Retrospektif gözlemsel olan çalışmaya; 18 yaşın üzerinde, orofarengeal ve nazofarengeal sürüntüleri COVID-19 PCR pozitif olan, hastaneye yatırılarak izlenen ve tedavi bitiminde kontrol örnekleri alınan COVID-19 hastaları dahil edildi. İlk grupta yer alan hastalara, T.C. Sağlık Bakanlığı Rehberi’ne uygun olarak öncelikli tedavi olan hidroksiklorokin başlandı. İkinci grubu, hidroksiklorokine yanıt vermeyen veya ağır pnömoni tanısı alan ve/veya yoğun bakım ünitesinde yatarak favipiravir tedavisi alan hastalar; üçüncü grubu ise hidroksiklorokinle kombine favipiravir tedavisi alan hastalar oluşturdu. Kontrol örnekleri, tedavi bitiminden en erken 24 saat sonra alındı. PCR pozitifliği devam eden hastalardan, 24-48 saatlik aralarla tekrarlayan örnekler alındı. SARS CoV-2 RNA tespiti, gerçek zamanlı revers transkriptaz PCR testiyle yapıldı.
Bulgular: Çalışmaya %52.2’si erkek ve yaş ortalaması 44.7±17.7 olan 492 hasta dahil edildi. Semptom sürelerinin ortalaması gruplar arasında benzer bulundu. Hastaların tamamında tedavi bitiminden 24 saat sonra PCR negatifleşme oranı %52.8 (260/492) olarak tespit edildi. Kırk sekiz saat sonra %27.9 (200/492) olan negatiflik oranı, 72 saat sonra %13.8 (123/492) ve 96 saat sonra %3.8 (80/492) olarak saptandı. Tüm örnek günleri için PCR negatifleşmesi oranları, gruplar arasında kıyaslandığında anlamlı düzeyde bir fark bulunmadı. Ayrıca; pozitif sonuç tarihinden ve tedavi bitiminden itibaren negatifleşmenin süresi açısından da anlamlı düzeyde bir fark saptanmadı. Tedaviye erken veya geç başlamanın PCR negatifleşme günü açısından fark yaratmadığı tespit edildi.
Sonuç: Hidroksiklorokin ve/veya favipiravir tedavisi alan COVID-19 hastalarında, tedavi bitiminden sonra alınan orofarengeal ve nazofarengeal sürüntülerde PCR negatifleşme süreleri veya negatifleşme oranları açısından fark saptanmadı
GİRİŞ
İlk olarak, Çin’de Aralık 2019’da ortaya çıkan ve sayıca artan pnömoni olgularına neden olan virus, önce yeni koronavirus (n-CoV) olarak tanımlanmış ardından n-CoV adı Uluslararası Virus Taksonomi Komitesi tarafından SARS-CoV-2 olarak değiştirilmiştir. Dünya Sağlık Örgütü (DSÖ) tarafından, hastalık koronavirus hastalığı 2019 (COVID-19) olarak adlandırılmış ve 11 Mart 2020 tarihinde pandemi ilan edilmiştir (1, 2). Aynı tarihte Türkiye’de ilk olgular görülmeye başlamıştır (3). COVID-19 hastalığında; akciğer, kalp, böbrek, gastrointestinal sistem gibi pek çok organ ve sistem etkilenerek çeşitli semptom ve bulgular ortaya çıkmaktadır (4).
SARS-CoV-2 infeksiyonunun ilk haftasında virus, özellikle üst solunum yollarında bulunmaktadır. COVID-19 hastalığında, üst ve/veya alt solunum yolu sekresyonlarında viral RNA’nın (ribonükleik asit) moleküler metotla saptanması tanı yöntemlerinden biridir. Yöntemin duyarlılığını artırmak için orofarengeal ve nazofarengeal sürüntü örneklerinin birlikte alınması önerilmektedir (5, 6, 7).
COVID-19 hastalığında denenen antiviral tedavilerin amacı, viral temizlenme ile bulaştırıcılığın azalması ve klinik iyileşme sağlanmasıdır. Klorokin/hidroksiklorokin, immünomodülatör ve potansiyel antiviral etkisinden dolayı COVID-19 hastalığının tedavisi için pek çok ülkede kullanılmıştır (8-10). İlk olarak Çin’den yayımlanan çalışmalarda, klorokin/hidroksiklorokin tedavisinin semptom süresini kısalttığı ve viral klirensi hızlandırdığı bildirilmiştir (11,12). Favipiravirin, COVID-19 hastalarında semptom süresini kısalttığını, viral klirensi artırdığını, oksijen gereksinimi ve mortalite oranını azalttığını bildiren çalışmalar yayımlanmıştır (13,14).
Bu çalışmada; ülkemizde çalışmanın yapıldığı dönemde COVID-19 tedavisinde kullanılmakta olan hidroksiklorokin ve/veya favipiravir verilen hastalarda, tedavi bitiminden sonra alınan orofarengeal ve nazofarengeal sürüntü örneklerinde polimeraz zincir reaksiyonu (“polymerase chain reaction – PCR”) negatifleşmesi durumunun değerlendirilmesi amaçlandı.
YÖNTEMLER
Hasta Alımı ve Takibi
15 Mart – 15 Ağustos 2020 tarihlerini kapsayan retrospektif gözlemsel çalışmamız, Ankara Eğitim Araştırma Hastanesi Etik Kurulu tarafından 03 Eylül 2020 tarih ve E-20 karar numarasıyla onaylandı. Çalışmaya; 18 yaş üzerinde, orofarengeal ve nazofarengeal sürüntüleri PCR pozitif olan, tedavi bitiminde kontrol örnekleri alınan ve hastaneye yatırılarak izlenen COVID-19 hastaları dahil edildi. Hastalığın tanısı, T.C. Sağlık Bakanlığı’nın çalışma döneminde yayımlanan COVID-19 Rehberi doğrultusunda PCR test pozitifliği ile koyulmuştur (3). Epidemiyolojik, klinik semptom ve muayene bulguları elektronik hasta kayıtlarından temin edildi. Hasta örneklerinde hemogram ve biyokimya testleri çalışılmış olup endikasyonu olan hastaların bilgisayarlı toraks tomografisi çekilmişti. Çalışmanın yürütüldüğü dönemde, T. C. Sağlık Bakanlığı COVID-19 Rehberi doğrultusunda PCR pozitif tüm hastalara ilk tedavi seçeneği olarak hidroksiklorokin başlanmaktaydı (3). Bu nedenle çalışmamıza dahil edilen ve ilk kabulde hafif/orta klinik tablosu olan hastalara hidroksiklorokin verildi; birden fazla komorbiditesi olan ileri yaştaki veya ağır klinik tablosu olan hastalara [takipne veya oda havasında oksijen satürasyonu düzeyinin (SpO2) %90’dan düşük olması veya bilateral akciğer tutulumu] favipiravir başlandı; yoğun bakım ünitesinde izlenen hastalara favipiravir ve/veya hidroksiklorokin verildi. Hidroksiklorokin kullanan hastalardan, tedavinin ikinci gününde yanıtsız olanlara (ateş, nefes darlığı gibi semptomları eklenen veya ilerleyenler) hidroksiklorokin kesilerek favipiravir başlandı.
Çalışmamızda; hidroksiklorokin (günde iki kez olacak şekilde; ilk gün 400 mg, sonraki 4 gün 200 mg, beş gün) alanlar Grup 1, favipiravir (günde iki kez olacak şekilde; ilk gün 1600 mg, sonraki 4 gün 600 mg, beş gün) alanlar Grup 2, hidroksiklorokin ve favipiravir kombinasyonu alanlar Grup 3 olarak tanımlandı. Semptomların başlamasından itibaren iki gün içinde tedavi başlanması erken tedavi, iki gün geçtikten sonra başlanması ise geç tedavi olarak kabul edildi.
Kontrol amaçlı orofarengeal ve nazofarengeal sürüntü örnekleri, tedavi bitiminden sonra 24 saat içinde alındı. İlk kontrol testleri pozitif saptananlarda, 24 saat aralarla ikinci, üçüncü veya dördüncü örnekler alınmaya devam edildi. PCR negatifleşmesi tespit edilen hastalardan tekrar örnek alınmadı. Kontrol amaçlı olarak en az iki örnek alınan, ancak pozitif saptananlar PCR negatifleşmesi yok olarak değerlendirildi. Veri analizi yapılırken, PCR negatifleşmesi oranları her örnek günü için ayrı hesaplandı.
Mikrobiyolojik Yöntem
Hastanemizin Tıbbi Mikrobiyoloji Bölümü COVID-19 PCR Tanı Laboratuvarı’na gönderilen orofarengeal ve nazofarengeal sürüntü örneklerinde, SARS-CoV-2 RNA tespiti için gerçek zamanlı ters transkripsiyon PCR testi uygulanmıştır. Bu amaçla Rotor-Gene Q 5plex HRM real-time PCR cihazında (Qiagen, Almanya), Bio-Speedy® COVID-19 RT-qPCR Tespit Kiti (Bioeksen, Türkiye) kullanılmıştır. Tüm test prosedürleri üretici firma talimatlarına uygun olarak gerçekleştirilmiştir. Test sonuçlarının yorumlanmasında sigmoidal amplifikasyon eğrileri görülen ve SARS-CoV-2RdRp geni hedefi (FAM) ≤38 olan örnekler SARS-CoV-2 pozitif olarak raporlanmıştır.
İstatistiksel Analiz
Veriler, SPSS (“Statistical Package for Social Sciences”) versiyon 22.0 programı (IBM Corp., ABD) ile değerlendirildi. Tanımlayıcı istatistikler ortanca, ortalama ± standart sapma ve yüzde olarak sunuldu. Tanımlayıcı istatistiklerin yanı sıra kategorik değişkenlerin karşılaştırılmasında; χ² testi, Yates χ² sınaması veya Fisher kesin χ² testi uygulandı. Değişkenlerin normal dağılıma uygunluğu, görsel (histogram ve olasılık grafikleri) ve analitik yöntemler (Kolmogorov-Smirnov testi veya Shapiro-Wilk testi) ile incelendi. Üç bağımsız grup arasında normal dağılıma uyduğu saptanan değişkenler için tek yönlü varyans analizi (ANOVA), normal dağılıma uymadığı saptanan değişkenler içinse Kruskal-Wallis testi istatistiksel yöntem olarak kullanıldı. İstatistiksel anlamlılık düzeyi p<0.05 olarak kabul edildi.
BULGULAR
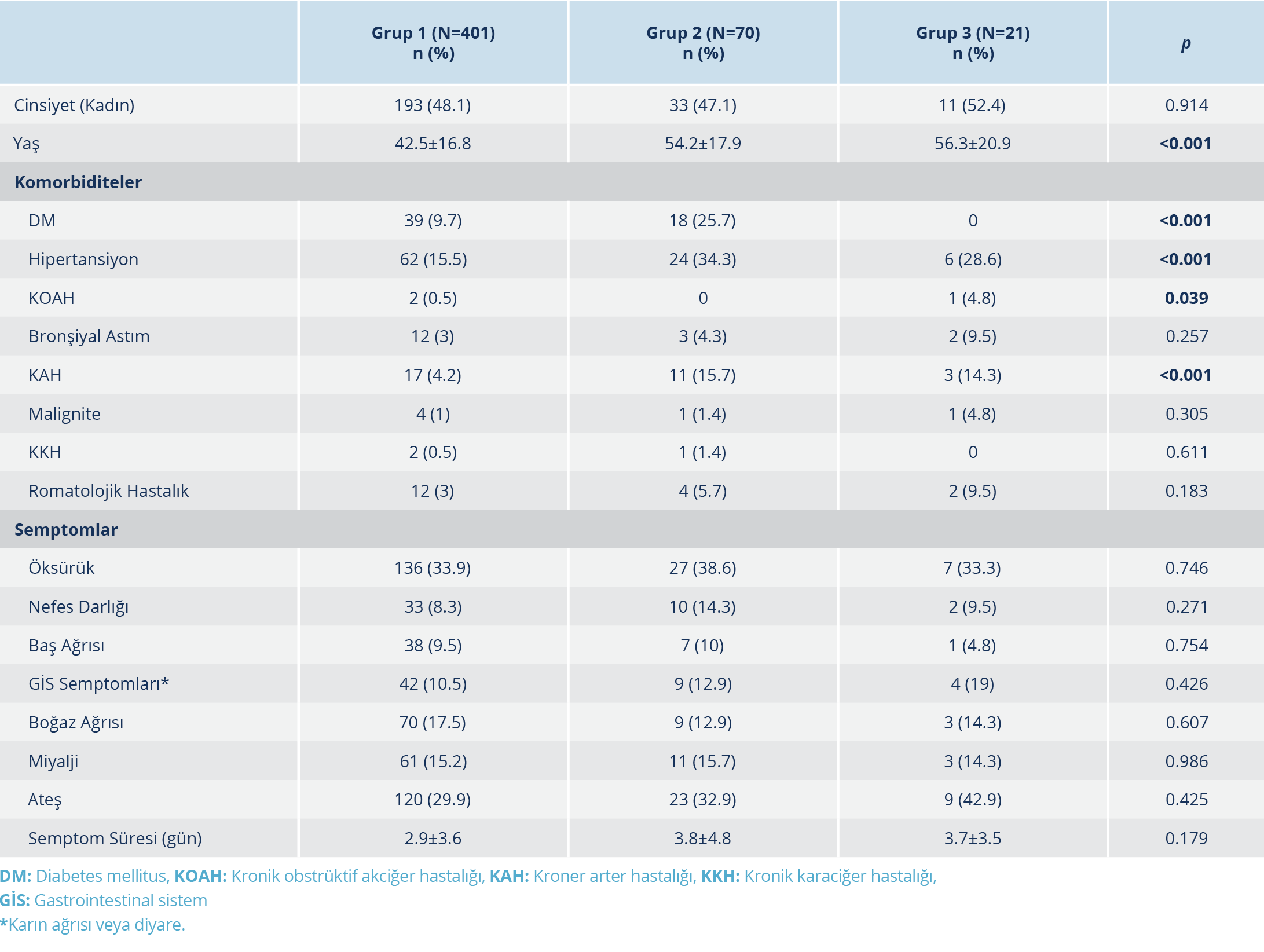
Hastaneye yatan toplam 492 hasta çalışmaya alındı ve üç grupta incelendi; Grup 1’de 401, Grup 2’de 70 ve Grup 3’te 21 hasta mevcuttu. Hastaların yaş ortalaması 44.7±17.7 olup 261 (%52.2)’i erkekti. Grup 2 hastalarından beşinde, iki gün hidroksiklorokin kullanıldıktan sonra favipiravir tedavisine geçilmişti. Yaş ortalaması Grup 1’de daha düşüktü (p<0.001). Altta yatan hastalıklar olarak DM (diabetes mellitus), hipertansiyon (HT) ve koroner arter hastalığı (KAH) grup 2’de daha yüksek oranda saptandı (p<0.001). Kronik obstrüktif akciğer hastalığı (KOAH), Grup 3’te daha yüksek orandaydı (p=0.039). En sık görülen semptomlar öksürük, ateş, boğaz ağrısı ve miyalji idi. Semptomlar açısından üç grup arasında anlamlı düzeyde fark saptanmadı. Tüm hastalarda yatış tarihinde sorgulanan semptom süresi ortalaması 4.2±3.8 gün olup üç grup arasında anlamlı düzeyde fark saptanmadı (Tablo 1).
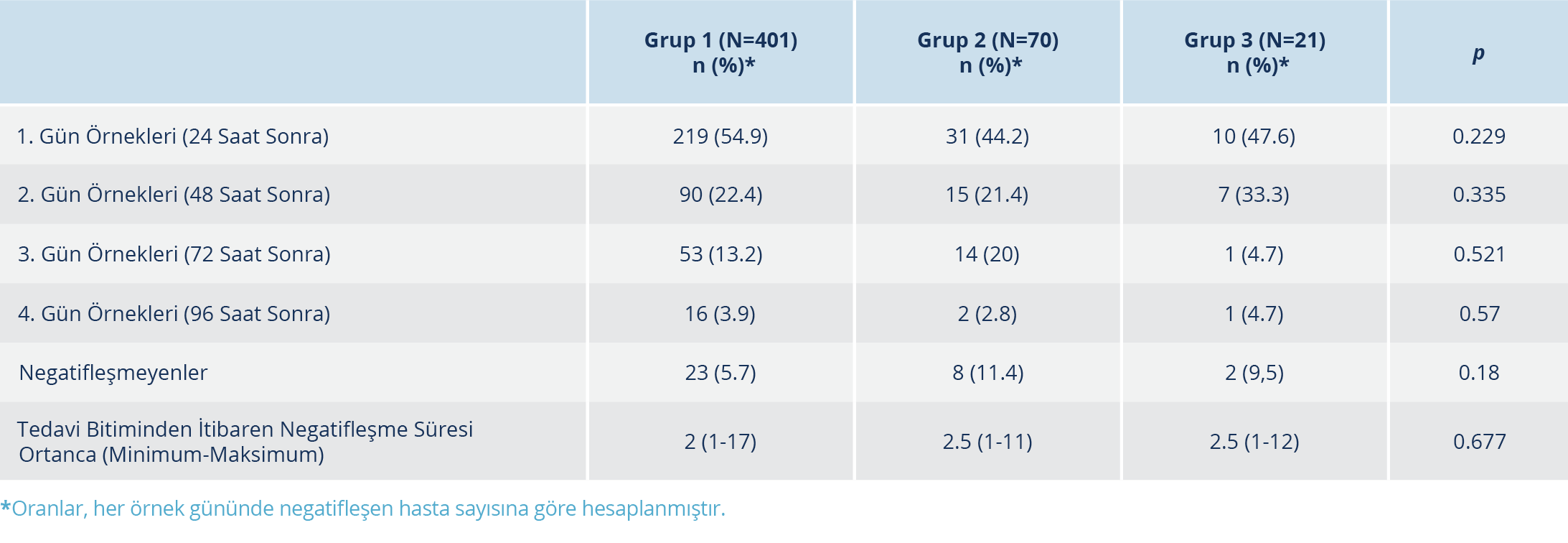
Tablo 3. Tedavi Bitiminden Sonraki Sürüntü Örneklerinde PCR Negatifliğinin Tedavi Gruplarına Göre
Karşılaştırılması
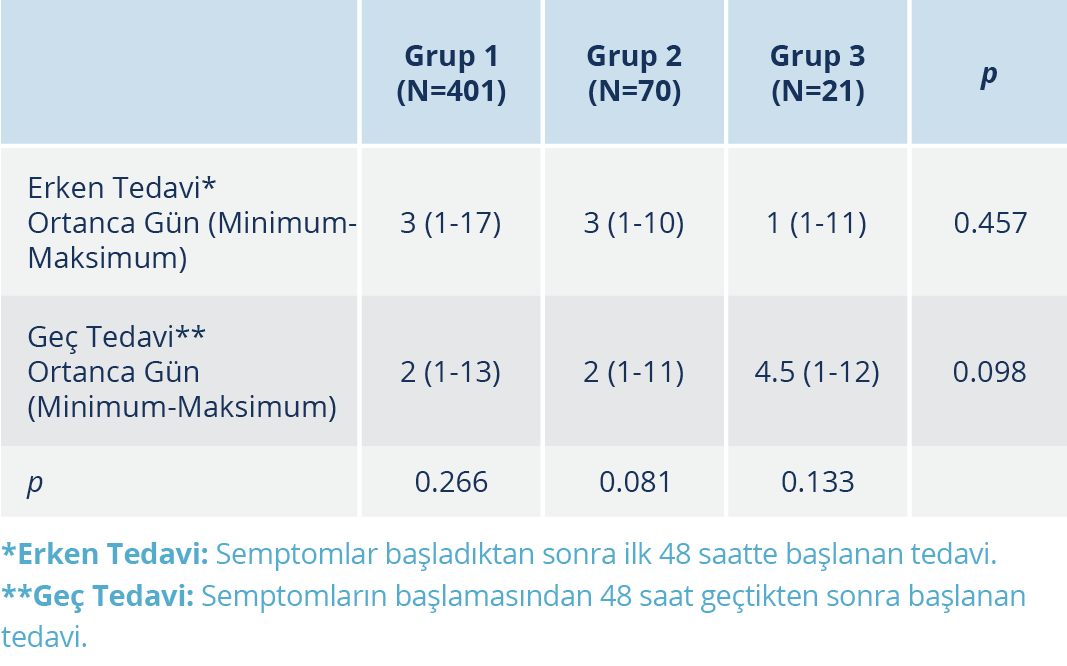
Tablo 4. PCR Negatifleşme Süresinin (Gün Bazında) Tedaviye
Erken veya Geç Başlanmasına Göre Karşılaştırılması
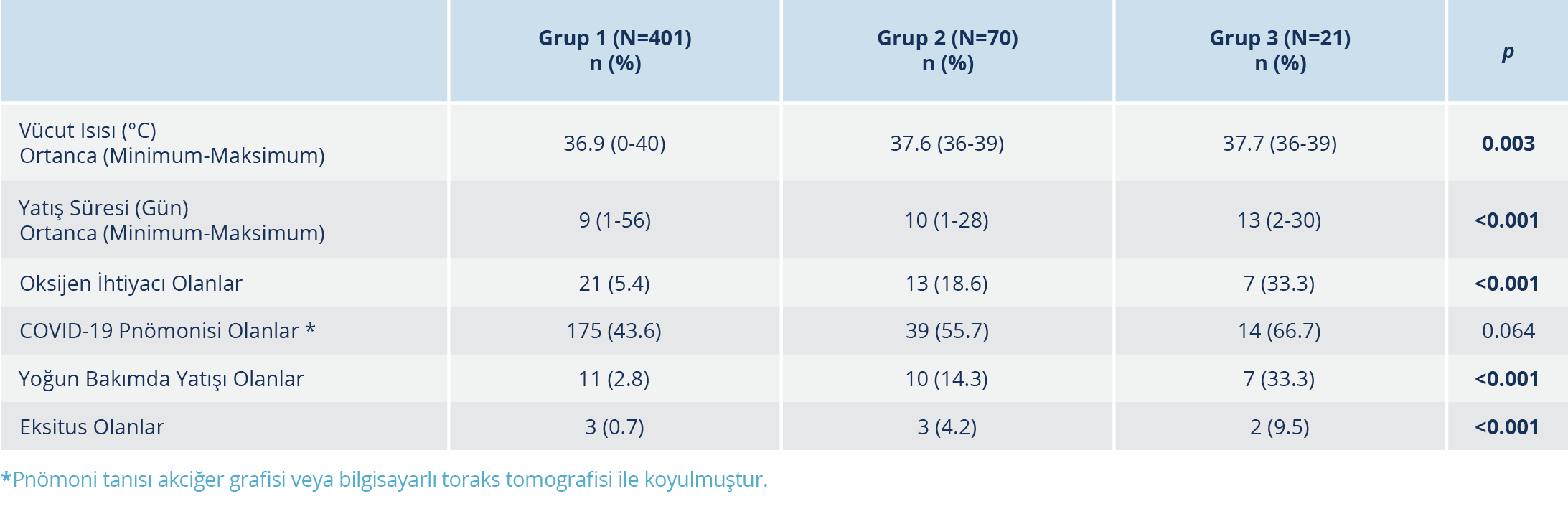
Hastaların muayene bulgularına göre vücut ısısı ortalamaları, Grup 1’de, Grup 2 ve 3’ten daha yüksekti (p<0.03). Hastaların 229 (%45.8)’unda pnömoni saptandı. Hidroksiklorokin alan Grup 1 hastalarında, pnömoni varlığı en düşük oranda olmakla birlikte istatistiksel açıdan gruplar arasında anlamlı düzeyde fark bulunmadı. Oksijen desteğine ihtiyaç duyan hastaların oranları Grup 2 ve 3’te daha yüksek olup fark anlamlı düzeydedir (p<0.001). Hastanede toplam yatış günü ortalaması 9.8±4.8 gündü. En uzun yatış süresi Grup 3’te kaydedilmiş olup gruplar arasındaki fark istatistiksel olarak anlamlı düzeydedir (p<0.001). Hastaların 28 (%5.6)’i yoğun bakım ünitesine yatırıldı. Yoğun bakım ünitesine yatış Grup 3’te en yüksek orandadır (p<0.001). Toplam 8 (%1.6) hasta eksitus olmuştur. Ölüm oranları Grup 1’de %0.7, Grup 2’de %4.2 ve Grup 3’te %9.5’dir (p<0.001). Tüm hastalarda, tedavi bitiminden sonra 24 saat içinde PCR negatifleşmesi oranı %52.8 (260/492) olarak tespit edildi; bu oran 48 saat sonra %27.9 (200/492), 72 saat sonra %13.8 (123/492) ve 96 saat sonra %3.8 (80/492) olarak tespit edildi. Örnekleri negatif olarak sonuçlanan hastalarda, tedavi bitiminden negatif saptanana kadar geçen süre ortancası 2 (1-17) gündür (Tablo 2).
Tüm örnek günlerinde PCR negatifleşmesi oranları, gruplar arasında kıyaslandığında anlamlı düzeyde fark bulunmadı. Ayrıca tedavi bitiminden itibaren PCR negatifleşmesi süresi açısından da anlamlı düzeyde bir fark saptanmadı (Tablo 3). Tedaviye erken veya geç başlamanın gruplar arasında PCR negatifleşmesi günü açısından fark yaratmadığı görüldü. Ek olarak, her grup kendi içinde kıyaslandığında; tedaviye erken veya geç başlama fark oluşturmadı (Tablo 4).
İRDELEME
Antiviral tedavinin amaçlarından biri, replikasyonu baskılayarak solunum yollarında viral klirensi sağlamak ve bulaştırıcılığı azaltmaktır. Çalışmaya dahil edilen hastaların izlendiği dönemde, SARS-CoV-2’ye karşı etkinliği kesinlik kazanmış bir antiviral mevcut değildi. Bu çalışmada, hidroksiklorokin ve/veya favipiravir alan hastaların orofarengeal ve nazofarengeal sürüntülerinde PCR negatifleşme oranları ve süreleri açısından fark olmadığı saptandı.
Solunum yolu örneklerinde PCR ile SARS-CoV-2 RNA saptanabilmesi, pek çok faktörden etkilenmektedir. Bu faktörler; viral yük, virusun üst solunum yollarında kısa süreli bulunması, örneğin nereden, nasıl veya ne zaman alındığı, laboratuvara ulaşma şartları, çalışma tekniği ve duyarlılığı olarak sayılabilir (6, 7). COVID-19 hastalarının solunum yolu örneklerinde, yanlış negatiflik oranları çalışmalar arasında farklılık göstermektedir (15).
İyileşen hastaların takiplerinde pozitifliğin yeniden ortaya çıkabildiği pek çok yayında bildirilmiştir. Söz konusu çalışmaların irdelendiği bir yayında; hasta popülasyonuna, demografik özelliklerine ve örneklerin türüne göre değişmekle birlikte hastaların %2-4 ile %69.2 kadarında yeniden pozitiflik saptanmıştır (7). Çalışmamızda, PCR negatifleşmesi tespit edilen hastalar takip edilmediği için bu kapsamda bir verimiz bulunmamaktadır.
Çalışmamızda, tedavi grupları arasında kaydedilen semptomlar ve semptom süreleri benzer olmakla birlikte DM, HT, KAH gibi komorbiditeler ile pnömoni oranları Grup 2 ve 3’te daha yüksek tespit edildi. Ancak hastaların çoğunda görüntülemenin erken yapılmış olması ve ancak bir kısmında bilgisayarlı tomografi çekilmesi nedeniyle pnömoni oranları düşük çıkmış olabilir. Yoğun bakım ünitesinde yatan ve eksitus olan hasta oranları Grup 2 ve Grup 3’te daha yüksektir. Grup 1 hastalarına kıyasla diğer gruplarda ağır hastalar bulunmakla birlikte PCR negatifleşmesi açısından fark saptanmadı.
Literatürde, klorokin/hidroksiklorokin veya favipiravir alanlar ve almayanların kıyaslandığı pek çok çalışma mevcuttur. Ayrıca COVID-19 tedavisinde denenen diğer seçeneklerle karşılaştırmalı çalışmalar da yayımlanmıştır (2, 16, 17-23). Bu çalışmalar, daha çok viral klirens üzerinedir ve aralarında hasta seçimi ve yöntem farklılıkları vardır.
Meta-analiz şeklinde gerçekleştirilen çalışmalar arasında, klorokin/hidroksiklorokinle tedavi edilenlerde hem klirensin daha hızlı olduğu çalışmalar hem de fark olmadığını gösteren çalışmalar yer almaktadır (9, 10, 19). Huang ve arkadaşlarının (18) çalışmasında, klorokinin viral klirens üzerine etkisi değerlendirilmiştir. Hasta sayısı 407 olup bizim örneklem sayımıza yakın olmakla birlikte 500-1000 mg olan klorokin dozu ve 10 gün olan tedavi süresi çalışmamızla uyumlu değildir. Söz konusu çalışmadaki PCR negatifleşme süre ortancası 3 gündür ve bizim sonucumuza (2 gün) benzer bulunmuştur. Tedavi bitimindeki %91 negatiflik oranı ise çalışmamızdan yüksek saptanmıştır. Bu farklılık, çalışmadaki tedavi şeması ile ilişkili olabilir. Kamran ve arkadaşlarının (16) 349 hastayı içeren çalışmasında, bizimle benzer bir yöntem kullanılmıştır. Hidroksiklorokin dozu ve süresi çalışmamızdakiyle aynıdır ve 7. günde tek PCR negatifleşmesi değerlendirilmiştir. Hastaların %52’sinde saptanan negatiflik oranı, bizim ilk örneklerimizdeki (6. gün) sonuçla benzerdir.
Favipiravirin PCR negatifleşmesi veya klirens üzerindeki etkisinin irdelendiği meta-analizler yayımlanmıştır. Söz konusu çalışmalar arasında favipiravir verilenlerde, klirensin daha erken olduğunu bildiren çalışmalar kadar fark olmadığını gösteren çalışmalar da mevcuttur (13, 14, 24). Zhao ve arkadaşları (20) favipiravir alan 36 hastada viral klirens saptanma gününü 17 gün olarak bildirmiştir. Söz konusu çalışmadaki favipiravir dozu çalışmamızla aynıdır ancak süre 7-14 güne uzatılmıştır. Ayrıca PCR testinin bazı hastalarda balgamda yapılması da negatifleşme süresini uzatmış olabilir. Doi ve arkadaşlarının (21) 88 hastayı kapsayan çalışmalarında, favipiravir erken ve geç başlanılan hastalar viral klirens saptanma oranları açısından kıyaslanmıştır. Tedaviye, erken grupta (n=44) tanı anında, geç grupta (n=44) ise 6. günde başlanmıştır. Favipiravir, 10 gün süreyle ve çalışmamızda yer alan tedaviden daha yüksek dozda verilmiştir. Klirens erken grupta %66.7, geç grupta ise %51 oranında çıkmıştır. Viral infeksiyonlarda, antiviral tedaviye erken başlamanın olumlu yönde etkisi olabileceği düşünülerek, çalışmamızda her grup kendi içinde erken veya geç tedavi alanlar olarak kıyaslandı. Ancak, tedaviye ilk iki gün içinde başlamanın negatifleşme açısından fark yaratmadığı saptandı. Çalışmamızda, grupların hasta sayısı ve klinik açıdan dengeli dağılmamış olması bu sonuca yol açmış olabilir.
Literatürde, klorokin/hidroksiklorokin ile favipiravir kombinasyonunun PCR negatifleşmesi üzerine etkisini kıyaslayan çalışmalar azdır. Ivashchenko ve arkadaşları (17), 60 olguyu içeren çalışmalarında 5. ve 10. gündeki viral klirens oranlarını kıyaslamıştır. Favipiravir alanlarda, klorokin alanlara göre 5. günde %62.5-%30 ve 10. günde %92.5-%80 olmak üzere daha yüksek oranda klirens saptamışlardır. Olgu sayısının az olması, test günlerinin değişkenliği ve klirensin hedeflenmesi bu çalışmanın farklı özellikleridir. Bosaeed ve arkadaşlarının (25) 20 olgu içeren çalışmasında, hidroksiklorokin ve favipiravir kombinasyonu alanlar standart tedavi alanlarla kıyaslanmıştır. Takibin 28. günündeki PCR negatifleşmesi tedavi grubunda %32, kontrol grubunda %29.5 oranında saptanmıştır. Çalışmada, tüm hastalardan kontrol amaçlı PCR sonucu alınamadığı belirtilmiş olup çalışmamızla kıyaslandığında kontrol grubu, tedavi planı, örnek alınma zamanı ve örnek türü açısından yöntem farklılığı söz konusudur. Ülkemizden Ömeroğlu ve arkadaşlarının (26) çalışmasına, İzmir ilinde farklı sağlık merkezlerinde ayaktan izlenen 1489 hasta dahil edilmiştir. Hastalığın 3. gününde PCR negatifleşme oranı, hidroksiklorokin alan grupta sadece favipiravir alan veya kombinasyon alan gruba kıyasla istatistiksel olarak anlamlı düzeyde daha yüksek saptanmıştır. Ancak, bu fark 14. günde saptanmamıştır. Bu çalışmada da hasta seçimi ve örnek alınma zamanları ile ilgili farklılıklar vardır.
Çalışmamızın bazı kısıtlılıkları mevcuttur. Ülkemizde çalışma döneminde, PCR pozitifliği olan herkese tedavi başlandığı için hidroksiklorokin ve/veya favipiravir verilmeyen kontrol grubu yoktur. Ek olarak, grupların hasta sayıları ve klinik özellikleri dengeli değildir. Uygulanacak tedavi seçeneği sadece hastaların klinik şiddetine göre belirlenmiş olup randomizasyon yapılamayışı yanlılık nedeni sayılabilir. Tüm hastalardan aynı günlerde örnek alınamamıştır. Ayrıca, bir kez negatiflik saptanan hastalarda ikinci örnek alınması planlanmadığı için klirens sonuçlarının değerlendirilememesi önemli bir kısıtlılıktır.
Sonuç olarak; gözlemsel olan bu çalışmada hidroksiklorokin ve/veya favipiravir tedavisi alan COVID-19 hastalarında, tedavi bitiminden sonra alınan orofarengeal ve nazofarengeal sürüntülerde PCR negatifleşme süreleri ve oranları açısından fark saptanmadı. Ayrıca, tedavinin erken başlanmasının da PCR negatifleşme sonuçlarında anlamlı fark yaratmadığı tespit edildi. Antiviral tedavinin, standart tedavi alan hastalarla kıyaslamalı prospektif olgu-kontrol çalışmaları planlanarak daha objektif veriler elde edileceği düşünülmektedir.
Hasta Onamı
Çalışma retrospektif gözlemsel bir çalışma şeklinde yapılmıştır.
Etik Kurul Kararı
Çalışma için Ankara Eğitim ve Araştırma Hastanesi Etik Kurulu’ndan 03 Eylül 2020 tarih ve E-20 karar numarasıyla onay alınmıştır.
Danışman Değerlendirmesi
Bağımsız dış danışman.
Yazar Katkıları
Fikir/Kavram – G.T.E., F.Ş.E., Ç.A.H.; Tasarım – G.T.E., F.Ş.E., Ç.A.H.; Denetleme – F.D., S.C., S.K.; Kaynak ve Fon Sağlama – F.D., Ü.Ö.S., A.B., S.K.; Malzemeler/Hastalar – Ü.Ö.S., P.G.; Veri Toplama ve/veya İşleme – E.B., A.B., M.Ö.; Analiz ve/veya Yorum – E.B., M.Ö., P.G., S.K.; Literatür Taraması – M.Ö., S.C., P.G., A.B., Ü.Ö.S.; Makale Yazımı – G.T.E., F.Ş.E., S.C.; Eleştirel İnceleme – Ç.A.H., F.D., E.B.
Çıkar Çatışması
Yazarlar herhangi bir çıkar çatışması bildirmemiştir.
Finansal Destek
Yazarlar finansal destek beyan etmemiştir.
Sunulan Bilimsel Etkinlik
Çalışma verilerinin bir bölümü, 9-12 Mart 2022 tarihinde gerçekleştirilen 22. Türk Klinik Mikrobiyoloji ve İnfeksiyon Hastalıkları Kongresi’nde poster olarak sunulmuştur.
Referanslar
- Coronavirus disease (COVID-19) pandemic [İnternet]. Geneva: World Health Organization. [erişim 10 Kasım 2021]. https://www.who.int/emergencies/diseases/novel-coronavirus-2019
- Cai Q, Yang M, Liu D, et al. Experimental treatment with favipiravir for COVID-19: an open-label control study. Engineering (Beijing). 2020;6(10):1192-8. [CrossRef]
- COVID-19 Bilgilendirme Platformu [İnternet]. Ankara: T.C. Sağlık Bakanlığı. [erişim 11 Kasım 2021]. https://covid19bilgi.saglik.gov.tr
- Cevik M, Bamford CGG, Ho A. COVID-19 pandemic-a focused review for clinicians. Clin Microbiol Infect. 2020;26(7):842-7. [CrossRef]
- Wang W, Xu Y, Gao R, et al. Detection of SARS-CoV-2 in different types of clinical specimens. JAMA. 2020;323(18):1843-4. [CrossRef]
- Erensoy S. [SARS-CoV-2 and microbiological diagnostic dynamics in COVID-19 pandemic]. Mikrobiyol Bul. 2020;54(3):497-509. Turkish. [CrossRef]
- Zou L, Ruan F, Huang M, et al. SARS-CoV-2 viral load in upper respiratory specimens of infected patients. N Engl J Med. 2020;382(12):1177-9. [CrossRef]
- Şimşek Yavuz S, Ünal S. Antiviral treatment of COVID-19. Turk J Med Sci. 2020;50(SI-1):611-9. [CrossRef]
- Elavarasi A, Prasad M, Seth T, et al. Chloroquine and hydroxychloroquine for the treatment of COVID-19: a systematic review and meta-analysis. J Gen Intern Med. 2020;35(11):3308-14. [CrossRef]
- Das RR, Jaiswal N, Dev N, Jaiswal N, Naik SS, Sankar J. Efficacy and safety of anti-malarial drugs (chloroquine and hydroxy-chloroquine) in treatment of COVID-19 İnfection: a systematic review and meta-analysis. Front Med (Lausanne). 2020;7:482. [CrossRef]
- Gao J, Tian Z, Yang X. Breakthrough: Chloroquine phosphate has shown apparent efficacy in treatment of COVID-19 associated pneumonia in clinical studies. Biosci Trends. 2020;14(1):72-3. [CrossRef]
- Chen J, Liu D, Liu L, et al. [A pilot study of hydroxychloroquine in treatment of patients with moderate COVID-19]. Zhejiang Da Xue Xue Bao Yi Xue Ban. 2020;49(2):215-9. Chinese. [CrossRef]
- Hassanipour S, Arab-Zozani M, Amani B, Heidarzad F, Fathalipour M, Martinez-de-Hoyo R. The efficacy and safety of favipiravir in treatment of COVID-19: a systematic review and meta-analysis of clinical trials. Sci Rep. 2021;11(1):11022. Erratum in: Sci Rep. 2022;12(1):1996. [CrossRef]
- Manabe T, Kambayashi D, Akatsu H, Kudo K. Favipiravir for the treatment of patients with COVID-19: a systematic review and meta-analysis. BMC Infect Dis. 2021;21(1):489. [CrossRef]
- Dinnes J, Deeks JJ, Berhane S, et al.; Cochrane COVID-19 Diagnostic Test Accuracy Group. Rapid, point-of-care antigen and molecular-based tests for diagnosis of SARS-CoV-2 infection. Cochrane Database Syst Rev. 2021;3(3):CD013705. [CrossRef]
- Kamran SM, Moeed HA, Mirza ZE, et al. Clearing the fog: is hydroxychloroquine effective in reducing coronavirus disease-2019 progression? a randomized controlled trial. Cureus. 2021;13(3):e14186. [CrossRef]
- Ivashchenko AA, Dmitriev KA, Vostokova NV, et al. AVIFAVIR for treatment of patients with moderate coronavirus disease 2019 (COVID-19): interim results of a phase II/III multicenter randomized clinical trial. Clin Infect Dis. 2021;73(3):531-4. [CrossRef]
- Huang M, Li M, Xiao F, et al. Preliminary evidence from a multicenter prospective observational study of the safety and efficacy of chloroquine for the treatment of COVID-19. Natl Sci Rev. 2020;7(9):1428-36. [CrossRef]
- Eze P, Mezue KN, Nduka CU, Obianyo I, Egbuche O. Efficacy and safety of chloroquine and hydroxychloroquine for treatment of COVID-19 patients-a systematic review and meta-analysis of randomized controlled trials. Am J Cardiovasc Dis. 2021;11(1):93-107.
- Zhao H, Zhang C, Zhu Q, et al. Favipiravir in the treatment of patients with SARS-CoV-2 RNA recurrent positive after discharge: a multicenter, open-label, randomized trial. Int Immunopharmacol. 2021;97:107702. [CrossRef]
- Doi Y, Hibino M, Hase R, et al. A prospective, randomized, open-label trial of early versus late favipiravir therapy in hospitalized patients with COVID-19. Antimicrob agents chemother. 2020;64(12):e01897-20. [CrossRef]
- Lou Y, Liu L, Yao H, et al. Clinical outcomes and plasma concentrations of baloxavir marboxil and favipiravir in COVID-19 patients: an exploratory randomized, controlled trial. Eur J Pharm Sci. 2021;157:105631. [CrossRef]
- Joshi S, Parkar J, Ansari A, et al. Role of favipiravir in the treatment of COVID-19. Int J Infect Dis. 2021;102:501-8. [CrossRef]
- Prakash A, Singh H, Kaur H, et al. Systematic review and meta-analysis of effectiveness and safety of favipiravir in the management of novel coronavirus (COVID-19) patients. Indian J Pharmacol. 2020;52(5):414-21. [CrossRef]
- Bosaeed M, Mahmoud E, Alharbi A, et al. Favipiravir and hydroxychloroquine combination therapy in patients with moderate to severe COVID-19 (FACCT Trial): an open-label, multicenter, randomized, controlled trial. Infect Dis Ther. 2021;10(4):2291-2307. [CrossRef]
- Ömeroğlu ŞK, Temel F, Altun D, Öztop B. Effects of hydroxychloroquine and favipiravir on clinical course in outpatients with COVID-19. Turk J Med Sci. 2021;51(6):2827-34. [CrossRef]