En Çok Okunanlar
Özet
Bruselloz, dünyada ve ülkemizde çok yaygın olarak görülmesine rağmen hastalığın tanı ve tedavisini yönlendirmede kullanılabilecek kanıta dayalı bir rehber bulunmamaktadır. Bu rehber, brusellozun tanı ve tedavisi ile ilgilenen farklı uzmanlık alanlarından hekimlere kanıta dayalı öneriler sunmak üzere Türk Klinik Mikrobiyoloji ve İnfeksiyon Hastalıkları Derneği tarafından hazırlanmıştır.
Rehberin hazırlanmasında, ABD İnfeksiyon Hastalıkları Derneği (IDSA)’nin Klinik Uygulama Rehberi Geliştirme Kılavuzu önerileri esas alınmıştır. Rehberi hazırlayan grup üyeleri tarafından, bruselloz tanı ve tedavisinde önemli olduğu düşünülen 20 soru belirlenmiş ve PICO [hasta/popülasyon (P), müdahale/indikator (I), karşılaştırma/kontrol (C), sonuç (O)] formatında oluşturulan bu sorulara yanıt verebilecek yayınlar, ULAKBİM TR Dizin, PubMed ve Cochrane veritabanlarından, tarih kısıtlaması olmadan taranmıştır. Her bir PICO sorusu ve her bir ayrı sonlanım için kanıtların derecelendirilmesinde ve önerilerin gücünün belirlenmesinde “Grading of Recommendations, Assessment, Development and Evaluation (GRADE) Working Group” yöntemi kullanılmıştır. PICO sorularına yanıt oluşturabilecek şekilde karşılaştırmalı klinik araştırmaların olması halinde bunların meta-analizleri, olmaması halindeyse olgu sunumları ve olgu serilerinden elde edilen verilerle “individual participant data” (IPD) meta-analizleri yapılmıştır. Önerilerin yeni çalışmaların sonuçları doğrultusunda belli aralıklarla güncellenmesi planlanmaktadır.
ÖNERİLERİN ÖZETİ
1- Brusellozdan kuşkulanılan hastalarda Rose Bengal testinin tanıdaki yeri nedir?
Öneri: Rose Bengal (RB) testinin bruselloz tanısında duyarlılığı yüksektir. Temas öyküsü ve uyumlu semptomları olan hastalarda hızlı tanı testi olarak kullanılması önerilir (Düşük kanıt düzeyi, güçlü öneri). Yapılan meta-analizlerinde testin özgüllüğü de yüksek bulunmuştur, ancak değerlendirilen kontrol grupları uygun olmadığı için, mevcut veriler bruselloz tanısında tek başına kullanılması konusunda yeterli değildir. Antikor taramaya yönelik bir test olması nedeniyle hastalığın erken dönemlerinde yalancı negatiflik olabileceğinin de akılda tutulması önerilir (Çok düşük kanıt düzeyi, güçlü öneri).
2- Brusellozdan kuşkulanılan hastalarda Wright standart tüp aglütinasyon testinin tanıdaki yeri nedir?
Öneri: Brusellozdan kuşkulanılan hastalarda Wright standart tüp aglütinasyon (STA) testinin ≥1:160 titrasyonda pozitifliğinin, bruselloz tanısı için duyarlılık ve özgüllüğü yüksek bulunmuştur. Erken tedavi başlanmasının gerekli olduğu durumlarda hızlı tanıda veya kültürün yapılamadığı durumlarda tanıda Wright STA testi kullanılabilir. Brusellozdan kuşkulanılan hastalarda RB testi pozitif saptandığı durumlarda tanının, daha özgül olması nedeniyle, Wright STA testi ile doğrulanması önerilir (Düşük kanıt düzeyi, güçlü öneri).
Brusella endokarditi olan hastalarda, Wright STA’nın, ≥1:1280 titrede pozitif olması mortalite ile ilişkili bulunmuştur. Bu nedenle bu grup hastalarda aynı zamanda, prognozu öngörmek için de Wright STA testinin kullanılması düşünülebilir (Düşük kanıt düzeyi, zayıf öneri).
3- Brusellozdan kuşkulanılan hastalarda enzim işaretli immün deney (ELISA) temelli testlerin tanıdaki yeri nedir?
Öneri: Brusellozdan kuşkulanılan ve RB testi pozitif olan hastalarda doğrulama amacıyla STA testi yerine ELISA temelli testler de kullanılabilir. Tanıda ELISA temelli testler kullanılacaksa IgM ve IgG testlerinin birlikte kullanılması önerilir (Çok düşük kanıt düzeyi, güçlü öneri).
4- Brusellozdan kuşkulanılan hastalarda polimeraz zincir reaksiyonu (PCR) temelli testlerin tanıdaki yeri nedir?
Öneri: Bruselloz tanısında PCR temelli testlerin duyarlılık ve özgüllüğü yüksektir, ancak pahalı olmaları, deneyimli personel ve teknik donanım gerektirmeleri nedeniyle ilk aşamada tanı testi olarak kullanımı önerilmez. Wright STA testinin negatif çıkmasına karşılık klinik kuşkunun devam ettiği ve kültür sonucunun beklenmesinin tanı ve tedaviyi geciktirerek hastada olumsuz sonuçlara yol açabileceği düşünüldüğü durumlarda bruselloz tanısı koymak için PCR temelli testlerin kullanımı düşünülebilir (Düşük kanıt düzeyi, güçlü öneri).
5- Nörobruselloz tanısında hangi tanısal testler tercih edilmelidir?
Öneri: Nörobrusellozdan kuşkulanılan hastalarda kesin tanı için, beyin omurilik sıvısı (BOS)’nda hücre sayımı, protein ve glukoz ölçümleri, kan ve BOS kültürü, serum ve BOS’ta Wright STA testi ve/veya Coombs’lu Wright STA testlerinin hepsinin bir arada yapılması önerilir (Çok düşük kanıt düzeyi, güçlü öneri).
Az sayıda doğrulanmış nörobruselloz tanısı alan olgudan elde edilen verilerde, BOS’ta ELISA ile Brucella spp. IgM ve/veya IgG bakılmasının, BOS Wright STA testine kıyasla daha duyarlı olduğu görüldüğünden, ulaşılabilen yerlerde BOS’ta Wright STA yerine ELISA IgM/IgG testinin tercih edilmesi düşünülebilir (Çok düşük kanıt düzeyi, zayıf öneri).
6- Bruselloz tedavisinde altı haftalık tedavi süresi dört haftalık tedavi süresinden üstün müdür?
Öneri: Komplike bruselloz olgularının (endokardit, nörobruselloz ve spondilit) dışlanarak bruselloz tedavi süresinin karşılaştırıldığı çalışmaların meta-analizinde, dört haftalık rejimlerle karşılaştırıldığında, altı haftalık antimikrobiyal tedavilerle relaps gelişme riski daha düşük bulunmuştur. Akut bruselloz tanısı konulan hastalarda altı haftalık tedavi kullanılması önerilir (Düşük kanıt düzeyi, güçlü öneri).
7-Bruselloz tedavisinde doksisiklin + streptomisin kombinasyonu, doksisiklin + rifampisin kombinasyonundan üstün müdür?
Öneri: Akut bruselloz tanısı konulan hastalarda tedavi rejimlerinin karşılaştırıldığı çalışmaların meta-analizinde doksisiklin-streptomisin (DOX-STREP) rejimi, doksisiklin-rifampisin (DOX-RIF) rejimine göre daha düşük tedavi başarısızlığı ve relapsla ilişkili bulunmuştur. Her iki tedavi rejimi arasında yan etki gelişimi açısından fark saptanmamıştır. Kullanım zorluğu ve uyum sorunu yaşamayacak akut bruselloz tanısı konulan hastalarda öncelikle DOX-STREP kombinasyonunun kullanılması önerilir (Düşük kanıt düzeyi, zayıf öneri).
8-Bruselloz tedavisinde doksisiklin + streptomisin kombinasyonu, doksisiklin + gentamisin kombinasyonundan üstün müdür?
Öneri: Akut bruselloz tedavisinde DOX-STREP kombinasyonunun, doksisiklin+gentamisin (DOX-GEN) kombinasyonuna, tedavi başarısızlığı, relaps ve yan etki gelişimi açısından üstünlüğü yoktur. Tedavide DOX ile kombinasyonda STREP veya GEN’den birinin tercih edilmesi önerilir (Orta kanıt düzeyi, güçlü öneri).
9-Bruselloz tedavisinde kinolon grubu antimikrobik içeren kombinasyonlar, kinolon içermeyen kombinasyonlardan üstün müdür?
Öneri: Akut bruselloz tedavi rejimlerini karşılaştıran çalışmaların meta-analizinde kinolon grubu antimikrobikleri içeren kombinasyonların, içermeyen kombinasyonlara göre, tedavi başarısızlığı, relaps ve yan etki gelişimi açısından üstün olmadığı görülmüştür. Ek olarak son yıllarda kinolon grubu antimikrobiklerle ilgili artan güvenlik endişeleri nedeniyle, akut bruselloz tedavisinde kinolon grubu antimikrobik içeren kombinasyonların öncelikli olarak tercih edilmemesi önerilir. Bruselloz tedavisinde kinolonların, sadece ilk seçenek ilaçların [DOX, RIF, GEN, STREP] yan etki, ilaç etkileşimi gibi herhangi bir nedenle kullanılamadığı durumlarda kombinasyonun bir bileşeni olarak düşünülmesi önerilir (Çok düşük kanıt düzeyi, güçlü öneri).
10-Bruselloz tanısı konmuş gebelerde rifampisin + seftriakson tedavisi, rifampisin + trimetoprim-sülfametoksazol tedavisine göre daha etkili midir?
Öneri: Bruselloz tanısı konmuş gebelerin tedavisinde farklı kombinasyonları karşılaştıran olgu serilerinin analizinde RIF + trimetoprim-sülfametoksazol (TMP-SMX) kombinasyonuyla, RIF+seftriakson (CRO) kombinasyonu arasında gebelik komplikasyonu gelişimi açısından bir fark belirlenmemiştir. Gebe bruselloz olgularının tedavisinde RIF+TMP-SMX veya RIF+CRO kombinasyonlarından birinin kullanılması önerilmekle birlikte TMP-SMX kombinasyonunun birinci trimesterde teratojenik etki, son trimesterde ise kernikterus geliştirme riski bulunması nedeniyle birinci ve üçüncü trimesterde RIF+CRO kombinasyonunun tercih edilmesi önerilir (Çok düşük kanıt düzeyi, zayıf öneri).
11-Nörobruselloz tedavisinde seftriakson içeren kombinasyon rejimi, seftriakson içermeyen rejime göre daha etkili midir?
Öneri: Tedavi rejimlerinin karşılaştırıldığı nörobruselloz olgu serilerinin “individual participant data” (IPD) meta-analizinde tedaviye CRO eklenmesinin tedavi başarısını anlamlı olarak artırdığı görülmüştür. Nörobruselloz tedavisinde standart tedaviye CRO eklenmesi önerilir (Düşük kanıt düzeyi, güçlü öneri).
12-Brucella spp. endokarditi olan hastalarda, tanı anındaki Wright STA testi titresi olumsuz sonuçları gösterir mi?
Öneri: Brucella spp. endokarditi olgularının IPD meta-analizinde, tanı anındaki Wright aglütinasyon titresinin 1/1280’in üzerinde olmasının, ölüm riskini belirgin olarak artırdığı belirlenmiştir. Brucella spp. endokarditi olan hastalarda, tanı anındaki Wright STA testi titresinin 1/1280’in üzerinde olması ölüm riskinin yüksek olabileceğini öngörmek amacıyla kullanılabilir (Düşük kanıt düzeyi, zayıf öneri).
13-Brucella spp. endokarditi olan hastalarda, 3’lü antimikrobik tedavi rejimleri, 2’li antimikrobik tedavi rejimlerinden daha üstün müdür?
Öneri: Brucella spp. endokarditi olgularının IPD meta-analizinde, 2’li antimikrobik tedavi alanlarda ölüm oranı, istatistiksel olarak anlamlı olmasa da 3’lü tedavi alanlardan daha yüksek bulunmuştur. Ölüm dışı istenmeyen etkiler birleşik sonlanımı (rekürans veya istenmeyen ilaç etkileri veya yeniden hastane yatışı veya hastane yatışında postoperatif komplikasyonlar veya bir yıl içinde yeniden ameliyat edilmede) 2’li antimikrobik tedavi alanlarda 3’lü tedavi alanlardan anlamlı olarak daha yüksek bulunmuştur. Bir diğer komplike bruselloz olan spondilodiskit çalışmalarının meta-analizinde de 3’lü tedaviler daha üstün bulunmuştur. Brucella spp. endokarditi olgularının tedavisinde 3’lü antimikrobik tedavi rejimleri önerilir (Düşük kanıt düzeyi, güçlü öneri).
14- Brucella spp. endokarditi olan hastalarda aminoglikozid içeren ve içermeyen tedaviler arasında olumsuz sonuçlar açısından fark var mıdır?
Öneri: Brucella spp. endokarditi olgularının IPD meta-analizinde, aminoglikozid içeren rejimlerle tedavi edilenlerde ölüm oranı belirgin olarak daha düşük, ancak başta istenmeyen ilaç etkileri olmak üzere ölüm dışı istenmeyen sonlanımların gelişme riski belirgin olarak daha yüksek bulunmuştur. Brucella spp. endokarditlerinde aminoglikozid içeren rejimlerle tedavi önerilir, ancak aminoglikozid verilen hastalarda, nefrotoksisite yönünden yakın izlem yapılmalı, ek nefrotoksik ajanların kullanımından kaçınılmalıdır (Düşük kanıt düzeyi, güçlü öneri).
15- Brucella spp. endokarditi olan hastalarda kapak cerrahisi uygulamasının olumsuz sonuçları azaltmada etkisi var mıdır?
Öneri: Brucella spp. endokarditi olgularının IPD meta-analizinde, kapak cerrahisi uygulanmasının ölüm riskini belirgin olarak azalttığı belirlenmiştir. Brucella spp. endokarditi tanısı konulan hastalarda, infektif endokardit ekipleri tarafından acil veya elektif kapak cerrahisi indikasyonları dikkatle değerlendirilerek, uygun bulunan hastalarda cerrahinin yapılması önerilir (Düşük kanıt düzeyi, güçlü öneri).
16- Brucella spp. endokarditi olan hastalarda ≤3 aylık antimikrobiyal tedaviler ile >3 aylık tedaviler arasında olumsuz sonuçlar açısından fark var mıdır?
Öneri: Brucella spp. endokarditi olgularının IPD meta-analizinde, ölen hastaların hemen hepsinin ilk üç ayda hayatını kaybettiği görülmüştür. Bu nedenle tedavi süresinin ölüm üzerine etkisi belirlenememiştir. Aynı analizde >3 ay tedavi alan ve almayan hastalar arasında ölüm dışı istenmeyen sonlanımların sıklığı açısından bir fark bulunamamıştır. (Bilgi boşluğu nedeniyle öneri yapılamaz).
17- Brucella spp. spondilodiskiti tedavisinde doksisiklin + streptomisin rejimi, doksisiklin + rifampisin rejimine üstün müdür?
Öneri: Brucella spp. spondilodiskiti olan hastalarda DOX+STREP rejimini DOX+RIF’le karşılaştıran çalışmaların kanıt düzeylerinin ve kalitesinin yetersiz olduğu görülmüştür. Brucella spp. spondilodiskiti tedavisinde antimikrobiyal tedavi rejimi konusunda kanıta dayalı öneri yapılabilmesi mümkün değildir, bu konuda bilgi boşluğu vardır. Akut bruselloz tedavi rejimlerini karşılaştıran çalışmaların meta-analizinde STREP içeren rejimin daha etkili bulunmuş olması nedeniyle, ek olarak rehber grubunda yer alan uzmanların da uzlaşısıyla, Brucella spp. spondilodiskiti tedavisinde de DOX+STREP rejimine öncelik verilmesi önerilmiştir (Bilgi boşluğu).
18- Brucella spp. spondilodiskiti tedavisinde 3’lü antimikrobiyal kombinasyon rejimleri, 2’li kombinasyon rejimlerinden üstün müdür?
Öneri: Brucella spp. spondilodiskiti olan hastalarda tedavi rejimlerini karşılaştıran çalışmaların meta-analizinde, 3’lü antimikrobiyal kombinasyonların, 2’li kombinasyonlardan daha başarılı olduğu görülmüştür. Brucella spp. spondilodiskiti tedavisinde 3’lü antimikrobiyal içeren kombinasyon tedavisi önerilir (Çok düşük kanıt düzeyi, zayıf öneri).
19- Brucella spp. spondilodiskiti tedavisinde kinolon içeren tedavi rejimleri içermeyen rejimlere üstün müdür?
Öneri: Brucella spp. spondilodiskiti olan hastalarda kinolon içeren antimikrobiyal kombinasyonlarla, içermeyen kombinasyonları karşılaştıran çalışmaların kanıt düzeylerinin ve kalitesinin yetersiz olduğu görülmüştür. Brucella spp. spondilodiskiti tedavisinde kinolon içeren kombinasyonların kullanımı konusunda kanıta dayalı öneri yapılabilmesi mümkün değildir. Bu konuda bilgi boşluğu vardır. Rehberi hazırlayan uzmanlar tarafından, Brucella spp. spondilodiskiti olgularının kombinasyon tedavisinde kinolonların, artan güvenlik endişeleri nedeniyle ilk seçenek olarak yer almaması, ilk seçenek ilaçların (DOX, RIF, GEN, STREP) yan etki, ilaç etkileşimi gibi herhangi bir nedenle kullanılamadığı durumlarda düşünülmesi önerilmektedir (Bilgi boşluğu).
20- Brucella spp. spondilodiskiti tedavisinde üç aydan uzun süreli tedavi üç aydan kısa süreli tedavilere üstün müdür?
Öneri: Brucella spp. spondilodiskiti olan hastalarda 3 aydan uzun süren antimikrobiyal tedavi rejimlerini, 3 aydan kısa süren tedavilerle karşılaştıran çalışmaların kanıt düzeylerinin ve kalitesinin yetersiz olduğu görülmüştür. Brucella spp. spondilodiskiti tedavisinin süresinin ne kadar olması gerektiği konusunda kanıta dayalı öneri yapılabilmesi mümkün değildir, bu konuda bilgi boşluğu vardır. Rehberi hazırlayan uzmanlar tarafından, Brucella spp. spondilodiskiti tedavisinin en az 3 ay uygulanması, tedavi sonunda klinik ve radyolojik olarak hasta bazında değerlendirme yapılarak gerekmesi halinde sürenin uzatılması önerilmektedir (Bilgi boşluğu).
AMAÇ VE KAPSAM
Bruselloz hem ülkemizde hem de dünyanın pek çok bölgesinde yaygın olarak görülmeye devam eden zoonotik bir hastalık olmasına karşın genel olarak ihmal edilmiştir. Dünyada yıllık 150-250 bin arasında insan brusellozu olgusu bildirilmekle birlikte, özellikle düşük gelirli ülkelerde bruselloz sıklığı konusunda güvenilir veriler bulunmamaktadır. Hastalık ülkemizde halen endemiktir ve çok sayıda insanı etkilemektedir. Hastalığın tanı ve tedavisi genellikle kişisel/bölgesel tecrübeler, küçük çaplı karşılaştırmalı klinik araştırmalar ve olgu serilerinden elde edilen deneyimlerle yönlendirilmektedir. Bruselloz tanı ve tedavisini yönlendirmede kullanılabilecek kanıta dayalı herhangi bir rehber bulunmadığı için, brusellozun tanı ve tedavisinde kanıta dayalı öneriler sunmak üzere bu rehber hazırlanmıştır.
Rehber, Türk Klinik Mikrobiyoloji ve İnfeksiyon Hastalıkları (KLİMİK) Derneği’nin üyeleri ve yönetiminin katkılarıyla hazırlanmış olup brusellozun tanı ve tedavisini kapsamaktadır. Rehberin hedef grubunu gerek ülkemizde, gerekse dünyada bruselloz hastalarını görüp, tanı ve tedavilerini yönlendiren aile hekimleri ve başta infeksiyon hastalıkları ve klinik mikrobiyoloji, iç hastalıkları, nöroloji, kardiyoloji, romatoloji olmak üzere tüm uzmanlık alanlarından hekimler oluşturmaktadır.
REHBER HAZIRLAMA BASAMAKLARI VE YÖNTEMLERİ
Rehberin hazırlanmasında ABD İnfeksiyon Hastalıkları Derneği’nin (IDSA) Klinik Uygulama Kılavuzlarının Geliştirilmesi Rehberi (1) önerileri esas alınmıştır.
Rehber Hazırlama Grubunun ve Görevlerinin Belirlenmesi
Dernek Yönetim Kurulu, KLİMİK Derneği’nin rehber hazırlama çağrısına olumlu yanıt veren, bruselloz konusunda yayını bulunan ve “sistematik derleme ve meta-analizi yapma” konusunda eğitim aldığını kanıtlayan 12 infeksiyon hastalıkları ve klinik kikrobiyoloji uzmanını rehberi hazırlamak üzere seçmiştir. Düzenli yapılan haftalık toplantıların üçüncüsünden sonra istatistiksel analizler ve GRADE sistemi kapsamında ortaya çıkan destek ihtiyacı nedeniyle bir biyoistatistik uzmanı (CA) da gruba dahil edilmiştir. Rehber Hazırlama Grubu’na seçilen üyelerden bir grup (AB, SÖ, FK, SB, ETY, EMS) literatürü sistematik olarak taramış, uygun makaleleri belirlemiş ve PICO [hasta/popülasyon (P), müdahale/indikator (I), karşılaştırma/kontrol (C), sonuç (O)] formatındaki soruları kullanarak bilimsel kanıtları özetlemiştir.
Çıkar Çatışması Bildirimleri
Rehber Grubu’nda yer alan kişilerin “International Committee of Medical Journal Editors” (ICMJE) tarafından oluşturulmuş formla (2) yaptıkları çıkar çatışması bildirimleri, KLİMİK Derneği 18. Dönem Etik Kurul’u tarafından gözden geçirilmiş, değerlendirilmiş ve onaylanmıştır. Şeffaflık sağlamak için Etik Kurul, konuyla ilgili tüm ilişkilerin tam olarak açıklanmasını talep etmiş ve Rehber Grubu’nun tüm üyeleri, Etik Kurul’un, kılavuz konusuyla ilgili gerçek, potansiyel veya görünür bir çatışma oluşturduğu şeklinde yorumlanabilecek herhangi bir finansal, fikri veya diğer çıkarların ifşa edilmesi talebine uymuştur. Etik Kurul tarafından açıklanan ilişkilerin olası çıkar çatışması açısından değerlendirilmesi, mali ilişkinin göreli ağırlığına (parasal miktar) ve ilişkinin alakasına (konuyla veya söz konusu olan öneriyle ilişkili olabileceği bağımsız bir gözlemci tarafından kolayca değerlendirilebilen seviyesine) dayandırılmıştır. Ek olarak, Rehber Grubu’nun tüm üyeleri, 2547 sayılı Yüksek Öğretim Kanunu Madde 37’de belirtilen kurallara da uymakla yükümlüdür (3). Çıkar çatışması olarak kabul edilen ve edilmeyen ilişki türleri Ek Dokümanların 4. maddesinde verilmiştir.
PICO Sorularının Oluşturulması
Öncelikle Rehber Grubu’nun tüm üyelerinden PICO formatında sorular hazırlaması istenmiştir. Hazırlanan sorular, tüm üyeler tarafından önem derecesine göre puanlanarak en çok puanı alan ve üzerinde uzlaşılmış olan toplam 20 soru seçilmiştir. Her bir klinik sorunun yanıtlanması için 2-4 üye görevlendirilmiştir. Yayınların taranmasından sonra uygun yanıtların verilemeyeceği durumlar için sorularda değişiklik yapılmıştır (5. ve 12. PICO soruları).
Sonlanımlar ve Müdahalelerin, Değerlerin, Tercihlerin ve Olanakların Değerlendirilmesi
Değerlendirilmesi uygun bulunan tüm sonlanımlar önceden belirlendi ve karar vermedeki önemlerine göre derecelendirildi. Her bir PICO sorusu için kullanılacak sonlanımların sıralanmasına grubun tamamının uzlaşısıyla karar verildi. Tanı testleri için “duyarlılık ve özgüllük”, tedavilerde “relaps, tedavi başarısızlığı, yan etki”, ek olarak infektif endokarditle ilgili olanlarda “ölüm”, hastalığın gebelerdeki yönetimi için “gebelik komplikasyonları” sonlanım olarak belirlendi. Özgül bir antibiyotik rejimini, diğer bir rejimle karşılaştıran ve aynı etkinlik/faydada bulunan PICO soruları için, karar vermede “istenmeyen etkiler” sonlanımı kritik olarak sıralanabildi, ancak akılcı kullanım, ulaşılabilir olması, hasta konforu ve maliyet gibi diğer konular da değerlendirildi.
Kanıtların Araştırılması, Toplanması ve Hangi Kanıtların Kullanılacağının Belirlenmesi
Literatür taramasını yapan ekip (AB, SÖ, FK, SB, ETY, EMS) çalışmalarını klinik soruları yanıtlayabilecek şekilde yürüttü. ULAKBİM TR Dizin, PubMed ve Cochrane elektronik veritabanlarında dizinlenmiş Türkçe ve İngilizce dillerindeki ≥17 yaş hastaları içeren yayınlar yıl sınırı olmaksızın tarandı. İlk tarama 2 Mart 2022 tarihinde yapıldı ve ardından 15-30 Haziran 2022 tarihinde tekrarlandı. Taramaları yapanlar elde ettikleri makalelerin başlık ve özetlerini okuduktan sonra özgül popülasyon, dahil edilme ve hariç tutulma ölçütlerine göre uygun bulduklarının tam metnini incelediler. Tam metin incelemelerinde, her bir PICO sorusundaki popülasyona, müdahaleye, karşılaştırma grubuna, sonlanıma dair veri içerenlerin dahil olması sağlanacak şekilde önceden hazırlanmış dahil edilme ve hariç tutulma ölçütlerine göre uygun bulunanlardan elde edilen veriler hazırlanmış formlara kaydedildi. Literatür taramalarından elde edilmiş makaleler, tüm grup tarafından dikkatle değerlendirildi ve hangi çalışmaların son analize dahil edileceğine karar verildi. Karşılaştırmalı klinik araştırmaların olması halinde çalışmaların PICO sorularına yanıt oluşturabilecek şekilde meta-analizleri yapıldı. Karşılaştırmalı çalışma bulunamayan infektif endokardit, nörobruselloz ve gebelik için, tek olgu sunumları ve olgu serilerinden, PICO sorularına yanıt içerenlerin verileri önceden hazırlanmış formlara kaydedilerek, sistematik derleme ve IPD meta-analizleri yapıldı.
Rehberde ve Yayın Taramalarında Kabul Edilen Tanımlamalar
Akut Bruselloz: Bir yıldan daha kısa süredir devam eden ateş, yorgunluk, iştahsızlık, kilo kaybı, baş ağrısı, gece terlemesi, yaygın kas ve eklem ağrıları olan hastada;
- Kan, vücut sıvıları (idrar, BOS, sinovyal sıvı ve plevral sıvı vb.) veya dokudan (kemik iliği, karaciğer biyopsisi vb) bakterinin üretilmesi,
- Standart tüp aglütinasyon testinde Brucella total antikor titresinin ≥1:160 pozitif olması,
- ≥2 hafta arayla alınmış akut ve konvalesan serum örneklerinde Brucella antikor titresinde 4 kat veya daha fazla artış olması (üstteki laboratuvar kriterini karşılamayan hastalarda).
Relaps Bruselloz: Akut bruselloz tedavisi tamamlandıktan ve iyileşme gözlendikten sonra brusellozla uyumlu objektif semptom ve bulguların yeniden ortaya çıkmasıdır;
- Yeniden kültür pozitifleşmesi veya
- Antikor titrelerinde artış olmalıdır.
Kronik Bruselloz:On iki aydan daha uzun süredir brusellozla uyumlu semptom veya bulguların olması ve yukarıda tanımlanmış “akut bruselloz” ölçütlerinin karşılanması;
- Fokal infeksiyon (tek bir organ veya organ sistemiyle ilişkili semptomların belirgin olması) veya
- Relaps bruselloz şeklinde görülebilir
Uzamış Konvalesan: Bruselloz tanısıyla bir tedavi kürünü tamamlamış ve antikor titreleri düşmüş, hatta kaybolmuş bir hastada, ateş gibi objektif bulguları olmaksızın infeksiyonun bazı semptomlarının devam etmesidir.
Komplike Olmamış Bruselloz: Fokal tutulumun olmadığı hastalık.
Komplike Bruselloz: Fokal tutulumların [kemik, eklem, genitorüriner, kardiyak, merkezi sinir sistemi (MSS), vb.] olduğu hastalık.
Kanıtların Özetlenmesi, Kanıtların Gücünün Derecelendirilmesi ve Önerilerin Oluşturulması
Seçilen makaleler için kalitatif veya kantitatif analizlerden hangisinin yapılacağına tüm grup birlikte karar verdi. Her PICO sorusu için kanıtların özeti tablosu literatür tarama ekibi tarafından hazırlandı. Randomize kontrollü çalışmaların, non-randomize karşılaştırmalı çalışmaların, tanı testi çalışmalarının ve olgu serilerinin yanlılık değerlendirmelerinde, her PICO sorusu ve her bir ayrı sonlanım için kanıtların derecelendirilmesinde ve önerilerin gücünün belirlenmesinde “Grading of Recommendations, Assessment, Development and Evaluation (GRADE) Working Group” önerileri kullanıldı (4-8).
Her bir PICO sorusu için hazırlanmış kanıtların özeti tablosu, tüm rehber grubu üyeleri tarafından dikkatle incelendi ve uygun şekilde düzenlendi. Bu incelemeler tamamlanarak hazırlanan son kanıt özetleri, tüm gruba sunularak tartışıldıktan sonra öneriler yapıldı. Literatür tarama yöntemlerine, tarama sonuçlarını detaylandıran PRISMA akış şemalarına, veri bilgi formlarına, kanıtların özet tablolarına ve meta-analizi sonuçlarına ek dökümanlar kısmından ulaşılabilir.
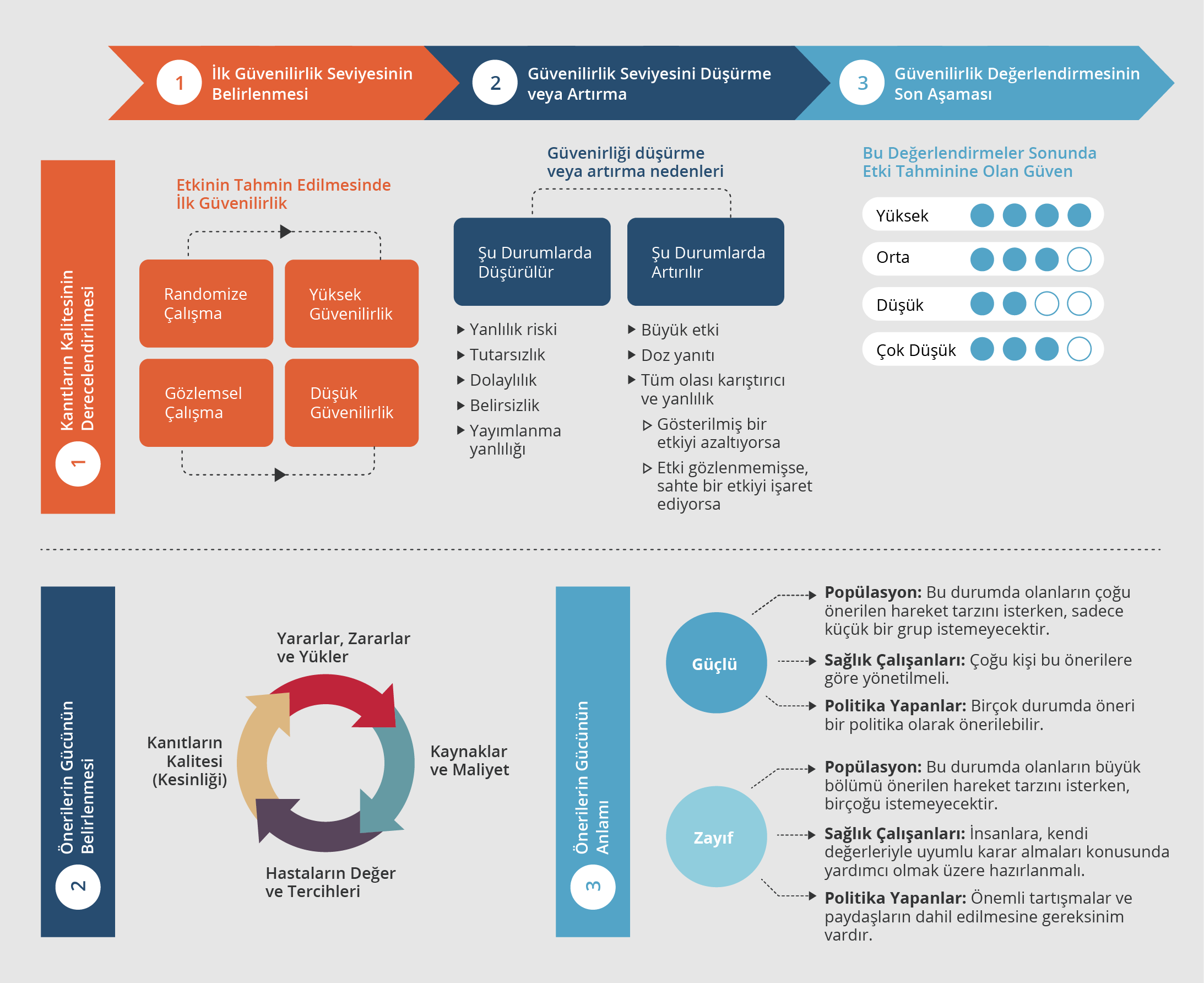
Şekil 1. GRADE Yöntemiyle Kanıtların Kalitesini ve Önerilerin Gücünü Derecelendirme Yaklaşımı ve Anlamları (1, 4)
Öneriler, GRADE yaklaşımıyla uyumlu olacak şekilde “güçlü” veya “zayıf” olarak sınıflandırılmış olup “önerilir” ifadesi güçlü öneriyi, “düşünülebilir” ifadesi zayıf öneriyi yansıtmaktadır. Sağlık çalışanları ve sağlık politikası yapıcıları için güçlü ve zayıf önerilerin ne anlama geldiği Şekil 1’de açıklandı.
Birçok öneri için yüksek kalitede kanıt yoktu. Kanıt kalite seviyesi düşük olmasına karşın güçlü öneri sadece, rehber grubu üyelerinin, önerinin bir veya daha fazla paradigmaya uygun olduğunu düşünmeleri durumunda yapıldı. Bu tür önerilerde, GRADE’de de önerilen aşağıdaki iki paradigma dikkate alındı:
- Hayatı tehdit eden bir durum için düşük kaliteli kanıtlarla yararın gösterilmesi (zarara dair kanıtların düşük veya yüksek olmasıyla birlikte),
- Düşük kaliteli kanıtlarla yarar gösterilirken, yüksek kaliteli kanıtlarla zarar olmadığının gösterilmesi.
İyi klinik uygulamalar ile ilgili öneriler için de GRADE yöntemleri kullanıldı. İyi bir klinik uygulama, rehber grubu tarafından sağlık bakımı uygulaması için zorunlu kabul edilen, özetlenmesi güç olan çok sayıda dolaylı kanıtla desteklenen ve bu önerinin uygulanmasının büyük, net bir pozitif sonuca yol açacağını işaret eden bir mesajı temsil eder.
“Bilgi boşluğu”, klinik öneri yapabilmek için önemli araştırma gereksiniminin olduğu durumlarda kullanıldı.
Tüm grup üyeleri, dokuz ay boyunca her çarşamba günü Zoom platformu üzerinden yapılan toplantılarda bir araya gelerek kanıt özetlerini sundular ve önerileri geliştirdiler. Üyeler rehberin hazırlanmasına eşit oranda katkı verdi ve önerileri onayladı.
Rehberin Yazılması
Rehber taslağı grup üyeleri tarafından oluşturularak, Microsoft word dosyası halinde Google Drive’a yüklendi. Her bir PICO sorusu için, ilgili kişiler tarafından toplantılarda elde edilmiş uzlaşı önerileri ve kanıtların özeti bu taslağa eklendi. Tüm grup üyeleri taslak metni okuyarak uygun bulduğu düzenlemeleri yaptı.
Rehberin Revizyonu
Mevcut literatür gözden geçirilerek, önerilere etki edebilecek yeni veri olup olmadığı kontrol edilecektir. Yeni veri olması halinde rehber grubu bir araya gelerek olası değişiklikleri tartışacak ve yeni önerilerde bulunacaktır.
GENEL BİLGİLER
Brucella cinsi bakterilerin neden olduğu bruselloz, esas olarak bir çiftlik hayvanı hastalığıdır, insanlar kazara konak olur. İlk kez 1859’da Malta’da, İngiliz birliklerindeki askerler arasında yüksek ateşle giden bir hastalığın ortaya çıkması üzerine David Bruce ve arkadaşlarının yaptığı araştırma sırasında tanınmış, etken bakteri ise aynı araştırmacılar tarafından 1887 yılında izole edilmiştir. Almroth Wright tarafından Widal testinin bu hastalığa uyarlanmasıyla 1897 yılında bruselloz tanısında aglütinasyon testlerinin kullanımına başlanmıştır (9). Ondülan ateş, Akdeniz ateşi veya Malta ateşi diye de adlandırılabilen insan brusellozu, hayvan brusellozunun ortadan kaldırılmasıyla gelişmiş ülkelerde elimine edilmiştir. Buna karşılık gelişmekte olan ülkelerde hayvan brusellozunun devam etmesinin doğal bir sonucu olarak halen endemik şekilde görülen bir zoonozdur. İnsanlarda sıklıkla akut ateşli bir hastalık olarak ortaya çıkar, ancak persiste ederek kronik, çok çeşitli komplikasyonları olan bir hastalık şeklinde de seyredebilir. Brucella spp. doğal konağı olan hayvanlarda hafif veya asemptomatik infeksiyonlara yol açar, glukoza tercih ettiği bir şeker olan eritritolden zengin organlarda yerleşmeyi tercih eder. Hayvanlardaki meme, uterus, plasenta ve epididim gibi organlar eritritolden zengindir; böylece bakteri hayvanlarda bu dokulara yerleşerek düşüğe, infertiliteye veya hayat boyu sürecek taşıyıcılığa yol açabilir. Brucella spp., infekte hayvanların sütünde, idrarında ve doğum salgılarında bol miktarda bulunur. İnsan plasentasında eritritol bulunmaz ancak bruselloz olmuş gebelerde gebelik komplikasyonlarının arttığı da gösterilmiştir (10,11).
Etken
Brusellozun etkeni Gram-negatif kokobasil görünümlü, fakültatif intrasellüler mikroorganizmalar olan Brucella cinsi bakterilerdir. Brucella spp.’nin moleküler çalışmaları, suşların genetik yapılarının çok benzer olduğunu, aslında tek tür şeklinde değerlendirebileceğini ve önceden tanımlanmış türlerin varyant olarak kabul edilebileceğini göstermiştir. Ancak klinik pratikte bu yaklaşım tatmin edici bulunmamış ve sekizi kara, dördü ise deniz memelerinde hastalık yapan 12 tür tanımlanmıştır. İnsanlarda hastalık yapan dört tür Brucella abortus, Brucella melitensis, Brucella suis ve Brucella canis’tir. B. abortus, sığırlarda ve Amerikan bizonlarında, B. suis domuzlarda ve Ren geyiklerinde, B. melitensis ise keçi ve koyunlarda hastalık yapar. Bu 3 tür insanda klasik bruselloza neden olur. Ülkemizde en yaygın olarak görülen tür B. melitensis’tir. B. abortus, B. melitensis, B. suis’in fenotipik ve antijenik özelliklerine göre sırasıyla yedi, üç ve beş biyovarı bulunmaktadır. B. canis köpek, tilki ve çakalları infekte eder, insanda hafif hastalık yaptığı bildirilmiştir. Brucella delphini, Brucella pinnipediae ve Brucella cetaceae deniz memelilerinde hastalık tablolarına neden olur. B. abortus ve B. canis nadir süpüratif komplikasyonlarla daha hafif seyirli bir hastalık yaparken, B. suis destrüktif lezyonlara ve uzun süren bir hastalığa yol açar. B. melitensis de fagositik hücrelerde daha yoğun konsantrasyonlarda çoğalabilmesi nedeniyle daha ciddi hastalığa ve komplikasyonlara yol açar (10-12).
Brucella türleri, küçük (0.5×0.6-1.5 μm), hareketsiz, kapsülsüzdür. Kültürde, kompleks besiyerlerinde bir hafta kadar bir sürede yavaş ürerler, bazıları zorunlu aeroptur. B. abortus ve B. suis ise kapnofilik olup üreme için %5-10 karbondioksit gerektirirler. Karbonhidratları fermente etmezler. Şekil 2’de olası Brucella spp. tanımlamasında kullanılabilecek akış şeması verilmiştir. Ekzotoksini olmayan Brucella türlerinin endotoksini de diğer Gram-negatif çomaklarınkinden daha az toksiktir. Brucella türleri hücre duvarındaki lipopolisakkarid (LPS)’in O antijeni içerip içermemesine göre pürtüksüz (“smooth”, translusen, homojen) veya pürtüklü (“rough”, opak, granüler veya yapışkan) bir şekil alabilirler. Pürtüklü koloni morfolojisinde bakterilerin virulansının büyük oranda azalması, pürtüksüz LPS O zincirinin virulans için önemli bir faktör olduğunu düşündürmektedir. Brucella türleri retiküloendotelyal sistemde intrasellüler olarak da yaşayabilir. İlk temastan sonra makrofaj ve monositler tarafından fagosite edilen bakteriler, bu hücreler içinde yaşamaya ve çoğalmaya devam edebilir. Fagosite edilen bakteriler dalak, karaciğer, kemik iliği, lenf nodları ve böbreklere taşınır. Bakteri, bu organlarda granulom formasyonunu indükleyen proteinler salgılar (10-12).
Dünyada Brusellozun Epidemiyolojisi
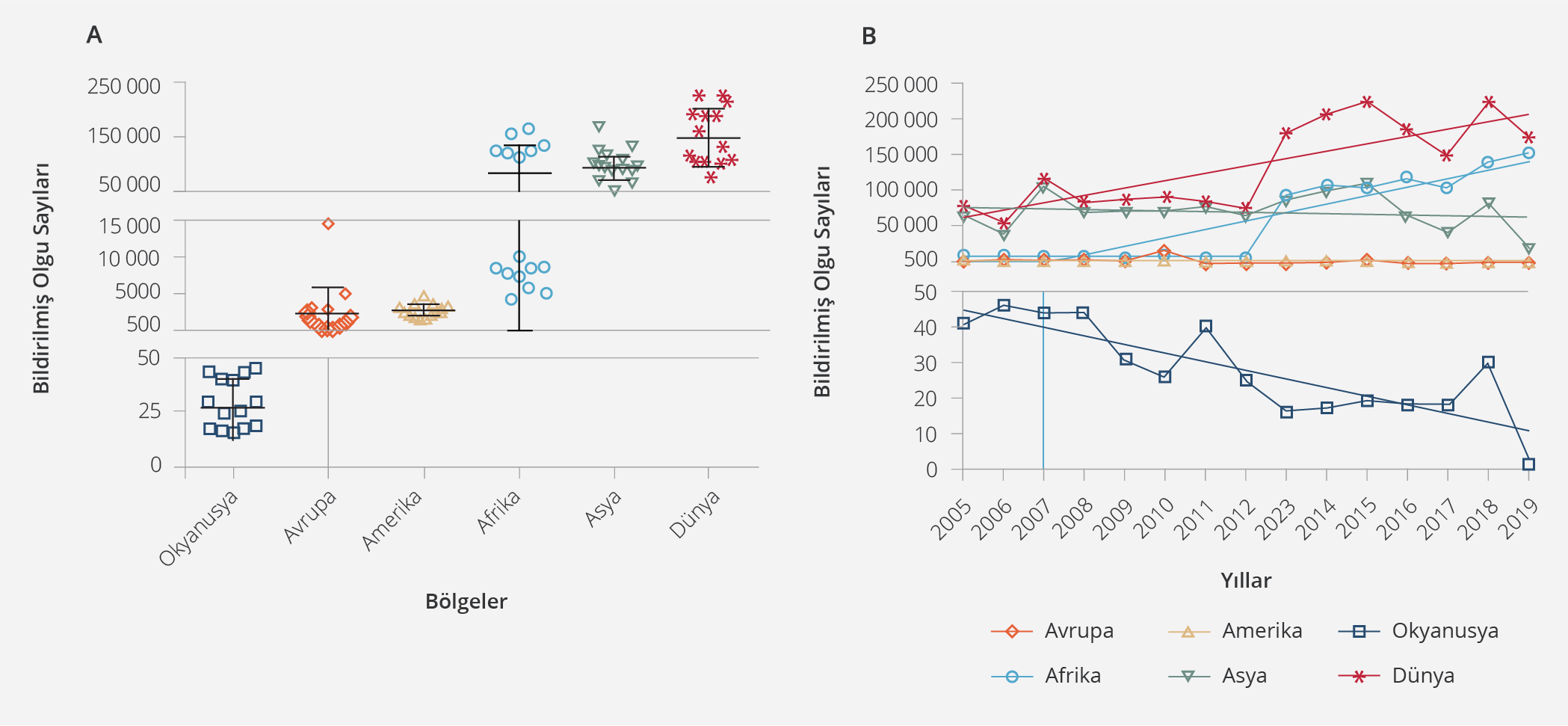
Şekil 3. Bölgelere Göre Dünya Hayvan Sağlığı Organizasyonu (WOAH/OIE)’na Bildirilmiş Bruselloz Olgu Sayıları (2005–2019) (A) (Grafikteki her bir nokta, her bir yıl içinde bildirilen insan brusellozu olgularının sayısını, çubuklarsa ortalama ve standart sapmayı göstermektedir) ve yıllar içindeki seyri (B) (13)
Bruselloz hem insanlarda hem de çiftlik hayvanlarında ciddi hastalıklara neden olan, küresel olarak görülen bir infeksiyon hastalığıdır. Dünyada yıllık olarak 150-250 bin arasında insan brusellozu olgusu bildirilmesine rağmen, özellikle düşük gelirli ülkelerde bruselloz sıklığı konusunda güvenilir veriler bulunmamaktadır. Küresel insan brusellozu sıklığını belirlemek amacıyla dünyada mevcut raporlama sistemlerinde bulunan ulusal verileri bir araya getiren, kısa süre önce yayımlanmış bir çalışmada, söz konusu verilerin yıllık küresel sıklığı belirlemek için oldukça yetersiz olduğu, gereken raporların sadece %48’inin girildiği, dünya popülasyonunun yaklaşık %47’sinin bu raporlarda temsil edildiği görülmüştür. Ek olarak raporlarda temsil edilen popülasyon ve gerçek olgu sayılarının bölgesel olarak büyük farklılıklar gösterdiği belirlenmiş, tüm bu nedenlerle insan brusellozu sıklığının doğru tahmin edilmesinin mümkün olmadığı bildirilmiştir. Bu çalışmanın verileriyle hazırlanmış, bildirimi yapılmış olgu sayılarının bölgesel dağılımı ve yıllar içindeki seyri Şekil 3’te verilmiştir (13).
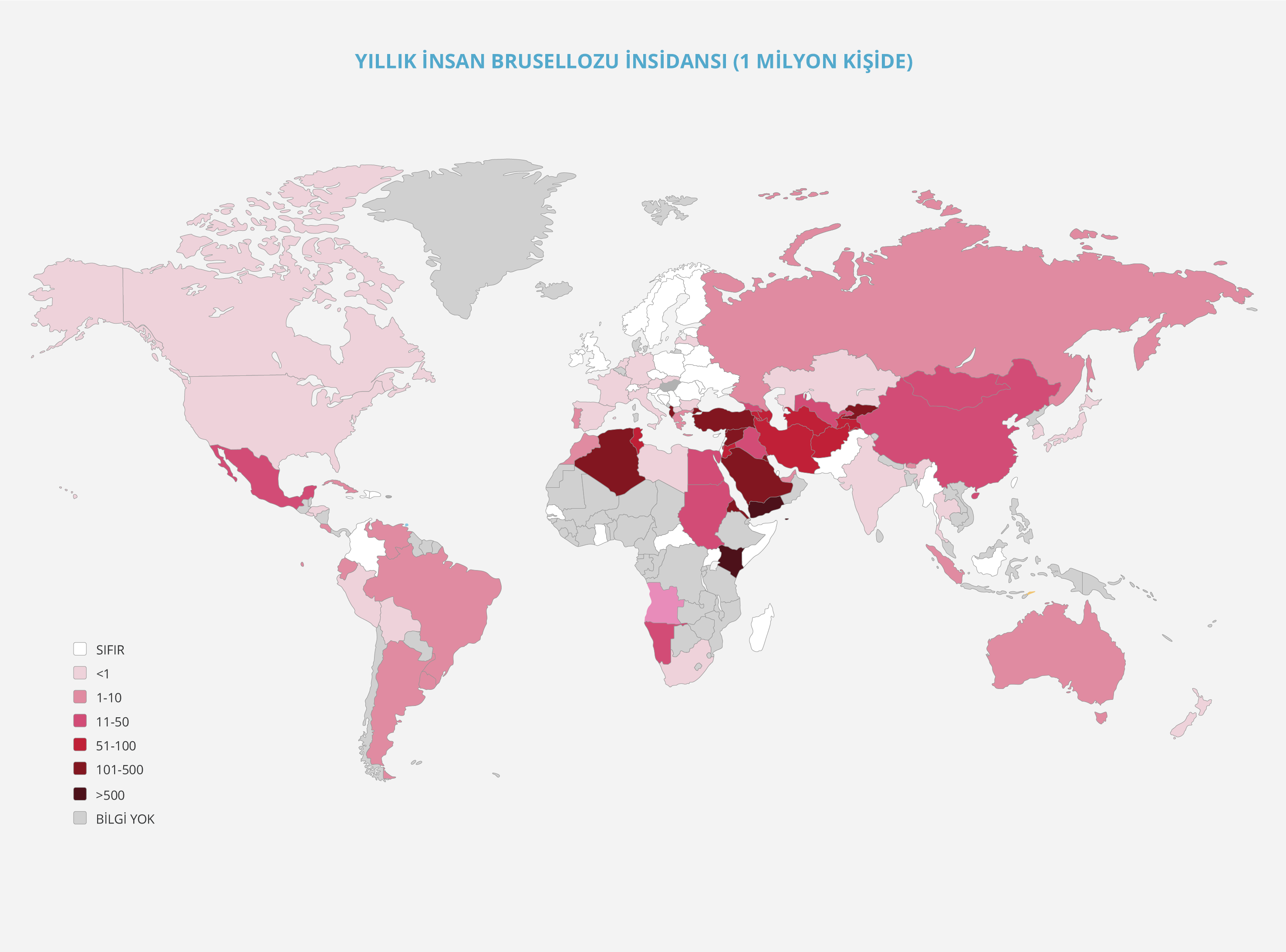
Şekil 4. Güncel Küresel İnsan Brusellozu Sıklığı (ulaşılabilen en güncel verilere göre hazırlanmıştır).
İnsan brusellozu, Avrupa’da genel olarak eradike edilmiş olmasına rağmen Arnavutluk, Bosna-Hersek, Kuzey Makedonya, Sırbistan, Kosova, Yunanistan, Portekiz ve İtalya’da halen yerel insan brusellozu olguları endemik olarak görülmektedir. Ancak özellikle 2016 yılından itibaren olgu sayılarında belirgin azalma olduğu ifade edilmektedir. Avrupa Hastalık Önleme ve Kontrol Merkezi (ECDC) 2022 Raporu’nda, Avrupa Birliği ve Avrupa Ekonomik Alanı (EU/EEA)’nda bruselloz insidansının 0.03 olgu/100 000 kişi olduğu, 2020 yılında Yunanistan ve Portekiz’in en yüksek yerel olgu sayılarına sahip olduğu belirtilmektedir. En düşük olgu sayısının 2020’de görülmesinde gerek hafif seyirli olguların başvurmamasına gerekse seyahatlerin azalmasına yol açması nedeniyle COVID-19 pandemisinin etkili olduğu düşünülmektedir (14,15). Asya’da bruselloz başta Yemen, Suriye, İran, Filistin ve Suudi Arabistan olmak üzere halen çok sayıda ülkede endemik olarak görülen bir hastalıktır. Afrika’da yeterli veri olmamakla birlikte özellikle Kenya, Eritre ve Cezayir’den çok sayıda olgu bildirilmektedir. Kuzey Amerika’da olgu sayıları oldukça düşüktür; Güney Amerika’da ise Asya kadar çok olmamakla birlikte Arjantin, Brezilya, Venezuela ve Ekvador’da diğer bölgelere göre daha sık tanımlanmaktadır. Son olarak Avustralya’da da düşük sıklıkta olmakla birlikte halen tanımlanan bir hastalıktır. Brusellozun sıklığını araştıran güncel çalışmalardan (13-20) yararlanarak hazırlamış olduğumuz harita (Şekil 4), Papas ve arkadaşlarının (19) 2006 yılında yapmış olduğu harita ile karşılaştırıldığında, geçen 16 yılda büyük bir değişiklik olmadığı dikkati çekmektedir. Bu nedenle Laine ve arkadaşları (13) tarafından da belirtildiği gibi insan brusellozunun Dünya Sağlık Örgütü (WHO) tarafından tekrar “ihmal edilen öncelikli zoonotik hastalık” olarak tanımlanmasının, gerekli kaynakların ayrılmasını sağlayarak hastalığın neden olduğu zararı ve kontrol stratejilerini belirlemede oldukça önemli olacağı açıktır.
Avrupa Birliği 2020 Zoonozlar Raporu’nda, üye ülkeler arasında resmen brusellozdan arınmış 20 ülkede sadece altı sığır sürüsünde infeksiyon tanımlanmış ve prevalansın çok düşük (<%0.001) olduğu bildirilmiştir (15). Bulgaristan, Hırvatistan, Macaristan, İtalya, Portekiz ve İspanya’dan oluşan diğer ülkelerde ise sığır brusellozu belirgin düşüş göstermiş, taranan 157 000 sürünün 603 (%0.38)’ünde tanımlanmıştır. Koyun ve keçi brusellozu, arınmış ülkelerde de diğer ülkelerde de stabil bir seyir izlenmiş olup diğer grupta yer alan ülkelerde taranan 160 000 sürünün 349 (%0.22)’unda pozitiflik saptanmıştır (21).
Türkiye’de Brusellozun Epidemiyolojisi
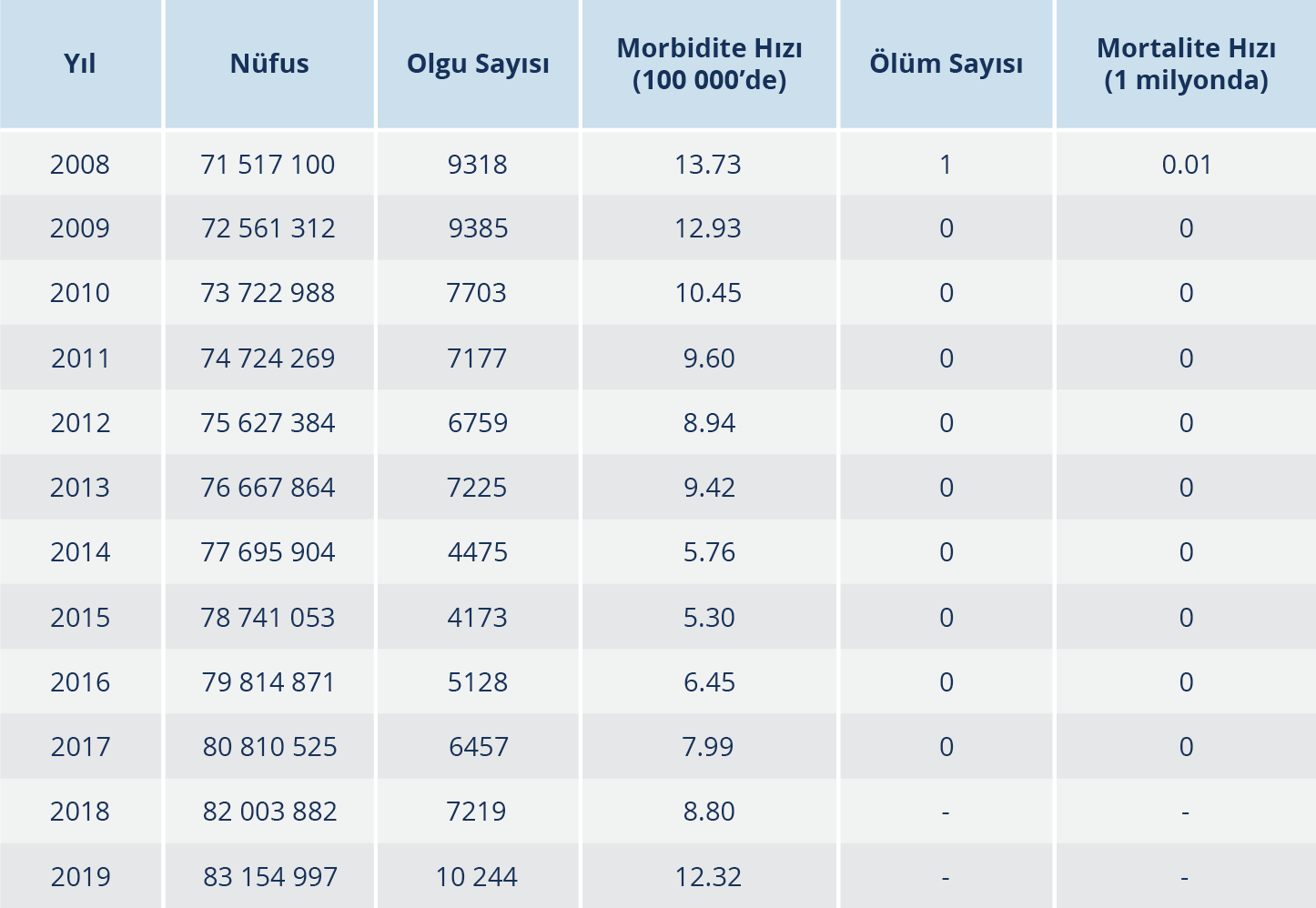
Tablo 1. 2008-2019 Yılları Arasında Ülkemizde Bildirimi Yapılmış Bruselloz Olgu ve Ölüm Sayıları (13, 20)
Bruselloz ülkemizde endemik bir hastalıktır (Şekil 4). En fazla Güneydoğu Anadolu ve Doğu Anadolu bölgelerinde görülmektedir. Tablo 1’de 2008 yılından 2019 yılına kadar ülkemizde bildirilmiş bruselloz olgu sayıları görülmektedir (13,20). İllere göre olguların dağılımına bakıldığında hastalığın Doğu ve Güneydoğu Anadolu bölgelerinde daha fazla olmak üzere tüm ülkede endemik şekilde görüldüğü dikkat çekmektedir.
Hayvan brusellozu konusunda ülkemizde ulaşılabilen son yayında ortalama sürü prevalansının 2012 yılından itibaren kitlesel aşılama programlarıyla %12.3’e düştüğü bildirilmiştir (21).
Tüm veriler bir arada değerlendirildiğinde ülkemizde insan brusellozu insidansının, özellikle 2012’deki kitlesel hayvan aşılamalarıyla hayvan brusellozunun azalmasına bağlı olarak 2012’den 2015 yılına kadar düşüş gösterdiği ve en düşük seviye olan 5.30/100 000 kişiye indiği ancak 2016 yılından itibaren, yine muhtemelen hayvanlarda hastalığın kontrolünün yetersizliğinin bir sonucu olarak tekrar yükselmeye başladığı ve 2019’da, 2012 öncesi seviyelere ulaşarak 12.32/100 000 kişiye çıktığı görülmektedir.
Brusellozun Bulaşması
Brusellozun bulaşması, hemen her zaman hayvan kaynaklarıyla direkt veya indirekt temasla olur; sığır, koyun, keçi ve domuzlar en önemli kaynaklardır. Hastalık, infekte hayvan doku veya sekresyonlarının (kan, idrar, vajinal sekresyon, aborte fetus ve özellikle plasenta) konjunktivayla veya çizilmiş, hasarlanmış deriyle direkt temasıyla, infekte hayvanların çiğ veya pastörize edilmemiş veya kaynatılmamış süt ve süt ürünlerinin ağızdan alınmasıyla, infekte aerosollerin inhalasyonla alınmasıyla ve çiftçilerin, mezbaha çalışanlarının ve laboratuvar çalışanlarının mesleki olarak mikroorganizmayla teması yoluyla edinilebilir (22,23). Etteki bakteri miktarının az olması ve genel olarak etin pişirilerek tüketilmesi nedeniyle infekte hayvan etleriyle bulaşma nadirdir. Brucella türleri ahırlarda, laboratuvarlarda ve mezbahalarda hava yoluyla da bulaşabilir. Hayvanlarda kullanılan canlı aşının yanlışlıkla insanlara inoküle edilmesiyle de bulaşmalar bildirilmektedir. RB-51 aşısı, subinhibitör konsantrasyonda RIF içeren besiyerinde yineleyen pasajlarla elde edilmiş bir B. abortus suşu içerdiğinden, bu yolla infekte olan kişideki etkenin RIF’e dirençli olduğu bilinmelidir. İnsanlar arasında bulaşma nadir olmakla birlikte cinsel yolla, intrauterin, emzirmeyle, organ nakli ve kan transfüzyonuyla bulaşmalar bildirilmiştir. Brucella türleri çiğ süt içinde 2-6 hafta, kremada 4°C’de 6 hafta, dondurmada 30 gün, taze peynirde 15-100 gün yaşayabilirken, sütün pastörizasyonu veya kaynatılmasıyla ölür (24,25).
Brusellozun Klinik Özellikleri
Hastalığın inkübasyon süresi 2-4 haftadır (5 gün-6 ay). Hastalık, semptomların süresine göre akut (semptom ve bulguların bir yıldan daha kısa süredir olduğu durum) veya kronik (semptom ve bulguların bir yıldan daha uzun süredir devam ettiği durum) olarak gruplandırılır. Bazı yayınlar, semptomları 3 aydan kısa sürenleri akut, 3 ay -1 yıl arasında devam edenleri subakut olarak sınıflandırmaktadır. Akut semptomatik hastalık, hastaların yaklaşık yarısında gelişir, yarısında ise asemptomatik seyir söz konusudur. Ateş aralıklı olabilir; bu nedenle ondülan (dalgalı) ateş diye de adlandırılır. Semptomatik hastalarda; ateş, titreme, baş ağrısı, myalji, artralji, aşırı gece terlemeleri, yorgunluk, iştahsızlık, kilo kaybı, depresyon ve eşlik eden lokalize infeksiyon varsa tutulan vücut bölgesini ilgilendiren semptomlar görülür. Fizik muayenede hastaların %10–20’sinde lenfadenomegali, %20-30’unda splenomegali belirlenir (24-27).
Kronik brusellozda ya primer infeksiyonun yinelemesi (%5-15) ya da lokalize bir infeksiyona ait semptom ve bulgular vardır; bir yıldan uzun süren klinik bulgular ve infeksiyonun objektif kanıtları (yüksek antikor titreleri ve/veya kan veya dokudan Brucella spp. üretilmesi) söz konusudur. Akut bruselloz sırasında da ortaya çıkabilen lokalize infeksiyonlarda, en sık sakroiliit, spondilit veya artrit şeklinde seyreden osteoartiküler (%2), epididimoorşit (%6) şeklinde seyreden genitoüriner (%2-20), bronşit/pnömoni şeklinde seyreden pulmoner (%7), hepatit şeklinde seyreden gastrointestinal (%3-6), menenjit şeklinde seyreden nörolojik (%2-7), endokardit şeklinde seyreden kardiyak (nadir), üveit şeklinde seyreden oküler ve döküntü şeklinde seyreden dermatolojik tutulumlar olabilir. Brusellozdan en sık ölüm nedeni infektif endokardittir.
Akut ve kronik bruselloz dışında bazı hastalarda “uzamış konvalesan dönem” de gözlenebilir. Bu tablo, bruselloz tanısıyla tedavi kürünü tamamlamış ve antikor titreleri düşmüş, hatta kaybolmuş bir hastada, infeksiyonun bazı semptomlarının, ateş gibi objektif bulgular olmaksızın devam etmesidir. Uzamış konvalesan dönemin nedeni tam olarak bilinmemekle birlikte, yapılmış psikolojik çalışmalarda bu kişilerde, genellikle bruselloz tanısından önce olmak üzere kişilik bozukluklarının daha sık görüldüğü belirlenmiştir. Her durumda, bu tabloda antimikrobiyal tedavinin yararı gösterilmemiştir ve önerilmemektedir (24).
Gebede bruselloz spontan düşük veya bebeğe intrauterin bulaşma riski taşımaktadır. İnsan plasentasında eritritol bulunmamasına rağmen, özellikle erken trimesterlerde Brucella spp. bakteriyemisi olanlarda düşük görülebilir. Brusellozdaki düşük riskinin, diğer bakteriyemilerdeki düşük riskinden daha yüksek olup olmadığı bilinmemektedir. Her durumda gebede brusellozun hızla tespit edilerek tedavi edilmesi fetus için hayat kurtarıcı olabilir. Emzirmeyle anneden bebeğe bulaşma nadir de olsa bildirilmiştir (24-27).
Akut brusellozda; ateş, hepatosplenomegali, yaygın lenfadenomegali ve lokal tutulum şeklinde fizik muayene bulguları olabilir. Bruselloz, ülkemizde endemik bir hastalık olması nedeniyle, uzamış ateşle başvuran hastaların ayırıcı tanısında düşünülmesi gereken hastalıkların en başında gelmektedir. Brusellozlu hastaların kan sayımında anemi, lökopeni, trombositopeni, pansitopeni gibi hematolojik anormallikler olabilir.
Bruselloz Tanısı
Kültür
Brusellozlu hastaların kanından, etkilenmiş dokularından veya kemik iliği örneğinden bakteri izole edilebilir. Tanıda kültür çok önemlidir ve altın standarttır; kan kültürü akut olguların %70’inde pozitiftir ve elde etmesi zor olmasına rağmen kemik iliği aspirasyonunun olguların yaklaşık %92’sinde pozitif olabileceği bildirilmektedir. Ancak Brucella spp.’nin üremesi zor ve yavaş olup primer örnekten üretilmesi 21 gün kadar uzun sürebilir. Kronik infeksiyonu olanlarda kültürün pozitif olma olasılığı düşüktür.
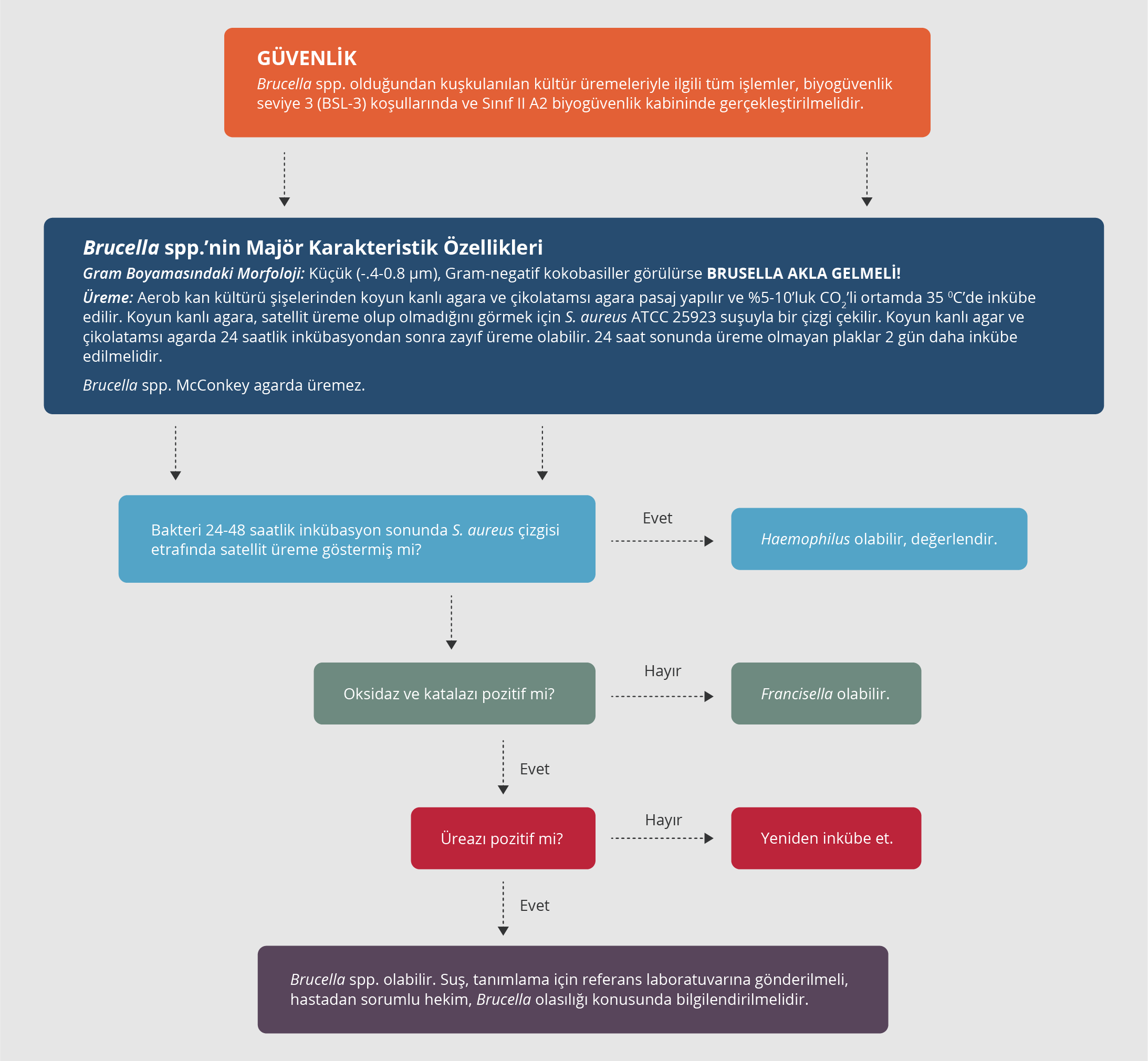
Laboratuvarda örneklerle güvenli bir şekilde çalışılması ve bulaşmaların önüne geçilmesi için, bruselloz düşünülen hastalardan kültür için gönderilen örnekler konusunda laboratuvar mutlaka bilgilendirilmelidir. Brucella spp. otomatize kan kültürü sistemlerinde sıklıkla üç gün içinde üremektedir; mevcut kan kültürü sistemlerindeki beş günlük inkübasyon süresi, özellikle akut bruselloz olgularının kan kültürlerinde Brucella spp.’nin üremesi için de yeterlidir. Ancak hastalık semptomları uzun süredir devam edenlerde veya fokal infeksiyonlarla başvuranlarda kan kültür şişelerinin inkübasyon süresinin iki haftaya uzatılması ve inkübasyon süresi sonunda bir pasaj yapılarak üreme olup olmadığının kontrol edilmesi gerekebilir. Kültürde uygun koloni morfolojisinde Gram-negatif, oksidaz pozitif, üreaz pozitif kokobasiller ürediğinde Brucella akla gelmeli ve ileri tiplendirme yapılmalıdır (Şekil 2). Brucella spp.’nin tanımlanması ve tiplendirilmesinde klasik olarak biyokimyasal testler (boya duyarlılıkları, H2S üretimi ve üreaz aktivitesi), faj lizisi, antiserum aglütinasyonu ve moleküler teknikler kullanılmaktadır (24-29). Mevcut ticari biyokimyasal tanımlama sistemleri yeterli değildir; Brucella spp. yanlışlıkla yakın türler olan Ochrobactrum anthropi veya Ochrobactrum intermedium veya Haemophilus influenza, Bergeyella zoohelcum, Bordetella bronchiseptica veya Psychrobacter phenylpyruvicus şeklinde tanımlanarak laboratuvardan edinilmiş infeksiyonlar dahil ciddi sonuçlara yol açabilir. Bu nedenle bu sistemlerin Brucella spp. tanımlamasında kullanımı önerilmemektedir. Son yıllarda mikroorganizmaların tanımlanmasında sıklıkla kullanılan MALDI-TOF MS, Brucella spp. tanımlamasında da hızlı, ekonomik ve güvenilir bir yöntem olarak öne çıkmaktadır (30).
Serolojik Antikor Belirleme Testleri
Kültürde üreme olmayan veya kültür olanakları olmayan yerlerde serolojik testler oldukça önemlidir. Brucella bakterilerine karşı antikor yanıtı, semptomatik/asemptomatik tüm hastalarda gelişir; aylar ve hatta yıllar boyunca kalabilir. Aglütinasyon testleri, bruselloz tanısını doğrulamada kullanılan ve antikor yanıtını araştıran serolojik testlerdir. Pürtüksüz koloni oluşturan Brucella türlerine (B. melitensis, B. abortus, B. suis) karşı gelişen hümoral immün yanıtta, O antijeni içeren LPS (S-LPS)’ye karşı gelişen antikorlar baskındır. Brusellozun serolojik tanısında kullanılan S-LPS antijeni sıklıkla B. abortus S19 suşundan elde edilir; insanda patojenik olan diğer iki türde (B. melitensis ve B. suis) de bu antijen bulunmaktadır. Doğal olarak bu antijenlerin kullanıldığı RB, Wright STA gibi testlerle tür düzeyinde ayırım yapılamamaktadır. Pürüzlü Brucella türleri olan B. canis ve B. ovis’te ise LPS’nin O zinciri yoktur ve bu nedenle infeksiyonlarının tanısı S-LPS antikorlarının araştırılmasıyla konulamaz. LPS molekülü, Francisella tularensis, Escherichia coli O116 ve O157, Salmonella urbana, Yersinia enterocolitica O:9, Vibrio cholerae, Stenotrophomonas maltophilia ve Afipia clevelandensis dahil birçok Gram-negatif bakteriyle çarpraz reaksiyon veren epitoplar taşımaktadır. Bu nonspesifik reaksiyonlardan sorumlu olan antikorlar genellikle IgM tipindedir. Brucella türlerinin sitozolik proteinleri, önemli çapraz reaksiyon göstermezler, bu nedenle antijen olarak kullanılabileceği düşünülmektedir.
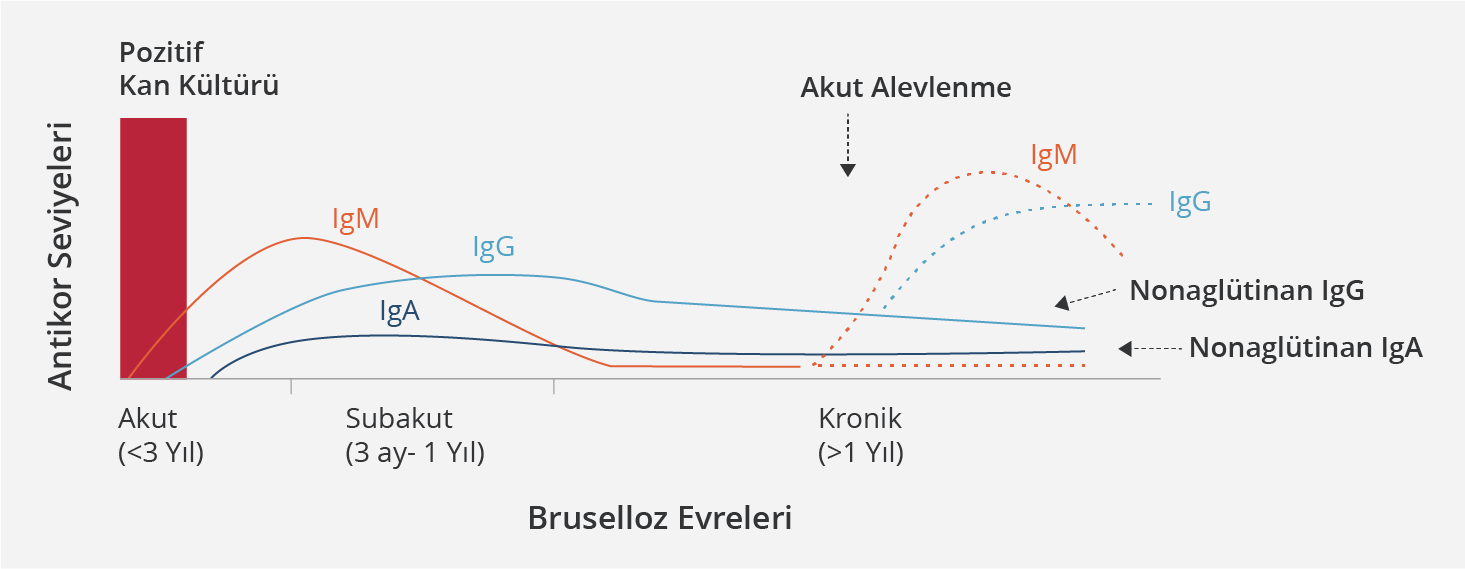
Brusellaya özgü serolojik aglütinasyon testlerinde, bakteriyel antijenlerin hasta serumundaki özgül antikorlarla direkt aglütinasyonuna bakılır. Rose Bengal, Wright STA, brusella mikroaglütinasyon testi (BMAT) (küçük plaklarda yapılan SAT), 2-merkaptoetanol STA, Coombs’lu STA ve immün yakalama aglütinasyon testlerinin (BrucellaCapt) hepsinde S-LPS’ye karşı antikorlar araştırılır. Rose Bengal kart testi, hızlı testtir. Duyarlılığının oldukça yüksek (>%90) olması ama özgüllüğünün düşük olması nedeniyle tarama için kullanılabileceği belirtilmektedir. Wright STA testi referans yöntem olup hem IgM, hem IgG, hem de IgA sınıfı antikorlar belirlenir. İnsanlarda Brucella infeksiyonlarına karşı immün yanıt farklılık göstermekle birlikte genel olarak brusellozun ilk haftasında IgM, ardından 2. haftada IgG ve sonrasında IgA yanıtı gelişir. Hastalığın erken dönemlerinde hepsinin titresi artar ve yaklaşık 4. haftada en yüksek seviyelerine ulaşır. Uzamış olgularda IgM konsantrasyonları düşebilir ve esas olarak IgG ve IgA yanıtı vardır; ancak tamamen iyileşmiş olguların %20-25’inde tedaviden sonraki ilk yılda bile IgM antikorları belirlenmiştir. İlerleyen süreçte non-aglütinan (inkomplet) antikorlar, aglütinanlardan daha fazla hale gelebilir ki bu da klasik STA’nın yalancı negatifliğine yol açabilir. Bu non-aglütinan antikorlar, aglütinasyon testine Coombs serumunun da eklenmesiyle (Coombs STA) gösterilebilir. BrucellaCapt, aynı test içinde hem aglütinan IgG ve IgM’yi hem de non-aglütinan IgG antikorlarını gösterebilen bir testtir. Erken antimikrobik tedavi sitozolik Brucella proteinlerine karşı antikor yanıtını azaltırken, LPS antikor yanıtını daha az oranda etkiler. IgG ve IgA’da hızlı bir düşüş olması genellikle antimikrobik tedaviye iyi bir yanıt olduğunu gösterirken, titrelerin artışı veya çok yüksek antikor seviyelerinin düşmemesi tedavi başarısızlığını, rezidüel hastalığı veya relapsı düşündürür. Ancak özellikle fokal komplikasyonu ve ilk tanı anındaki titreleri çok yüksek olan hastalarda antikor titrelerinin daha yavaş düşebileceği, bu nedenle tedavi sonunda pozitifliğin devam etmesinin her zaman tedavi başarısızlığını, kronikleşmeyi veya relapsı göstermeyeceği de akılda tutulmalıdır; hastalar esas olarak klinik semtom ve bulgularına göre değerlendirilmelidir. Relaps durumunda genellikle IgG seviyelerinde belirgin, IgA seviyelerinde orta dereceli bir artış olurken, IgM seviyelerinde artış olmaz. Wright STA testinde iki hafta ara ile alınan akut ve konvalesan serumda titrenin ≥4 kat artması veya ≥1/160 tek titre pozitifliği (endemik bölgelerde ≥1/320) olması tanısal olarak kabul edilir (24-29). Şekil 5’te brusellozun evrelerine göre antikorların seyri gösterilmiştir.
Serolojik aglütinasyon testlerinin en önemli sorunları infeksiyonun erken evrelerinde yalancı negatiflikleri, IgM tipi antikorların yukarıda belirtilmiş bazı Gram-negatif çomaklarla çapraz reaksiyon vermesi, çok fazla miktarda antikor olması veya özgül olmayan serum faktörleri nedeniyle düşük dilusyonlarda aglütinasyonun inhibisyonu (prezon olayı), inkomplet antikorlar nedeniyle yalancı negatiflik olması ve B. canis infeksiyonlarının tanısını koyamamalarıdır. Bu durumlar için sırasıyla testin 2-3 hafta sonra tekrarlanması, IgM cinsi antikorların merkaptoetanol veya daha az toksik olan ditiyotreitol gibi maddelerle parçalanarak STA testi yapılması, serumun ileri dilüsyonlarının (>1/320) yapılması, Coombs’lu STA veya BrucellaCapt testleriyle yapılması ve türe özgü bir test kullanılması önerilmektedir (29).
Tanı için gerek LPS gerek diğer antijenlerin kullanıldığı ELISA ve benzeri yöntemlerle yapılan serolojik testler de bulunmaktadır. Ancak bu testler her yerde bulunamamaları, duyarlılık, özgüllük sorunları gibi nedenlerle halen aglütinasyon testlerinin yerine geçmemektedir.
Nükleik Asit Amplifikasyon Testleri
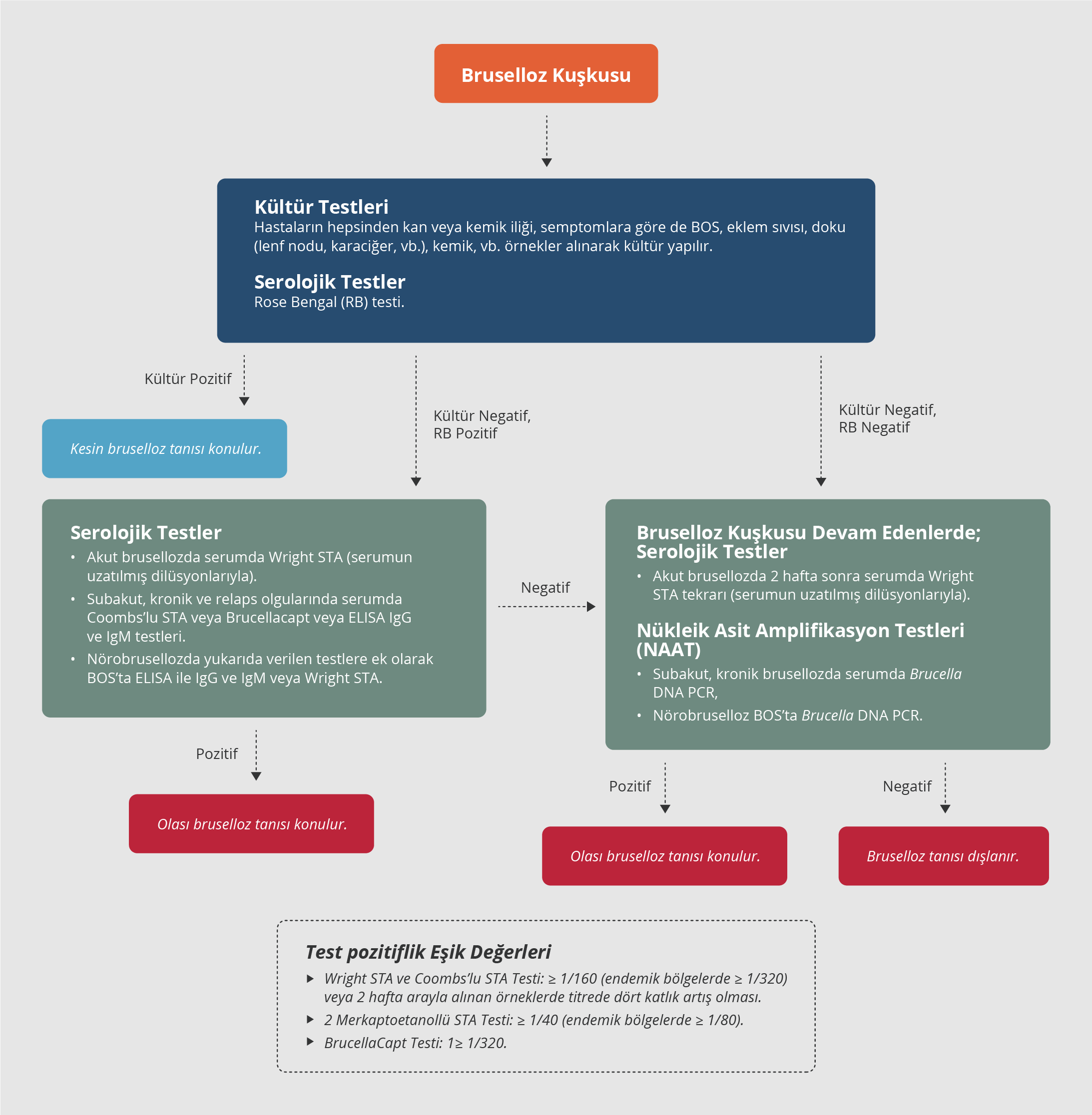
Başta PCR olmak üzere oldukça duyarlı yöntemler olan nükleik asit amplifikasyon testleri (NAAT), hem brusellozun hem de fokal komplikasyonların tanısında gittikçe artan oranlarda kullanılmaktadır. Çok duyarlı olmaları, gittikçe kolaylaşan yapılma şekilleri, hızlı ve güvenilir olmaları gibi avantajları bulunmakla birlikte, semptomu olmayan hastalarda da pozitif olarak belirlenebilmeleri, dolayısıyla aktif infeksiyonu belirlemedeki sorunları, pahalı olmaları, kolay ulaşılamamaları gibi birçok dezavantajı da bulunmaktadır. Amerikan Hastalık Kontrol ve Korunma Merkezleri (CDC) tarafından klinik örneklerde PCR ile Brucella DNA belirlenmesi, olası laboratuvar tanı ölçütü olarak önerilmektedir (11,29,31). Bruselloz düşünülen olgularda tanı testlerinin kullanımı için, rehber çalışmasında elde edilen kanıtlara dayanılarak oluşturulan algoritma Şekil 6’da sunulmuştur.
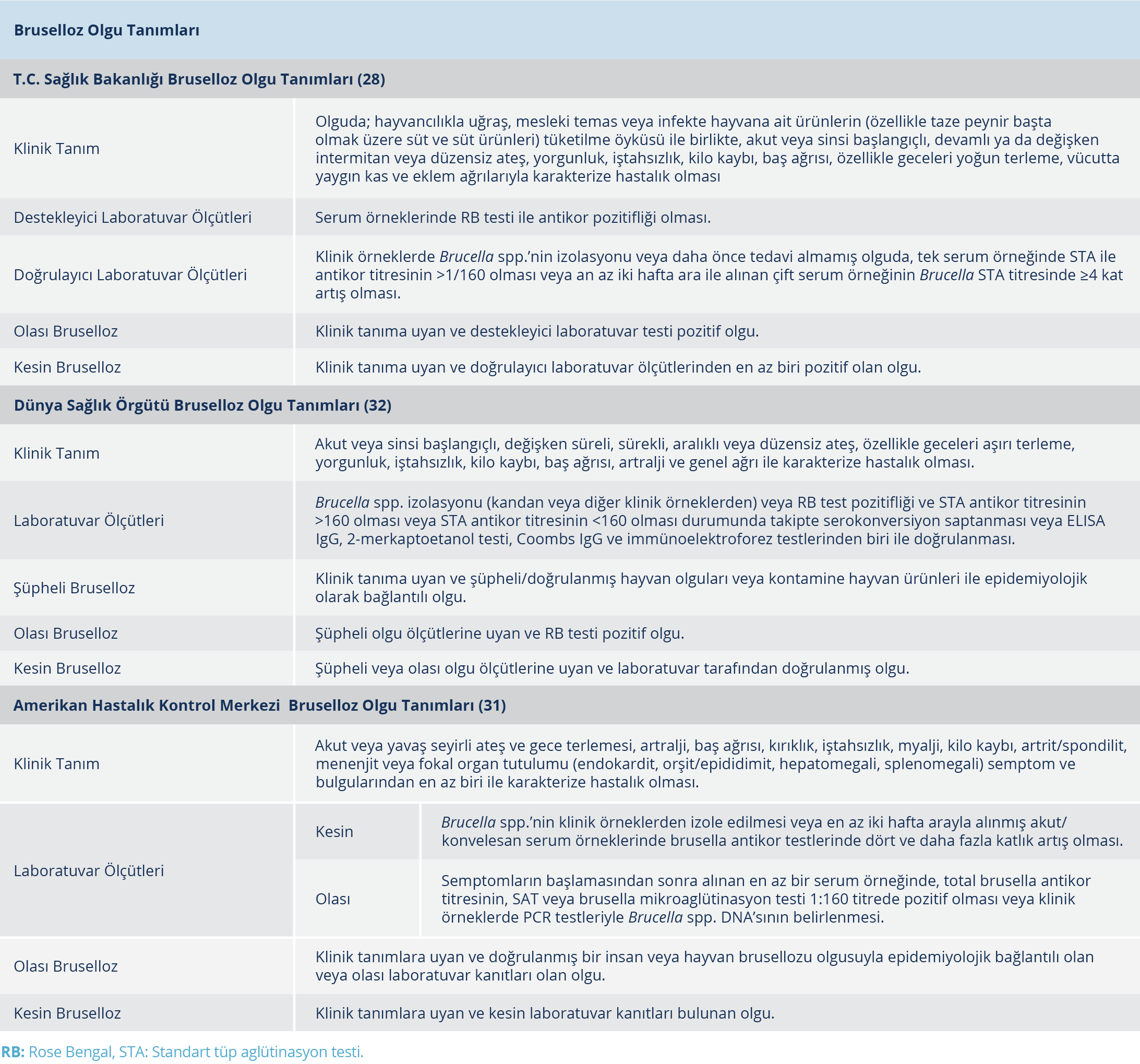
Bruselloz Olgu Tanımları
Bruselloz için T.C. Sağlık Bakanlığı, WHO ve CDC tarafından hastalığın sürveyansında kullanılması önerilen olgu tanımları Tablo 2’de verilmiştir.
Nörobruselloz Tanı Ölçütleri
Laboratuvar tarafından doğrulanmış bruselloz tanısı olan hastada (serum SAT ≥1:160 veya kültür pozitif) aşağıdakilerden en az birisinin varlığı;
- Nörobruselloz ile uyumlu semptom ve bulgu (kronik baş ağrısı, insomnia, depresyon, konfüzyon, kişilik değişiklikleri, nörolojik tutulumlar),
- BOS kültür pozitifliği ve/veya BOS antikor pozitifliği,
- BOS lenfositoz, protein yüksekliği, glukoz düşüklüğü ve/veya radyolojik bulgular (nörolojik tutulumu destekleyen kraniyal manyetik rezonans görüntüleme (MRI) veya bilgisayarlı tomografi (BT) bulguları) (33-54).
Bu ölçütler dışında bazı çalışmalarda sadece serum ve/veya BOS’ta brusella antikorlarının “enzyme-linked immunosorbent assay” (ELISA) ile saptanmasıyla nörobruselloz tanısı konulmuştur (42-50). Serum ve BOS’ta brusella antikorlarının sadece immünofloresan (IFA) veya kompleman fiksasyon testleriyle gösterilmesi yoluyla tanı konulan az sayıda olgu da bildirilmiştir (51,52). Bir olgu sunumunda ve 51 olgunun incelendiği bir çalışmadaki 27 olguda sadece serum veya BOS’ta PCR pozitifliğine göre nörobruselloz tanısı konulmuştur (53,54).
Brucella spp. Antimikrobiyal Duyarlılık Testleri
Bir hastanın herhangi bir klinik örneğinde Brucella spp. üremesi saptandığında, referans laboratuvarlar dışında antimikrobiyal duyarlılık testlerinin yapılması, sonuçların bildirilmesi genel olarak gerekli ve uygun değildir. Direnç nadiren sorundur ve mutlaka referans laboratuvarlarda tanımlanmalıdır. In vitro duyarlılık sonuçlarıyla klinik etkinlik birbiriyle korele olmayabilir. Bazı durumlarda kullanılmaması gereken ajanlara da duyarlılık tanımlanarak tedavinin yanlış yönlendirilmesine neden olunabilir. Uygun tedaviye başlanabilmesi için önemli olan bakterinin doğru tanımlanmasıdır (12). Brucella spp. için genel olarak kabul edilen bir antimikrobiyal duyarlılık testi (ADT) standardı ve kullanılan antimikrobikler için sınır değerleri bulunmamaktadır. Bu da günlük pratikte ADT testlerinde ve kullanılan sınır değerlerde çeşitliliğe yol açmakta, ADT test sonuçlarının ülkeler ve laboratuvarlar arasında karşılaştırılmasını zorlaştırmaktadır. Brucella spp. zor üreyen bakterilerdir ve klinik örneklerden ilk izolasyonları için kan içeren kültür plakları ve %5’lik CO2’li ortamda inkübasyon önerilmektedir. Klinik ve Laboratuvar Standartları Enstitüsü (CLSI) tarafından Brucella spp. için bir sıvı mikrodilüsyon (BMD) ADT tanımlanmıştır; bu standartta besiyeri olarak Brucella buyyonu (BB) kullanılması önerilmektedir (55). Bunun dışında bazı maddeler eklenmiş Mueller–Hinton buyyonuyla BMD, Brucella agarla agar dilüsyon yöntemleri de kullanılmaktadır. Klinik ve Laboratuvar Standartları Enstitüsü standardında RIF ve florokinolonlar için sınır değerler tanımlanmamıştır, diğer antimikrobiyaller içinse sadece duyarlılık sınır değerleri verilmiş, dirençli sınır değeri tanımlanmamıştır. Trimetoprim-sülfametoksazol için belirlenen minimum inhibitör konsantrasyonu (MİK) değerleri, sınır değere çok yakın kümelendiği için, vahşi suşlarda sıklıkla “orta duyarlı”, “dirençli” sonuçlara neden olmaktadır; ilgili suşların tam genom dizilemelerinde RIF direnç fenotipiyle ilişkili genomik bir değişim saptanmamasına rağmen RIF MİK değerleri beklenmedik şekilde yüksek çıkmaktadır. Avrupa Antimikrobiyal Duyarlılık Testi Komitesi (EUCAST), ISO 20776 standardını esas alarak, ADT’de gereksinime göre ekleme yapılmamış, katyonu ayarlanmış Mueller–Hinton buyyonu (CAMHB), bazı maddeler eklenmiş CAMHB, yeterli üreme olmaması halindeyse “fastidious anaerobe agar” (veya buyyon) önermektedir (56). Kültür besiyerleri ve inkübasyon konusunda CLSI önerileri, ISO 20776 standardını karşılamadığı için kısa süre önce Avrupa Antimikrobiyal Duyarlılık Testi Komitesi (EUCAST) temsilcilerinin kontrolünde ve Avrupa Brucella referans laboratuvarlarının yer aldığı bir Avrupa Birliği (AB) çalışma grubu, farklı kültür besiyerleri, kültür koşulları ve ADT’lerini karşılaştırarak CLSI M45 dokümanının ISO 20776 standardına adaptasyonunu sağlamıştır. Söz konusu çalışmada, yöntemi değerlendirmek için standart operasyon prosedürü (SOP) oluşturulmuş ve laboratuvarlar arası validasyon çalışmaları yapılmıştır. Çalışmalarda toplam 57 vahşi B. melitensis suşu ve bir dirençli suş kullanılmıştır. Sonuç olarak; B. melitensis için yapılacak BMD ADT için CAMHB’un uygun olduğuna karar verilmiş ve BMD plaklarının doğru inokulumla hazırlanması ve %5 CO2 ortam yerine normal ortamda 48 saat inkübe edilmesi gerektiği bildirilmiştir. Özellikle TMP-SMX MİK değerleri okunurken %80’lik üreme inhibisyonun dikkate alınması gerektiği vurgulanmıştır (57).
Brusellozun Tedavisi
Bruselloz, hücre içine yerleşebilen bir patojen olması nedeniyle, yinelemeleri ve kronikleşmeyi önlemek amacıyla uzun süreli ve kombinasyon tedavisi gerektirir. Kullanılacak ajanlardan birinin hücre içine geçişinin iyi olması önemlidir. Tedavi kombinasyonlarında kullanılabilen antibiyotikler tetrasiklin (TET), DOX, STREP, RIF, GEN, TMP-SMX ve siprofloksasin (CIP)’nden oluşur. Nörobruselloz olgularında ise CRO kombinasyonda yer alabilen bir ajandır. Doksisiklin, hücre içine iyi geçebilmesi ve hücre içi bakterilere güçlü etkisi nedeniyle tedavinin temelini oluşturur. Rifampisin+DOX kombinasyonunun, oral bir rejim olması nedeniyle uygulama kolaylığı vardır ve bu nedenle WHO tarafından ilk seçenek tedavi olarak önerilmektedir; ancak klinik araştırmalarda bu tedavi rejimiyle relaps riskinin daha yüksek olabileceği bildirilmektedir. Doksisiklin-aminoglikozid kombinasyonunda (ilk üç hafta STREP veya ilk bir hafta GEN şeklinde) ise relaps riskinin daha düşük olabileceği rapor edilmiştir. Fokal komplikasyon olmayan hastalıkta tedavi süresi altı haftayken, fokal tutulum olan kişilerde tedavi süresi 3-6 aya kadar uzatılabilir (11,58).
Trimetoprim-sülfametoksazol, bruselloz tedavisinde gerek 2’li gerekse 3’lü kombinasyonlarda yaygın kullanılan ilaçlardan biridir (10); TMP-SMX+RIF kombinasyonu özellikle pediatrik veya gebe hastalarda kullanılmıştır. Trimetoprim-sülfametoksazol (8 mg/kg/gün TMP dozu olacak şekilde) + RIF’le, TMP-SMX+DOX kombinasyonlarını karşılaştıran randomize kontrollü bir çalışmada, TMP-SMX+DOX kombinasyonuyla tedavi başarısının daha yüksek olduğu görülmüştür [%95 güven aralığı (GA)=0.174-0.862; “odds ratio” (OR)=0.387; p=0.020] (59).
Trimetoprim-sülfametoksazol özellikle komplike bruselloz olgularında olmak üzere birçok ülkede 3’lü kombinasyonlar içinde yaygın olarak kullanılmakta ve %90 civarı tedavi başarısı olduğu belirtilmektedir. Ancak komplike brusellozda TMP-SMX içeren 3’lü rejimleri önermek için yeterli kanıt bulunmamaktadır. Bazı yazarlar, WHO tarafından önerilen DOX-RIF rejimindeki yüksek relaps riski göz önüne alındığında, TMP-SMX’in bu rejime eklenebileceğini düşünmektedir (11). Brucella spp.’de TMP-SMX’e karşı direnç gelişebilmesi konusunda uyarılar da yapılmakla birlikte (12) yukarıdaki “Brucella spp. Antimikrobiyal Duyarlılık Testleri” bölümünde de belirtildiği gibi Brucella spp.’de TMP-SMX direncinin tanımlanmasında gerek uygun besiyerlerinin kullanımı gerekse MİK değerlerinin okunmasındaki sorunlar konusunda dikkatli olunmalıdır. Eldeki veriler, TMP-SMX’in bruselloz tedavisinde, özellikle DOX’lu kombinasyonlar içinde yer alabileceğini, ancak ek çalışmalara gereksinim olduğunu düşündürmektedir.
Tablo 3’te, kanıt olması halinde rehberdeki analizlerle elde edilen sonuçlara göre, kanıt olmayan durumlarda ise rehber grubunda yer alan uzmanların önerisiyle yapılmış bruselloz tedavi önerileri sunulmuştur.
Kimi in vitro çalışmalarda azitromisin (AZM)’in de Brucella spp.’ye etkili olabileceği bildirilmiştir (60). Bir hayvan çalışmasında, profilaktik AZM’nin hem düşük hem de yüksek düzey B. melitensis’e maruz bırakılan farelerde etkili olduğu gösterilmiştir (61). Gözlemsel bir klinik çalışmada, AZM-GEN kombinasyonuyla 10 hastanın dördü başarıyla tedavi edilirken, üçünde relaps, ikisinde tedavi başarısızlığı görülmüş, birinde ise istenmeyen etkiler nedeniyle tedavi değişikliği yapılması gerekmiştir (62). Ancak kısa süre önce yapılmış bir in vitro çalışmada Bosna-Hersek’ten izole edilmiş 108 B. melitensis suşunun >%90’ında AZM direnci belirlendiği bildirilmiştir (63). Yine ülkemizde yapılmış bir in vitro çalışmada da AZM’nin B. melitensis suşlarına karşı etkinliğinin sınırlı olduğu ve test edilen 73 suşun %50’sinde direnç belirlendiği bildirilmiştir (64).
Eldeki veriler, AZM’nin bruselloz tedavisinde, diğer alternatifler olduğu sürece değerlendirilmemesi gerektiğini düşündürmekle birlikte, ek çalışmalara gereksinim olduğu açıktır.
Hayvan Brusellozunun Kontrolü ve Önlenmesi
Hayvan brusellozunun kontrolü ve önlenmesi, genel olarak duyarlı hayvanların aşılanması ve infekte hayvanların taranarak kesilmesi şeklinde sağlanır. Bir bölgede hayvanlarda hastalığın prevalansı >%5 ise tüm hayvanların (genç ve erişkin) kitlesel olarak aşılanması, %1-5 arasındaysa genç hayvanların aşılanması ve tarama/kesme uygulamalarının bir arada kullanılması, <%1 olması halindeyse tarama/kesme şeklinde bir program uygulanması gerekir. Bu yaklaşımlara ek olarak infeksiyon yayılımını engelleyecek genel hijyen kurallarına uyumun artırılması ve hayvan hareketlerinin kontrolü de sıklıkla gerekir.
Ülkemizde 2011 yılında yapılmış bir çalışmada sürülerde seropozitiflik oranlarının sığırlar için %6.9, koyunlar içinse %30 olarak belirlenmesiyle 1 Ocak 2012 tarihinden itibaren hayvan brusellozunun önlenmesinde subkutan aşılama durdurularak konjunktival canlı, atenüe B. melitensis Rev‐1 ve canlı, atenüe B. abortus S-19 aşılarıyla kitlesel aşılamaya geçilmiştir. Bu uygulamayla sürü prevalansında önemli azalma görülmüş ve ortalama %12.3’e düşmüştür. Bu kitlesel aşılamaların prevalansın %5’in altına düşmesine kadar devam etmesi planlanmaktadır (21).
İnsan Brusellozunun Önlenmesi
İnsan brusellozunun önlenebilmesi için çiftlik hayvanlarında hastalığın kontrol altına alınması en önemli basamaktır. İkinci önlem çiğ süt/süt ürünlerinin tüketilmemesi ve tüm sütlerin pastörizasyonudur. Brucella spp., WHO Risk Grubu 3 patojendir; çalışan kişi için riskliyken, toplum için risk teşkil etmeyen mikroorganizma grubunda yer alır. Ancak laboratuvar ortamından en kolay bulaşan patojenlerdendir. Klinik örneklerde bulunan bakterilerin sayısı bulaşmada önemlidir; kan ve biyopsi örneklerinde, testi çalışan kişiye önemli risk oluşturacak sayıda bakteri nadiren bulunur, ama yine de tüm kan ve biyopsi örnekleri en az Biyogüvenlik Seviye 2 (BSL-2) koşullarında çalışılmalıdır. Brucella spp.’nin üretilmiş olduğu besiyerlerindeyse tehlikeli sayıda mikroorganizma bulunduğu için çok daha ciddi önlemler alınmalıdır. Bu aşamada BSL-3 ortamlar ve uygulamalar gereklidir. Ek olarak, Brucella spp. CDC’nin biyolojik silah amacıyla kullanılabilecek potansiyel ajanlar listesinde A kategorisinde yer almaktadır. Klinik laboratuvarlarda uygun güvenlik önlemlerinin alınması ve mezbaha gibi yerlerde uygun koruyucu giysilerin kullanılması alınabilecek diğer önlemlerdir (65). İnsanda kullanılabilecek bir aşı henüz bulunmamaktadır.
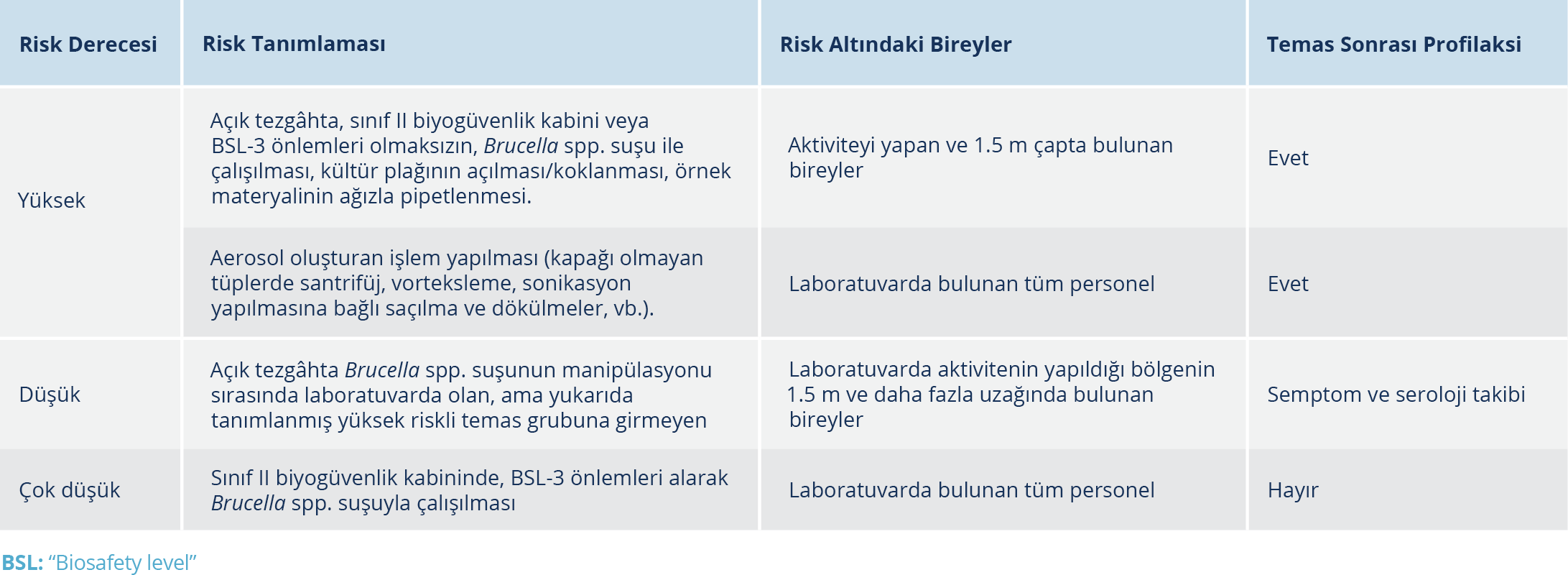
Temas Sonrası Profilaksi
Etik sebepler, Brucella temasına neden olan olayların çeşitliliği, gerçek riskin tanımlanmasının güçlüğü, her salgında az sayıda kişinin bulunması nedeniyle, riskli çalışanlarda, temas sonrası profilaksinin etkinliğini değerlendiren kontrollü çalışma bulunmamaktadır. Ancak anekdotal veriler, temas sonrası profilaksinin, klinik hastalık gelişme riskini azaltabileceğini göstermektedir (66).
Bruselloz Olan Hayvanla veya Ürünleriyle Temas
Hasta bruselloz semptomları açısından bilgilendirilir ve izlenir; insan brusellozu semptomları olması halinde uygun örnekler alınarak test yapılır.
Hayvan Aşısıyla Temas
Hayvanlarda kullanılan Brucella aşıları canlı bakteri içerir ve temas halinde hastalığı bulaştırma riski taşır. Bu aşıları uygulayan veterinerlerde kazayla inokülasyon sık görülmektedir. Aşı olarak sığırlarda B. abortus 19 veya RB51 suşu, koyun ve keçilerde ise B. melitensis Rev 1 suşu kullanılmaktadır. Bu aşıların kazayla inokülasyonunda bruselloz bulaşma riski, özellikle miktar azsa çok yüksek değildir, ancak potansiyel bulaşma riski nedeniyle bu şekilde teması olan kişilere de hızla temas sonrası profilaksi (PEP) başlanmalıdır. RB51 suşu RIF’e dirençli olduğu için PEP’te bu ilaç kullanılmamalıdır (67). Bu durumda PEP olarak DOX 2X100 mg/gün, TMP-SMX 160/800 tb 2X1/gün, 21 gün kullanılabilir (65,66,68). Dünya Sağlık Örgütü, DOX’u tek başına 42 gün önermektedir (27).
Bu aşıların göze sıçraması halinde (konjunktival inokülasyon) bruselloz bulaşma riski daha yüksektir. Bu nedenle bu tür temaslarda lokal göz bakımı ve bir veya iki ilaçla 6 haftalık tam tedavi önerilmektedir. Brucella RB51 suşu, hayvanlarda süte geçebilmesi nedeniyle insanlara bu yolla da bulaşarak infeksiyonlara neden olabilmektedir. RB51 infeksiyonunu tespit etmek için mevcut bir serolojik test yoktur. Aşıyla temas etmiş semptomatik bireyler için kan kültürü önerilir (68).
Laboratuvar Materyalleriyle Temas
Kontamine materyalle teması olacak kişiler, maruziyet riski açısından değerlendirilerek; “yüksek risk”, “düşük risk” ve “çok düşük risk” şeklinde gruplandırılmalıdır. Yüksek riskli temasta mümkün olan en kısa sürede antimikrobiyal profilaksiye başlanmalıdır. Bununla birlikte profilaksi, temastan 24 hafta sonrasına kadar başlanabilir. Düşük riskli temasta ise, semptom ve serolojik takip yapılarak serokonversiyon oluştuğunda tedavi verilmesi şeklinde bir yaklaşım söz konusudur. Bağışıklığı baskılanmış bireylerde ve gebelerde profilaksi verilebilir. Düşük riskli temas varlığında sağlık çalışanı ile birlikte tartışılarak karar verilmelidir (28,65,66,69).
Yüksek riskli temas; bakteri kültürünün koklanması, direkt olarak deri ile temas, ağızla pipetleme, inokulasyon, göz, burun veya ağıza sıçraması gibi çalışanın direkt teması, açık tezgahta Brucella üreyen kültür ile çalışmak (BSL-3 alanları dışında çalışmak) veya Brucella çalışma alanına 1.5 m veya daha yakın bulunmak, Brucella izolatı ile yapılan aerosol oluşturan herhangi bir işlem sırasında laboratuvarda bulunmak, inhale etmek (örneğin vorteksleme veya katalaz testi) ve amniyotik sıvı, plasenta gibi üreme materyalleri ile çalışmak olarak tanımlanmıştır (28).
Brucella suşu pozitif kan kültürü şişesi veya amniyotik sıvı, plasenta gibi üreme sistemi materyalleri ile çalışan birinden 1.5 m’den daha uzak mesafede bulunmak, aerosol oluşturmayan işlemler sırasında açık bir bankta çalışmak düşük riskli temas olarak tanımlanmaktadır (28).
Riskli işlemlerin, uygun kişisel koruyucu ekipman (örn. eldiven, önlük, göz koruması) ile sertifikalı Sınıf II biyogüvenlik kabininde gerçekleştirilmesi ve kan, serum, beyin omurilik sıvısı gibi rutin bir klinik numunenin sertifikalı bir Sınıf II biyogüvenlik kabininde, uygun kişisel koruyucu ekipman (örn. eldiven, önlük, göz koruması) kullanılarak çalışılması minimum (çok düşük) riskli temas olarak kabul edilmektedir. Bu durumda herhangi bir takip önerilmemektedir (28).
Temas sonrası profilaksi için DOX 2X100 mg/gün, RIF 1X600mg/gün 21 gün boyunca kullanılmalıdır (28, 68). Bazı yazarlar 21 günlük DOX tedavisinin de tek başına yeterli olabileceğini bildirmektedir (65). Temas eden kişiler 6 ay boyunca, haftalık olarak semptom gelişimi ve temas sonrasında bazal, 6, 12, 18 ve 24. haftalarda olmak üzere serolojik testlerle izlenmelidir (28, 69). Profilaksi önerileri Tablo 4’te özetlenmiştir.
PICO SORULARI, ÖNERİLER VE ÖNERİLERİ DESTEKLEYEN KANITLARIN ÖZETİ
1- Brusellozdan kuşkulanılan hastalarda Rose Bengal testinin tanıdaki yeri nedir?
Öneri: Rose Bengal (RB) testinin bruselloz tanısında duyarlılığı yüksektir. Temas öyküsü ve uyumlu semptomları olan hastalarda hızlı tanı testi olarak önerilir (Düşük kanıt düzeyi, güçlü öneri). Yapılan meta-analizlerde özgüllüğü de yüksek bulunmakla birlikte kontrol grupları uygun olmadığı için, mevcut veriler bruselloz tanısında tek başına kullanılması konusunda yeterli değildir. Antikor taramaya yönelik bir test olması nedeniyle hastalığın erken dönemlerinde yalancı negatiflik olabileceğinin de akılda tutulması önerilir (Çok düşük kanıt düzeyi, güçlü öneri).
Kanıtların Özeti: Öneri ile ilgili kanıtlar, bruselloz tanısında RB testinin duyarlılık ve özgüllüğünün araştırıldığı sekiz kesitsel çalışmanın meta-analizine dayanmaktadır. Bu çalışmaların beşinde (70-74) referans test olarak kültür pozitifliği alınırken, birinde (75) kültür ve/veya STA pozitifliği, birinde (76) kültür ve/veya STA pozitifliği veya titre artışı, birinde (77) ise yalnız STA pozitifliği alınmıştır. Meta-analizine tüm çalışmalar (n=3347) dahil edildiğinde, RB testinin havuz duyarlılığı %99 (%95 GA=%90-99) özgüllüğü ise %96 (%95 GA=%80-99) bulunmuştur. Yalnız kültürün referans alındığı çalışmalar (n=2752) esas alındığında ise havuz duyarlılık %99 (%95 GA=%47-99); özgüllük ise %94 (%95 GA=%71-99) bulunmuştur.
Andriopoulus ve arkadaşlarının (70) 2015 yılında yayımlanan çalışmasında, 2000-2010 yılları arasında Sparta Hastanesi’nde takip edilen 83 akut bruselloz hastası içinde kan kültürü pozitifliği olan 65 hasta çalışma grubu olarak alınmıştır. Aynı hasta grubu içerisinden 2013 yılında kontrol edilen tamamen sağlıklı olan 72 birey kontrol grubu olarak alınmıştır. Rose Bengal testinde B. abortus antijeni ve bir otomatize kültür sistemi (bioMérieux, Fransa) kullanılmıştır. Testin duyarlılığı %100 (%95 GA=%94-100), özgüllüğü %88 (%95 GA=%78-94) bulunmuştur.
Çiftçi ve arkadaşlarının (71) 2005’te yayımlanan çalışmasında, Eylül 2001-Eylül 2003 tarihleri arasında Akdeniz Üniversitesi Tıp Fakültesi Hastanesi’ndeki 77 bruselloz şüpheli olgu için kan kültürü pozitifliği olan 35 olgu çalışma grubu, kalan 42 olgu ise kontrol grubu olarak alınmıştır. Rose Bengal testi için B. abortus S99 suşundan hazırlanan ticari antijen (Spinreact, İspanya) kullanılmıştır. Testin duyarlılığı %100 (%95 GA=%90-100), özgüllüğü %45 (%95 GA=%30-61) bulunmuştur.
Diaz ve arkadaşlarının çalışması (72), 1975-2001 yılları arasında Barselona’daki yedi merkezde yapılmıştır. Çalışmada 208 kültür pozitif olgu
(B. melitensis) çalışma grubu olarak alınırken, brusellozla ilişkili semptomu olmayıp başka infeksiyon şüphesi olan 1559 kişi birinci kontrol grubu ve asemptomatik olup yakın hayvan teması olan ya da canlı hayvan aşısı batan 20 kişi ikinci kontrol grubu olarak alınmıştır. Rose Bengal testi için 30 µl serum ile Brucella antijeni (“Veterinary Laboratory Agency”, İngiltere) karıştırılarak 8 dk inkübe edilmiştir. Testin duyarlılığı %100 (%95 GA=%98-100), özgüllüğü %99 (%95 GA=%98-99) bulunmuştur.
Mert ve arkadaşlarının (73) 2003’te yayımlanan çalışmasında, İstanbul Üniversitesi, Cerrahpaşa Tıp Fakültesi Hastanesi’nde son 20 yıllık dönemde takipli 30 kültür pozitif hasta çalışma grubu olarak alınırken; brusellozu taklit eden başka hastalığı olan 280 hasta (20 miliyer tüberküloz, 33 sıtma, 20 tifoid ateş, 20 erişkin “still” hastalığı, 47 sistemik lupus eritematozus, 50 romatoid artrit, 27 sarkoidoz, 63 lenfoma) kontrol grubu olarak alınmıştır. Aglütinasyon testlerinde B. abortus S.99 suşu (Pendik Veteriner Araştırma Laboratuvarı, İstanbul, Türkiye) kullanılmış olup testler kör olarak yapılmıştır. Testin duyarlılığı %100 (%95 GA=%88-100), özgüllüğü %100 (%95 GA=%99-100) bulunmuştur.
Purwar ve arkadaşlarının (74) çalışmasında, Ocak 2004-Temmuz 2005 tarihleri arasında Hindistan’ın Karnataka eyaletinde bir hastaneye akut nedeni bilinmeyen ateş yakınması ile başvuran 400 hasta içinde 20 kültür pozitif olgu çalışma grubu olarak alınırken kalan 380 hasta kontrol grubu olarak alınmıştır. Rose Bengal antijeni Hindistan Veterinerlik Araştırma Enstitüsü, Biyolojik Ürünler Bölümü’nden temin edilmiştir. Kültür için 5-10 ml kan örneği beyin-kalp infüzyonu agara Castaneda yöntemi ile inoküle edilmiş ve 37 °C’de dört haftaya kadar veya üremenin ortaya çıktığı zamana kadar (hangisi daha önceyse) inkübe edilmiştir. Testin duyarlılığı %100 (%95 GA=%83-100), özgüllüğü %96 (%95 GA=%94-98) bulunmuştur.
Sırmatel ve arkadaşlarının (75) çalışmasında, 1992-1995 yılları arasında Gaziantep Üniversitesi Tıp Fakültesi Hastanesi’nde bruselloz tanısı ile takip edilen 184 hasta çalışma grubu olarak alınırken 20 sağlıklı kan donorü kontrol grubu olarak alınmıştır. Testin duyarlılığı %68 (%95 GA=%61-75), özgüllüğü %70 (%95 GA=%46-88) bulunmuştur. Aynı çalışmanın alt analizi yapılarak yalnız kültür pozitif olan 20 olgu ele alındığında ise testin duyarlılığı %90 (%95 GA=%70-99), özgüllüğü %70 (%95 GA=%46-88) olarak bulunmuştur.
Vrioni ve arkadaşlarının (76) çalışmasında, Ocak 2000-Aralık 2002 arası Yunanistan, Ioannina Üniversite Hastanesi’nde takipli 243 akut bruselloz hastası çalışma grubu olarak alınırken 50 sağlıklı kan donorü kontrol grubu olarak alınmıştır. Kan kültürü için BacT/Alert sisteminde (bioMérieux, Fransa) 10 gün süreyle inkübe edilmiş, üreme olmazsa 10 gün daha uzatılmış ve Brucella agara (Becton Dickinson, ABD) 10. ve 20. günlerde kör alt kültürler ekilmiştir. Bu alt kültürler, üç gün boyunca %5 ila %10 CO2 atmosferde 37°C’de inkübe edilmiştir. Rose Bengal testinin duyarlılığı %96 (%95 GA=%93-98), özgüllüğü %100 (%95 GA=%93-100) bulunmuştur.
El-Hossain Aly Reda ve arkadaşlarının (77) Kahire’de gerçekleştirdiği çalışmada, Kasım 2015-Mayıs 2016 tarihleri arasında klinik olarak bruselloz şüphesi olan 100 serum örneği değerlendirilmiş ve STA pozitifliği olan 95 olgu çalışma grubu olarak alınmıştır. Rose Bengal testinde BioMed-RB kullanılarak 50 µl hasta serumu ile 50 µl ölü B. abortus antijeni lam üzerinde karıştırılmış 4 dk inkübasyon sonrası aglütinasyon olması pozitif olarak yorumlanmıştır. STA testinde 1 damla (50 µl) BioMed-Brucel- Abortus / Melitensis antijeni seri dilüe edilmiş, 1 ml’lik serum örnekleri (1:20-1:1280) ile karıştırılmış ve 37°C’de 24 saat inkübe edilmiştir. Rose Bengal testinin duyarlılığı %96 (%95 GA=%90-99), özgüllüğü %100 (%95 GA=%48-100) bulunmuştur. (Bkz. Ek Şekil 8-10, Ek Tablo 1-3)
Öneri Gerekçesi: Rose Bengal testi, yüksek duyarlılık düzeyi, kolay ulaşılabilir olması ve hızlı sonuç vermesi nedenleri ile bruselloz tanı algoritmasında ilk uygulanacak testtir.
Bilgi Açığı: Değerlendirilen çalışmaların hemen hemen tamamında, testin yapıldığı grup bruselloz olma olasılığı yüksek olan hastalardan (klinik bulguları uyumlu ve şüpheli temas öyküleri olması nedeni ile) ve kontrol grubu da bruselloz olmadığı bilinen sağlıklı kişiler ya da kan donörlerinden oluşmaktadır. Çalışmaların çoğunda örneklem büyüklükleri belirsizdir. Rose Bengal testi ile bruselloz tanısının dışlanabilmesi için, hastalığın endemik olduğu bölgelerde yapılacak, yeterli örneklem büyüklüğüne sahip, yalnız bruselloz şüpheli hastaların dahil edildiği, prospektif saha çalışmalarına gereksinim vardır.
2- Brusellozdan kuşkulanılan hastalarda Wright standart tüp aglütinasyon testinin tanıdaki yeri nedir?
Öneri: Brusellozdan kuşkulanılan hastalarda Wright standart tüp aglütinasyon (STA) testinin ≥1:160 titrasyonda pozitifliğinin, bruselloz tanısı için duyarlılık ve özgüllüğü yüksek bulunmuştur. Erken tedavi başlanmasının gerekli olduğu durumlarda hızlı tanıda veya kültürün yapılamadığı durumlarda tanıda Wright STA testi kullanılabilir. Brusellozdan kuşkulanılan hastalarda RB testi pozitif saptandığında da tanının, daha özgül olması nedeniyle Wright STA testi ile doğrulanması önerilir (Düşük kanıt düzeyi, güçlü öneri).
Brusella endokarditi olan hastalarda, Wright STA’nın ≥1:1280 titrede pozitif olması mortalite ile ilişkili bulunmuştur. Dolayısıyla bu hasta grubunda prognozu öngörmek için Wright STA testinin kullanımı da düşünülebilir (Düşük kanıt düzeyi, zayıf öneri).
Kanıtların Özeti: Öneri ile ilgili kanıtlar, bruselloz tanısında kültürün referans test alınarak, STA testinin duyarlılık ve özgüllüğünün araştırıldığı dokuz kesitsel çalışmanın meta-analizine dayanmaktadır. Bu çalışmaların meta-analizi sonucu (n=3015) STA testinin havuz duyarlılığı %96 (%95 GA=%90-98); özgüllüğü %99 (%95 GA=%98-99); pozitif olasılık oranı 130.2 (%95 GA=50.81-333.61); negatif olasılık oranı ise 0.03 (%95 GA= 0.01- 0.1) bulunmuştur (Bkz. Ek Bruselloz tanısı).
Andriopoulus ve arkadaşlarının (70) çalışmasında, STA testinde B. abortus antijeni ile serum örnekleri 1:40-1:3200 arası dilüsyonlarda karıştırılmıştır. Otomatize kültür sistemi (bioMérieux, Fransa) kullanılmış. Testin duyarlılığı %100 (%95 GA=%94-100), özgüllüğü %89 (%95 GA=%79-95) bulunmuştur.
Arabacı ve Oldacay’ın (78) çalışmasında, 2009 yılı boyunca Çanakkale Devlet Hastanesi’nde takipli seroloji ve kültür pozitifliği ile tanı konulan 131 akut bruselloz hastası çalışma grubuna alınırken 105 sağlıklı kan donörü kontrol grubuna alınmıştır. Standart tüp aglütinasyon testinde B. abortus antijeni (Refik Saydam Hıfzıssıhha Merkezi Başkanlığı, Ankara, Türkiye) ile serum örnekleri 1:40-1:5160 arası dilüsyonlarda karıştırılmıştır. Otomatize kan kültürü sistemi (VERSA-TREK, ABD) kullanılmıştır. Beş gün içinde üreme olmayan örneklerde inkübasyon 30 güne uzatılmış ve yedi gün sonra Brucella agara (Beckton Dickinson, ABD) kör alt kültürler ekilmiştir. Bruselloz tanılı 131 olgu arasında yalnız kültür pozitif olan 9 olgu meta-analizine dahil edilerek STA testinin duyarlılığı %100 (%95 GA=%66-100), özgüllüğü %99 (%95 GA=%95-100) olarak hesaplanmıştır.
Çeken ve arkadaşlarının (79) Ocak-Haziran 2007 döneminde Ankara’da yaptıkları çalışmada, 35 akut bruselloz olgusu içinde kültür pozitif 16 olgu çalışma grubu olarak belirlenmiştir. Kontrol grubu ise hastaneye başka sebeplerden başvuran klinik olarak bruselloz düşünülmeyen, STA titresi negatif olan gönüllü kişilerden oluşturulmuştur. Standart tüp aglütinasyon testi için B. abortus S99 suşu antijeni (Refik Saydam Hıfzıssıhha Merkezi Başkanlığı, Ankara, Türkiye) kullanılmıştır. Kan kültürleri Bactec 9050 (Becton Dickinson, ABD) otomatize sistemi ile 30 gün süre ile inkübe edilmiştir. İnkübasyonun 10, 20 ve 30. günlerinde üremeyen örneklerden kör pasajlar yapılmıştır. Testin duyarlılığı %94 (%95 GA=%70-100), özgüllüğü %100 (%95 GA=%83-100) bulunmuştur.
Diaz ve arkadaşlarının (72) yukarıda söz edilen çalışmasında, STA testi mikrotitre plaklarında gerçekleştirilmiştir. Testin duyarlılığı %89 (%95 GA=%84-93), özgüllüğü %100 (%95 GA=%99-100) bulunmuştur.
Ertek ve arkadaşlarının (80) Atatürk Üniversitesi Tıp Fakültesi Hastanesi’nde yürüttükleri çalışmada, 32 kültür pozitif olgu çalışma grubu ve 20 sağlıklı birey kontrol grubu olarak belirlenmiştir. Standart tüp aglütinasyon testi için B. abortus antijeni (Pendik Veteriner Kontrol Enstitüsü, İstanbul, Türkiye) kullanılmış ve serum örnekleri 1:20’den başlayarak dilüe edilmiştir. Kültür için aseptik olarak hastalardan iki kan numunesi (her biri 10 ml) ve bir kemik iliği numunesi (sternal aspirat, 1 ml) alınmış ve BACTEC 9240 sisteminde (Becton-Dickinson, ABD) 21 gün süreyle inkübe edilmiştir. Testin duyarlılığı %94 (%95 GA=%79-99), özgüllüğü %100 (%95 GA=%83-100) bulunmuştur.
Memish ve arkadaşlarının (81) çalışmasında, Ekim 1999-Ekim 2000 arasında, semptomatik kültür pozitif 68 olgu ve 70 sağlıklı gönüllü hasta değerlendirmeye alınmıştır. Standart tüp aglütinasyon testi için B. abortus ve B. melitensis antijenleri 1010 mikroorganizma/ml içeren B. abortus SS14 ve B. melitensis SS15 süspansiyonları (Wellcome Diagnostics, İngiltere) kullanılarak bir mikrotitre aglutinasyon prosedürü ile ölçülmüş, prezon fenomenini önlemek için serumlar rutin olarak 1:80’den 1:20 480’e seyreltilmiştir. Kültür için hastalardan iki kan numunesi (her biri 5-10 ml) alınmış ve BACTEC 9240 sisteminde (Becton-Dickinson, ABD) 7 gün süreyle inkübe edilmiştir. Testin duyarlılığı %96 (%95 GA=%88-99), özgüllüğü %100 (%95 GA=%95-100) bulunmuştur.
Mert ve arkadaşlarının (73) yukarıda açıklandığı gibi gerçekleştirilen çalışmasında, STA testinde B. abortus S.99 suşu (Pendik Veteriner Kontrol Enstitüsü, İstanbul, Türkiye) kullanılmış, testin duyarlılığı %100 (%95 GA=%88-100), özgüllüğü %99 (%95 GA=%97-100) bulunmuştur.
Purwar ve arkadaşlarının çalışmasında (74), STA antijeni Hindistan Veterinerlik Araştırma Enstitüsü Biyolojik Ürünler Bölümü’nden temin edilmiştir. Testin duyarlılığı %100 (%95 GA=%83-100), özgüllüğü %96 (%95 GA=%94-98) bulunmuştur.
Sırmatel ve arkadaşlarının (75) çalışmasındaki yalnız kültür pozitif olan 20 olgu meta-analizine dahil edildiğinde STA testinin duyarlılığı %100 (%95 GA=%84-100) ve özgüllüğü %100 (%95 GA=%83-100) bulunmuştur. (Bkz. Ek Şekil 11, 12 ve Ek Tablo 1, 4, 5)
Öneri Gerekçesi: Kültür, bruselloz tanısında altın standart tanı yöntemi olmakla birlikte duyarlılığı düşüktür. Aynı zamanda kültür sonuçları geç çıkmakta ve birinci basamak hatta bazı ikinci basamak sağlık hizmeti veren kurumlarda çalışılamamaktadır. Standart tüp aglütinasyon testi ise oldukça duyarlı ve özgül bir test olup kültürden daha kolay uygulanabilmektedir. Ayrıca bu rehberde brusella endokarditi bölümünde (Bkz. PICO 12) elde edilmiş veriler, tanı anında yüksek STA testi titrelerinin bulunmasının kötü prognozla ilişkisini desteklemektedir.
Bilgi açığı: Değerlendirilen çalışmaların hemen hemen tamamında testin yapıldığı grup bruselloz olma olasılığı yüksek olan hastalar ve kontrol grubu da bruselloz olmadığı bilinen kişilerden oluşmaktadır. Çalışmaların çoğunda örneklem büyüklükleri belirsizdir. Standart tüp aglütinasyon testinin, bruselloz tanısında tek başına güçlü olarak önerilebilmesi için, hastalığın endemik olduğu bölgelerde yapılacak, yeterli örneklem büyüklüğüne sahip, yalnız bruselloz şüpheli hastaların dahil edildiği, prospektif saha çalışmalarına gereksinim vardır.
3- Brusellozdan kuşkulanılan hastalarda enzim işaretli immün deney (ELISA) temelli testlerin tanıdaki yeri nedir?
Öneri: Brusellozdan kuşkulanılan, RB testi pozitif hastalarda doğrulama amacıyla STA testi yerine ELISA temelli testler de kullanılabilir. Tanıda ELISA temelli testler kullanılacaksa IgM ve IgG testlerinin birlikte kullanılması önerilir (Çok düşük kanıt düzeyi, güçlü öneri).
Kanıtların Özeti: Öneri ile iligili kanıtlar, bruselloz tanısında ELISA testinin duyarlılık ve özgüllüğünün araştırıldığı sekiz kesitsel çalışmanın meta-analizine dayanmaktadır. Bu çalışmaların üçünde (71,80,81) referans test olarak kültür pozitifliği alınırken, birinde (77) STA pozitifliği, birinde (82) kültür ve/veya STA pozitifliği, üçünde ise (75,76,78) kültür ve/veya STA pozitifliği veya titre artışı alınmıştır. Ayrıca iki çalışmadaki (75,78) bruselloz tanılı hastalar arasında yalnız kültür pozitifler ayrılarak, sonuçları referans olarak yalnız kültür pozitiflerin alındığı meta-analizi sonucuna dahil edilmiştir. Meta-analizi sonucunda, ELISA IgG testi (n=1380) için duyarlılık %81 (%95 GA=%66-91), özgüllük %97 (%95 GA=%89-99); ELISA IgM testi (n=1380) için duyarlılık %74 (%95 GA=%56 86), özgüllük %99 (%95 GA=%87-99); ELISA IgM+IgG testi (n=715) için duyarlılık %87 (%95 GA=%50-97), özgüllük %98 (%95 GA=%94-99) olarak bulunmuştur. Referans test olarak kültür pozitifliğinin alındığı çalışmaların ayrıca meta-analizi yapıldığında ise duyarlılık ve özgüllük sırasıyla, ELISA IgG testi (n=408) için %81 (%95 GA=%59-92) ve %91 (%95 GA=%72-97); ELISA IgM testi (n=307) için %83 (%95 GA=%56-95) ve %97 (%95 GA=%60-99) olarak hesaplanmıştır. [STATA (StataCorp, ABD) programı ile havuz duyarlılık ve özgüllük analizi yapılabilmesi için en az dört çalışma olması gerekmektedir. Kültür pozitifliğini referans alan ELISA IgM+IgG duyarlılık ve özgüllüğünün araştırıldığı yalnız üç çalışma olması nedeni ile havuz analizi yapılamadı.]
Çiftçi ve arkadaşlarının (71) çalışmasında, ELISA testlerinin duyarlılığı IgM için %71 (%95 GA=%54- 85), özgüllüğü %74 (%95 GA=%58-86); IgG için ise duyarlılık %97 (%95 GA=%85-100), özgüllük %55 (%95 GA=%39-75) bulunmuştur.
Ertek ve arkadaşlarının (80) çalışmasında, ELISA kiti (Novum, Almanya) ile Brucella’ya özgü IgG ve IgM antikorları test edilmiştir. Çalışma sonucunda ELISA testlerinin duyarlılıkları ve özgüllükleri sırasıyla IgM için %100 (%95 GA=%89-100) ve %85 (%95 GA=%62-97); IgG için %81 (%95 GA=%64-93) ve %95 (%95 GA=%75-100) bulunurken IgM + IgG için %75 (%95 GA=%57-89) ve %94 (%95 GA=%73-100) olarak tespit edilmiştir.
Memish ve arkadaşlarının (81) çalışmasında, ELISA testleri (Genzyme Virotech GmbH, Almanya) ile IgG ve IgM antikorları test edilmiş, test sonuçları pozitif veya negatif olarak kaydedilmiştir. Sınırda olan sonuçlar yeniden test edilip pozitif veya negatif olarak doğrulanmıştır. Çalışma sonucunda ELISA testlerinin duyarlılıkları ve özgüllükleri sırasıyla, IgM için %79 (%95 GA=%67-88) ve %100 (%95 GA=%95-100); IgG için %46 (%95 GA=%3-58) ve %97 (%95 GA=%90-100) bulunurken IgM+IgG için %94 (%95 GA=%85-98) ve %97 (%95 GA=%90-100) olarak tespit edilmiştir.
El-Hossain Aly Reda ve arkadaşlarının (77) çalışmasında, ELISA IgG testinde (Vircell SL, İspanya) B. abortus’un (S-99 suşu) LPS antijeni ile kaplanmış 96 oyuktan oluşan bir mikrotitre plakası kullanılmıştır. ELISA IgG testinin duyarlılığı %79 (%95 GA=%69-87), özgüllüğü %80 (%95 GA=%28-99) bulunmuştur.
Asaad ve Alqahtani’nin (82) çalışmasında, Nisan 2010-Eylül 2011 tarihleri arasında Suudi Arabistan’ın Najran ilinde King Khalid Hastanesi’nde takipli 340 bruselloz şüpheli hasta değerlendirilmiştir. Hastalar semptom süresine göre; akut (<2 ay) (n=180), subakut (2-12 ay) (n=110), kronik (>1 yıl) (n=50) olarak üç gruba ayrılmış ve kontrol grubu olarak 110 sağlıklı kan donörü seçilmiştir. Çalışma tasarımında referans test olarak kültür pozitifliği, STA pozitifliği veya ELISA pozitifliği alınmış olmakla birlikte yapmış olduğumuz meta-analizinde ELISA testlerinin performansını belirlemek için kültür pozitifliği ile kesin bruselloz olan 50 hasta dahil edilmiştir. Kan kültürleri, bifazik kan kültürü ortamı (bioMérieux, Fransa) kullanılarak 30 gün boyunca %5-10 karbondioksit atmosferinde 37°C’de inkübe edilmiş, alt kültürleme haftalık olarak yapılmış ve şüpheli koloniler standart tekniklere göre tanımlanmıştır. ELISA testi (Genzyme Virotech, Almanya) için >11 Virotech “unite” (VE) pozitif kabul edilmiştir. ELISA testlerinin duyarlılıkları ve özgüllükleri sırasıyla, IgM için %84 (%95 GA= %71-93) ve %99 (%95 GA=%97-100); IgG için ise %96 (%95 GA=%86-100) ve %99 (%95 GA=%97-100) olarak bulunmuştur.
Arabacı ve Oldacay’ın (78) yukarıda belirtilen çalışmasında, ELISA IgM ve IgG testlerinde (Vircell SL, İspanya) eşik değerler sırasıyla, 20 U ve 30 U alınmıştır. Araştırmacılar ELISA testlerinin duyarlılıkları ve özgüllüklerini sırasıyla, IgM için %50 (%95 GA=%41-85) ve %100 (%95 GA=%97-100); IgG için %66 (%95 GA=%57-74) ve %99 (%95 GA=%95-100); IgM + IgG için ise %34 (%95 GA=%26-43) ve %100 (%95 GA=%97- 100) olarak bulmuşlardır. Aynı çalışmada referans test olarak yalnız kültür pozitif olgular alınıp alt analiz yapıldığında ise ELISA testlerinin duyarlılıkları ve özgüllükleri sırasıyla IgM için %89 (%95 GA=%52-100) ve %100 (%95 GA=%97-100); IgG için %89 (%95 GA=%52-100) ve %99 (%95 GA=%95-100) olarak hesaplanmıştır.
Sırmatel ve arkadaşlarının (75) çalışmasında, ELISA testlerinin duyarlılıkları ve özgüllükleri sırasıyla, IgM için %49 (%95 GA=%42-57) ve %100 (%95 GA=%83-100); IgG için %62 (%95 GA=%55-68) ve %100 (%95 GA=%83-100) olarak hesaplanmıştır. Aynı çalışmada referans test olarak yalnız kültür pozitif olgular alınıp alt analiz yapıldığında ise ELISA testlerinin duyarlılıkları ve özgüllükleri sırasıyla, IgM için %62 (%95 GA=%38- 82) ve %100 (%95 GA=%83-100); IgG için %86 (%95 GA=%64-97) ve %100 (%95 GA=%83-100) olarak hesaplanmıştır.
Vrioni ve arkadaşları (76), ELISA testlerinin duyarlılıkları ve özgüllüklerini sırasıyla, IgM için %62 (%95 GA=%55-68) ve %100 (%95 GA=93-100); IgG için %91 (%95 GA=%86-94) ve %100 (%95 GA= %93-100); IgM + IgG için ise %99 (%95 GA=%96-100) ve %100 (%95 GA=%93-100) olarak bulmuşlardır. (Bkz. Ek Şekil 13-16 ve Ek Tablo 1, 6, 7)
Öneri Gerekçesi: Duyarlılığın RB ve STA testlerinden daha düşük olması, testin çalışılması için cihaz ve kit gereksinimi, daha maliyetli olması gerekçeleriyle ilk basamak tanıda kullanımı önerilmemiştir.
Bilgi açığı: Analize dahil edilen çalışmalarda kullanılan ELISA kitleri farklıdır. ELISA sonuçları için eşik değerler bazı çalışmalarda belirtilmemiştir. Belirtilen çalışmalarda ise farklı değerler eşik değer olarak alınmıştır. Çalışmaların çoğunda brusellozun klinik tanımları (akut-kronik-relaps) yapılmamıştır. ELISA testlerinin performanslarını daha iyi değerlendirebilmek için; prospektif, yeterli örneklem büyüklüğüne sahip, akut-kronik ve relaps tanımlarının iyi tariflendiği, aynı ELISA kitlerinin kullanıldığı, eşik değerlerin net belirlendiği çalışmalara ihtiyaç vardır.
4- Brusellozdan kuşkulanılan hastalarda polimeraz zincir reaksiyonu (PCR) temelli testlerin tanıdaki yeri nedir?
Öneri: Bruselloz tanısında PCR temelli testlerin duyarlılık ve özgüllüğü yüksektir. Bununla birlikte pahalı olmaları, deneyimli personel ve teknik donanım gerektirmeleri nedeniyle ilk aşamada tanı testi olarak kullanımı önerilmez. Wright STA test sonucu negatif çıkmasına rağmen klinik kuşkunun devam ettiği hastalarda ve kültür sonucunun beklenmesinin tanı ve tedaviyi geciktirerek hastada olumsuz sonuçlara yol açabileceği düşünüldüğü durumlarda bruselloz tanısı koymak için PCR temelli testlerin kullanımı önerilir (Düşük kanıt düzeyi, güçlü öneri).
Kanıtların Özeti: Öneri ile iligili kanıtlar, bruselloz tanısında PCR testinin duyarlılık ve özgüllüğünün araştırıldığı 11 kesitsel çalışmanın meta-analizine dayanmaktadır. Dahil edilen çalışmalarda referans test olarak ikisinde (74,83) kültür pozitifliği, üçünde (77,84,85) STA pozitifliği, dördünde (65,68,72,73) kültür ve/veya STA pozitifliği, ikisinde ise (63,75) kültür ve/veya STA pozitifliği veya titre artışı alınmıştır. Meta-analizine tüm çalışmalar (n=3067) dahil edildiğinde PCR testinin duyarlılığı %93 (%95 GA=%75-98) ve özgüllüğü %98 (%95 GA= %92-99) bulunmuştur.
Alvarez Ojeda ve arkadaşları (83), Meksika’da 2015 yılında yürüttükleri çalışmaya farklı ekonomik koşullara sahip olan brusellozu düşündüren semptomu bulunan kişiler ile semptomu olmayan ancak brusellozlu hastalarla birlikte yaşayan 92 kişiyi dahil etmiştir. Araştırmacılar bu çalışmada, RB, STA, 2-merkaptoetanol (2-ME) ve kültür pozitif olgularda PCR testinin duyarlılık ve özgüllüğünü ayrı ayrı hesaplamıştır. Brucella abortus’un dış zarının immünojenik 31 KDa proteinini kodlayan genin (BCSP31: Brucella cinsine özgüdür ve B. abortus, B. melitensis ve B. suis’te korunur) bir kısmını çoğaltan primerler kullanılmıştır [B4 (5’-TGGCTC GGTTGCCAATATCAA-3’) ve B5 (5’-CGCGCTTG CCTTTCAGGTCTG-3’) sekansları]. Bu çalışmada yer alan 31 hastaya ait STA verileri, STA eşik değeri bizim rehber çalışmamızda kabul ettiğimiz ≥1/160 yerine ≥1/80 olarak alındığı için analize dahil edilmedi. PCR ürünlerinin miktarının ELISA ile ölçüldüğü PCR-ELISA testi ile bruselloz kabul edilen 92 olgu arasında kültür pozitif olan altı kişi analize dahil edilerek hesaplandığında PCR testinin duyarlılığı %100 (%95 GA=%54-100) ve özgüllüğü %80 (%95 GA=%70-88) bulundu.
Purwar ve arkadaşlarının (74) çalışmasında, BMEI1162’nin aşağı yönündeki IS711 gen bölgesi (Gen bankası erişim numarası: NC_003317) DNA amplifikasyonu için hedef olarak kullanılmıştır; primerler, 279bp amplifikasyon ürünü veren ileri primer (5’AAC AAG CGG CAC CCC TAA AA3’) ve revers primer (5’CAT GCG CTA TGA TCT GGT TACG3’)’dir. Testin duyarlılığı %100 (%95 GA=%83-100) iken özgüllüğü %97 (%95 GA=%95-98) bulunmuştur.
El-Hossain Aly Reda ve arkadaşlarının (77) çalışmasında, tüm Brucella türlerinin DNA’sını belirleyebilmek üzere PrimerDesignTMgenesigkit ve oasigTaqMan 2x qPCRMastermix kullanılmış ve tek basamaklı Applied Biosystem cihazında kantitatif gerçek zamanlı PCR yapılmıştır. Çalışmada PCR testinin duyarlılığı %65 (%95 GA=%55-75), özgüllüğü ise %40 (%95 GA=%5-85) bulunmuştur.
Khodabakhshi ve arkadaşlarının (84) 2019 yılında İran’da yaptıkları çalışmaya, Golestan Üniversitesi Tıp Fakültesi’nde takipli 65 ateşli ve bruselloz şüpheli hasta dahil edilmiştir. Standart tüp aglütinasyon testinin referans test olarak alındığı bu çalışmada, 29 hastada bruselloz doğrulanmış olup 36 hastada dışlanmıştır. Kan örneklerinden DNA ekstraksiyonu, ticari bir DNA kan ekstraksiyon kiti (Stratech, İngiltere) ile üreticinin talimatlarına göre yapılmıştır. Primerler olarak, BCSP31 geni, 223bp amplifikasyon ürünü veren ileri primer (5’ TGG CTC GGT TGC CAA TAT CAA3’) ve revers primer (5’CGC GCT TGC CTT TCA GGT CTG3’) kullanılmıştır. Prob olarak ise FAM -ACGGGCGCAATCT -MGB -NFQ kullanılmıştır. Araştırmacılar bu çalışmada PCR testinin duyarlılığını %55 (%95 GA=%36-74), özgüllüğünü ise %83 (%95 GA=%67-94) bulmuştur.
Kuila ve arkadaşlarının (85) çalışmasında, Hindistan’ın Batı Bengal eyaletinde bulunan Peerless Hastanesi ve B.K. Roy Araştırma Merkezi’ne başvuran 2088 ateşli hasta değerlendirmeye alınmıştır. Dahil edilme kriteri olarak hastaların en az üç haftadır olan ateş yüksekliği ve odak bulunamamış olması kabul edilmiştir. Bu hastaların 385’inde STA referans alındığında bruselloz tanısı doğrulanırken 1703’ünde dışlanmıştır. Serum örneklerinden genomik DNA ekstraksiyonu Qiagen kan mini kiti (Qiagen, Almanya) ile yapılmıştır. Kullanılan primerler, BCSP-B4(F)-TGG CTC GGT TGC CAA TAT CAA ve BCSP-B5(R)-CGC GCT TGC CTT TCA GGT CTG’dir. Araştırmacılar bu çalışmada PCR testinin duyarlılığını %22 (%95 GA=%18-26), özgüllüğünü ise %100 (%95 GA=%99-100) bulmuştur.
Asaad ve Alqahtani’nin (82) çalışmasında, PCR testi ile Brucella spp.’ye özgü 31-kDa zar proteininin üretimini kodlayan gen içindeki 223-bp’lik bir hedef dizinin tespiti için, spesifik primerler [ileri primer: 5’-TGGCTCGGTTGCCAATATCAA-3’ ve revers primer: 5’- CGCGCTTGCCTTTCAGGTCTG-3’ (Qiagen, ABD)] ve Brucella DNA izolasyonu için E.Z.N.A. ticari kiti (Omega Biotech, ABD) kullanılmıştır. Bu çalışma ile PCR testinin duyarlılığı %76 (%95 GA=%62-87), özgüllüğü ise %100 (%95 GA=%99-100) bulunmuştur.
Çeken ve arkadaşlarının (79) çalışmasında, PCR için DNA örnekleri hasta lökositlerinden elde edilmiştir. Taze kandan lökosit izolasyonu için ficoll (PAA Laboratories GmbH, Avusturya) kullanılmıştır. DNA, DZ DNA izolasyon kiti (Dr. Zeydanlı, Türkiye) kullanılarak fenol kloroform yöntemi ile izole edilmiştir. Brucella abortus’un 31 kDa’luk antijenini kodlayan genin 223 baz çiftlik bölgesinin çoğaltılması için B4 (5’-TGG CTC GGT TGC CAA TAT CAA-3’) (ileri primer) ve B5 (5’-CGC GCT TGC CTT TCA GGT CTG-3’) (revers primer) primerleri (MWG, Almanya) kullanılmıştır. Çalışmada PCR testinin duyarlılığı %97 (%95 GA=%85-100), özgüllüğü ise %100 (%95 GA=%83-100) bulunmuştur.
Morata ve arkadaşları (86), Ocak 1999-Aralık 2001 tarihleri arasında İspanya’nın Malaga ilinde, 57 aktif bruselloz tanılı hastaya ait 59 kan örneğini incelemiştir. Aynı çalışmada, başka sebebe bağlı 30 ateşli hasta, daha önce bruselloz tedavisi alan ve aktif yakınması olmayan 41 hasta, mesleksel bruselloz maruziyeti olup yüksek brusella antikorları olan asemptomatik 14 hasta ve 28 sağlıklı kan donorü olmak üzere toplamda 113 kişi kontrol grubu olarak değerlendirmeye alınmıştır. Çalışma kapsamında, PCR-ELISA yönteminin tanıdaki yeri araştırılmıştır. Brucella cinsinin tüm biyovarlarında bulunan, 31 kDa büyüklüğünde B. abortus’un immünojenik bir zar proteinini kodlayan genin korunmuş bölgesinden 223-bp’lik bir fragman amplifiye edilmiş olup bir çift 21 nükleotid primeri, B4 (5’-TGG CTC GGT TGC CAA TAT CAA 3’) ve B5 (5’-CGC GCT TGC CTT TCA GGT CTG 3’) (Amersham Pharmacia Biotech, İspanya), amplifikasyon işleminde kullanılmıştır. PCR testinin duyarlılığı %95 (%95 GA=%86-99), özgüllüğü ise %96 (%95 GA=%90-99) bulunmuştur.
Sürücüoğlu ve arkadaşlarının (87) 2009’da yayımlanan çalışmasında, 24 aylık dönemde Atatürk Eğitim ve Araştırma Hastanesi ile Celal Bayar Üniversitesi Tıp Fakültesi Hastanesi’nde takipli 50 bruselloz hastası ve 30 sağlıklı kan donörü çalışmaya dahil edilmiştir. Farklı klinik formlardaki brusellozlu hastalarda hızlı tanıda geçek zamanlı PCR yöntemi konvansiyonel yöntemler ile karşılaştırılmıştır. Araştırmacılar bu çalışmada, PCR testinin duyarlılığını %88 (%95 GA=%76-95), özgüllüğünü ise %100 (%95 GA=%88-100) bulmuştur.
Mitka ve arkadaşlarının (88) 2007 yılında yayımlanan çalışmasında, 1998-2004 yılları arasında Yunanistan’ın Selanik kentinde infeksiyon hastalıkları hastanesinde bruselloz tanısı ile takipli 200 hastaya ait 4926 kan örneği (1642 periferal tam kan, 1642 “buffy coat” örneği ve 1642 serum örneği) çalışma grubuna alınmıştır. Kontrol grubu olarak, 50 sağlıklı kontrol, 50 bakteriyel infeksiyonu (Salmonella, Yersinia, E. coli, Enterobacter aerogenes, Klebsiella pneumoniae, H. influenzae ve Pseudomonas aeruginosa) olan hasta belirlenmiştir. Bu çalışmada akut ve relaps brusellozun hızlı tanısında dört farklı PCR metodu kültür ve serolojik testler ile karşılaştırılmıştır. Birinci PCR yönteminde 223-bp’lik bir fragmanı amplifiye eden, B4 (5’-TGG CTC GGT TGC CAA TAT CAA 3’) ve B5 (5’-CGC GCT TGC CTT TCA GGT CTG 3’) primerleri kullanılmıştır. İkinci PCR yönteminde amp2 gen bölgesininin 193 bp’lik parçasını amplifiye eden JPF (5’-GCG CTC AGG CTG CCG ACG CAA 3’) ve JPR (5’-ACC AGC CAT TGC GGT CGG TA 3’) kullanılmıştır. Üçüncü yöntemde ise aynı gen bölgesinin 282 pb’lik fragmanını kodlayan P1 (5’-TGG AGG TCA GAA ATG AAC 3’) ve P2 (5’-GAG TGC GAA ACG AGC GC 3’) primerleri kullanılmıştır. Dördüncü PCR yönteminde ise pb26 gen bölgesinin 1029 bp’lik alanını amplifiye eden 26A (5’-GCC CCT GAC ATA ACC CGC TT 3’) ve 26B (5’-GAG CGT GAC ATT TGC CGA TA 3’) primerleri kullanılmıştır. Bu çalışmada tüm PCR testlerinde duyarlılık %95.5-100 iken özgüllük %100 olarak bulunmuştur. Analize dahil edilen diğer çalışmalarda çoğunlukla B4 ve B5 primerleri kullanıldığı için son analize birinci PCR yönteminin serumda çalışılmış sonuçları dahil edildiğinde; duyarlılık %100 (%95 GA=%98-100), özgüllük %100 (%95 GA=%98-100) bulunmuştur.
Vrioni ve arkadaşlarının (76) 2004 yılında yayımlanan çalışmasında, PCR ürünlerinin miktarının ELISA ile ölçüldüğü PCR-ELISA testinin tanısal değeri araştırılmıştır. Primerler olarak B4 (5’- TGG CTC GGT TGC CAA TAT CAA 3’) ve B5 (5’-CGC GCT TGC CTT TCA GGT CTG 3’) (MWG-Biotech, Almanya) kullanılmıştır. Bu çalışmada duyarlılık %99 (%95 GA=%97%-100), özgüllük %100 (%95 GA= %93-100) bulunmuştur. (Bkz. Ek Şekil 17, 18 ve Ek Tablo 1, 8, 9)
Öneri Gerekçesi: Testin çalışılması için deneyimli personel ve ekipman gereksinimi, oldukça maliyetli olması, aglütinasyon testlerinin en az PCR kadar duyarlı olması gibi sebeplerle ilk basamak tanıda kullanımı önerilmemiştir.
Bilgi Açığı: PCR testinde kullanılan primerlerin ve yöntemlerin aynı olduğu daha fazla sayıda çalışmaya ihtiyaç vardır.
5- Nörobruselloz tanısında hangi tanısal testler tercih edilmelidir?
Öneri: Nörobrusellozdan kuşkulanılan hastalarda kesin tanı için, BOS’ta hücre sayımı, protein ve glukoz ölçümleri, kan ve BOS kültürü, serum ve BOS’ta Wright STA testi ve/veya Coombs’lu Wright STA testlerinin hepsinin bir arada yapılması önerilir (Çok düşük kanıt düzeyi, güçlü öneri).
Az sayıda doğrulanmış nörobruselloz tanısı alan olgudan elde edilen verilerde, BOS’ta ELISA ile Brucella spp. IgM ve/veya IgG bakılmasının, BOS Wright STA testine kıyasla daha duyarlı olduğu görüldüğünden, ulaşılabilen yerlerde BOS’ta Wright STA yerine BOS’ta ELISA IgM/IgG testinin tercih edilmesi düşünülebilir (Çok düşük kanıt düzeyi, zayıf öneri).
Kanıtların Özeti: Nörobruselloz tanısı alan ve tanı için kullanılmış testlerin belirtildiği toplam 1022 olgu içeren yayınla (33-54, 89-210) yaptığımız sistematik derleme ve IPD meta-analizinde, nörobruselloz tanısında, altın standart tanı testi olan BOS kültürü pozitifliğinin çok düşük oranda belirlendiği ve bu testin nörobruselloz tanısındaki duyarlılığının %18.4 olduğu görülmüştür. Nörobruselloz tanısında en sık kullanılan testlerin, Brucella antikorlarını saptayan BOS’ta STA ve Coombs’lu STA testi olduğu görülmüştür. BOS’ta RB testi, çalışılan olguların %57.3’ünde, BOS’ta STA testi ise çalışılan olguların %69.06’unda pozitif saptanmıştır. Ancak incelenen çalışmalarda BOS aglütinasyon testinde pozitif titre düzeyi için farklı eşik değerler kullanılmıştır ve bir fikir birliği bulunmamaktadır. Çalışmaların çoğunda herhangi bir titrede bulunan pozitif sonuç, tanı için yeterli kabul edilmiştir. Ancak alt sınır olarak 1/4-1/80 gibi farklı eşik değerler alınıp, herhangi bir titrede saptanan pozitifliğin anlamlı kabul edildiği belirtilmiştir (33-43, 89-94). Guven ve arkadaşlarının (33) çalışmasında, BOS’ta aglütinasyon testinin pozitif eşik değeri 1:8 olarak alındığında; duyarlılık %94 (%95 GA= %83-99), özgüllük %96 (%95 GA= %89-99), pozitif prediktif değeri %94 (%95 GA= %83-99) ve negatif prediktif değeri %96 (%95 GA=%89-99) olduğu belirtilmiştir. BOS’ta yapılan antikor testlerinin pozitif sonucu, serumdaki IgG’nin spontan difüzyonuna bağlı olabileceğinden, kesin olarak intratekal IgG sentezi olduğunu göstermemektedir (92). Nöroborelyoz tanısında, BOS/serum antikor indeksinin belirlenmesi için, valide edilmiş metodoloji kullanılarak ve eşzamanlı olarak BOS ve serum numunelerinin alınması önerilmektedir (211). Brusellozda nörolojik tutulumun doğrulanması için nöroborelyozda olduğu gibi BOS’ta herhangi bir titrede aglütinasyon testi pozitifliği yerine BOS/serum antikor indeksi kullanılmasının gerekip gerekmediğini araştıran çalışmalara ihtiyaç vardır.
Beyin ve omurilik sıvısı kültür ve STA testi sonuçları tek tek sunulan olgu raporları ve çalışmalar değerlendirilerek, BOS kültürü pozitif olan hastalarda Wright STA ve ELISA testlerinin duyarlılığını tanımlamak üzere alt grup analizi yapıldı. BOS kültüründe üremesi olan ve BOS’ta STA çalışılan 84 olgunun 64 (%76.2)’ünde STA pozitifliği saptandı. Ancak yukarıda da belirtildiği gibi bu olgu raporu ve çalışmalarda kabul edilen pozitif eşik değer farklılık göstermektedir. Sınır değer olarak 1/4 titre üzerindeki pozitifliklerin kabul edildiği çalışmalar (33,36,38,40,41,89,94,95,99,100,108,117,124,127,138,151,157,160,162,165,171,176,182,185,187,190,199,204,206) değerlendirildiğindeyse 52 BOS kültürü pozitif hastanın 41 (%78.8)’inde STA’ın pozitif olduğu görüldü. BOS kültüründe üremesi olan ve BOS’ta ELISA ile Brucella spp. antikorları bakılmış toplam 20 hastanın 19 (%95)’unda IgM ve/veya IgG pozitifliği saptanmıştır. Nörobruselloz olmayan hastaların BOS’unun incelenmesi mümkün olmadığı için kullanılan testlerin özgüllükleri belirlenememiştir.
Beyin ve omurilik sıvısı’nda ELISA ile IgM ve/veya IgG testi, bakılan olguların %91.6’sında pozitif saptanmıştır. Serum ve BOS’ta IFA ve kompleman fiksasyon testi çalışılan az sayıda olgu bulunmaktadır. Aynı şekilde serum ve BOS’ta PCR ile Brucella DNA veya 16S rRNA’yı değerlendiren yeterli sayıda hasta bildirimi bulunmamaktadır. Yeni nesil dizileme [Next-generation sequencing (NGS)] ile BOS’ta Brucella DNA bakılan altı olgunun tamamında pozitiflik saptanmıştır (96-98). Bu test umut vaat etmekle birlikte diğer testlerle karşılaştırılarak yapılan ve daha fazla sayıda olgu içeren çalışmalara ihtiyaç bulunmaktadır.
Nörobrusellozlu olguların BOS’unda lenfositoz, protein yüksekliği, glukoz düşüklüğü görülebilmektedir. Gerçekleştirmiş olduğumuz sistematik derleme ve analizde nörobruselloz olgularının BOS’unda ortalama 156 lökosit görülmüş, BOS lökosit sayısı olguların %87’sinde ml’de >5 hücre olarak bulunmuştur. Aynı analizde BOS ortalama protein düzeyi 211.7 mg/dl olup BOS proteini olguların %85.3’ünde ≥45 mg/dl, BOS glukozu olguların %56.8’inde <45 mg/dl, BOS/kan glukozu ortalaması 0.36 ve BOS/kan glukozu olguların %53’ünde <0.4 bulunmuştur.
Nörobruselloz tanısı alan olguların 444’üne kraniyal BT veya MRI çekilmiştir. Bu görüntülemelerde 220 olgu (%49.5)’da anormal bulgu saptanmıştır. (Bkz. Ek Tablo 10).
Önerilerin Gerekçesi: Nörobruselloz tanısında kullanılan klasik testlerin hiçbirinin duyarlılığı %100 olmadığı gibi, bu testlerin nörobruselloz tanısındaki özgüllüğünü araştıran çalışma da bulunamamıştır. Var olan sınırlı verilerle yaptığımız sistemetik derleme ve IPD meta-analizinin sonucunda; nörobrusellozdan şüphelenilen olguların tanısında, hastalığın ağırlığı ve neden olabileceği morbidite ve mortaliteler de dikkate alındığında, yeterli duyarlılık ve özgüllüğe sahip diğer bir test belirleninceye kadar, BOS’ta hücre sayımı ve biyokimyasal inceleme, kan ve BOS kültürü, Wright STA testi ve/veya Coombs’lu brusella aglütinasyon testleri veya BOS’ta ELISA ile Brucella spp. IgG ve IgM testlerinin tümünün bir arada yapılmasının gerekli olduğu düşünülmüştür. Ayrıca BOS’ta Brucella spp. üremesiyle nörobruselloz tanısı almış sınırlı sayıdaki kanıtlı nörobruselloz olgusunda, Wright STA yerine ELISA ile BOS’ta Brucella spp. IgM ve/veya IgG bakılması halinde daha yüksek oranda pozitiflik belirlendiği (%95’e karşılık %78.8) için, ulaşılabilen yerlerde BOS’ta STA yerine ELISA ile Brucella spp. IgG ve/veya IgM temelli testlerin tercih edilebileceği düşünülmüştür.
Bilgi Açığı: Brusellozda nörolojik tutulumun doğrulanması için nöroborelyoz tanısında olduğu gibi BOS’ta herhangi bir titrede aglütinasyon testi pozitifliği yerine BOS/serum antikor indeksi kullanılmasının gerekip gerekmediğini araştıran çalışmalara ihtiyaç bulunmaktadır.
Altın standart tanı testi olan BOS kültürü ile BOS Wright/Coombs’lu Brucella aglütinasyon testi, ELISA, IFA ve PCR testlerini karşılaştıran, duyarlılık ve özgüllük bildirebilecek şekilde tasarlanmış çalışmalara ihtiyaç bulunmaktadır.
6- Bruselloz tedavisinde altı haftalık tedavi süresi dört haftalık tedavi süresinden üstün müdür?
Öneri: Komplike bruselloz olgularının (endokardit, nörobruselloz ve spondilit) dışlanarak bruselloz tedavi süresinin karşılaştırıldığı çalışmaların meta-analizinde, dört haftalık rejimlerle karşılaştırıldığında, altı haftalık antimikrobiyal tedavilerle relaps gelişme riski daha düşük bulunmuştur. Akut bruselloz tanısı konulan hastalarda altı haftalık tedavi kullanılması önerilir (Düşük kanıt düzeyi, güçlü öneri).
Kanıtların Özeti:
Etkinlik
Öneri ile ilgili kanıtlar, akut brusellozda dört hafta ile altı hafta süren tedavileri karşılaştıran randomize kontrollü çalışmaların meta-analizine dayanmaktadır. Konu ile ilgili yayınlanmış altı randomize kontrollü çalışmaya ulaşılmıştır (212-217). Çalışmaların tamamında, toplam 613 hastada tedavi rejimlerinin relaps gelişimine etkisi, dört çalışmada (213,214,216,217) toplam 438 hastada tedavi başarısızlığına etkisi değerlendirilmiştir. Çalışmalar arasında relaps gelişimi için takip süreleri değişken olup, üç çalışmada 12 ay (212,214,216), iki çalışmada altı ay (213,217), bir çalışmada ise üç aydır (215). Çalışmaların üçünde komplike ve uzun tedavi gerektiren hastalar (nörobruselloz, endokardit ve spondilit) dışlanırken (212,216,217), diğer üç çalışmada bu hastalar dahil edilmiştir (213-215). Komplike ve uzun tedavi gerektiren olguların dışlandığı çalışmalar değerlendirildiğinde dört haftalık tedaviler ile karşılaştırıldığında (n=433) ≥ 6 haftalık tedavilerde relaps gelişme riski düşük saptanmıştır [“risk ratio” (RR)=0.52, %95 GA=0.32-0.85; I2=38]. Tedavi başarısızlığı, komplike ve uzun tedavi gerektiren olguların dışlandığı 2 çalışmada toplam 287 hastada değerlendirilmiş ve her iki grup arasında anlamlı fark saptanmamıştır (RR=0.50, %95 GA=0.18-1.42; I2=0.0).
Hastaların büyük bir çoğunluğu iki farklı çalışmadan alınmıştır (212, 216). Solera ve arkadaşları (212) tarafından yapılan çalışma, randomize, çift kör ve çok merkezli olarak tasarlanmış, tedavi gerektiren komplike hastalar dışlanmış (spondilit) ve relaps için takip süresi 12 ay olarak belirlenmiştir. Çalışmada toplam 167 hasta randomize edilmiştir.; DOX-GEN kolunda yedi hasta, DOX-STREP kolunda ise beş hasta spondilit nedeniyle çalışmadan dışlanmıştır. DOX-GEN kolunda dört hastada, DOX-STREP kolunda ise beş hastada takip sürecine uyumsuzluk ve klinisyen isteği nedeniyle sonuç verilerine ulaşılamamıştır. Çalışmada, DOX (30 gün)-GEN (7 gün) (n=73) ile DOX (45 gün)-GEN (7 gün) (n=73) tedavi rejimleri toplam 146 hastada relaps açısından karşılaştırılmıştır. Relaps açısından her iki kol arasında istatistiksel farklılık saptanmamıştır (RR=0.60, %95 GA=0.28-1.28). Montejo ve arkadaşları (216), randomize, açık etiketli ve tek merkezli olarak yapılan çalışmalarında, altı farklı tedavi rejimini relaps ve tedavi başarısızlığı açısından karşılaştırmıştır. Çalışmada, relaps için takip süresi 12 ay olarak belirlenmiştir. Randomizasyon sonrası toplam 32 hasta [komplike olgular (n=21), tedavi ilaçlarına alerji (n=5), daha önce tedavi öyküsü (n=6)] çalışmadan dışlanmıştır. On üç hastada bir yıl değerlendirmesi yapılamamıştır. Meta-analizine, kombinasyon rejimleri alan hastalar dahil edilmiş, tek tedavi rejimi uygulanan hastalar [rejim 2 (n=64), rejim 3 (n=71)] değerlendirmeye alınmamıştır. Dört hafta tedavi rejimleri [DOX-RIF (rejim 1, 28 gün), n=65] ile ≥6 hafta tedavi rejimleri [DOX-STREP (rejim 4-6, 6 hafta), DOX-RIF (rejim 5-6, 6 hafta) (n=130)] karşılaştırılmıştır. Dört hafta tedavi rejimleri ile karşılaştırıldığında ≥6 hafta tedavi rejimleri düşük relaps gelişimi ile ilişkili iken (RR=0.32, %95 GA=0.15-0.70), tedavi başarısızlığı (RR=0.50, %95 GA=0.03-7.87) açısından her iki grup arasında anlamlı farklılık saptanmamıştır (216). (Bkz. Ek Şekil 19-21 ve Ek Tablo 11, 12)
Güvenlik
Üç çalışmada yer alan toplam 286 hastada, dört hafta ve ≥6 hafta tedavi rejimleri güvenlik açısından değerlendirilmiştir (212,214,215). Her iki grup arasında yan etki gelişimi açısından farklılık saptanmamıştır (RR=1.00, %95 GA=0.69-1.44). Hastaların büyük bir çoğunluğu Solera ve arkadaşları (212) tarafından yürütülen çalışmadan alınmıştır. Çalışmada dört hafta tedavi kolunda %40 (n=29), ≥ 6 hafta tedavi kolunda ise %38 (n=28) yan etki gelişimi saptanmıştır. Yan etkilerin tamamı ciddi olmayıp en sık saptananlar sırasıyla fototoksite (n=31) ve gastrointestinal yan etkilerdir (epigastrik ağrı, bulantı, kusma) (n=21). Her iki grup arasında yan etki gelişimi açısından fark saptanmamıştır (RR=0.97, %95 GA=0.64-1.45) (212). (Bkz. Ek Şekil 19-21 ve Ek Tablo 11, 12)
Öneri Gerekçesi: Komplike olmayan bruselloz olgularında dört hafta tedavi rejimleri ile karşılaştırıldığında altı hafta antibiyotik tedavisinin relaps gelişimini azaltmadaki etkinliği, daha uzun antibiyotik tedavisinin potansiyel zararlarından (yan etki) fazladır.
Bilgi Açığı: Çalışmalarda farklı tedavi kombinasyonları, homojen olmayan hasta gruplarında, değişken sonlanımlar açısından karşılaştırılmıştır. Çalışmaların pek çoğunda optimal örneklem büyüklükleri belirsizdir. Standart kombinasyon tedavi rejimlerini, homojen hasta gruplarında (komplike olmayan hastalar), standart sonlanımlar için (relaps, takip süreleri ve yan etki) karşılaştıran prospektif randomize çalışmalara ihtiyaç vardır.
7- Bruselloz tedavisinde doksisiklin + streptomisin kombinasyonu, doksisiklin + rifampisin kombinasyonundan üstün müdür?
Öneri: Akut bruselloz tanısı alan hastalarda tedavi rejimlerinin karşılaştırıldığı çalışmaların meta-analizinde DOX-STREP rejimi, DOX-RIF rejimine göre daha düşük tedavi başarısızlığı ve relapsla ilişkili bulunmuştur. Her iki tedavi rejimi arasında yan etki gelişimi açısından fark saptanmamıştır. Kullanım zorluğu ve uyum sorunu yaşamayacak akut bruselloz tanılı hastalarda öncelikle DOX-STREP kombinasyonunun kullanılması önerilir (Düşük kanıt düzeyi, zayıf öneri).
Kanıtların Özeti:
Etkinlik
Öneri ile ilgili kanıtlar, akut brusellozda DOX-RIF ve DOX-STREP tedavi rejimlerini karşılaştıran randomize kontrollü çalışmaların meta-analizine dayanmaktadır (213, 217-224). Meta-analizine, dokuz randomize kontrollü çalışma dahil edilmiş ve toplam 975 hastada tedavi rejimleri, relaps ve tedavi başarısızlığı açısından karşılaştırılmıştır. DOX-RIF ile karşılaştırıldığında DOX-STREP tedavi rejimi daha az tedavi başarısızlığı (RR=0.50, %95 GA=0.26-0.95) ve relaps (RR=0.36, %95 GA=0.23-0.56) gelişimi ile ilişkili bulunmuştur. Çalışmaların dördünde tedavi etkinliğini etkileyebilecek komplike olguların (nörobruselloz, endokardit, spondilit) dışlandığı (216,218,221,222), beş çalışmada ise komplike olguların dahil edildiği saptanmıştır (213,219,220,223,224). DOX-RIF ile karşılaştırıldığında DOX-STREP tedavi rejimi komplike olguların dahil edildiği çalışmalarda daha az tedavi başarısızlığı ile ilişkili iken (RR=0.41, %95 GA=0.19-0.90), komplike olguların dışlandığı çalışmalarda her iki rejim arasında tedavi başarısızlığı açısından fark saptanmamıştır (RR=2.56, %95 GA=0.60-10.95). Relaps gelişimi açısından karşılaştırıldığında komplike brusellozlu hastaların dahil edildiği (RR=0.37, %95 GA=0.20-0.69) ve edilmediği (RR=0.34, %95 GA=0.18-0.66) çalışmalarda DOX-STREP tedavi rejimi daha az relaps gelişimi ile ilişkili bulunmuştur. Relaps gelişimi için takip süresinin altı ay olduğu dört çalışmanın (RR=0.40, %95 GA=0.20-0.82) (213,218,220,221) ve 12 ay olduğu beş çalışmanın (RR=0.33, %95 GA=0.18-0.59) meta-analizi sonucuna göre (216,217,219,223,224) DOX-STREP rejimi DOX-RIF tedavi rejimine göre daha az relaps gelişimi ile ilişkilidir.
Meta-analizine dahil edilen hastaların büyük çoğunluğu üç çalışmadan alınmıştır (216,222,224). Montejo ve arkadaşları (216), randomize, açık etiketli ve tek merkezli çalışmada, altı farklı tedavi rejimini karşılaştırmıştır. Randomizasyon sonrası toplam 32 hasta [komplike olgular (n=21), tedavi ilaçlarına alerji (n=5), daha önce tedavi öyküsü (n=6) olanlar] çalışmadan dışlanmıştır. On üç hastanın da bir yıl değerlendirmesi yapılamamıştır. Meta-analizine kombinasyon rejimleri alan hastalar dahil edilmiş, DOX-RIF (rejim 1 ve 5, n=111 ve DOX-STREP (rejim 4 ve 6, n=84) tedavi rejimleri karşılaştırılmıştır. DOX-RIF ile karşılaştırıldığında DOX-STREP daha düşük relaps gelişimi ile ilişkili bulunmuş (RR=0.28, %95 GA=0.01-0.29), tedavi başarısızlığı açısından her iki rejim arasında fark saptanmamıştır (RR=0.26, %95 GA=0.01-5.42).
Solera ve arkadaşlarının (224) yürüttüğü randomize, açık etiketli, çok merkezli çalışmada, toplam 194 [DOX-RIF (n=100), DOX-STREP (n=94)] hasta randomize edilmiştir. Ancak etkin bir randomizasyon yöntemi kullanılmamıştır (tek sayılı yaşlara sahip hastalara DOX-RIF, çift sayılı yaşlara sahip hastalara DOX-STREP tedavisi başlanmıştır). Çalışmada komplike olgular dışlanmamış her iki kolda beş spondilit olgusu çalışmaya dahil edilmiştir. Relaps için takip süresi 12 ay olarak belirlenmiştir. Hastaların %86’sı (n=167) planlanan bir yıl takip süresini tamamlamıştır. DOX-RIF kolunda 13 (%13) hasta, DOX-STREP kolunda ise 14 (%15) hastada izlem süresi tamamlanamamıştır. Her iki grupta dört hasta ilaç yan etkisi ve uyumsuzluk nedeniyle çalışmadan dışlanmıştır. DOX-RIF ile karşılaştırıldığında DOX-STREP tedavi rejimi daha az relaps gelişimi ile ilişkili iken (RR=0.33, %95 GA=0.13-0.87), tedavi başarısızlığı açısından iki tedavi rejimi arasında farklılık saptanmamıştır (RR=0.27, %95 GA=0.06-1.22).
Hashemi ve arkadaşlarının (222) yürüttüğü randomize açık, tek merkezli çalışmada, toplam 219 hasta üç farklı tedavi grubuna [OFX-RIF (n=73), DOX-RIF (n=73), DOX-STREP (n=73)] randomize edilmiştir. Randomizasyon amacıyla rastgele sayılar tablosu kullanılmıştır. Çalışmada komplike bruselloz olguları (endokardit, spondilit, nörobruselloz), karaciğer ve böbrek yetmezliği olan hastalar ve son altı ay içerisinde bruselloz tedavisi alan hastalar dışlanmıştır. Relaps gelişimi için takip süresi altı ay olarak belirlenmiştir. Tedavi başarısızlığı DOX-RIF kolunda 62 hastada, DOX-STREP kolunda ise 65 hastada değerlendirilmiştir. DOX-RIF ile karşılaştırıldığında DOX-STREP tedavi rejimi daha az tedavi başarısızlığı ile ilişkilidir (RR=0.29, %95 GA=0.08-0.99). Relaps, DOX-RIF kolunda 59, DOX-STREP kolunda ise 65 hastada değerlendirilebilmiş ve her iki tedavi rejimi arasında fark saptanmamıştır (RR=0.32, %95 GA=0.09-1.12). (Bkz. Ek Şekil 22-24 ve Ek Tablo 13, 14)
Güvenlik
Öneri ile ilgili kanıtlar yedi randomize kontrollü çalışmadan toplam 748 hastanın meta-analizi ile elde edilmiştir. Tedavi kesilmesine veya değiştirilmesine neden olan ciddi yan etkiler değerlendirilmeye alınmıştır; DOX-RIF ve DOX-STREP tedavi rejimleri arasında yan etki gelişimi açısından istatistiksel bir fark saptanmamıştır (RR=0.50, %95 GA=0.13-1.93) (207-210,212,216,217).
Tedavi kesilmesine neden olan yan etki gelişimi açısından komplike bruselloz hastalarının dahil edildiği (RR=0.27, %95 GA=0.03-2.34) (195,201,205,206) ve edilmediği (RR=0.87, %95 GA=0.14-5.32) (220,223,224) çalışmalarda DOX-RIF ve DOX-STREP tedavi rejimleri arasında yan etki gelişimi için istatistiksel fark saptanmamıştır. Dört çalışmada her iki kolda hiçbir hastada tedavi kesilmesine neden olan yan etki gelişimi saptanmamıştır (213,219,222,223). Diğer üç çalışmada DOX-RIF kolunda altı, DOX-STREP kolunda ise iki hastada tedavi, yan etki nedeniyle kesilmiştir (218,221,224). Solera ve arkadaşlarının (224) çalışmasında, DOX-RIF kolunda iki hastada epigastrik ağrı, bulantı, kusma, ishal nedeniyle, bir hastada ise şiddetli alerjik reaksiyon ve bir hastada ise karaciğer enzimlerinde >5 kat artış olması nedeniyle; DOX-STREP kolunda ise bir hastada gastrointestinal şikayetler nedeniyle tedavi kesilmiştir. Ersoy ve arkadaşlarının (221) çalışmasında, DOX-RIF tedavisi alan iki hastada bulantı ve kusma nedeniyle tedavi kesilmiştir. Acocella ve arkadaşlarının (218) çalışmasında, DOX-STREP kolunda bir hastada vertigo nedeniyle tedavi kesilmiştir. (Bkz. Ek Şekil 22-24 ve Ek Tablo 13, 14)
Önerinin Gerekçesi: DOX-RIF rejimi ile karşılaştırıldığında relaps ve tedavi başarısızlığı açısından DOX-STREP rejimi daha etkin bulunmuştur. Ancak etkinlik kadar tedavinin uygulanma şekli ve hastanın tedaviye uyumunu etkileyecek faktörler de göz önünde bulundurulmalıdır. Streptomisin tedavisinin parenteral (intramüsküler) uygulanma zorunluluğu hastanın tedaviye uyumunu etkileyecek önemli bir faktördür.
Bilgi Açığı: Çalışmalarda örneklem sayılarının küçük olması tip 2 hata olasılıklarını artırmakta ve tedavi rejimlerinin sonuca etkisini değerlendirmeyi güçleştirmektedir. Çalışma popülasyonunun birden fazla tedavi grubuna randomize edilmesi de tedavi kollarındaki örneklemlerin daha da küçülmesine neden olmaktadır. Sonuç parametrelerinin ve özellikle relaps tanımlarının değişken olması sonuçların yorumlanmasını güçleştirmektedir. Homojen hasta gruplarında, aynı süreler ile uygulanan tedavi rejimlerini karşılaştıran ve standart sonlamın noktalarının tanımlandığı yüksek olgu sayısına sahip prospektif karşılaştırmalı randomize çalışmalara ihtiyaç vardır.
8- Bruselloz tedavisinde doksisiklin + streptomisin kombinasyonu, doksisiklin + gentamisin kombinasyonundan üstün müdür?
Öneri: Akut bruselloz tedavisinde DOX-STREP kombinasyonunun, DOX-GEN kombinasyonuna, tedavi başarısızlığı, relaps ve yan etki gelişimi açısından üstünlüğü yoktur. Tedavide DOX ile kombinasyonda STREP veya GEN önerilir (Orta kanıt düzeyi, güçlü öneri).
Kanıtların Özeti:
Etkinlik
Literatür taraması sonucunda DOX-STREP ve DOX-GEN kombinasyonlarının etkinliklerinin karşılaştırıldığı iki randomize kontrollü çalışma bulunmuştur ve 355 hastayı içeren bu iki çalışma tedavi başarısızlığı, relaps ve yan etki açısından meta-analizine dahil edilmiştir (225,226). Roushan ve arkadaşlarının (225) 2006 yılında yayımlanan çalışmasında, hastalar, bir grup DOX (45 gün) + STREP (14 gün), diğer grup ise DOX (45 gün) + GEN (7 gün) olacak şekilde iki gruba randomize edilmiş ve bir yıl süreyle takip edilmiştir. Her iki grupta 100’er hasta çalışmaya dahil edilmiş ancak takipten çıkan hastalar nedeniyle DOX-GEN grubunda 97, DOX-STREP grubunda ise 94 hastada analizler gerçekleştirilmiştir. Çalışmaya, sakroiliit ve periferal artrit tanıları olan hastalar dahil edilmiş olmasına rağmen, spondilit veya nörobruselloz gibi komplikasyonu olan hastalar alınmamıştır. Hastalık semptomlarının başlangıcından tanı anına kadar geçen süreye göre değerlendirildiğinde çalışmaya alınan hastaların DOX-GEN grubunda 73 (%75.3)’ü, DOX-STREP grubunda ise 81 (%86.2)’i akut (<2 ay) olgulardan oluşmaktadır. Geri kalan hastalar arasında subakut (2 ay-1 yıl) ve kronik (>1 yıl) olgular da mevcuttur.
Meta-analizine dahil edilen ve Roushan ve arkadaşları (226) tarafından 2010 yılında yayımlanan diğer çalışmada, hastalar, bir grup DOX (45 gün) + STREP (14 gün), diğer grup ise DOX (8 hafta) + GEN (5 gün) olacak şekilde iki gruba randomize edilmiş ve bir yıl süreyle takip edilmiştir. Her iki gruba 82 hasta alınmış ve analizler bu hastaların tamamı üzerinden yapılmıştır. Çalışmaya, sakroiliit ve periferal artrit tanıları olan hastalar dahil edilmiş olmasına rağmen, spondilit veya nörobruselloz gibi komplikasyonu olan hastalar alınmamıştır.
Meta-analizi sonucunda akut bruselloz tedavisinde DOX-STREP kombinasyonunun, tedavi başarısızlığı (RR=2.03, %95 GA=0.62-6.62) ve relaps açısından (RR=1.62, %95 GA=0.54-4.88) DOX-GEN kombinasyonundan üstün olmadığı bulunmuştur. (Bkz. Ek Şekil 25-27 ve Ek Tablo 15, 16)
Güvenlik
Yan etki gelişimi açısından çalışmalar değerlendirildiğinde tedavi kesmeyi gerektirecek düzeyde yan etki gelişimi sadece bir çalışmada (226) bildirildiği için meta-analizi sadece bu çalışma ile yapılmıştır. Akut bruselloz tedavisinde DOX-STREP kombinasyonunun, DOX-GEN kombinasyonundan, tedavi kesmeyi gerektirecek düzeyde yan etki gelişmesi açısından üstün olmadığı bulunmuştur (RR=2.03, %95 GA=0.62-6.62). (Bkz. Ek Şekil 25-27 ve Ek Tablo 15, 16)
Öneri Gerekçesi: Streptomisin, bruselloz tedavisinde 14-21 gün kullanılan bir aminoglikoziddir. Gentamisin, kullanım süresi STREP’e göre daha kısa süreli olduğundan (5-7 gün) hasta uyumunu artırabileceği, ayrıca potansiyel yan etkiler açısından daha az riske sahip olacağı için tedavide tercih edilebilir.
Bilgi Açığı: Akut bruselloz tedavisinde DOX-STREP ve DOX-GEN kombinasyonlarının etkinlik ve güvenliğinin araştırıldığı aynı merkezden çıkan sadece iki randomize kontrollü çalışma bulunmaktadır. Bu çalışmalarda körlemenin yapılmamış olması ve açık etiketli olmaları yanlılık riskini artıran faktörler olarak karşımıza çıkmaktadır. Ayrıca her iki çalışmada GEN farklı sürelerde (5 veya 7 gün) hastalara uygulanmıştır. Sabit sürelerde GEN uygulanan, farklı merkezlerce yürütülmüş ve körlemenin yapıldığı randomize kontrollü çalışmalara ihtiyaç vardır.
9- Bruselloz tedavisinde kinolon grubu antimikrobik içeren kombinasyonlar, kinolon içermeyen kombinasyonlardan üstün müdür?
Öneri: Akut bruselloz tedavi rejimlerini karşılaştıran çalışmaların meta-analizinde, kinolon grubu antimikrobikleri içeren kombinasyonların, içermeyen kombinasyonlara göre, tedavi başarısızlığı, relaps ve yan etki gelişimi açısından üstün olmadığı görülmüştür. Ek olarak kinolon grubu antimikrobiklerle ilgili son yıllarda artan güvenlik endişeleri nedeniyle, akut bruselloz tedavisinde kinolon grubu antimikrobik içeren kombinasyonların öncelikle tercih edilmemesi önerilir. Bruselloz tedavisinde kinolonların, sadece ilk seçenek ilaçların (DOX, RIF, GEN, STREP) yan etki, ilaç etkileşimi gibi herhangi bir nedenle kullanılamadığı durumlarda, kombinasyonun bir bileşeni olarak düşünülmesi önerilir (Çok düşük kanıt düzeyi, güçlü öneri).
Kanıtların Özeti:
Etkinlik
Kinolon içeren ve içermeyen kombinasyonların karşılaştırıldığı toplamda 11 klinik çalışma değerlendirilmiştir (214,215,221,222,227-233). Söz konusu çalışmalardan üçü (230-232) randomize kontrollü olmayıp gözlemsel çalışma niteliğindedir. Bir çalışma (233) İngilizce dilinde yayımlanmamış olup sadece İngilizce özet bölümü vardır. Bu nedenle araştırma sorusunun yanıtlanması için meta-analizine yedi randomize kontrollü çalışma (214,215,221,222, 227-229) dahil edilmiştir. Makalelerin hepsinde yanlılık riski yüksek tespit edilmiştir. Çalışmaların çoğunda menenjit, endokardit, spondilit gibi brusellozun komplikasyonu olan hastalar çalışma dışı tutulmuş olmasına rağmen bir çalışmada (227) her bir grupta dokuzar spondilit, kalça veya diz artriti içeren hasta olduğu, bir diğer çalışmada da (229) sayısı ve klinik özellikleri açıklanmasa da çalışmaya spondiliti olan hastaların dahil edildiği anlaşılmaktadır. Bu nedenle sonlanım noktası olarak tespit edilen tedavi başarısızlığı, relaps ve yan etki açısından meta-analizi yapılırken, kalça, diz artriti veya spondilit hastası içeren bu iki makale (komplike olgular) hem ayrıca analiz edilerek hem bu iki makale hariç tutularak (komplike olmayan olgular) alt grup analizleri ile birlikte hem de bütün olguları içeren ortak bir meta-analiz gerçekleştirilmiştir.
Meta-analizine dahil edilen Ersoy ve arkadaşlarının (221) çalışmasında, DOX-RIF verilen 45 hasta, DOX-STREP verilen 32 hasta ve OFX-RIF verilen 41 hasta olmak üzere üç ayrı karşılaştırma grubu vardır. Bu çalışma, meta-analizine dahil edilirken tedavi rejiminde kinolon içermeyen ilk iki grubun hasta sayıları birleştirilerek tek bir grup olarak analize dahil edilmiştir. Söz konusu çalışma ile benzer tedavi grupları içeren Hashemi ve arkadaşlarının (222) çalışmasında da aynı birleştirme yapılmış ve meta-analizine dahil edilmiştir.
Keramat ve arkadaşlarının (229) çalışmasında ise DOX-RIF verilen 61 hasta, CIP +RIF verilen 62 hasta ve CIP+DOX verilen 55 hasta üç ayrı karşılaştırma grubunu oluşturmaktaydı. Meta-analizine veriler girilirken CIP içeren 2. ve 3. grup hastalar birleştirilerek tek bir grup olarak analize dahil edilmiştir. Kinolon içeren ve içermeyen rejimlerle tedavi başarısızlığının değerlendirilmesinde sadece altı çalışmada bu sonlanım noktasına dair veriler olması nedeniyle meta-analizi bu altı çalışma ile yapılmış olup 695 hastayı içermektedir. Akut bruselloz tedavisinde kinolon içeren ve içermeyen rejimlerin hem alt grup analizinde hem de totalde, tedavi başarısızlığı açısından birbirinden farklı olmadıkları bulunmuştur (RR=1.03, %95 GA=0.57-1.85).
Kinolon içeren ve içermeyen rejimlerin relaps oranları açısından karşılaştırılmasının meta-analizi yedi çalışma kapsamında toplam 648 hastayı içermektedir. Akut brusellozda kinolon içeren ve içermeyen rejimlerle tedavinin, hem alt grup analizinde hem de totalde, relaps olasılığı açısından birbirinden farklı olmadıkları bulunmuştur (RR=0.84, %95 GA=0.52-1.37). Keramat ve arkadaşlarının (229) çalışması, meta-analizinde en fazla hasta sayısının olduğu iki çalışmadan biridir; 178 hasta çalışmaya dahil edilmişken sadece 114 hastanın takipte relaps verileri bildirilmiştir. Çalışma popülasyonu göz önüne alındığında, 64 (%35) gibi önemli sayıda hastanın relaps verilerini içermemesi önemli bir eksiklik olarak görünmektedir. Üç kollu (DOX+RIF; CIP+RIF; CIP+DOX) çalışmada tedavi başarısı ve istenmeyen sonlanımlar açısından bir fark görülmediği bildirilmiştir. (Bkz. Ek Şekil 28-30 ve Ek Tablo 17, 18)
Güvenlik
Yan etki bildirimleri, çalışmaların bazılarında sadece “yan etki gelişti” veya “gelişmedi” şeklindedir ve gelişen yan etkilerin detayları ve tedavi kesmeye neden olup olmadıkları belirtilmemektedir. Dolayısıyla bu meta-analizinde, sadece karşılaştırılan tedavi rejimleri ile sonlanım noktası olarak herhangi bir yan etkinin gelişip gelişmediği alınabilmiştir. Kinolon içeren ve içermeyen rejimlerin yan etki oranları açısından karşılaştırılmasında meta-analizi, yedi çalışmada toplam 684 hastayı içermektedir. Akut brusellozda kinolon içeren ve içermeyen rejimlerle tedavinin hem alt grup analizinde hem de totalde, herhangi bir yan etki gelişimi açısından birbirinden farklı olmadıkları bulunmuştur (RR=0.73, %95 GA=0.43-1.25). (Bkz. Ek Şekil 28-30 ve Ek Tablo 17, 18)
Öneri Gerekçesi: Kinolonlar yaygın olarak kullanılan antibiyotik gruplarındandır. Tendonları, kasları, eklemleri, merkezi sinir sistemini içeren ciddi yan etkilere yol açma potansiyeli nedeniyle Amerikan Gıda ve İlaç Dairesi (FDA) tarafından akut bakteriyel sinüzit, kronik bronşitin akut bakteriyel alevlenmesi ve komplike olmayan üriner infeksiyonlarda kullanılmaması konusunda uyarıda bulunulmuştur. Belirtilen endikasyonlarda ancak alternatif tedavilerin uygulanamaması durumlarında uzman onayı ile kullanılması önerilmektedir (234). Bruselloz tedavisinde kullanılabilecek başka temel ilaçlar bulunması nedeniyle kinolonlar ancak bu ilaçlar kullanılamadığı durumlarda alternatif bir seçenek olarak düşünülmelidir.
Bilgi Açığı: Bu konu ile ilgili çalışmalar oldukça heterojen tedavi rejimlerinden oluşmaktadır. Aynı zamanda çalışmalarda uygun randomizasyon ve körleme eksiktir. Tedavide temel rejim olarak kabul edilen DOX-RIF kombinasyonu ile birebir kinolonlu rejimlerin karşılaştırıldığı, randomizasyonu ve körlemesi iyi planlanmış, sonlanım noktaları ve takip süreleri uygun tanımlarla belirlenmiş randomize kontrollü çalışmalara ihtiyaç vardır.
10- Bruselloz tanısı konulmuş gebelerde rifampisin + seftriakson tedavisi rifampisin + trimetoprim-sülfametoksazol tedavisine göre daha etkili midir?
Öneri: Bruselloz tanısı almış gebelerin tedavisinde farklı kombinasyonları karşılaştıran olgu serilerinin analizinde RIF+TMP-SMX kombinasyonuyla, RIF+CRO kombinasyonu arasında gebelik komplikasyonu gelişimi açısından bir fark belirlenmemiştir. Gebe bruselloz olgularının tedavisinde RIF+TMP-SMX veya RIF+CRO kombinasyonlarından birinin kullanılması önerilir. Ancak TMP-SMX’in birinci trimesterde teratojenik etki, son trimesterde ise kernikterusa neden olma riskleri bulunması nedeniyle birinci ve üçüncü trimesterde RIF+CRO kombinasyonunun tercih edilmesi önerilir (Çok düşük kanıt düzeyi, zayıf öneri).
Kanıtların Özeti: Gebe bruselloz olgularında yapılmış randomize kontrollü bir çalışma bulunmamaktadır. Tam metnine ulaşılabilen, olgulara ait ayrıntılı klinik bilgilerin yer aldığı, 18 yaş ve üzeri, antepartum dönemde tanı almış (kültür üremesi, STA ya da Coombs’lu aglütinasyon pozitifliği ile) ve RIF+TMP-SMX ya da RIF+CRO tedavilerinden birisi bu dönemde başlanmış olan gebelerin yer aldığı bir retrospektif kohort çalışma, üç olgu serisi ve 10 olgu raporu çalışmaya dahil edilmiştir (235-247). Gebelik komplikasyonu geliştikten sonra bruselloz tanısı ya da tedavisi alan, tedavi almayan, 18 yaş altı ya da klinik verilerine ulaşılamayan hastalar çalışmaya dahil edilmemiştir. Primer sonlanım gebelik komplikasyonu gelişimi olup bunlar; spontan abortus, preterm eylem, intrauterin fetal ölüm ve uzamış membran rüptürüdür.
Analize dahil edilen ve ayrıntılı klinik verilerine ulaşılabilen 146 hastadan oluşan gebe bruselloz kohortu oluşturulmuştur. Hastaların 67 (%45.9)’sinde RIF+TMP-SMX, 79 (%54.1)’unda RIF+CRO kombinasyonu kullanılmıştır. Toplamda 146 gebenin 58 (%45.9)’inde gebelik komplikasyonu gelişmiş olup en sık görülen preterm eylemdir. Hastaların takip süreleri değişken olmakla birlikte hastaların üçünde relaps geliştiği bildirilmiştir. Gebelik komplikasyonu gelişimini etkileyen değişkenler analiz edildiğinde iki grup arasında tek anlamlı farklılık gebelik haftasında görülmüştür (p=0.029). RIF+TMP-SMX tedavisi alan gebelerin 24 (%35,8)’ünde, RIF+CRO tedavisi alanların ise 34 (%43)’ünde gebelik komplikasyonu izlenmiştir (p=0.375). Aradaki fark istatistiksel olarak anlamlı düzeyde bulunmamıştır. (Bkz. Ek Tablo 19, 20)
Güvenlilik: Güvenlilik konusunda da fetüste antimikrobiyallere bağlı gelişebilecek yan etkiler ile ilgili net veri sunan bir çalışma bulunmamaktadır. Çalışmaların çoğunda TMP-SMX fetal kernikterus riski nedeni ile üçüncü trimesterde tercih edilmemiştir. (Bkz. Ek Tablo 19, 20)
Öneri Gerekçesi: Bruselloz tedavisinde kullanılan TET, aminoglikozit ve kinolon grubu antibiyotiklerin gebelerde kullanılamaması nedeni ile oldukça sınırlı tedavi seçeneği bulunmaktadır. Kullanılabilecek ilaçlar TMP-SMX, RIF ve CRO’dur. Gebe bruselloz hastalarının takibinde; hastalığın erken tanınması ve komplikasyon gelişimini en aza indirgeyecek şekilde uygun tedavilerin erkenden başlanması en önemli noktadır. RIF+TMP-SMX ve RIF+CRO kombinasyonları gebelik komplikasyonu gelişimi açısından benzer özellikte olup gebe bruselloz olgularında kullanılabilir. TMP-SMX’in birinci trimesterde teratojenite, üçüncü trimesterde ise kernikterus riski nedeni ile kullanımına dikkat edilmelidir. Bu dönemlerde alternatif olarak RIF+CRO kombinasyonu tercih edilebilir.
Bilgi Açığı: İyi planlanmış, prospektif çalışmaların yokluğu nedeni ile gebelerde bruselloz tedavisi ile ilgili mevcut bilgiler genellikle gözlemsel çalışmalardan ve olgu raporlarından elde edilmiştir. Yapılan çalışmaların pek çoğu brusellozun gebelik komplikasyonları üzerindeki etkisini değerlendirmeye yönelik olduğu için tedavi ile ilgili veriler kısıtlıdır. Bu nedenle bu veriler üzerinden tedavi rejiminin klinik sonlanım üzerindeki etkisini değerlendirmek yanıltıcı olabilir. Güvenlilik konusunda da fetüste antimikrobiyallere bağlı gelişebilecek yan etkiler ile ilgili net veri sunan bir çalışma bulunmamaktadır. Bu konuda ileri çalışmalara ihtiyaç vardır.
11- Nörobruselloz tedavisinde seftriakson içeren kombinasyon rejimi, seftriakson içermeyen rejime göre daha etkili midir?
Öneri: Tedavi rejimlerini karşılaştıran nörobruselloz olgu serilerinin IPD meta-analizinde tedaviye CRO eklenmesinin tedavi başarısını anlamlı olarak artırdığı görülmüştür. Nörobruselloz tedavisinde standart tedaviye CRO eklenmesi önerilir (Düşük kanıt düzeyi, güçlü öneri).
Kanıtların Özeti: Literatürde tespit edilen 189 nörobruselloz olgusu kapsamında ayrıntılı klinik verilerine ulaşılabilen 121 olgunun analizi yapılmıştır (41,208,248-263). Hastaların 63 (%48)’ünün tedavileri CRO içerirken, 58 (%42)’inin tedavileri CRO içermiyordu. Seftriakson içeren tedavi rejimi alan hastaların 52 (%68)’sinde tam iyileşme (ölüm, relaps ve sekel olmaması) görülmüştür (Bkz. Ek Tablo 21, 22).
Çok değişkenli analizde, nörobrusellozda tedaviye CRO eklenmesi (OR=7.48, %95 GA=3.19-17.53; p<0.001) tam iyileşmeye etki eden en önemli faktör olarak saptanmıştır. Nörobrusellozda standart tedaviye CRO eklenmelidir (Bkz. Ek Tablo 23).
Bilgi Açığı: Literatürde nörobruselloz tedavisi ile ilgili veriler olgu sunumları ve retrospektif çalışmalarla sınırlıdır. Bu konu ile ilgili çalışmalar oldukça heterojen tedavi rejimlerinden oluşmaktadır. Tedavide temel rejim olarak kabul edilen DOX-RIF kombinasyonu ile bu tedaviye CRO eklenmesinin klinik başarıya etkisinin araştıralacağı randomize kontrollü çalışmalara ihtiyaç vardır.
Önerinin Gerekçesi: Nörobrusellozda DOX-RIF tedavisine CRO eklenmesiyle başarılı sonuçlara ulaşmak mümkündür.
12- Brucella spp. endokarditi olan hastalarda, tanı anındaki Wright STA testi titresi olumsuz sonuçları gösterir mi?
Öneri: Brucella spp. endokarditi olgularının IPD meta-analizinde, tanı anındaki Wright aglütinasyon titresinin 1/1280’in üzerinde olmasının, ölüm riskini belirgin olarak artırdığı belirlenmiştir. Brucella spp. endokarditi olan hastalarda, tanı anındaki Wright STA testi titresinin 1/1280’in üzerinde olmasının ölüm riskinin yüksek olabileceğini öngörmek açısından kullanımı düşünülebilir (Düşük kanıt düzeyi, zayıf öneri).
Kanıtların Özeti: Seksen altı çalışmada yer alan 273 Brucella spp. endokarditi olgusunu içeren IPD meta-analizi çalışmasında (264-349), başvuruda Wright aglütinasyon titresi bilinen 227 hastada mortaliteye etki eden risk faktörlerinin tek değişkenli analizinde, başvurudaki Wright aglütinasyon titresi >1/1280 olan hastalarda mortalite oranı (15/90, %16.6), olmayanlardan (12/137, %8.75) daha yüksek bulunmuştur (p=0.072). Aynı verilerin çok değişkenli analizinde de başvurudaki Wright aglütinasyon titresinin >1/1280 olması, ölümü gösteren bağımsız bir risk faktörü olarak tanımlanmıştır (OR=7.01, %95 GA=1.96-24.99). Tanı anındaki Wright STA testi titresinin >1/1280 olması ölüm dışı istenmeyen sonlanımlar için de tek değişkenli analizlerde risk faktörü olarak tanımlanmıştır [15/81 (%18.51)’e karşılık 10/132 (%7.57); p=0.016]. (Bkz. Ek Şekil 31 ve Ek Tablo 24-31)
Önerinin Gerekçesi: Bruselloz klinik görünümleri içinde en sık ölüme neden olan klinik tablo infektif endokardittir. Bu nedenle Brucella spp.’ye bağlı infektif endokardit gelişen hastalarda mortaliteyi öngördürecek prognostik, ölçülebilir faktörlerin tanımlanması, ölümü azaltabilecek etkili önlemlerin erkenden alınmasına olanak tanıyabilir. Başvuru anındaki Wright STA testi titresi, tüm hastalarda kolayca bakılabilen, kolay uygulanabilen bir test olması ve hem ölümü hem de ölüm dışı istenmeyen sonlanımları öngördürebileceğine dair kanıtlar elde edilmiş olması nedeniyle, Brucella spp.’ye bağlı endokardit tanısı konulan hastalarda tedavi öncesi bakılarak prognostik değerlendirmede kullanılabileceği düşünülmüştür.
Bilgi Açığı: Brucella spp.’ye bağlı endokardit olgularında tanı anındaki Wright STA testi titresinin prognostik değerini araştıran prospektif bir gözlemsel çalışma bulunamamıştır. Var olan kanıtlar tek olgu veya çoklu olgu serilerinin IPD meta-analiziyle elde edilmiştir. Brucella spp.’ye bağlı endokardit tanımlanmış hastalarda prognoza etki edecek faktörleri analiz edecek ülke çapında yapılacak prospektif, çok merkezli, kohort çalışmalara gereksinim vardır.
13- Brucella spp. endokarditi olan hastalarda, 3’lü antimikrobik tedavi rejimleri, 2’li antimikrobik tedavi rejimlerinden daha üstün müdür?
Öneri: Brucella spp. endokarditi olgularının IPD meta-analizinde, 2’li antimikrobik tedavi alanlarda ölüm oranı, istatistiksel olarak anlamlı olmasa da 3’lü tedavi alanlardan daha yüksek bulunmuştur. Ölüm dışı istenmeyen etkiler birleşik sonlanımı (rekürans veya istenmeyen ilaç etkileri veya yeniden hastane yatışı veya hastane yatışında postoperatif komplikasyonlar veya bir yıl içinde yeniden ameliyat edilme) 2’li antimikrobik tedavi alanlarda 3’lü tedavi alanlardan anlamlı olarak daha yüksek bulunmuştur. Bir diğer komplike bruselloz tablosu olan spondilodiskit konusunda yapılmış çalışmaların, bu rehber çalışması sırasında yapılan meta-analizinde de 3’lü tedaviler daha üstün bulunmuştur (bakınız 18 numaralı PICO sorusu). Brucella spp. endokarditi olgularının tedavisinde 3’lü antimikrobik tedavi rejimleri önerilir (Düşük kanıt düzeyi, güçlü öneri).
Kanıtların Özeti: Seksen altı çalışmada yer alan 273 Brucella spp. endokarditi olgusunu içeren IPD meta-analizinde (264-349) 2’li tedavi alan hastaların 7/52 (%13.46)’si ölmüşken, 3’lü tedavi alan hastaların %11.36’sının öldüğü belirlenmiştir (p=0.634). Aynı analizde diğer istenmeyen sonlanımlar (rekürans veya istenmeyen ilaç etkileri veya yeniden hastane yatışı veya hastane yatışında postoperatif komplikasyonlar veya bir yıl içinde yeniden ameliyat edilme) 2’li tedavi alanların %20.4’ünde görülmüşken, 3’lü tedavi alanların %9.8’inde görülmüştür (p=0.038). (Bkz. Ek Tablo 24, 25, 27-29, 32, 33)
Önerinin Gerekçesi: Brusellozun en ölümcül şekli olan endokarditli olgularda gerek ölümü gerekse ölüm dışı diğer istenmeyen sonlanımları azaltabilecek müdahaleler oldukça önemlidir. Brucella spp.’ye bağlı endokardit olgularında, cerrahi müdahalenin yanında diğer önemli bileşen olan antimikrobiyal tedavinin etkili olması çok kritiktir. Geçmiş yıllarda sunulmuş tek olgu veya olgu serilerinde yer alan Brucella spp. endokardit olgularına ait verilerin IPD-meta-analizinde istatistiksel olarak anlamlı olmasa da sayısal olarak ölüm oranının daha az görülmüş olması, diğer istenmeyen sonlanımların 3’lü tedavi alan grupta belirgin olarak daha az görülmesi ve ayrıca endokardit gibi bir diğer komplike bruselloz tablosu olan spondilodiskit olgularıyla ilgili yapılmış klinik araştırmaların meta-analizinde 3’lü tedavilerin daha etkili bulunmuş olması nedenleriyle endokardit olgularında da 3’lü antimikrobik tedavi kombinasyonlarının kullanımı önerilmiştir.
Bilgi Açığı: Brucella spp.’ye bağlı endokarditi olan hastalarda 2’li veya 3’lü antimikrobik tedavi kombinasyonlarının etkinliğini ve güvenilirliğini karşılaştıran gözlemsel veya randomize kontrollü bir klinik araştırma yoktur. Brucella spp. endokarditlerinde 2’li ve 3’lü antimikrobik tedavi kombinasyonlarının etkinliğini ve güvenilirliğini araştıran, ülke çapında yapılacak gözlemsel ve randomize kontrollü klinik çalışmalara gereksinim vardır.
14- Brucella spp. endokarditi olan hastalarda aminoglikozid içeren ve içermeyen tedaviler arasında olumsuz sonuçlar açısından fark var mıdır?
Öneri: Brucella spp. endokarditi olgularının IPD meta-analizinde, aminoglikozid içeren rejimlerle tedavi edilenlerde ölüm oranı belirgin olarak daha düşük tespit edilmekle birlikte başta istenmeyen ilaç etkileri olmak üzere, ölüm dışı istenmeyen sonlanımların gelişme riski de belirgin olarak daha yüksek bulunmuştur. Brucella spp. endokarditlerinde aminoglikozid içeren rejimlerle tedavi önerilir, ancak aminoglikozid verilen hastalarda, nefrotoksisite yönünden yakın izlem yapılmalı, ek nefrotoksik ajanların kullanımından kaçınılmalıdır (Düşük kanıt düzeyi, güçlü öneri).
Kanıtların Özeti: Brucella spp.’ye bağlı endokardit olgu sunumu veya olgu serilerini içeren toplam 86 yayındaki (264-349) 273 hasta verisiyle yapılan IPD meta-analizinde, tek değişkenli analizde, aminoglikozid içeren rejimlerle tedavi yapılanlarda ölüm oranı [10/123 (%8.1)], aminoglikozid içeren rejimlerle tedavi edilmeyenlerden [22/147 (%14.9)] daha düşük bulunmuştur (p=0.084). Yukarıda söz edilen IPD meta-analizinin çok değişkenli analizinde de tedavide aminoglikozid içeren rejimlerin kullanılması ölüm riskini azaltan bağımsız bir risk faktörü olarak tanımlanmıştır (OR=0.250, %95 GA=0.075-0.831; p=0.024). Aynı çalışmada tek değişkenli analizlerde aminoglikozid içeren rejimler kullanılan hastalarda, kullanmayanlara göre ölüm dışı istenmeyen sonlanımların (rekürans veya istenmeyen ilaç etkileri veya yeniden hastane yatışı veya hastane yatışında postoperatif komplikasyonlar veya bir yıl içinde yeniden ameliyat edilme) daha fazla görüldüğü saptanmış [%19.7’ye karşılık %5.1; p<0.001] ve farkın özellikle ilaç istenmeyen etkilerinden [%7.8’e karşılık %0.7; p=0.006] kaynaklandığı görülmüştür. Çok değişkenli analizlerde de aminoglikozid içeren tedavilerin kullanılması, ölüm dışı istenmeyen sonlanımlar açısından riski artıran bağımsız bir risk faktörü olarak saptanmıştır (OR=2.84, %95 GA=1.06-7.58; p=0.036). (Bkz. Ek Tablo 24, 25, 27-29, 34, 35)
Önerinin Gerekçesi: Brusellozun en ölümcül komplikasyonu olan endokarditin geliştiği olgularda, tedavinin cerrahiyle birlikte ana bileşeni olan antimikrobiyal tedavinin optimizasyonu oldukça önemlidir. Mevcut veriler, aminoglikozid içeren tedavi rejimlerinin endokarditli olgularda ölümü azaltırken, başta istenmeyen ilaç etkileri olmak üzere daha fazla istenmeyen olaylara yol açtığını düşündürmektedir. Komplike olmayan bruselloz olgularının tedavisini karşılaştıran gözlemsel ve randomize kontrollü çalışmaların, bu rehber çalışması için yapılan meta-analizinde de aminoglikozid içeren rejimlerde tedavi başarısının daha yüksek olduğu görülmüştür (bakınız 7 numaralı PICO sorusu). Brucella spp.’ye bağlı endokardit olgularının antimikrobiyal tedavisinde de aminoglikozid içeren rejimlerin kullanımı önerilmiştir. Ancak aminoglikozidlerin başta nefro/ototoksik etkileri gibi gayet iyi tanımlanmış istenmeyen etkilerinin, diğer antimikrobiklerden daha fazla olabileceği de burada yapılmış analizlerde görülmüştür. Bu nedenle aminoglikozid başlanan hastalarda istenmeyen etkilerin yakından izleminin ve aminoglikozidlerle benzer istenmeyen etki profili olan ve endokardit gibi kardiyak sorunu olan hastalarda sıklıkla kullanılabilen başta diüretikler gibi ilaçların birlikte kullanımından mümkün olduğunca kaçınılması gerektiği de vurgulanmıştır.
Bilgi Açığı: Brucella spp.’ye bağlı endokarditi olan hastalarda aminoglikozid içeren ve içermeyen tedavi kombinasyonlarının etkinliğini ve güvenilirliğini karşılaştıran gözlemsel veya randomize kontrollü klinik araştırmalar yoktur. Brucella spp. endokarditlerinde STREP veya GEN içeren veya içermeyen tedavi kombinasyonlarının etkinliğini ve güvenilirliğini araştıran, ülke çapında yapılacak gözlemsel ve randomize kontrollü klinik çalışmalara gereksinim vardır.
15- Brucella Spp. endokarditi olan hastalarda kapak cerrahisi uygulamasının olumsuz sonuçları azaltmada etkisi var mıdır?
Öneri: Brucella spp. endokarditi olgularının IPD meta-analizinde, kapak cerrahisi uygulanmasının ölüm riskini belirgin olarak azalttığı belirlenmiştir. Brucella spp. endokarditi tanısı konulan hastalarda, İnfektif Endokardit Ekibi tarafından acil veya elektif kapak cerrahisi indikasyonları dikkatle değerlendirilerek, uygun bulunan hastalarda cerrahinin yapılması önerilir (Düşük kanıt düzeyi, güçlü öneri).
Kanıtların Özeti: Brucella spp.’ye bağlı endokardit olgu sunumu veya olgu serilerini içeren toplam 86 yayındaki (264-349) 273 hasta verisiyle yapılan IPD meta-analizinde, mortaliteye etki eden risk faktörlerinin tek değişkenli analizinde, kapak cerrahisi yapılanlarda ölüm oranı, yapılmayanlardan belirgin olarak daha düşük bulunmuştur [10/184 (%5.4)’e karşılık 22/86 (%25.5); p<0.001].
Aynı şekilde çok değişkenli analizlerde de kapak cerrahisi yapılması ölümü azaltan bağımsız faktör olarak tanımlanmıştır (OR=0.068, %95 GA=0.019-0.237). (Bkz. Ek Tablo 24, 25, 27-29, 36)
Önerinin Gerekçesi: İnfektif endokardit gelişmiş hastalarda etkenden bağımsız olarak, akut kalp yetmezliğine yol açacak kapak yetmezliği gelişmişse acilen, kontrol edilemeyen lokal (apse, fistül, anevrizma vb.) veya sistemik infeksiyon (kan kültürlerinin negatifleşmemesi veya ateşin düşmemesi ve başka bir kaynak bulunamaması), yineleyen embolizm, büyük vejetasyon veya ileri sol kalp kapağı yetersizliği veya darlığı olması halinde erken kapak ameliyatı önerilir. Bunlara ek olarak tedavisi güç olan mikroorganizmalar söz konusuysa da cerrahinin öncelenmesi tavsiye edilmektedir. Brucella spp., özellikle hücre içinde de yerleşebilmesi nedeniyle tedavisi güç mikroorganizmalar grubunda yer almaktadır ve bu nedenle de eskiden beri endokarditli olgularda kapak cerrahisinin sıklıkla gerekeceği ve yapılmasının iyi olacağı uzman görüşü olarak bildirilmektedir (350). Seksen altı çalışmada yer alan 273 bruselloz olgusunu değerlendirdiğimiz IPD meta-analizinde endokardit tanısı konulmuş olgulardan kapak ameliyatı yapılanlarda mortalitenin belirgin olarak daha az görüldüğü ve cerrahi uygulanmasının mortaliteyi belirgin olarak azaltan en önemli faktör olduğu görülmüştür. Brucella spp.’ye bağlı endokarditi olan hastalarda acil veya elektif kalp kapak ameliyatı indikasyonlarının İnfektif Endokardit Ekibi tarafından dikkatle değerlendirilmesi ve bu hastalarda indikasyon varlığında cerrahinin geciktirilmeden yapılması, mortalitenin azaltılması açısından önemlidir.
Bilgi Açığı: Brucella spp. endokarditi olan hastalarda kapak cerrahisi yapılmasının, ölüm ve diğer istenmeyen sonlanımlar üzerine etkisini araştıran randomize, kontrollü çalışmalara gereksinim vardır.
16- Brucella spp. endokarditi olan hastalarda ≤3 aylık antimikrobiyal tedaviler ile >3 aylık tedaviler arasında olumsuz sonuçlar açısından fark var mıdır?
Öneri: Brucella spp. endokarditi olgularının IPD meta-analizinde, ölen hastaların hemen hepsinin ilk üç ayda ölmüş olduğu görülmüştür. Bu nedenle tedavi süresinin ölüm üzerine etkisi belirlenememiştir. Aynı analizde >3 ay tedavi alan ve almayan hastalar arasında ölüm dışı istenmeyen sonlanımların sıklığı açısından bir fark bulunamamıştır. Bilgi boşluğu nedeniyle öneri yapılamaz (Bilgi boşluğu).
Kanıtların Özeti: Brucella spp.’ye bağlı endokardit olgu sunumu veya olgu serilerini içeren toplam 86 yayındaki (264-349) 273 hasta verisiyle yapılan IPD meta-analizinde, ölen 32 hastanın sadece beşi >3ay tedavi alabilmiş, diğerleri tedavinin ilk üç ayında ölmüştür; >3 ay tedavi alabilen hastalar genellikle sağ kalanlar olduğu için, tedavi süresinin ölüm üzerine etkisini tanımlayabilmek mümkün olmamıştır. Ölümlerin hepsi ilk üç ayda gerçekleştiği için ölüm sonlanımına göre değerlendirildiğinde çıkan fark yanlılık içermektedir.
Üç aydan fazla tedavi alan ve almayan hastalar arasında ölüm dışı istenmeyen sonlanımların görülme sıklığı açısından bir fark bulunmamıştır [16/113 (%14.15)’e karşılık 16/132 (%12.12); p=0.949]. (Bkz. Ek Tablo 24, 25, 27-29, 37)
Önerinin Gerekçesi: Eldeki veriler Brucella spp.’ye bağlı endokardit olgularında tedavi süresinin ne kadar olması gerektiği konusunda öneri yapabilmek için yeterli değildir.
Bilgi Açığı: Brucella spp.’ye bağlı endokardit nedeniyle izlenen hastalarda uygun tedavi süresinin belirlenebilmesi için, farklı tedavi rejimlerini, ölüm ve relapsı, yeniden hastane yatışını, ilaç istenmeyen etkileri gibi sonlanımları karşılaştıran, gözlemsel ve randomize-kontrollü çalışmalar yapılması gereklidir.
17- Brucella spp. spondilodiskiti tedavisinde doksisiklin + streptomisin rejimi, doksisiklin + rifampisin rejimine üstün müdür?
Öneri: Brucella spp. spondilodiskiti olan hastalarda DOX-STREP rejimini DOX-RIF rejimiyle karşılaştıran çalışmaların meta-analizinde, var olan çalışmaların kanıt düzeylerinin kalitesinin yetersiz olduğu görülmüştür. Brucella spp. spondilodiskiti tedavisinde antimikrobiyal tedavi rejimi konusunda kanıta dayalı öneri yapılabilmesi mümkün değildir; bu konuda bilgi boşluğu vardır. Akut bruselloz tedavi rejimlerini karşılaştıran çalışmaların meta-analizinde STREP içeren rejimin daha etkili bulunmuş olması nedeniyle ve ek olarak rehberi hazırlayan uzmanların da uzlaşısıyla, Brucella spp. spondilodiskiti tedavisinde de DOX-STREP rejimine öncelik verilmesi önerilmiştir (Bilgi boşluğu).
Kanıtların Özeti: İkisi randomize kontrollü, dördü gözlemsel çalışma olmak üzere toplam altı çalışmanın verileri incelendi (219, 351-355). Çalışma verileri relaps ve tedavi başarısızlığı açısından ayrı ayrı analize dahil edilerek sonuçlar elde edildi. Beş çalışmanın içerdiği toplam 288 hastada tedavi rejimlerinin relaps gelişimi üzerine etkisi ve altı çalışmanın içerdiği toplam 382 hastada tedavi rejimlerinin tedavi başarısızlığı üzerine etkisi değerlendiridi. DOX+STREP rejimi ile DOX+RIF rejimi arasında relaps (OR=0.64, %95 GA=0.23-1.74) ve tedavi başarısızlığı (OR=0.84, %95 GA=0.43-1.64) açısından istatistiksel olarak fark saptanmadı.
Ariza ve arkadaşlarının (219) tek merkezde gerçekleştirdikleri randomize kontrollü, çift kör çalışmada bruselloz tanısı alan 95 hasta DOX+STREP ve DOX+RIF tedavi kollarında değerlendirilmiştir. Fokal tutulumlu osteoartiküler bruselloz olgularının alt grupta değerlendirildiği bu çalışmada sonlanım noktaları tedavi başarısızlığı ve relaps olup ortalama takip süresi 15 aydır. DOX+STREP alan dokuz osteoartiküler bruselloz hastasının birinde tedavi başarısızlığı, ikisinde relaps görülürken; DOX+RIF tedavisi alan dokuz osteoartiküler bruselloz hastasının ikisinde tedavi başarısızlığı, ikisinde relaps izlenmiştir.
Bayındır ve arkadaşlarının (351) yapmış olduğu randomize kontrollü, açık etiketli, tek merkezli çalışmada, beş tedavi rejimine (STREP-TET, STREP-DOX, STREP-DOX-RIF, DOX-RIF, OFX-RIF) randomize edilmiş toplam 102 Brucella spp. spondilodiskiti olgusu, tedavi başarısızlığı ve relaps açısından en az altı ay izlenmiştir. STREP+DOX alan 21 hastanın dördünde tedavi başarısızlığı görülmüş ve relaps izlenmemiş; DOX+RIF alan 20 hastanın üçünde tedavi başarısızlığı, ikisinde ise relaps görülmüştür.
Buzgan ve arkadaşlarının (352), 1028 bruselloz olgusunun klinik özellikleri ve komplikasyonlarını değerlendirdiği retrospektif gözlemsel, tek merkezli çalışmada, 141 osteoartiküler bruselloz olgusu farklı tedavi rejimleri alırken relaps açısından değerlendirilmiştir. Otuz beş olgu DOX+RIF, 41 olgu DOX+STREP kullanmış olup hastalar 12 ay takip edilmiştir. Bu tedavi rejimlerinde relaps oranları sırasıyla %11.4 (n=4) ve %7.3 (n=3) olarak bulunmuştur.
Colmenero ve arkadaşlarının (353), tek merkezde gerçekleştirdikleri restrospektif gözlemsel çalışmada, doz ve sürenin belirtilmediği DOX+STREP ve DOX+RIF olan iki tedavi kolunda yer alan 87 brusella spondilodiskiti olan hasta tedavi başarısızlığı, relaps, sekel ve mortalite açısından değerlendirilmiştir. DOX+STREP tedavisi alan 71 hastanın 11’inde tedavi başarısızlığı, ikisinde mortalite, beşinde sekel izlenirken, relaps görülmemiştir. DOX+RIF tedavisi alan 16 hastanın üçünde tedavi başarısızlığı, birinde sekel izlenirken, relaps ve mortalite görülmemiştir.
Jia ve arkadaşlarının (354), 590 bruselloz hastasındaki tedavi komplikasyonlarını değerlendirdiği retrospekif gözlemsel, tek merkezli çalışmada osteoartiküler tutulumu olan hastalar farklı tedavi rejimleri sonrası altı ay boyunca relaps açısından izlenmiştir. DOX+RIF alan 55 hastanın dördünde, DOX+STREP alan 11 hastanın ikisinde relaps izlendiği bildirilmiştir.
Ulu-Kılıç ve arkadaşlarının (355), komplike ve komplike olmayan spinal bruselloz tedavisini değerlendirdiği retrospektif gözlemsel, çok merkezli çalışmada farklı tedavi rejimi kullanan toplam 277 hasta tedavi başarısızlığı açısından değerlendirilmiştir. DOX+STREP alan sekiz hastanın birinde, DOX+RIF alan 95 hastanın sekizinde tedavi başarısızlığı görülmüştür. (Bkz. Ek Şekil 32, 33 ve Ek Tablo 38, 39)
Önerinin Gerekçesi: Çalışmalarda relaps için takip süresi 6-15 ay arasında değişmektedir ve relaps tanımları net değildir. Üç çalışmada genel bruselloz olgularının alt grubunda osteoartiküler tutulumu olan hastalar bulunmaktadır ve analiz bu olguların verileriyle yapılmıştır (219,352,354). Söz konusu çalışmalar brusella spondilodiskiti için tasarlanmış çalışmalar değildir. Brucella spp. spondilodiskiti olan hastalarda DOX+STREP rejimini DOX+RIF ile karşılaştıran çalışmaların meta-analizinde, var olan çalışmaların kanıt düzeylerinin ve kalitesinin yetersiz olduğu görülmüştür. Brucella spp. spondilodiskiti tedavisinde antimikrobiyal tedavi rejimi konusunda bilgi boşluğu vardır, öneri yapılabilmesi mümkün değildir.
Bilgi Açığı: Standart dozda tedavi verilen ve benzer sürelerde takip edilen brusella spondilodiskiti hastalarında DOX+STREP ve DOX+RIF tedavisinin etkinliğini gösterecek randomize kontrollü çalışmalara ihtiyaç vardır.
18- Brucella spp. spondilodiskiti tedavisinde 3’lü antimikrobiyal kombinasyon rejimleri, 2’li kombinasyon rejimlerinden üstün müdür?
Öneri: Brucella spp. spondilodiskiti olan hastalarda tedavi rejimlerini karşılaştıran çalışmaların meta-analizinde, 3’lü antimikrobiyal kombinasyonların, 2’li kombinasyonlardan daha başarılı olduğu görülmüştür. Brucella spp. spondilodiskiti tedavisinde üç antimikrobiyal içeren kombinasyon tedavisi önerilir (Çok düşük kanıt düzeyi, zayıf öneri).
Kanıtların Özeti: Öneriyle ilgili kanıtlar, biri randomize kontrollü, dördü gözlemsel çalışma olmak üzere toplam beş çalışmanın verilerine dayanmaktadır (351-353, 355, 358). Söz konusu çalışmaların verileri tedavi başarısızlığı açısından analize dahil edilerek sonuçlar elde edilmiştir; toplam 704 hastada, Brucella spp.’ye etkili 3’lü rejimle, 2’li rejimin tedavi başarısızlığı üzerine etkisi değerlendirilmiştir. Brucella spp.’ye etkili 2’li rejimle karşılaştırıldığında 3’lü rejim daha az tedavi başarısızlığı (OR=0.50, %95 GA=0.29-0.89) ile ilişkilidir. Tedavide kullanılan ilaçlar açısından, DOX+STREP+RIF rejimiyle DOX+STREP kombinasyonunun karşılaştırıldığı biri randomize kontrollü, üçü gözlemsel olmak üzere toplam dört çalışmadaki 344 hastanın verileri analiz edildiğinde, DOX+STREP+RIF rejiminin tedavi başarısızlığı açısından DOX+STREP rejimine üstünlüğü gösterilememiştir (OR=0.67, %95 GA=0.28-1.62). DOX+STREP+RIF rejimiyle DOX+RIF alan hastaların yer aldığı biri randomize kontrollü, ikisi gözlemsel çalışma sonuçlarını içeren toplam üç çalışmadaki 347 hastanın verileri analiz edildiğinde, DOX+STREP+RIF rejiminin tedavi başarısızlığı açısından DOX+RIF rejimine üstünlüğü gösterilememiştir (OR=0.55, %95 GA=0.78-1.15).
Bayındır ve arkadaşlarının 17. soruda detayları verilmiş olan çalışmasında (351), STREP+DOX+RIF ile 3’lü kombinasyon tedavisi alan 22 hastada tedavi başarısızlığı ve relaps görülmemişken, 2’li STREP+TET tedavi kombinasyonu alan 20 hastanın ikisinde tedavi başarısızlığı görülmüş, relaps izlenmemiş; 2’li STREP+DOX tedavi kombinasyonu alan 21 hastanın dördünde tedavi başarısızlığı görülmüş, relaps izlenmemiş; 2’li DOX+RIF tedavi kombinasyonu alan 20 hastanın üçünde tedavi başarısızlığı, ikisinde relaps görülmüş; 2’li OFX+RIF tedavi kombinasyonu alan 19 hastanın ise beşinde tedavi başarısızlığı, beşinde relaps izlenmiştir.
Buzgan ve arkadaşlarının (352) 17. soruda detayları verilmiş olan çalışmasında, 53 olgu DOX+STREP+RIF içeren 3’lü tedavi rejimiyle izlenmiş, bu gruptaki hastalarda 12. ayda relaps oranının % 5.7 (n=3) şeklinde gözlendiği ve diğer tedavi rejimlerine göre daha düşük olduğu bildirilmiştir. Bu çalışmada 35 olgu DOX+RIF, 41 olgu DOX+STREP, 12 olgu ise CIP+DOX şeklinde 2’li tedavi rejimi kullanmış olup 2’li tedavi alan gruplarda relaps oranları sırasıyla %11.4 (n=4), %7.3 (n=3) ve %16.7 (n=2) olarak bulunmuştur.
Jia ve arkadaşlarının (353) 17. soruda detayları verilmiş olan çalışmasında, DOX+RIF+levofloksasin (LEV) ile 3’lü tedavi rejimi alan 39 hastanın ikisinde relaps izlenirken, 2’li tedavi rejimlerinden DOX+RIF alan 55 hastanın dördünde, DOX+STREP alan 11 hastanın ikisinde, DOX+moksifloksasin (MOX) alan 17 hastanın üçünde ve RIF+LEV alan 15 hastanın üçünde relaps izlenmiştir.
Ulu-Kılıç ve arkadaşlarının (355) 17. soruda detayları verilmiş olan çalışmasında, 3’lü tedavi rejimlerinden DOX+RIF+STREP kullanan 141 hastanın 11’inde, DOX+RIF+GEN alan 22 hastanın hiçbirinde, DOX+RIF+CIP kullanan 11 hastanın birinde tedavi başarısızlığı görülürken; 2’li tedavi rejimlerinden DOX+STREP alan sekiz hastanın birinde ve DOX+RIF alan 95 hastanın sekizinde tedavi başarısızlığı görülmüştür.
Mermut ve arkadaşlarının (357) retrospektif gözlemsel çalışmasında, osteoartiküler tutulumu olan 70 hastada DOX+STREP+RIF tedavisi alanlarla DOX+STREP tedavisi alanlar relaps açısından değerlendirilmiştir; DOX+STREP+RIF tedavisi alan 42 hastada relaps oranı %7 (n=3), DOX+STREP tedavisi alan hastalarda relaps oranı %11 (n=7) olarak bulunmuştur. (Bkz. Ek Şekil 34-36 ve Ek Tablo 40, 41)
Önerinin Gerekçesi: Brucella spp. spondilodiskiti olan hastalarda tedavi rejimlerini karşılaştıran çalışmaların meta-analizinde, 3’lü antimikrobiyal kombinasyonların, 2’li kombinasyonlardan daha başarılı olduğu görülmüştür. Brucella spp. spondilodiskiti tedavisinde üç antimikrobiyal içeren kombinasyon tedavisi önerilir.
Bilgi Açığı: Randomize kontrollü çalışmaların olmayışı ve kullanılan tedavi rejimlerinin farklı ajanlar içerip standart olmayışı nedeniyle kanıta dayalı güçlü öneri yapmak oldukça güçtür. Bu alanda, DOX+STREP+RIF rejimiyle DOX+STREP veya DOX+RIF rejimini karşılaştıracak, daha fazla sayıda hasta içeren randomize kontrollü çalışmalara ihtiyaç vardır.
19- Brucella spp. spondilodiskiti tedavisinde kinolon içeren tedavi rejimleri içermeyen rejimlere üstün müdür?
Öneri: Brucella spp. spondilodiskiti olan hastalarda kinolon içeren antimikrobiyal kombinasyonlarla, içermeyen kombinasyonları karşılaştıran çalışmaların meta-analizinde, var olan çalışmaların kanıt düzeylerinin ve kalitesinin yetersiz olduğu görülmüştür. Brucella spp. spondilodiskiti tedavisinde kinolon içeren kombinasyonların kullanımı konusunda kanıta dayalı öneri yapılabilmesi mümkün değildir, bu konuda bilgi boşluğu vardır. Rehber grubunda yer alan uzmanlar tarafından, Brucella spp. spondilodiskiti olgularının kombinasyon tedavisinde kinolonların, bu grup antimikrobiklerle ilgili artan güvenlik endişeleri nedeniyle, ilk seçenek olarak yer almaması, ilk seçenek ilaçların (DOX, RIF, GEN, STREP) yan etki, ilaç etkileşimi gibi herhangi bir nedenle kullanılamadığı durumlarda düşünülmesi önerilir (Bilgi boşluğu).
Kanıtların Özeti: Biri randomize kontrollü, dördü gözlemsel çalışma olmak üzere toplam beş çalışmanın verileri incelenmiştir (351,352,354, 355,359). Veriler tedavi başarısızlığı açısından analiz edilmiş ve toplam 665 hastada kinolon içeren rejimle kinolon içermeyen rejimlerin tedavi başarısızlığı üzerine etkisi değerlendirilmiştir. Kinolon içeren rejim kinolon içermeyen rejime göre daha fazla tedavi başarısızlığı (OR=2.30, %95 GA=1.26-4.19) ile ilişkilidir. Ayrıca 2’li tedavi rejimine (DOX-STREP veya DOX-RIF) kinolon eklenmesi ve eklenmemesi arasında tedavi başarısızlığı açısından fark olup olmadığını değerlendirebilmek için 297 hasta içeren toplam üç gözlemsel çalışmanın verileri analiz edilmiştir. Tedavi başarısı için 2’li tedaviye kinolon eklenmesinin (OR=0.96, %95 GA=0.34-2.70) üstünlüğü gösterilememiştir. Ancak bahsedilen çalışmalarda tedavi rejimleri oldukça heterojen olup kinolon grubundan farklı ilaçlar bulunmaktadır.
Alp ve arkadaşlarının (357) prospektif, randomize olmayan çalışmasında, spinal tutulumla seyreden brusellozda DOX+STREP ve CIP+RIF tedavileri karşılaştırılmıştır. Sırasıyla 15 ve 16 hastanın değerlendirildiği çalışmada her iki tedavi rejiminde de relaps izlenmemiştir. DOX+STREP alanların sekizinde hafif derecede, birinde orta derecede sekel görülmüş olup CIP+RIF alanların ise dokuzunda hafif derecede, ikisinde orta derecede sekel görülmüştür. Burada görülen sekeller tedavi başarısızlığı olarak değerlendirilmiştir.
Bayındır ve arkadaşlarının (351) 17. soruda detayları verilmiş olan çalışmasında, kinolon içeren rejimlerden OFX+RIF alan 19 hastanın 10 (%52)’unda tedavi başarısızlığı (5 hastada) veya relaps (5 hastada) izlenmişken, kinolon içermeyen diğer rejimlerde tedavi başarısızlığı ve relaps oranlarının %0-25 arasında değiştiği bildirilmiştir.
Buzgan ve arkadaşlarının (352) 17. soruda detayları verilmiş olan çalışmasında, 12 olguda CIP+DOX, 35 olguda DOX+RIF, 41 olguda DOX+STREP, 53 olguda ise DOX+STREP+RIF tedavi rejimleri uygulanmış ve 12 ay içinde relaps oranı diğer tüm rejimlerdeki oranlardan fazla olacak şekilde %16.7 bulunmuştur.
Jia ve arkadaşlarının (354) 17. soruda detayları verilmiş olan çalışmasında, kinolon içeren rejimlerden DOX+RIF+LEV alan 39 hastanın ikisinde, DOX+MOX alan 17 hastanın üçünde, RIF+LEV alan 15 hastanın üçünde relaps izlenmişken; kinolon içermeyen rejimlerden DOX+RIF alan 55 hastanın dördünde, DOX+STR alan 11 hastanın ikisinde relaps izlenmiştir.
Ulu-Kılıç ve arkadaşlarının (355) 17. soruda detayları verilmiş olan çalışmasında, kinolon içeren rejimlerden DOX+RIF+CIP alan 11 hastanın birinde tedavi başarısızlığı görülürken, kinolon içermeyen rejimlerden DOX+STREP alan sekiz hastanın birinde, DOX+RIF+STREP alan 141 hastanın 11’inde, DOX+RIF alan 95 hastanın sekizinde tedavi başarısızlığı görülmüştür. Aynı çalışmada, DOX+RIF+CN alan 22 hastanın hiçbirinde tedavi başarısızlığı görülmemiştir. (Bkz. Ek Şekil 37, 38 ve Ek Tablo 42, 43).
Önerinin Gerekçesi: Kinolon grubu antibiyotiklerin standart ilaçlar olan DOX, STREP ve RIF yerine kullanılması uygun değildir. Ayrıca standart tedavi rejimine eklendiğinde de benzer sonuçlar elde edilmektedir. Kinolonlar istenmeyen etkiler dolayısıyla standart ilaçların kullanılamadığı durumlarda alternatif tedavide düşünülmelidir. Brucella spp. spondilodiskiti olan hastalarda kinolon içeren antimikrobiyal kombinasyonlarla, içermeyen kombinasyonları karşılaştıran çalışmaların kanıt düzeylerinin ve kalitesinin yetersiz olduğu görülmüştür. Brucella spp. spondilodiskiti tedavisinde kinolon içeren kombinasyonların kullanımı konusunda bilgi boşluğu vardır, öneri yapılabilmesi mümkün değildir.
Bilgi Açığı: Kinolon içeren rejimlerle içermeyen rejimlerin karşılaştırıldığı randomize kontrollü çalışmalara ihtiyaç vardır.
20- Brucella spp. spondilodiskiti tedavisinde üç aydan uzun süreli tedavi üç aydan kısa süreli tedavilere üstün müdür?
Öneri: Brucella spp. spondilodiskiti olan hastalarda üç aydan uzun süren antimikrobiyal tedavi rejimlerini, üç aydan kısa tedavilerle karşılaştıran çalışmaların meta-analizinde, var olan çalışmaların kanıt düzeylerinin ve kalitesinin yetersiz olduğu görülmüştür. Brucella spp. spondilodiskitinde ideal tedavi süresi konusunda kanıta dayalı öneri yapılabilmesi mümkün değildir, bu konuda bilgi boşluğu vardır. Rehber grubunda yer alan uzmanlar tarafından, Brucella spp. spondilodiskiti tedavisinin en az üç ay uygulanması, tedavi sonunda klinik ve radyolojik olarak hasta bazında yapılacak değerlendirmeye göre sürenin uzatılması önerilir (Bilgi boşluğu).
Kanıtların Özeti: Üç gözlemsel çalışmanın verileri incelendi (358-360). Çalışma verileri tedavi başarısızlığı (relaps ve sekel) açısından analize dahil edilerek sonuçlar elde edildi. Üç çalışmanın içerdiği toplam 157 hastada üç aydan uzun süreli herhangi bir tedavi rejimiyle üç ay ve daha az süreli herhangi bir tedavi rejiminin tedavi başarısızlığı üzerine etkisi değerlendirildi. Üç aydan uzun süreli tedavi verilmesinin, tedavi başarısızlığı açısından, üç ay ve daha az tedavi verilmesine üstünlüğü gösterilemedi (OR=0.63, %95 GA=0.25-1.57). Analize farklı iki süreyi karşılaştırmadığı için dahil edilemeyen ancak uzun süreli tedavinin (en az altı ay) başarısını vurgulayan Ioannou ve arkadaşlarının (361) çalışmasında da vurgulandığı gibi tedavi süresine klinik ve radyolojik bulgulara göre hasta bazında karar verilebilir.
El Miedany ve arkadaşlarının (358), prospektif gözlemsel, çok merkezli çalışmasında yapılan analizlerden birinde osteoartiküler brusellozda farklı sürelerde tedavi verilen hastalarda relaps oranları değerlendirilmiştir. Bu çalışmada üç aydan az tedavi alan yedi hastanın 4 (%57.1)’ünde relaps görülürken, üç aydan uzun süre tedavi alan 90 hastanın 17 (%18.8)’sinde relaps görülmüştür.
Solera ve arkadaşlarının (359) prospektif gözlemsel çalışmasında, brusella spondilodiskiti olan 35 hasta, 1-6 yıl arasında değişen sürelerde izlenmiş olup sekel gelişen hastaların sonuçları tedavi başarısızlığı olarak değerlendirildi. Üç aydan az tedavi alan 21 hastanın 15 (%71.4)’inde tedavi başarısızlığı görülürken, üç aydan fazla tedavi alan 14 hastanın 9 (%64.2)’unda tedavi başarısızlığı görüldü.
Yılmaz ve arkadaşlarının (360) retrospektif gözlemsel çalışmasında, brusella spondilodiskiti olan 25 hasta 1 ay-10 yıl arasında değişen sürelerde izlenmiş olup sekel gelişen hastaların sonuçları tedavi başarısızlığı olarak değerlendirildi. Üç aydan az tedavi alan beş hastanın 1 (%20)’inde tedavi başarısızlığı görülürken, üç aydan fazla tedavi alan 20 hastanın 9 (%45)’unda tedavi başarısızlığı görüldü. (Bkz. Ek Şekil 39 ve Ek Tablo 44, 45)
Önerinin Gerekçesi: Çalışmalar analiz edilirken, çeşitli tedavi rejimleri uygulanan hastalar tedavi süresi üç ay ve daha kısa süreli olanlar ve üç aydan uzun olanlar şeklinde iki gruba ayrılmış ve tedavi sonrasında sekel görülüp görülmemesine göre tedavi başarısı değerlendirilmiştir. Tedavi rejimleri benzer değildir. Ayrıca Brucella spp. spondilodiskiti olan hastalarda üç aydan uzun süren antimikrobiyal tedavi rejimlerini, üç aydan kısa süren tedavilerle karşılaştıran çalışmaların kanıt düzeylerinin ve kalitesinin yetersiz olduğu görülmüştür. Brucella spp. spondilodiskiti tedavisinin süresinin ne kadar olması gerektiği konusunda bilgi boşluğu vardır, öneri yapılabilmesi mümkün değildir.
Bilgi Açığı: Brusella spondilodiskiti tedavisinde aynı rejimi farklı sürelerde alan hasta verilerinin karşılaştırıldığı randomize kontrollü çalışmalara ihtiyaç vardır.
Danışman Değerlendirmesi
Bağımsız dış danışman.
Yazar Katkıları
Fikir/Kavram – S.Ş.Y., M.A., G.A., A.A., N.D., Ö.E., A.K.Ç., S.S.K., N.T.; Tasarım – S.Ş.Y., A.B., S.Ö.; Denetleme – S.Ş.Y., A.B., S.Ö.; Kaynak ve Fon Sağlama – S.Ş.Y., M.A., G.A., A.A., N.D., Ö.E., A.K.Ç., S.S.K., N.T.; Malzemeler/Hastalar – E.T.Y., S.Ö., A.B., S.B., F.K., E.M.S., M.A., S.S.K., N.T.; Veri Toplama ve/veya İşleme – E.T.Y., S.Ö., A.B., S.B., F.K., E.M.S., M.A., S.S.K., N.T.; Analiz ve/veya Yorum – S.Ş.Y., G.A., A.A., Ö.A., N.D., Ö.E., A.K.Ç., C.A.; Literatür Taraması – E.T.Y., S.Ö., A.B., S.B., F.K., E.M.S., M.A., S.S.K., N.T.; Makale Yazımı – S.Ş.Y., M.A., G.A., A.A., N.D., Ö.E., A.K.Ç., S.S.K., N.T., S.Ö., A.B., S.B., F.K., E.M.S., E.T.Y.; Eleştirel İnceleme – S.Ş.Y., G.A., Ö.A., A.A., Ö.E., N.D., A.K.Ç., S.S.K., N.T., M.A.
Çıkar Çatışması
Yazarlar herhangi bir çıkar çatışması bildirmemiştir.
Finansal Destek
Yazarlar finansal destek beyan etmemiştir.
Referanslar
- Handbook for Clinical Practice Guidelines Development (Version 2.2018) [Internet]. Arlington: The Infectious Disease Society of America. [erişim 2 Mayıs 2019]. https://idsocietyorg.app.box.com/s/zumf91rnftiv9xfzos5eot9sg2tgg2fr
- Disclosure of Interest (Updated February 2021) [Internet]. International Committee of Medical Journal Editors (ICMJE). [erişim 12 Ocak 2023]. https://www.icmje.org/disclosure-of-interest/
- Yükseköğretim Kanunu [Internet]. Ankara: T.C. Cumhurbaşkanlığı Mevzuat Bilgi Sistemi. [erişim 12 Ocak 2023]. https://www.mevzuat.gov.tr/mevzuatmetin/1.5.2547.pdf
- Schünemann H, Brożek J, Guyatt G, Oxman A (eds). Grade Handbook [Internet]. Grading of Recommendations, Assessment, Development and Evaluation (GRADE) Working Group (www.gradeworkinggroup.org).[erişim 2 Mayıs 2019]. https://gdt.gradepro.org/app/handbook/handbook.html
- Higgins JP, Altman DG, Gøtzsche PC, et al; Cochrane Bias Methods Group; Cochrane Statistical Methods Group. The Cochrane Collaboration’s tool for assessing risk of bias in randomised trials. BMJ. 2011;343:d5928. [CrossRef]
- Whiting PF, Rutjes AW, Westwood ME, et al; QUADAS-2 Group. QUADAS-2: a revised tool for the quality assessment of diagnostic accuracy studies. Ann Intern Med. 2011;155(8):529-36. [CrossRef]
- Wells GA, Shea B, O’Connell D, et al. The Newcastle-Ottawa scale (NOS) for nonrandomized studies and QUADAS-2 tool for diagnostic test accuracy studies. [Internet]. Ottawa: The Ottowa Hospital Research Institute. [erişim 13 Mayıs 2019]. https://www.ohri.ca/programs/clinical_epidemiology/oxford.asp
- Guyatt GH, Oxman AD, Vist GE, et al; GRADE Working Group. GRADE: an emerging consensus on rating quality of evidence and strength of recommendations. BMJ. 2008;336(7650):924-6. [CrossRef]
- Wyatt HV. Lessons from the history of brucellosis. Rev Sci Tech. 2013;32(1):17-25. [CrossRef]
- Murray PR, Rosenthal KS, MA Pfaller, et al. Medical Microbiology. 9th ed. Amsterdam: Elsevier Inc., 2021; 293-306.
- Pappas G, Akritidis N, Bosilkovski M, Tsianos E. Brucellosis. N Engl J Med. 2005;352(22):2325-36. [CrossRef]
- Rowlinson MC, Lee P. 16.6 Brucella spp.—Brucellosis. In: Snyder JW, Leber AL, eds. Clinical Microbiology Procedures Handbook. 4th ed. Washington DC: ASM Press, 2016: 16.6.1-16.6.12.
- Laine CG, Scott HM, Arenas-Gamboa AM. Human brucellosis: Widespread information deficiency hinders an understanding of global disease frequency. PLoS Negl Trop Dis. 2022;16(5):e0010404. [CrossRef]
- Annual Epidemiological Report for 2020: Brucellosis [Internet]. Solna: European Centre for Disease Prevention and Control (ECDC). [erişim 15 Mayıs 2022]. https://www.ecdc.europa.eu/sites/default/files/documents/AER_2020_Report_BRUC.pdf
- European Food Safety Authority; European Centre for Disease Prevention and Control. The European Union One Health 2020 Zoonoses Report. EFSA J. 2021;19(12):e06971. [CrossRef]
- Tao Z, Chen Q, Chen Y, et al. Epidemiological characteristics of human brucellosis – China, 2016-2019. China CDC Wkly. 2021;3(6):114-9.
- Musallam II, Abo-Shehada MN, Hegazy YM, Holt HR, Guitian FJ. Systematic review of brucellosis in the Middle East: disease frequency in ruminants and humans and risk factors for human infection. Epidemiol Infect. 2016;144(4):671-85. [CrossRef]
- Wang XH, Jiang H. [Global prevalence of human brucellosis]. Zhonghua Liu Xing Bing Xue Za Zhi. 2020;41(10):1717-22. Chinese. [CrossRef]
- Pappas G, Papadimitriou P, Akritidis N, Christou L, Tsianos EV. The new global map of human brucellosis. Lancet Infect Dis. 2006;6(2):91-9. [CrossRef]
- Bruselloz İstatistik Verileri [Internet]. Ankara: T.C Sağlık Bakanlığı Halk Sağlığı Genel Müdürlüğü Zoonotik ve Vektörel Hastalıklar Daire Başkanlığı. [erişim 15 Ekim 2022]. https://hsgm.saglik.gov.tr/tr/zoonotikvektorel-bruselloz/istatistik.html
- Çakır Ş, Yıldırım M. [Control and eradication strategies of brucellosis small ruminants in Turkey]. Dicle Üniv Vet Fak Derg. 2018;(2)98-104. Turkish.
- Haque N, Bari MS, Hossain MA, et al. An overview of Brucellosis. Mymensingh Med J. 2011;20(4):742-7.
- Ergönül O, Zeller H, Kiliç S, et al. Zoonotic infections among veterinarians in Turkey: Crimean-Congo hemorrhagic fever and beyond. Int J Infect Dis. 2006;10(6):465-9. [CrossRef]
- Gül HC, Erdem H. Brucellosis. In: Mandell GL, Bennett JE, Dolin R, eds. Mandell, Douglas, and Bennett’s Principles and Practice of Infectious Diseases. 9th ed. Philadelphia: Churchill Livingstone, 2020: 2753-8.
- Nicoletti P. Relationship between animal and human disease. In: Young EJ, Corbel MJ, eds. Brucellosis: Clinical and Laboratory Aspects. 1st ed. Boca Raton, Florida: CRC Press, 1989: 41-3.
- Brucellosis in humans and animals [Internet]. Geneva: World Health Organization. [erişim 14 Mayıs 2022]. https://www.who.int/publications/i/item/9789241547130
- Brucellosis Reference Guide 2017 [Internet]. Atlanta: Centers for Disease Control and Prevention (CDC). [erişim 14 Mayıs 2022]. https://www.cdc.gov/brucellosis/pdf/brucellosi-reference-guide.pdf
- Bulaşıcı Hastalıkların İhbarı ve Bildirim Sistemi: Standart Tanı, Sürveyans ve Laboratuvar Rehberı̇, 2004 [Internet]. Ankara T.C. Sağlık Bakanlığı Temel Sağlık Hizmetleri Genel Müdürlüğü. [erişim 14 Mayıs 2022]. https://dosyasb.saglik.gov.tr/Eklenti/1442,bhastaliktedavipdf.pdf?0
- Yagupsky P, Morata P, Colmenero JD. Laboratory diagnosis of human brucellosis. Clin Microbiol Rev. 2019;33(1):e00073-19. [CrossRef]
- Christoforidou S, Kyritsi M, Boukouvala E, et al. Identification of Brucella spp. isolates and discrimination from the vaccine strain Rev.1 by MALDI-TOF mass spectrometry. Mol Cell Probes. 2020;51:101533. [CrossRef]
- Brucellosis (Brucella spp.): 2010 Case Definition [Internet]. Atlanta: Centers for Disease Control and Prevention. [erişim 14 Mayıs 2022]. https://ndc.services.cdc.gov/case-definitions/brucellosis-2010/
- WHO recommended strategies for the prevention and control of communicable diseases, 2001 [Internet]. Geneva: World Health Organization (WHO). [erişim 14 Mayıs 2022]. https://apps.who.int/iris/handle/10665/67088
- Guven T, Ugurlu K, Ergonul O, et al. Neurobrucellosis: clinical and diagnostic features. Clin Infect Dis. 2013;56(10):1407-12. [CrossRef]
- Ceran N, Turkoglu R, Erdem I, et al. Neurobrucellosis: clinical, diagnostic, therapeutic features and outcome. Unusual clinical presentations in an endemic region. Braz J Infect Dis. 2011;15(1):52-9.
- Demiraslan H, Metan G, Mese EA, et al. Neurobrucellosis: an evaluation of a rare presentation of brucellosis from a tertiary care centre in Central Anatolia, Turkey. Trop Doct. 2009;39(4):233-5. [CrossRef]
- Karsen H, Tekin Koruk S, Duygu F, Yapici K, Kati M. Review of 17 cases of neurobrucellosis: clinical manifestations, diagnosis, and management. Arch Iran Med. 2012 Aug;15(8):491-4.
- Zheng N, Wang W, Zhang JT, et al. Neurobrucellosis. Int J Neurosci. 2018;128(1):55-62. [CrossRef]
- Erdem H, Kilic S, Sener B, et al. Diagnosis of chronic brucellar meningitis and meningoencephalitis: the results of the Istanbul-2 study. Clin Microbiol Infect. 2013;19(2):E80-6. [CrossRef]
- Jiao LD, Chu CB, Kumar CJ, et al. Clinical and laboratory findings of nonacute neurobrucellosis. Chin Med J (Engl). 2015;128(13):1831-3. [CrossRef]
- Bodur H, Erbay A, Akinci E, Colpan A, Cevik MA, Balaban N. Neurobrucellosis in an endemic area of brucellosis. Scand J Infect Dis. 2003;35(2):94-7. [CrossRef]
- Demiroğlu YZ, Turunç T, Karaca S, et al. [Neurological involvement in brucellosis; clinical classification, treatment and results]. Mikrobiyol Bul. 2011;45(3):401-10. Turkish.
- Ibrahimagić OĆ, Smajlović D, Dostović Z, Iljazović A, Kojić B, Zonić L. Neurobrucellosis and cerebral venous sinus thrombosis: a case report. Acta Clin Belg. 2017;72(5):343-5. [CrossRef]
- Miguel PS, Fernández G, Vasallo FJ, et al. Neurobrucellosis mimicking cerebral tumor: case report and literature review. Clin Neurol Neurosurg. 2006;108(4):404-6. [CrossRef]
- Algahtani H, Shirah B, Abdulghani D, Farhan R, Algahtani R. Occupational neurobrucellosis mimicking a brain tumor: A case report and review of the literature. Case Rep Infect Dis. 2017;2017:1434051. [CrossRef]
- Soares CN, Angelim AIM, Brandão CO, Santos RQ, Mehta R, Silva MTTD. Neurobrucellosis: the great mimicker. Rev Soc Bras Med Trop. 2022;55:e05672021. [CrossRef]
- Anadure RK, Goel J, Sahu S, Vidhale T. Recurrent encephalopathy with transverse myelitis: An uncommon presentation of neurobrucellosis. J Neurosci Rural Pract. 2019;10(4):703-6. [CrossRef]
- Nepal G, Balayar R, Bhatta S, et al. Neurobrucellosis: A differential not to be missed in patients presenting with neuropsychiatric features. Clin Case Rep. 2021;9(6):e04190. [CrossRef]
- Seidel G, Pardo CA, Newman-Toker D, Olivi A, Eberhart CG. Neurobrucellosis presenting as leukoencephalopathy: the role of cytotoxic T lymphocytes. Arch Pathol Lab Med. 2003;127(9):e374-7. [CrossRef]
- Panagariya A, Sharma B, Mathew V. Pseudotumor–like presentation of neurobrucellosis. J Assoc Physicians India. 2007;55:301-2.
- Jochum T, Kliesch U, Both R, Leonhardi J, Bär KJ. Neurobrucellosis with thalamic infarction: a case report. Neurol Sci. 2008;29(6):481-3. [CrossRef]
- Dias MS, Morganho A, Passão V, Aguiar T, Pedrosa R. [Neuro-brucellosis. Report of 8 cases]. Acta Med Port. 1995;8(12):671-5. Portuguese.
- Malhi AB, Ridal M, Bouchal S, Belahsen MF, El Alami MN. [Neurobrucellosis: a treatable cause of sensorineural hearing loss not to ignore]. Pan Afr Med J. 2015;22:122. French. [CrossRef]
- Lima JI, Canelas CF, Veiga AS, Carvalho DM. Neurobrucellosis and venous sinus thrombosis: an uncommon association. Rev Soc Bras Med Trop. 2016;49(3):383-5. [CrossRef]
- Maji S, Manjunath N, Bahubali VH, et al. Neurobrucellosis: A neglected entity? An update from tertiary care Neurocentre of South East Asia. J Neurol Sci. 2020;411:116683. [CrossRef]
- CLSI. Methods for Antimicrobial Dilution and Disk Susceptibility Testing of Infrequently Isolated or Fastidious Bacteria. 3rd ed. CLSI guideline M45. Wayne, PA: Clinical and Laboratory Standards Institute; 2015.
- ISO 20776-1:2006: Clinical Laboratory Testing and In Vitro Diagnostic Test Systems—Susceptibility Testing of Infectious Agents and Evaluation of Performance of Antimicrobial Susceptibility Test Devices—Part 1: Reference Method for Testing the In Vitro Activity of Antimicrobial Agents against Rapidly Growing Aerobic Bacteria Involved in Infectious Diseases. International Organization for Standardization: Geneva, Switzerland, 2006.
- Tscherne A, Mantel E, Boskani T, et al; EMERGE AST Working Group. Adaptation of Brucella melitensis Antimicrobial Susceptibility Testing to the ISO 20776 Standard and Validation of the Method. Microorganisms. 2022;10(7):1470. [CrossRef]
- Ariza J, Bosilkovski M, Cascio A, et al; International Society of Chemotherapy; Institute of Continuing Medical Education of Ioannina. Perspectives for the treatment of brucellosis in the 21st century: the Ioannina recommendations. PLoS Med. 2007;4(12):e317. [CrossRef]
- Roushan MR, Gangi SM, Ahmadi SA. Comparison of the efficacy of two months of treatment with co-trimoxazole plus doxycycline vs. co-trimoxazole plus rifampin in brucellosis. Swiss Med Wkly. 2004;134(37-38):564-8. [CrossRef]
- Akova M, Gür D, Livermore DM, Kocagöz T, Akalin HE. In vitro activities of antibiotics alone and in combination against Brucella melitensis at neutral and acidic pHs. Antimicrob Agents Chemother. 1999;43(5):1298-300. [CrossRef]
- Atkins HS, Spencer S, Brew SD, et al. Evaluation of azithromycin, trovafloxacin and grepafloxacin as prophylaxis against experimental murine Brucella melitensis infection. Int J Antimicrob Agents. 2010;36(1):66-8. [CrossRef]
- Solera J, Beato JL, Martínez-Alfaro E, Segura JC, de Tomas E; Grupo de Estudio de Castilla la Mancha de Enfermedades Infecciosas Group. Azithromycin and gentamicin therapy for the treatment of humans with brucellosis. Clin Infect Dis. 2001;32(3):506-9. [CrossRef]
- Arapović J, Kompes G, Dedić K, et al. Antimicrobial resistance profiles of human Brucella melitensis isolates in three different microdilution broths: the first multicentre study in Bosnia and Herzegovina. J Glob Antimicrob Resist. 2022;29:99-104. [CrossRef]
- Parlak M, Güdücüoğlu H, Bayram Y, et al. Identification and determination of antibiotic susceptibilities of Brucella strains isolated from patients in van, Turkey by conventional and molecular methods. Int J Med Sci. 2013;10(10):1406-11. [CrossRef]
- Tuon FF, Cerchiari N, Cequinel JC, et al; Brucellosis Workgroup. Guidelines for the management of human brucellosis in the State of Paraná, Brazil. Rev Soc Bras Med Trop. 2017;50(4):458-64. [CrossRef]
- Robichaud S, Libman M, Behr M, Rubin E. Prevention of laboratory-acquired brucellosis. Clin Infect Dis. 2004 Jun 15;38(12):e119-22. [CrossRef]
- Zervos MJ, Bostic G. Exposure to Brucella in the laboratory. Lancet. 1997;349(9052):651. [CrossRef]
- Third case of rifampin/penicillin-resistant strain of RB51 brucella from consuming raw milk, January 24, 2019 [Internet]. Pennsylvania Department of Health. [erişim 16 Mayıs 2022]. https://www.health.pa.gov/topics/Documents/HAN/2019-PAHAN-434-01-24-19-ADV_RB-51.pdf
- Centers for Disease Control and Prevention (CDC). Laboratory-acquired brucellosis–Indiana and Minnesota, 2006. MMWR Morb Mortal Wkly Rep. 2008;57(2):39-42.
- Andriopoulos P, Kalogerakou A, Rebelou D, et al. Prevalence of Brucella antibodies on a previously acute brucellosis infected population: sensitivity, specificity and predictive values of Rose Bengal and Wright standard tube agglutination tests. Infection. 2015;43(3):325-30. [CrossRef]
- Ciftçi C, Ozoğ F, Oztekin A, et al. [Comparison of the serological tests used for the laboratory diagnosis of brucellosis]. Mikrobiyol Bul. 2005;39(3):291-9. Turkish.
- Díaz R, Casanova A, Ariza J, Moriyón I. The Rose Bengal Test in human brucellosis: a neglected test for the diagnosis of a neglected disease. PLoS Negl Trop Dis. 2011;5(4):e950. [CrossRef]
- Mert A, Ozaras R, Tabak F, et al. The sensitivity and specificity of Brucella agglutination tests. Diagn Microbiol Infect Dis. 2003;46(4):241-3. [CrossRef]
- Purwar S, Metgud SC, Mutnal MB, Nagamoti MB, Patil CS. Utility of serological tests in the era of molecular testing for diagnosis of human brucellosis in endemic area with limited resources. J Clin Diagn Res. 2016;10(2):DC26-9. [CrossRef]
- Sirmatel F, Türker M, Bozkurt AI. [Evaluation of the methods used for the serologic diagnosis of brucellosis]. Mikrobiyol Bul. 2002;36(2):161-7. Turkish.
- Vrioni G, Gartzonika C, Kostoula A, Boboyianni C, Papadopoulou C, Levidiotou S. Application of a polymerase chain reaction enzyme immunoassay in peripheral whole blood and serum specimens for diagnosis of acute human brucellosis. Eur J Clin Microbiol Infect Dis. 2004;23(3):194-9. [CrossRef]
- El-Hossain Aly Reda S, Abd El-Messiah MA, Madkour LA, Kassem AEM. Serology versus real time PCR in the diagnosis of human brucellosis. J Pure Appl Microbio. 2017;11(2):677-83. [CrossRef]
- Arabacı F, Oldacay M. Evaluation of serological diagnostic tests for human Brucellosis in an endemic area. J Microbiol Infect Dis. 2012;2(2):50-6. [CrossRef]
- Çeken S, Kaygusuz S, Kılıç D, Ağalar C. [Diagnosis of acute brucellosis by polymerase chain reaction technique]. Turk Hij Den Biyol Derg. 2015;72(2):91-8. Turkish. [CrossRef]
- Ertek M, Yazgı, H, Özkurt Z, Ayyildiz A, Parlak M. Comparison of the diagnostic value of the standard tube agglutination test and the ELISA IgG and IgM in patients with brucellosis. Turk J Med Sci. 2006;36(3):159-63.
- Memish ZA, Almuneef M, Mah MW, Qassem LA, Osoba AO. Comparison of the Brucella Standard Agglutination Test with the ELISA IgG and IgM in patients with Brucella bacteremia. Diagn Microbiol Infect Dis. 2002;44(2):129-32. [CrossRef]
- Asaad AM, Alqahtani JM. Serological and molecular diagnosis of human brucellosis in Najran, Southwestern Saudi Arabia. J Infect Public Health. 2012;5(2):189-94. [CrossRef]
- Álvarez-Ojeda MG, Saldaña-Fuentes C, Ballesteros-Elizondo MR, et al. [Comparison of the tests polymerase chain reaction, serology, and blood culture with respect to sensitivity and specificity for detection of Brucella spp. in human samples]. Gac Med Mex. 2015;151(5):620-7. Spanish.
- Khodabakhshi B, Abbasi A, Torabi Rostami M, Joshaghani H R, Roshandel G. Comparison of quantitative real-time polymerase chain reaction (qRT-PCR) and agglutination assays in diagnosis of brucellosis in Golestan Province, North of Iran. JoMMID. 2019;7(4):116-9.
- Kuila P, Dutta D, Chakrabarty U, Chatterjee D, Das S. Comparison of serological tests and PCR for diagnosis of human brucellosis suffering from fever. Asian J Pharm Clin Res. 2017;10(5):109-11. [CrossRef]
- Morata P, Queipo-Ortuño MI, Reguera JM, García-Ordoñez MA, Cárdenas A, Colmenero JD. Development and evaluation of a PCR-enzyme-linked immunosorbent assay for diagnosis of human brucellosis. J Clin Microbiol. 2003;41(1):144-8. [CrossRef]
- Surucuoglu S, El S, Ural S, et al. Evaluation of real-time PCR method for rapid diagnosis of brucellosis with different clinical manifestations. Pol J Microbiol. 2009;58(1):15-9.
- Mitka S, Anetakis C, Souliou E, Diza E, Kansouzidou A. Evaluation of different PCR assays for early detection of acute and relapsing brucellosis in humans in comparison with conventional methods. J Clin Microbiol. 2007;45(4):1211-8. [CrossRef]
- Ranjbar M, Rezaiee AA, Hashemi SH, Mehdipour S. Neurobrucellosis: report of a rare disease in 20 Iranian patients referred to a tertiary hospital. East Mediterr Health J. 2009;15(1):143-8.
- McLean DR, Russell N, Khan MY. Neurobrucellosis: clinical and therapeutic features. Clin Infect Dis. 1992;15(4):582-90. [CrossRef]
- Patra S, Kalwaje Eshwara V, Pai AR, Varma M, Mukhopadhyay C. Evaluation of clinical, diagnostic features and therapeutic outcome of neurobrucellosis: a case series and review of literature. Int J Neurosci. 2022;132(11):1080-90. [CrossRef]
- Oueslati I, Berriche A, Ammari L, et al. Epidemiological and clinical characteristics of neurobrucellosis case patients in Tunisia. Med Mal Infect. 2016;46(3):123-30. [CrossRef]
- Dar W, Wani M, Mir F, et al. Isolated neurobrucellosis-characteristic clinical and laboratory features. Acta Neurol Belg. 2022;122(6):1469-75. [CrossRef]
- Karaoglan I, Namiduru M, Akcali A, Cansel N. Different manifestations of nervous system involvement by neurobrucellosis. Neurosciences (Riyadh). 2008;13(3):283-7.
- Daif AK. The value of oligoclonal bands in neurobrucellosis. Ann Saudi Med. 1991;11(4):411-3. [CrossRef]
- Fan S, Ren H, Wei Y, et al. Next-generation sequencing of the cerebrospinal fluid in the diagnosis of neurobrucellosis. Int J Infect Dis. 2018;67:20-4. [CrossRef]
- Wen H, Jin D, Cai L, Wu T, Liu H. Neurobrucellosis with ischemic stroke and spinal cord involvement: a case report. BMC Neurol. 2021;21(1):129. [CrossRef]
- Du Y, Yang H, Jiang H, Du X. A Death Due to Neurobrucellosis – Linfen City, Shanxi Province, China, May 2021. China CDC Wkly. 2021;3(53):1144-5. [CrossRef]
- Yaşar K, Şengöz G, Yıldırım F, Nazlıcan Ö. [Evaluation of cases with neurobrucellosis]. Bakırköy Tıp Dergisi. 2007;3:57-60. Turkish.
- Demirdağ K, Özden M, Kalkan M, Çelik İ, Kılıç SS. [Brucellosis: Retrospective evaluation of 146 cases]. Flora. 2002;7(2):120-5. Turkish.
- Turkoglu SA, Halicioglu S, Sirmatel F, Yildiz M, Yildiz N, Yildiz S. Vasculitis and neurobrucellosis: Evaluation of nine cases using radiologic findings. Brain Behav. 2018;8(4):e00947. [CrossRef]
- Rossi M, Tascini C, Carannante N, Di Caprio G, Sofia S, Iacobello C. Neurobrucellosis: diagnostic and clinical management of an atypical case. New Microbiol. 2018;41(2):165-7.
- Raina S, Sharma A, Sharma R, Bhardwaj A. Neurobrucellosis: A case report from Himachal Pradesh, India, and review of the literature. Case Rep Infect Dis. 2016;2016:2019535. [CrossRef]
- Eren S, Bayam G, Ergönül O, et al. Cognitive and emotional changes in neurobrucellosis. J Infect. 2006;53(3):184-9. [CrossRef]
- Sanchez-Sousa A, Torres C, Campello MG, et al. Serological diagnosis of neurobrucellosis. J Clin Pathol. 1990;43(1):79-81. [CrossRef]
- Ata F, Yousaf Z, Sharif MK, Abdallah A. Demyelinating steroid-responsive neurobrucellosis. BMJ Case Rep. 2020;13(3):e233798. [CrossRef]
- Obiako OR, Ogoina D, Danbauchi SS, Kwaifa SI, Chom ND, Nwokorie E. Neurobrucellosis–a case report and review of literature. Niger J Clin Pract. 2010;13(3):347-50.
- Ben Ali N, Mrabet-Khiari H, Echebbi S, Mrabet A. [Neurobrucellosis]. Tunis Med. 2011;89(11):866-7. French.
- Vafaeimanesh J, Shahamzeh A, Bagherzadeh M. Neurobrucellosis in systemic lupus erythematosus. Caspian J Intern Med. 2017;8(2):119-22. [CrossRef]
- Despotopoulos S, Akinosoglou K, Tzimas T, Akritidis N, Gogos C. Diagnosis of neurobrucellosis in resource-limited real-world settings: A case-series of 8 patients. J Neurol Sci. 2017;379:293-5. [CrossRef]
- Mahdavi FS, Abbasi Khoshsirat N, Madanipour A. Lumbosacral polyradiculitis associated with brucellosis. IDCases. 2020;23:e01028. [CrossRef]
- Al-Sous MW, Bohlega S, Al-Kawi MZ, Alwatban J, McLean DR. Neurobrucellosis: clinical and neuroimaging correlation. AJNR Am J Neuroradiol. 2004;25(3):395-401.
- Yamout BI, Massouh J, Hushaymi I, Zeineddine M, Saab G. Neurobrucellosis presenting as longitudinally extensive transverse myelitis: A case report and review of the literature. Mult Scler Relat Disord. 2020;40:101947. [CrossRef]
- Kanjo MA, Ahmed HM, Alnahari EA. Unusual presentation of neurobrucellosis in Jeddah, Kingdom of Saudi Arabia. Neurosciences (Riyadh). 2021;26(4):385-8. [CrossRef]
- Kemec Z, Tüzün C, Yıldırım İ. Neurobrucellosis presented by cerebral salt wasting. Cureus. 2020;12(5):e8275. [CrossRef]
- Inan AS, Ceran N, Erdem I, et al. Neurobrucellosis with transient ischemic attack, vasculopathic changes, intracerebral granulomas and basal ganglia infarction: a case report. J Med Case Rep. 2010;4:340. [CrossRef]
- Colmenero JD, Queipo-Ortuño MI, Reguera JM, Baeza G, Salazar JA, Morata P. Real time polymerase chain reaction: a new powerful tool for the diagnosis of neurobrucellosis. J Neurol Neurosurg Psychiatry. 2005;76(7):1025-7. [CrossRef]
- Bajin MD, Savaş Ö, Aslan F, Sennaroğlu L. Cochlear implantation in neurobrucellosis. Balkan Med J. 2016;33(1):108-11. [CrossRef]
- Mergen B, Sarici AM, Baltu F, Ozaras R, Adaletli I. An unusual presentation of sixth nerve palsy: neurobrucellosis. GMS Ophthalmol Cases. 2019;9:Doc13. [CrossRef]
- Ge Y, Guan HZ, Fan SY, Zhu R, Ma XJ, Li TS. [A clinical analysis of 20 patients with neurobrucellosis]. Zhonghua Nei Ke Za Zhi. 2017;56(10):729-33. Chinese. [CrossRef]
- Khademi A, Poursadeghfard M, Nikandish Noubar R. Neurobrucellosis presented with a hyperacute onset: A case report. Iran J Public Health. 2016;45(12):1652-5.
- Lulu AR, Araj GF, Khateeb MI, Mustafa MY, Yusuf AR, Fenech FF. Human brucellosis in Kuwait: a prospective study of 400 cases. Q J Med. 1988;66(249):39-54.
- Díaz-Vintimilla JJ, Rosales Hernández LA, Zapata-Arenas R, Sánchez-Montes S, Becker I. Subacute transverse myelitis as a clinical presentation of neurobrucellosis. J Infect Dev Ctries. 2021;15(9):1359-63. [CrossRef]
- Akdeniz H, Irmak H, Anlar O, Demiröz AP. Central nervous system brucellosis: presentation, diagnosis and treatment. J Infect. 1998;36(3):297-301. [CrossRef]
- Mahajan SK, Sharma A, Kaushik M, Raina R, Sharma S, Banyal V. Neurobrucellosis: an often forgotten cause of chronic meningitis. Trop Doct. 2016 Jan;46(1):54-6. [CrossRef]
- Shah IA, Kawoos Y, Sanai BA, Rabyang S, Banday D. Neurobrucellosis presenting as acute psychosis. J Neurosci Rural Pract. 2018;9(4):644-6. [CrossRef]
- Akcay Hİ, Kurtuncu M, Celik SY, Gunduz T, Eraksoy M. Neurobrucellosis presenting with mania. Acta Neurol Belg. 2017;117(1):373-5. [CrossRef]
- Bellissima P, Turturici MA. [Neurobrucellosis: clinical and therapeutic features]. Infez Med. 1998;6(1):25-30. Italian.
- Yazdi NA, Moosavi NS, Alesaeidi S, Salahshour F, Ghaemi O. Diffuse neurobrucellosis of cerebellum, brainstem, spinal cord, and cauda equina: A case report and literature review. J Radiol Case Rep. 2022;16(5):1-9. [CrossRef]
- Dreshaj S, Shala N, Dreshaj G, Ramadani N, Ponosheci A. Clinical manifestations in 82 neurobrucellosis patients from Kosovo. Mater Sociomed. 2016;28(6):408-11.
- Spyrou A, Natsis KS, Papamichalis E, Mourtzinos H. Intraventricular haemorrhage and seizures in a patient with dementia: a case of chronic neurobrucellosis. Age Ageing. 2019;48(4):601-2. [CrossRef]
- Farhan N, Khan EA, Ahmad A, Ahmed KS. Neurobrucellosis: A report of two cases. J Pak Med Assoc. 2017;67(11):1762-3.
- Tekin-Koruk S, Duygu F, Gursoy B, Karaagac L, Bayraktar M. A rare case of seronegative neurobrucellosis. Ann Saudi Med. 2010;30(5):412-4. [CrossRef]
- Li Q, Dai F, Zhu L, Wang J, Jing Y. [Ocular syndromes in patients with neurobrucellosis]. Zhonghua Yan Ke Za Zhi. 2015;51(12):896-900. Chinese.
- Asadipooya K, Dehghanian A, Omrani GH, Abbasi F. Short-course treatment in neurobrucellosis: a study in Iran. Neurol India. 2011;59(1):101-3. [CrossRef]
- Awada A, Korri H, Issa Z, Ali Y, Beaini M. [Progressive paraparesis with sensorineural deafness and leukoencephalopathy revealing neurobrucellosis]. Rev Neurol (Paris). 2011;167(2):181-4. French. [CrossRef]
- Kesav P, Modi M, Singla V, Khurana D, Prabhakar S. Kaleidoscopic presentation of neurobrucellosis. J Neurol Sci. 2013;331(1-2):165-7. [CrossRef]
- Yetkin MA, Bulut C, Erdinc FS, Oral B, Tulek N. Evaluation of the clinical presentations in neurobrucellosis. Int J Infect Dis. 2006;10(6):446-52. [CrossRef]
- Wu M, Cui R, Li F, Huo L, Luo Y. Extensive intraspinal hypermetabolism caused by neurobrucellosis shown on 18F-FDG PET/CT. Clin Nucl Med. 2020;45(9):722-4. [CrossRef]
- Goktepe AS, Alaca R, Mohur H, Coskun U. Neurobrucellosis and a demonstration of its involvement in spinal roots via magnetic resonance imaging. Spinal Cord. 2003;41(10):574-6. [CrossRef]
- Sarmiento Clemente A, Amerson-Brown MH, Foster CE. An adolescent with neurobrucellosis caused by brucella abortus cattle vaccine strain RB51. Pediatr Infect Dis J. 2021;40(9):e353-5. [CrossRef]
- Banerjee TK, Pal AK, Das S. Neurobrucellosis presenting as acute meningoencephalitis. Neurol India. 1999;47(2):160.
- Kochar DK, Kumawat BL, Agarwal N, et al. Meningoencephalitis in brucellosis. Neurol India. 2000;48(2):170-3.
- Marques IB, Marto N, Raimundo A, Gil-Gouveia R. Myelitis and polyradiculoneuropathy with severe pain: Unusual neurological manifestations as presenting symptoms of brucellosis. Neurologist. 2018;23(4):131-4. [CrossRef]
- Krishnan C, Kaplin AI, Graber JS, Darman JS, Kerr DA. Recurrent transverse myelitis following neurobrucellosis: immunologic features and beneficial response to immunosuppression. J Neurovirol. 2005;11(2):225-31. [CrossRef]
- Nashi S, Preethish-Kumar V, Maji S, et al. Case report: Neurobrucellosis with plastered spinal arachnoiditis: A magnetic resonance imaging-based report. Am J Trop Med Hyg. 2018;98(3):800-2. [CrossRef]
- Ozkavukcu E, Tuncay Z, Selçuk F, Erden I. An unusual case of neurobrucellosis presenting with unilateral abducens nerve palsy: clinical and MRI findings. Diagn Interv Radiol. 2009;15(4):236-8. [CrossRef]
- Gloeb DJ, Lupi C, O’Sullivan MJ. Neurobrucellosis complicating pregnancy: a case report. Infect Dis Obstet Gynecol. 1994;1(6):285-9. [CrossRef]
- Udugama JMM, Lekamwasam JDVC, Piyasiri DLB, Wijeweera KDDS, Vijayabandara MSK, Wickramasinge DSA. Neurobrucellosis complicated with lumbar epidural abscess; A shepherd’s agony. Ceylon Med J. 2018;63(4):190-1. [CrossRef]
- Kyebambe PS. Acute brucella meningomyeloencephalo-spondylosis in a teenage male. Afr Health Sci. 2005;5(1):69-72.
- Gul HC, Erdem H, Gorenek L, et al. Management of neurobrucellosis: an assessment of 11 cases. Intern Med. 2008;47(11):995-1001. [CrossRef]
- Molins A, Montalbán J, Codina A. Parkinsonism in neurobrucellosis. J Neurol Neurosurg Psychiatry. 1987;50(12):1707-8. [CrossRef]
- Dias SP, Sequeira J, Almeida M. Spastic paraparesis and sensorineural hearing loss: keep brucellosis in mind. J Neurol Sci. 2018 Feb 15;385:144-5. [CrossRef]
- Sturniolo G, Mondello P, Bruno S, et al. Neurobrucellosis associated with syndrome of inappropriate antidiuretic hormone with resultant diabetes insipidus and hypothyroidism. J Clin Microbiol. 2010;48(10):3806-9. [CrossRef]
- Rajan R, Khurana D, Kesav P. Deep gray matter involvement in neurobrucellosis. Neurology. 2013;80(3):e28-9. [CrossRef]
- Trifiletti RR, Restivo DA, Pavone P, Giuffrida S, Parano E. Diabetes insipidus in neurobrucellosis. Clin Neurol Neurosurg. 2000;102(3):163-5. [CrossRef]
- Guney F, Gumus H, Ogmegul A, et al. First case report of neurobrucellosis associated with hydrocephalus. Clin Neurol Neurosurg. 2008;110(7):739-42. [CrossRef]
- Montazeri M, Sadeghi K, Khalili H, Davoudi S. Fever and psychosis as an early presentation of Brucella-associated meningoencephalitis: a case report. Med Princ Pract. 2013;22(5):506-9. [CrossRef]
- Yousif B, Nelson J. Neurobrucellosis–a rare complication of renal transplantation. Am J Nephrol. 2001;21(1):66-8. [CrossRef]
- Karaoglan I, Akcali A, Ozkur A, Namýdurua M. Neurobrucellosis mimicking demyelinizating disorders. Ann Saudi Med. 2008;28(2):148-9. [CrossRef]
- Suárez-Esquivel M, Ruiz-Villalobos N, Jiménez-Rojas C, et al. Brucella neotomae Infection in Humans, Costa Rica. Emerg Infect Dis. 2017;23(6):997-1000. Erratum in: Emerg Infect Dis. 2017;23(8):1435. [CrossRef]
- Hatipoglu CA, Yetkin A, Ertem GT, Tulek N. Unusual clinical presentations of brucellosis. Scand J Infect Dis. 2004;36(9):694-7. [CrossRef]
- Nas K, Tasdemir N, Cakmak E, Kemaloglu MS, Bukte Y, Geyik MF. Cervical intramedullary granuloma of Brucella: a case report and review of the literature. Eur Spine J. 2007;16 Suppl 3(Suppl 3):255-9. Erratum in: Eur Spine J. 2007;16 Suppl 3:260. [CrossRef]
- Munckhof WJ, Jennison AV, Bates JR, Gassiep I. First report of probable neurobrucellosis in Australia. Med J Aust. 2013;199(6):423-5. [CrossRef]
- Baldi PC, Araj GF, Racaro GC, Wallach JC, Fossati CA. Detection of antibodies to Brucella cytoplasmic proteins in the cerebrospinal fluid of patients with neurobrucellosis. Clin Diagn Lab Immunol. 1999;6(5):756-9. [CrossRef]
- Tugcu B, Nacaroglu SA, Coskun C, Kuscu DY, Onder F. Chronic Meningitis Complicating Intracranial Hypertension in Neurobrucellosis: A Case Report. Semin Ophthalmol. 2015;30(5-6):429-31. [CrossRef]
- Van den Enden E, Vlieghe E, Demeester R, Ieven G, Jansens H, Van den Hauwe L. A traveler with neurobrucellosis. Travel Med Infect Dis. 2009;7(4):215-8. [CrossRef]
- Kizilkilic O, Turunc T, Yildirim T, Demiroglu YZ, Hurcan C, Uncu H. Successful medical treatment of intracranial abscess caused by Brucella spp. J Infect. 2005;51(1):77-80. [CrossRef]
- Kochar DK, Gupta BK, Gupta A, Kalla A, Nayak KC, Purohit SK. Hospital-based case series of 175 cases of serologically confirmed brucellosis in Bikaner. J Assoc Physicians India. 2007;55:271-5.
- Alqwaifly M, Al-Ajlan FS, Al-Hindi H, Al Semari A. Central nervous system brucellosis granuloma and white matter disease in immunocompromised patient. Emerg Infect Dis. 2017;23(6):978-81. [CrossRef]
- Bingöl A, Togay-Işikay C. Neurobrucellosis as an exceptional cause of transient ischemic attacks. Eur J Neurol. 2006;13(5):544-8. [CrossRef]
- Kesav P, Vishnu VY, Khurana D. Fatal disseminated neurobrucellosis. QJM. 2014;107(4):321-2. [CrossRef]
- Karaca S, Demiroglu YZ, Karataş M, Tan M. Acquired progressive spastic paraparesis due to neurobrucellosis: a case report. Acta Neurol Belg. 2007;107(4):118-21.
- Adaletli I, Albayram S, Gurses B, et al. Vasculopathic changes in the cerebral arterial system with neurobrucellosis. AJNR Am J Neuroradiol. 2006;27(2):384-6.
- Ozisik HI, Ersoy Y, Refik Tevfik M, Kizkin S, Ozcan C. Isolated intracranial hypertension: a rare presentation of neurobrucellosis. Microbes Infect. 2004 Jul;6(9):861-3. [CrossRef]
- Sengoz G, Yasar KK, Yildirim F, Nazlican O. Sensorineural hearing loss in neurobrucellosis. Neurosciences (Riyadh). 2008;13(3):299-301.
- Erdem M, Namiduru M, Karaoglan I, Kecik VB, Aydin A, Tanriverdi M. Unusual presentation of neurobrucellosis: a solitary intracranial mass lesion mimicking a cerebral tumor : a case of encephalitis caused by Brucella melitensis. J Infect Chemother. 2012;18(5):767-70. [CrossRef]
- Ay S, Tur BS, Kutlay S. Cerebral infarct due to meningovascular neurobrucellosis: a case report. Int J Infect Dis. 2010;14 Suppl 3:e202-4. [CrossRef]
- Ciftçi E, Erden I, Akyar S. Brucellosis of the pituitary region: MRI. Neuroradiology. 1998;40(6):383-4. [CrossRef]
- Solaroglu I, Kaptanoglu E, Okutan O, Beskonakli E. Solitary extra-axial posterior fossa abscess due to neurobrucellosis. J Clin Neurosci. 2003;10(6):710-2. [CrossRef]
- Bilen S, Güneş HN, Saka M, Ak F. Four different clinical manifestations of neurobrucellosis (case reports). Eur J Intern Med. 2008;19(8):e75-7. [CrossRef]
- Yilmaz M, Ozaras R, Mert A, Ozturk R, Tabak F. Abducent nerve palsy during treatment of brucellosis. Clin Neurol Neurosurg. 2003;105(3):218-20. [CrossRef]
- Roig J, Sarró F, Borrás M, Fernández E. [Intracranial hypertension as presentation of neurobrucellosis in a patient on hemodialysis]. Nefrologia. 2008;28(5):568-9. Spanish.
- Koussa S, Chemaly R. Neurobrucellosis presenting with diffuse cerebral white matter lesions. Eur Neurol. 2003;50(2):121-3. [CrossRef]
- Ulas UH, Hamamcioglu K, Eroglu E, et al. Paraplegia associated with brucellosis involving the anterior lumbrosacral nerve roots. J Peripher Nerv Syst. 2003;8(1):8-12. [CrossRef]
- Novati R, Viganò MG, de Bona A, Nocita B, Finazzi R, Lazzarin A. Neurobrucellosis with spinal cord abscess of the dorsal tract: a case report. Int J Infect Dis. 2002;6(2):149-50. [CrossRef]
- Tuncer-Ertem G, Tülek N, Yetkin MA. [Case report: subdural hemorrhage in neurobrucellosis]. Mikrobiyol Bul. 2004;38(3):253-6. Turkish.
- Zaidan R, Al Tahan AR. Cerebral venous thrombosis: a new manifestation of neurobrucellosis. Clin Infect Dis. 1999;28(2):399-400. [CrossRef]
- Oliveri Rl, Matera G, Focà A, Zappia M, Aguglia U, Quattrone A. Polyradiculoneuropathy with cerebrospinal fluid albuminocytological dissociation due to neurobrucellosis. Clin Infect Dis. 1996;23(4):833-4. [CrossRef]
- da Cunha S, Gaspar E, Meliço-Silvestre A, Azlvedo-Bernarda R, da Costa C. Neurobrucellosis–another cause of increased adenosine deaminase activity in cerebrospinal fluid. J Infect Dis. 1990;161(1):156-7. [CrossRef]
- Kutlu M, Cevahir N, Erdenliğ-Gürbilek S, Akalın Ş, Uçar M, Sayın-Kutlu S. The first report of Brucella suis biovar 1 isolation in human in Turkey. J Infect Public Health. 2016;9(5):675-8. [CrossRef]
- Güleç F, Uysal HS, Y, Zorlu Y. Lökoensefalopati ve sağırlık ile başvuran Bir nörobruselloz olgusu. Turk Norol Derg. 2011;17:102-5.
- Ertem G, Kutlu G, Ataman Hatipoğlu Ç, Bulut C, Demiröz AP. A rare presentation of brucellosis: polyradiculopathy and peripheral neuritis. Turkish Journal of Medical Sciences. 2012;42(2):359-64. [CrossRef]
- Kaya S, Kostakoğlu U. [A brucellosis case with macular rash and peripheral neuropathy]. Mikrobiyol Bul. 2009;43(1):147-51. Turkish.
- Karaca S, Selçuki D, Mavioğlu H, Dönmez H. [Neurobrucellosis]. Ankara Üniversitesi Tıp Fakültesi Mecmuası. 2001;54(4):381-6. Turkish.
- Ural O, Güler S. [Neurobrucellosis: A case report]. Flora 2007;12(4):208-10. Turkish.
- Ateş MA, Algül A, Geçici Ö, Semiz UB, Turhan V, Çetin M. [Acute psychosis due to neurobrucellosis: A case report]. Anadolu Psikiyatri Dergisi. 2008;9(3):188-90. Turkish.
- Özdemir D, Albayrak F, Cesur S, Gönenli B, Sözen T, Tekeli E. [A case of neurobrucellosis]. İnfeksiyon Dergisi. 2003;17(4):499-500.
- Akin A, Demiralin F, Bilgin RR, Tosun S, Mermut G, Gedizlioğlu M. A case of neurobrucellosis. J Exp Clin Med. 2015;32(1):39-41.
- Papadopoulos VE, Patas K, Tountopoulou A, et al. Seronegative neurobrucellosis-do we need new neurobrucellosis criteria? Int J Infect Dis. 2021;111:124-6. [CrossRef]
- Karsen H, Akdeniz H, Karahocagil MK, Irmak H, Sünnetçioğlu M. Toxic-febrile neurobrucellosis, clinical findings and outcome of treatment of four cases based on our experience. Scand J Infect Dis. 2007;39(11-12):990-5. [CrossRef]
- Bains R, Dahhan T, Belzowski A, Heinze ER, Wong AL, Clements PJ. An interesting case of neurobrucellosis mimicking neuropsychiatric lupus. Case Rep Rheumatol. 2018;2018:9793535. [CrossRef]
- Renard D, Taieb G, Heroum C, Lado S. Meningomyeloradiculitis as presenting feature of brucellosis. J Neurol. 2006;253(12):1651-2. [CrossRef]
- Mousa AR, Koshy TS, Araj GF, et al. Brucella meningitis: presentation, diagnosis and treatment–a prospective study of ten cases. Q J Med. 1986;60(233):873-85.
- Araj GF, Lulu AR, Khateeb MI, Saadah MA, Shakir RA. ELISA versus routine tests in the diagnosis of patients with systemic and neurobrucellosis. APMIS. 1988;96(2):171-6.
- Araj GF, Lulu AR, Saadah MA, Mousa AM, Strannegard IL, Shakir RA. Rapid diagnosis of central nervous system brucellosis by ELISA. J Neuroimmunol. 1986;12(3):173-82. [CrossRef]
- Li Q, Liu J, Jiang W, et al. A case of brucellosis-induced Guillain-Barre syndrome. BMC Infect Dis. 2022;22(1):72. [CrossRef]
- Ahmed R, Patil BS. Neurobrucellosis: a rare cause for spastic paraparesis. Braz J Infect Dis. 2009;13(3):245. [CrossRef]
- Vinod P, Singh MK, Garg RK, Agarwal A. Extensive meningoencephalitis, retrobulbar neuritis and pulmonary involvement in a patient of neurobrucellosis. Neurol India. 2007;55(2):157-9. [CrossRef]
- Kumral E, Çetin FE. Variants of avellis syndrome due to medulla oblongata infarction: a case series. neurologist. 2021;26(5):185-8. [CrossRef]
- Lantos PM, Rumbaugh J, Bockenstedt LK, et al. Clinical Practice Guidelines by the Infectious Diseases Society of America (IDSA), American Academy of Neurology (AAN), and American College of Rheumatology (ACR): 2020 Guidelines for the prevention, diagnosis and treatment of lyme disease. Clin Infect Dis. 2021;72(1):e1-e48. [CrossRef]
- Solera J, Geijo P, Largo J, et al; Grupo de Estudio de Castilla-la Mancha de Enfermedades Infecciosas. A randomized, double-blind study to assess the optimal duration of doxycycline treatment for human brucellosis. Clin Infect Dis. 2004;39(12):1776-82. [CrossRef]
- Colmenero Castillo JD, Hernandez Marquez S, Reguera Iglesias JM, Cabrera Franquelo F, Rius Diaz F, Alonso A. Comparative trial of doxycycline plus streptomycin versus doxycycline plus rifampin for the therapy of human brucellosis. Chemotherapy. 1989;35(2):146-52. [CrossRef]
- Agalar C, Usubutun S, Turkyilmaz R. Ciprofloxacin and rifampicin versus doxycycline and rifampicin in the treatment of brucellosis. Eur J Clin Microbiol Infect Dis. 1999;18(8):535-8. [CrossRef]
- Karabay O, Sencan I, Kayas D, Sahin I. Ofloxacin plus rifampicin versus doxycycline plus rifampicin in the treatment of brucellosis: a randomized clinical trial [ISRCTN11871179]. BMC Infect Dis. 2004;4:18. [CrossRef]
- Montejo JM, Alberola I, Glez-Zarate P, et al. Open, randomized therapeutic trial of six antimicrobial regimens in the treatment of human brucellosis. Clin Infect Dis. 1993;16(5):671-6. [CrossRef]
- Majzoobi MM, Hashmi SH, Emami K, Soltanian AR. Combination of doxycycline, streptomycin and hydroxychloroquine for short-course treatment of brucellosis: a single-blind randomized clinical trial. Infection. 2022;50(5):1267-71. [CrossRef]
- Acocella G, Bertrand A, Beytout J, et al. Comparison of three different regimens in the treatment of acute brucellosis: a multicenter multinational study. J Antimicrob Chemother. 1989;23(3):433-9. Erratum in: J Antimicrob Chemother. 1989;24(4):629. [CrossRef]
- Ariza J, Gudiol F, Pallares R, et al. Treatment of human brucellosis with doxycycline plus rifampin or doxycycline plus streptomycin. A randomized, double-blind study. Ann Intern Med. 1992;117(1):25-30. [CrossRef]
- Colmenero JD, Fernández-Gallardo LC, Agúndez JA, Sedeño J, Benítez J, Valverde E. Possible implications of doxycycline-rifampin interaction for treatment of brucellosis. Antimicrob Agents Chemother. 1994;38(12):2798-802. [CrossRef]
- Ersoy Y, Sonmez E, Tevfik MR, But AD. Comparison of three different combination therapies in the treatment of human brucellosis. Trop Doct. 2005;35(4):210-2. Erratum in: Trop Doct. 2006;36(2):128. [CrossRef]
- Hashemi SH, Gachkar L, Keramat F, et al. Comparison of doxycycline-streptomycin, doxycycline-rifampin, and ofloxacin-rifampin in the treatment of brucellosis: a randomized clinical trial. Int J Infect Dis. 2012;16(4):e247-51. [CrossRef]
- Ariza J, Gudiol F, Pallarés R, Rufí G, Fernández-Viladrich P. Comparative trial of co-trimoxazole versus tetracycline-streptomycin in treating human brucellosis. J Infect Dis. 1985;152(6):1358-9. [CrossRef]
- Solera J, Rodríguez-Zapata M, Geijo P, et al. Doxycycline-rifampin versus doxycycline-streptomycin in treatment of human brucellosis due to Brucella melitensis. The GECMEI Group. Grupo de Estudio de Castilla-la Mancha de Enfermedades Infecciosas. Antimicrob Agents Chemother. 1995;39(9):2061-7. [CrossRef]
- Roushan MR, Mohraz M, Hajiahmadi M, Ramzani A, Valayati AA. Efficacy of gentamicin plus doxycycline versus streptomycin plus doxycycline in the treatment of brucellosis in humans. Clin Infect Dis. 2006;42(8):1075-80. [CrossRef]
- Roushan MR, Amiri MJ, Janmohammadi N, Hadad MS, Javanian M, Baiani M, Bijani A. Comparison of the efficacy of gentamicin for 5 days plus doxycycline for 8 weeks versus streptomycin for 2 weeks plus doxycycline for 45 days in the treatment of human brucellosis: a randomized clinical trial. J Antimicrob Chemother. 2010;65(5):1028-35. [CrossRef]
- Akova M, Uzun O, Akalin HE, Hayran M, Unal S, Gür D. Quinolones in treatment of human brucellosis: comparative trial of ofloxacin-rifampin versus doxycycline-rifampin. Antimicrob Agents Chemother. 1993;37(9):1831-4. [CrossRef]
- Hasanain A, Mahdy R, Mohamed A, Ali M. A randomized, comparative study of dual therapy (doxycycline-rifampin) versus triple therapy (doxycycline-rifampin-levofloxacin) for treating acute/subacute brucellosis. Braz J Infect Dis. 2016;20(3):250-4. [CrossRef]
- Keramat F, Ranjbar M, Mamani M, Hashemi SH, Zeraati F. A comparative trial of three therapeutic regimens: ciprofloxacin-rifampin, ciprofloxacin-doxycycline and doxycycline-rifampin in the treatment of brucellosis. Trop Doct. 2009;39(4):207-10. [CrossRef]
- Kalo T, Novi S, Nushi A, Dedja S. Ciprofloxacin plus doxycycline versus rifampicin plus doxycycline in the treatment of acute brucellosis. Med Mal Infect. 1996;26: 587-9.
- Saltoglu N, Tasova Y, Inal AS, Seki T, Aksu HS. Efficacy of rifampicin plus doxycycline versus rifampicin plus quinolone in the treatment of brucellosis. Saudi Med J. 2002;23(8):921-4.
- Taghvaee MR, Nozadi MS, Hassani M. A comparison between doxycycline-rifampin and ciprofloxacin-rifampin regimens in the treatment of acute Brucellosis. Indian J Med Sci. 2011;65(10):436-43.
- Sarmadian H, Didgar F, Sufian M, Zarinfar N, Salehi F. Comparison between efficacy of ciprofloxacin doxycycline and rifampin ‐ doxycycline regimens in treatment and relapse of brucellosis. Tropical Medicine & International Health. 2009;14(suppl 2):209.
- FDA updates warnings for fluoroquinolone antibiotics [Internet]. New Hampshire: US.S. Food and Drug Administration (FDA). [erişim 12 Ekim 2022]. https://www.fda.gov/news-events/press-announcements/fda-updates-warnings-fluoroquinolone-antibiotics
- Bosilkovski M, Stojovski M, Siskova D, Ridov A, Kostoska E, Krstevski K. Brucellosis in pregnancy: case reports with different outcomes in an endemic region. Acta Clin Croat. 2020;59(2):338-43. [CrossRef]
- Sayılır K, Kutlu SS, Baykam N, Eren Ş, Çelikbaş AK, Dokuzoğuz B. [Spontaneous abortion due to Brucellosis: Report of two cases]. İnfeksiyon Dergisi. 2003;17(3):345-8. Turkish.
- Yapça ÖE, Satılmış ÖK, Yapça D, Gül S. [Brucella seroprevalence among pregnant women in Sorgun district of Yozgat]. KÜ Tıp Fak Derg. 2013;15(1):26-8. Turkish.
- Karcaaltincaba D, Sencan I, Kandemir O, Guvendag-Guven ES, Yalvac S. Does brucellosis in human pregnancy increase abortion risk? Presentation of two cases and review of literature. J Obstet Gynaecol Res. 2010;36(2):418-23. [CrossRef]
- al-Aska AK, Chagla AH. Laboratory-acquired brucellosis. J Hosp Infect. 1989;14(1):69-71. [CrossRef]
- Roushan MR, Baiani M, Asnafi N, Saedi F. Outcomes of 19 pregnant women with brucellosis in Babol, northern Iran. Trans R Soc Trop Med Hyg. 2011;105(9):540-2. [CrossRef]
- Jensenius M, von der Lippe B, Hermansen NO, et al. Brucellar mastitis: presentation of a case and review of the literature. Int J Infect Dis. 2008;12(1):98-100. [CrossRef]
- Giannacopoulos I, Eliopoulou MI, Ziambaras T, Papanastasiou DA. Transplacentally transmitted congenital brucellosis due to Brucella abortus. J Infect. 2002;45(3):209-10. [CrossRef]
- Cebesoy FB, Balat O, Mete A. An extraordinary cause of vertebral fracture in pregnant woman: brucellosis. Arch Gynecol Obstet. 2009;280(2):301-3. [CrossRef]
- Shamo’on H, Izzat M. Congenital brucellosis. Pediatr Infect Dis J. 1999;18(12):1110-1. [CrossRef]
- Ceylan A, Köstü M, Tuncer O, Peker E, Kırımi E. Neonatal brucellosis and breast milk. Indian J Pediatr. 2012;79(3):389-91. [CrossRef]
- Malone FD, Athanassiou A, Nores LA, Dalton ME. Poor perinatal outcome associated with maternal Brucella abortus infection. Obstet Gynecol. 1997;90(4 Pt 2):674-6. [CrossRef]
- Inan A, Erdem H, Elaldi N, et al. Brucellosis in pregnancy: results of multicenter ID-IRI study. Eur J Clin Microbiol Infect Dis. 2019;38(7):1261-8. [CrossRef]
- Akçam FZ, Akçam M, Yılmaz M, Temel EN, Kaya O, Yılmaz GR. [Neurobrucellosis: Two cases, two different presentations]. Turk J Neurol. 2020;26(4):342-5. Turkish. [CrossRef]
- Mutlu B, Bolca Z, Kalender B, Gündeş S, Vahaboğlu H. [A case of neurobrucellosis with depressive symptoms and treatment intoolerance]. İnfeksiyon Dergisi. 2002;16(1):99-101. Turkish.
- Türkoğlu R, Gencer M, Çetinkaya Y, Tireli H. [Neurobrucellosis mimicking multiple sclerosis: Report of two cases]. Archieves of Neuropsychiatry. 2007;44:120-3. Turkish.
- Kalkan A, Bulut V, Bulut S, Berilgen MS, Müngen B. [Neurobrucellosis: Case report]. İnfeksiyon Dergisi. 2000;14(1):131-4. Turkish.
- Ataman-Hatipoğlu Ç, Yetkin A, Tuncer-Ertem G, Tanyel E, Oral B, Tülek N. [Unusual clinical presentations of brucellosis]. İnfeksiyon Dergisi. 2005;19(1):47-52. Turkish.
- Kayaaslan B, Akıncı E, Baştuğ A, et al. Analysis of 161 adult patients with brucellosis. Turk J Med Sci. 2013;43:187-93. [CrossRef]
- Powers HR, Nelson JR, Alvarez S, Mendez JC. Neurobrucellosis associated with feral swine hunting in the southern United States. BMJ Case Rep. 2020;13(12):e238216. [CrossRef]
- Thomas R, Kameswaran M, Murugan V, Okafor BC. Sensorineural hearing loss in neurobrucellosis. J Laryngol Otol. 1993;107(11):1034-6. [CrossRef]
- Miyares FR, Deleu D, ElShafie SS, et al. Irreversible papillitis and ophthalmoparesis as a presenting manifestation of neurobrucellosis. Clin Neurol Neurosurg. 2007;109(5):439-41. [CrossRef]
- Islam MN. An elderly lady with neurobrucellosis and multiple co-morbid conditions. Mymensingh Med J. 2018;27(2):412-6.
- Fatani DF, Alsanoosi WA, Badawi MA, Thabit AK. Ceftriaxone use in brucellosis: A case series. IDCases. 2019;18:e00633. [CrossRef]
- Abduljabbar M. Efficacy of antibiotics in neurobrucellosis. Eur J Neurol. 1995;2(2):123-6. [CrossRef]
- Lemnouer A, Frikh M, Maleb A, Ahizoune A, Bourazza A, Elouennass M. Brucellosis: A cause of meningitis not to neglect. IDCases. 2017;10:97-99. [CrossRef]
- Vajramani GV, Nagmoti MB, Patil CS. Neurobrucellosis presenting as an intra-medullary spinal cord abscess. Ann Clin Microbiol Antimicrob. 2005;4:14. [CrossRef]
- Bussone G, La Mantia L, Grazzi L, Lamperti E, Salmaggi A, Strada L. Neurobrucellosis mimicking multiple sclerosis: a case report. Eur Neurol. 1989;29(4):238-40. [CrossRef]
- Bucher A, Gaustad P, Pape E. Chronic neurobrucellosis due to Brucella melitensis. Scand J Infect Dis. 1990;22(2):223-6. [CrossRef]
- al Kasab S, al Fagih M, al Rasheed A, et al. Management of Brucella endocarditis with aortic root abscess. Chest. 1990;98(6):1532-4. [CrossRef]
- Pazderka E, Jones JW. Brucella abortus endocarditis: successful treatment of an infected aortic valve. Arch Intern Med. 1982 Aug;142(8):1567-8. [CrossRef]
- Heibig J, Beall AC Jr, Myers R, Harder E, Feteih N. Brucella aortic endocarditis corrected by prosthetic valve replacement. Am Heart J. 1983;106(3):594-6. [CrossRef]
- Flugelman MY, Galun E, Ben-Chetrit E, Caraco J, Rubinow A. Brucellosis in patients with heart disease: when should endocarditis be diagnosed? Cardiology. 1990;77(4):313-7. [CrossRef]
- Randa T, Christelle E, Rachoin R, et al. Brucella involving the heart: a hidden disease. Int J Cardiovasc Imaging. 2021;37(10):2901-4. [CrossRef]
- Jeroudi MO, Halim MA, Harder EJ, Al-Siba’i MB, Ziady G, Mercer EN. Brucella endocarditis. Br Heart J. 1987;58(3):279-83. [CrossRef]
- Göz M, Gürsoy B, Hazar A, Demir D, Koçasan A, Söylemez N. Concomitant aortic valve replacement and mitral valve repair: A case of endocarditis of brucella. Göztepe Tıp Dergisi. 2009;24(4):201-3.
- Akinci E, Gol MK, Balbay Y. A case of prosthetic mitral valve endocarditis caused by Brucella abortus. Scand J Infect Dis. 2001;33(1):71-2. [CrossRef]
- Hadjinikolaou L, Triposkiadis F, Zairis M, Chlapoutakis E, Spyrou P. Successful management of Brucella mellitensis endocarditis with combined medical and surgical approach. Eur J Cardiothorac Surg. 2001;19(6):806-10. [CrossRef]
- Chan R, Hardiman RP. Endocarditis caused by Brucella melitensis. Med J Aust. 1993;158(9):631-2. [CrossRef]
- Guerrero ML, Aldámiz G, Bayón J, Cohen VA, Fraile J. Long-term survival of salvage cardiac transplantation for infective endocarditis. Ann Thorac Surg. 2011 Nov;92(5):e93-4. [CrossRef]
- Fernández-Guerrero ML, Martinell J, Aguado JM, Ponte MC, Fraile J, de Rábago G. Prosthetic valve endocarditis caused by Brucella melitensis. A report of four cases successfully treated with tetracycline, streptomycin, and sulfamethoxazole and trimethoprim plus valve replacement. Arch Intern Med. 1987;147(6):1141-3.
- Alhyari AR, Bakri FG, Al-Mousa EN, Al-Smady MM. Successful treatment of Brucella endocarditis with aortic root abscess. Saudi Med J. 2005;26(3):473-5.
- Sayar N, Terzi S, Yilmaz HY, et al. A case of prosthetic mitral valve Brucella endocarditis complicated with torsades de pointes. Heart Vessels. 2006;21(5):331-3. [CrossRef]
- Park SH, Choi YS, Choi YJ, Cho SH, Yoon HJ. Brucella endocarditis with splenic abscess: a report of the first case diagnosed in Korea. Yonsei Med J. 2009;50(1):142-6. [CrossRef]
- Pratt DS, Tenney JH, Bjork CM, Reller LB. Successful treatment of Brucella melitensis endocarditis. Am J Med. 1978;64(5):897-900. [CrossRef]
- Şimşek-Yavuz S, Şensoy A, Kaşıkçıoğlu H, et al. Infective endocarditis in Turkey: aetiology, clinical features, and analysis of risk factors for mortality in 325 cases. Int J Infect Dis. 2015;30:106-14. [CrossRef]
- Du N, Wang F. Clinical characteristics and outcome of Brucella endocarditis. Turk J Med Sci. 2016;46(6):1729-33. [CrossRef]
- Gunes Y, Tuncer M, Guntekin U, et al. Clinical characteristics and outcome of Brucella endocarditis. Trop Doct. 2009;39(2):85-8. [CrossRef]
- Jia B, Zhang F, Pang P, et al. Brucella endocarditis: Clinical features and treatment outcomes of 10 cases from Xinjiang, China. J Infect. 2017;74(5):512-4. [CrossRef]
- Jariwala P. 3D transthoracic echocardiography of Brucella endoaortitis and endocarditis of the aortic valve and ascending aorta. Echocardiography. 2013;30(7):E215-7. [CrossRef]
- Sasmazel A, Baysal A, Fedakar A, et al. Treatment of Brucella endocarditis: 15 years of clinical and surgical experience. Ann Thorac Surg. 2010;89(5):1432-6. [CrossRef]
- al-Harthi SS. The morbidity and mortality pattern of Brucella endocarditis. Int J Cardiol. 1989;25(3):321-4. [CrossRef]
- Amirghofran AA, Karimi A, Emaminia A, Sharifkazemi MB, Salaminia S. Brucellosis relapse causing prosthetic valve endocarditis and aortic root infective pseudoaneurysm. Ann Thorac Surg. 2011;92(4):e77-9. [CrossRef]
- Brigandi’ A, Terranova C, Toscano A, Vita G. Acute ischemic stroke due to endocarditis from Brucella infection. Neurol Sci. 2020;41(4):953-4. [CrossRef]
- Mert A, Kocak F, Ozaras R, et al. The role of antibiotic treatment alone for the management of Brucella endocarditis in adults: a case report and literature review. Ann Thorac Cardiovasc Surg. 2002;8(6):381-5.
- Sabzi F, Heidari A, Faraji R. Right ventricular outflow tract endocarditis caused by brucellosis. J Infect Public Health. 2017;10(5):678-80. [CrossRef]
- Cohen N, Golik A, Alon I, et al. Conservative treatment for Brucella endocarditis. Clin Cardiol. 1997;20(3):291-4. [CrossRef]
- Oguzhan N, Akgun H, Unal A, et al. Brucella glomerulonephritis and prosthetic valve endocarditis: a case report. Int Urol Nephrol. 2012;44(2):643-6. [CrossRef]
- Al Dahouk S, Schneider T, Jansen A, et al. Brucella endocarditis in prosthetic valves. Can J Cardiol. 2006;22(11):971-4. [CrossRef]
- Acar A, Turhan V, Diktaş H, Oncül O, Cavuşlu S. [A case of brucellosis complicated with endocarditis, pyelonephritis, sacroileitis and thyroiditis]. Mikrobiyol Bul. 2009;43(1):141-5. Turkish.
- Cay S, Cagirci G, Maden O, Balbay Y, Aydogdu S. Brucella endocarditis – a registry study. Kardiol Pol. 2009;67(3):274-80.
- Jacobs F, Abramowicz D, Vereerstraeten P, Le Clerc JL, Zech F, Thys JP. Brucella endocarditis: the role of combined medical and surgical treatment. Rev Infect Dis. 1990;12(5):740-4. [CrossRef]
- Almér LO. A case of brucellosis complicated by endocarditis and disseminated intravascular coagulation. Acta Med Scand. 1985;217(1):139-40. [CrossRef]
- Golden B, Layman TE, Koontz FP, Mergner WJ. Brucella suis endocarditis. South Med J. 1970 Apr;63(4):392-5.
- Yildiz A, Tufekcioglu O, Aras D, Ozeke O, Celenk MK, Sasmaz A. Myocardial noncompaction presenting with Brucella endocarditis. Int J Cardiol. 2009;131(3):e87-9. [CrossRef]
- Raju IT, Solanki R, Patnaik AN, Barik RC, Kumari NR, Gulati AS. Brucella endocarditis – a series of five case reports. Indian Heart J. 2013;65(1):72-7. [CrossRef]
- al-Kasab S, al-Fagih MR, al-Yousef S, et al. Brucella infective endocarditis. Successful combined medical and surgical therapy. J Thorac Cardiovasc Surg. 1988;95(5):862-7.
- Dourakis S, Sambatakou H, Tsiachris D, Kittou N, Alexopoulou A, Archimandritis A. A 70-year-old stock-breeder with tricuspid valve and defibrillator lead Brucella endocarditis. Int J Cardiol. 2008;126(3):e47-9. [CrossRef]
- Sunar H, Duran E. Vegetectomy in Brucella endocarditis. Ann Thorac Surg. 2002;73(6):2036. [CrossRef]
- Özsöyler I, Yılık L, Bozok S, et al. Brucella endocarditis: the importance of surgical timing after medical treatment (five cases). Prog Cardiovasc Dis. 2005;47(4):226-9. [CrossRef]
- Manade VV, Kakrani A, Gadage SN, Misra R. Brucella endocarditis in a non-endemic area presenting as pyrexia of unknown origin. BMJ Case Rep. 2014;2014:bcr2014203555. [CrossRef]
- Keleş C, Bozbuğa N, Sişmanoğlu M, et al. Surgical treatment of Brucella endocarditis. Ann Thorac Surg. 2001;71(4):1160-3. [CrossRef]
- O’Meara JB, Eykyn S, Jenkins BS, Braimbridge MV, Phillips I. Brucella melitensis endocarditis: successful treatment of an infected prosthetic mitral valve. Thorax. 1974;29(3):377-81. [CrossRef]
- Al-Khuwaitir TS, Wani BA, Sherbeeni SM. Combined Brucella melitensis and streptococcal viridans endocarditis. Saudi Med J. 2002;23(1):99-103.
- Obrenović-Kirćanski B, Velinović M, Vranes M, et al. Mitral valve endocarditis during brucellosis relapse. Vojnosanit Pregl. 2012;69(8):725-9.
- Yazıcı HU, Mert KU, Senol U, Ulus T. [A case with tricuspid valve Brucella endocarditis presenting with acute right heart failure]. Turk Kardiyol Dern Ars. 2012;40(4):364-7. Turkish. [CrossRef]
- Köse Ş, Serin Senger S, Ersan G, Oğuz F, Kuzucu L. Presentation of two cases diagnosed with Brucella endocarditis. Intern Med. 2012;51(8):953-5. [CrossRef]
- Yavuz T, Ozaydin M, Ulusan V, Ocal A, Ibrisim E, Kutsal A. A case of mitral stenosis complicated with seronegative Brucella endocarditis. Jpn Heart J. 2004;45(2):353-8. [CrossRef]
- Botta L, Bechan R, Yilmaz A, Di Bartolomeo R. Prosthetic valve endocarditis due to Brucella: successful outcome with a combined strategy. J Cardiovasc Med (Hagerstown). 2009;10(3):257-8. [CrossRef]
- Cakalagaoglu C, Keser N, Alhan C. Brucella-mediated prosthetic valve endocarditis with brachial artery mycotic aneurysm. J Heart Valve Dis. 1999;8(5):586-90.
- Tuncer M, Ekim H, Güneş Y, Güntekin U. Atrial septal defect presenting with Brucella endocarditis. Circ J. 2008;72(12):2096-7. [CrossRef]
- Koumallos N, Paschalis A, Antoniades C, et al. Valve replacement for Brucella endocarditis: two case reports. Int J Cardiol. 2008;127(2):e83-5. [CrossRef]
- Shetty RK, Madken M, Naha K, Vivek G. Successful management of native-valve Brucella endocarditis with medical therapy alone. BMJ Case Rep. 2013;2013:bcr2013200086. [CrossRef]
- Keshtkar-Jahromi M, Boroumand M, Razavi SM, et al. Brucella endocarditis, a report of 14 cases (1991-2009). J Infect. 2010;61(1):89-92. [CrossRef]
- Caylan R, Keske S, Durmaz T, Keles T, Tasyaran MA. A case of Brucella endocarditis in association with superficial femoral artery thrombus. Trop Doct. 2009;39(4):251-2. [CrossRef]
- Alsoub H, El-Shafie SS. A farmer with artificial valve endocarditis. Postgrad Med J. 2001;77(904):126-7. [CrossRef]
- Abu Romeh SH, Kozma GN, Johny KV, Sabha M. Brucella endocarditis causing acute renal failure. Nephron. 1987;46(4):388-9. [CrossRef]
- Je HG, Song H. Brucella endocarditis in a non-endemic country: first reported case in East Asia. Circ J. 2008;72(3):500-1. [CrossRef]
- Biyik I, Oto O, Ergene O. Brucella pancarditis with dissecting aortic root abscess, left ventricular pseudoaneurysm and ventricular septal defect. J Int Med Res. 2007;35(3):422-6. [CrossRef]
- Schvarcz R, Svedenhag J, Rådegran K. A case of Brucella melitensis endocarditis successfully treated by a combination of surgical resection and antibiotics. Scand J Infect Dis. 1995;27(6):641-2. [CrossRef]
- Sungur C, Sungur A, Gedikoglu G, et al. Fatal Brucella melitensis endocarditis in a hemodialysis patient. Nephron. 1994;67(2):234-5. [CrossRef]
- Leandro J, Roberto H, Antunes M. Brucella endocarditis of the aortic valve. Eur J Cardiothorac Surg. 1998;13(1):95-7. [CrossRef]
- Skillington PD, McGiffin DC, Kemp R, Bett JH, Holt G, Forgan-Smith R. Brucellosis complicated by aortic valve endocarditis. Aust N Z J Med. 1988 Dec;18(7):872-3. [CrossRef]
- Katircibaşi MT, Koçum HT, Cölkesen AY, Tekin A, Sezgin AT. Management of Brucella endocarditis on native mitral valve in a patient with prosthetic aortic valve: a case report. Int J Cardiol. 2008;129(2):300-1. [CrossRef]
- Murdaca G, Colombo BM, Caiti M, Cagnati P, Massa G, Puppo F. Remission of Brucella endocarditis in a patient with mitral valve mechanical prosthesis by antibiotic therapy alone: a case report. Int J Cardiol. 2007;117(1):e35-6. [CrossRef]
- Barham WB, Church P, Brown JE, Paparello S. Misidentification of Brucella species with use of rapid bacterial identification systems. Clin Infect Dis. 1993;17(6):1068-9. [CrossRef]
- Arslan H, Korkmaz ME, Kart H, Gül C. Management of Brucella endocarditis of a prosthetic valve. J Infect. 1998;37(1):70-1. [CrossRef]
- Platt P, Gray J, Carson P. Brucella endocarditis–a successfully treated case. J Infect. 1980;2(3):275-8. [CrossRef]
- Farid Z, Trabolsi B, Yassin W, Watten RH, Higashi GI. Acute brucellosis presenting as fever of unknown origin (FUO). Trans R Soc Trop Med Hyg. 1980;74(3):402-4. [CrossRef]
- Kalaycioglu S, Imren Y, Erer D, Zor H, Arman D. Brucella endocarditis with repeated mitral valve replacement. J Card Surg. 2005;20(2):189-92. [CrossRef]
- Lezaun R, Teruel J, Maître MJ, Artaza M. Brucella endocarditis on double valvular prosthesis. Postgrad Med J. 1980;56(652):119-20. [CrossRef]
- Alsoub H. Brucella infective endocarditis: a report of four successfully treated patients. Clin Microbiol Infect. 2001;7(7):382-5. [CrossRef]
- Iglesias A, Nuñez L. Brucella mellitensis endocarditis on a porcine heterograft bioprosthesis. Chest. 1981;80(6):747-9. [CrossRef]
- Hudson RA. Brucella abortus endocarditis; a case. Circulation. 1957;16(3):411-3. [CrossRef]
- Mohandas N, Balasubramanian R, Prasad SB. Can Brucella endocarditis be treated successfully with medical therapy alone? Trop Doct. 2009;39(2):123-4. [CrossRef]
- Kanji JN, Saxinger L. Brucella infection at cardiac pacemaker site in a patient who had consumed raw caribou meat in Northern Canada. CMAJ. 2018;190(37):E1108-E1110. [CrossRef]
- Tasbakan MI, Yamazhan T, Arda B, et al. Tissue culture positive prosthetic aortic valve Brucella endocarditis. Ir J Med Sci. 2006;175(2):84. [CrossRef]
- Rahman A, Burma O, Felek S, Yekeler H. Atrial septal defect presenting with Brucella endocarditis. Scand J Infect Dis. 2001;33(10):776-7. [CrossRef]
- Al-Majid FM. Pacemaker lead endocarditis due to Brucellosis. Saudi Med J. 2010;31(4):448-50.
- Koruk ST, Erdem H, Koruk I, et al. Management of Brucella endocarditis: results of the Gulhane study. Int J Antimicrob Agents. 2012;40(2):145-50. [CrossRef]
- Reguera JM, Alarcón A, Miralles F, Pachón J, Juárez C, Colmenero JD. Brucella endocarditis: clinical, diagnostic, and therapeutic approach. Eur J Clin Microbiol Infect Dis. 2003;22(11):647-50. [CrossRef]
- Rhodes HM, Williams DN, Hansen GT. Invasive human brucellosis infection in travelers to and immigrants from the Horn of Africa related to the consumption of raw camel milk. Travel Med Infect Dis. 2016;14(3):255-60. [CrossRef]
- Cancan Gursul N, Vardar I, Demirdal T, Gursul E, Ural S, Yesil M. Clinical and microbiological findings of infective endocarditis. J Infect Dev Ctries. 2016;10(5):478-87. [CrossRef]
- Yetkin U, Yılık L, Özsöyler İ, et al. Brucella endocarditis and its rare complications. Turk Gogus Kalp Dama. 2012;20(1):44-9. [CrossRef]
- Yıldız F, Bayram E, Kelle B, Erken E. Brucella endocarditis presenting with findings resembling vasculitis. Arch Rheumatol. 2015;30(1):79-82. [CrossRef]
- Şimşek-Yavuz S, Akar AR, Aydoğdu S, et al. [Diagnosis, treatment and prevention of infective endocarditis: Turkish consensus report]. Klimik Derg. 2019; 32(Suppl. 1): 2-116. Turkish. [CrossRef]
- Bayindir Y, Sonmez E, Aladag A, Buyukberber N. Comparison of five antimicrobial regimens for the treatment of brucellar spondylitis: a prospective, randomized study. J Chemother. 2003;15(5):466-71. [CrossRef]
- Buzgan T, Karahocagil MK, Irmak H, et al. Clinical manifestations and complications in 1028 cases of brucellosis: a retrospective evaluation and review of the literature. Int J Infect Dis. 2010;14(6):e469-78. [CrossRef]
- Colmenero JD, Ruiz-Mesa JD, Plata A, et al. Clinical findings, therapeutic approach, and outcome of brucellar vertebral osteomyelitis. Clin Infect Dis. 2008;46(3):426-33. [CrossRef]
- Jia B, Zhang F, Lu Y, et al. The clinical features of 590 patients with brucellosis in Xinjiang, China with the emphasis on the treatment of complications. PLoS Negl Trop Dis. 2017;11(5):e0005577. [CrossRef]
- Ulu-Kilic A, Karakas A, Erdem H, et al. Update on treatment options for spinal brucellosis. Clin Microbiol Infect. 2014;20(2):75-82. [CrossRef]
- Mermut G, Ozgenç O, Avcı M, et al. Clinical, diagnostic and therapeutic approaches to complications of brucellosis: an experience of 12 years. Med Princ Pract. 2012;21(1):46-50. [CrossRef]
- Alp E, Koc RK, Durak AC, et al. Doxycycline plus streptomycin versus ciprofloxacin plus rifampicin in spinal brucellosis [ISRCTN31053647]. BMC Infect Dis. 2006;6:72. [CrossRef]
- El Miedany YM, El Gaafary M, Baddour M, Ahmed I. Human brucellosis: do we need to revise our therapeutic policy? J Rheumatol. 2003;30(12):2666-72.
- Solera J, Lozano E, Martínez-Alfaro E, Espinosa A, Castillejos ML, Abad L. Brucellar spondylitis: review of 35 cases and literature survey. Clin Infect Dis. 1999;29(6):1440-9. [CrossRef]
- Yilmaz E, Parlak M, Akalin H, et al. Brucellar spondylitis: review of 25 cases. J Clin Rheumatol. 2004;10(6):300-7. [CrossRef]
- Ioannou S, Karadima D, Pneumaticos S, et al. Efficacy of prolonged antimicrobial chemotherapy for brucellar spondylodiscitis. Clin Microbiol Infect. 2011;17(5):756-62. [CrossRef]