En Çok Okunanlar
Özet
Amaç: Çalışma kapsamında, hastanemizde çalışılmış olan anti-hepatit C virusu (HCV) ve HCV-RNA test sonuçları incelenerek HCV-RNA çalışılması için uygun olan tarama testi eşik değerinin belirlenmesine ve doğru algoritmaların geliştirilmesine katkıda bulunmak amaçlandı.
Yöntemler: 2017-2019 tarihleri arasında hastanemize başvuran ve anti-HCV serolojik test sonuçlarında reaktivite saptanan hastalar, tespit edilebilen HCV-RNA test sonuçları ile birlikte retrospektif olarak incelendi. Anti-HCV reaktifliği olan hastalar; 0-20 yaş, 21-40 yaş, 41-60 yaş ve ≥61 yaş olarak dört gruba ayrılarak analiz edildi. HCV-RNA sonuçları da aynı yaş gruplarına göre değerlendirildi. Anti-HCV reaktifliği olup HCV-RNA sonuçlarına ulaşılabilen hastalar S/Co değerlerine göre 1-5 mIÜ/ml, 5.1-10 mIÜ/ml ve ≥10.1 mIÜ/ml olmak üzere üç gruba ve 1.0-3.8 mIÜ/ml ve ≥3.9 mIÜ/ml olmak üzere iki gruba ayrılarak incelendi.
Bulgular: Literatürdeki veriler doğrultusunda bizim çalışmamızda da anti-HCV reaktif hastalar S/Co değerlerine göre 1.0-3.8 mIÜ/ml ve ≥3.9 mIÜ/ml olmak üzere iki gruba ayrıldı; birinci gruptaki hastaların sadece %2’sinde HCV-RNA pozitifliği saptanırken, ikinci grupta bu oranının %44.4 olduğu görüldü. Hastalar, S/Co değerlerine göre 1-5 mIÜ/ml, 5.1-10 mIÜ/ml ve ≥10.1 mIÜ/ml olmak üzere üç gruba ayrıldığında; S/Co değeri 1-5 mIÜ/ml arasında olan 56 hastanın sadece %1.8’inde HCV-RNA pozitifliği saptanırken, S/Co değerinin 5.1-10 mIÜ/ml arasında olduğu grupta bu oran %25, S/Co değerinin ≥10.1 mIÜ/ml olduğu grupta ise %55.2 idi. Her iki kategoride de gruplar arasındaki fark istatistiksel olarak anlamlı düzeyde bulundu.
Sonuç: Anti-HCV testleri için ülkelerin kendi popülasyonlarını temsil edecek şekilde kapsamlı çalışmalar yapması, yaygın kullanımda olan kitler için eşik değer belirlemesi ve bunu algoritmalarla uygulanabilir hale getirmesi büyük önem taşımaktadır.
GİRİŞ
Hepatit C virusuna karşı (anti-HCV) antikor saptamaya yönelik testler ilk olarak 1990 yılında ABD Gıda ve İlaç Dairesi (U.S. Food and Drug Administration – FDA) tarafından lisanslanmış olup HCV infeksiyonunun klinik teşhisi ve taranması için yaygın olarak kullanılmaktadır (1). Hepatit C virusu prevalansının %10’un altında olduğu popülasyonlarda yalancı pozitif sonuçlara daha sık rastlanmakta olup test edilen kişiyle ilgili klinik bilgiler olmadan, herhangi bir numune için pozitif tarama testi sonucu ile kesin bir kanıya varılamaz (2).
Hastalık Kontrol ve Korunma Merkezleri (Centers for Disease Control and Prevention – CDC), pozitif anti-HCV tarama testi sonucunun “recombinant immunoblot assay” (RIBA) gibi daha spesifik bir serolojik testle veya bir nükleik asit amplifikasyon testi (NAT) ile doğrulanmasını önermektedir (3). Bununla birlikte, anti-HCV için laboratuvarların çoğu, yalnızca pozitif tarama testi sonucunu bildirir ve hastanın hekimi istemedikçe pozitif sonuçları daha spesifik serolojik veya nükleik asit amplifikasyon testleri ile rutin olarak doğrulamaz. Fakat anti-HCV tarama testi sonuçlarının yorumlanması, daha spesifik testlerin ne zaman isteneceği ve bu amaçla hangi testlerin yapılması gerektiği konularında her sağlık profesyoneli yeterli bilgiye sahibi olamayabilir. Ek test yapılmadan raporlanan reaktif anti-HCV sonucu hem hekim hem hasta için kaygı verici olabilir. Bu nedenle refleks tamamlayıcı test uygulamasının kullanılması hem hastaya hem hekime en kısa sürede doğru sonuç verilebilmesi için önerilmektedir. Fakat yapılacak ek testler ya da doğrulama testleri her laboratuvarda bulunmayabilir ya da reaktivite gösteren tüm hastalara bu testlerin uygulanması maliyet etkin olmayabilir.
Hastalık Kontrol ve Korunma Merkezleri’nin rehberinde tarama testlerinde eşik değer olarak hangi sinyal-kesme (sample/cut off – S\Co) oranlarının kullanılabileceğine dair öneriler bulunmaktadır (2). Fakat bu değerlerin çalışılan hasta popülasyonuna ve HCV prevalansına göre değişebildiği bilinmektedir. Bu nedenle hem ek test yapılacak numune sayısını en aza indirmek hem de pozitif sonuçların kişinin gerçek antikor durumunu yansıtma olasılığını artırmak için laboratuvarlar hizmet verdikleri hasta popülasyonuna ve kullanılan testin özelliklerine göre tarama testlerinde kullandıkları S\Co oranlarını belirleyecek algoritmalar geliştirebilir. Oluşturulacak olan algoritmalar için temel unsurlar; testin uygulandığı popülasyonun HCV prevalansı, kullanılan kitin “cut off” değeri ve yapılacak çalışmalarla testin uygulandığı popülasyonda anti-HCV reaktif sonuçlarda hangi S\Co oranının kişinin gerçek antikor durumunu yansıtma olasılığının yüksek olduğunun belirlenmesidir.
Çalışma kapsamında, hastanemizde 2017-2019 yılları arasında çalışılmış olan anti-HCV ve HCV-RNA test sonuçlarını inceleyerek, HCV tanısında kullanılan serolojik ve moleküler tanı yöntemlerini retrospektif olarak değerlendirmeyi, anti-HCV pozitif hastalarda refleks test olarak HCV-RNA çalışılması için uygun olan tarama testi eşik değerini belirlemeyi ve doğru algoritmaların geliştirilmesine katkıda bulunmayı amaçladık.
YÖNTEMLER
Çalışma Dizaynı ve Çalışmaya Alınan Hastalar
2017-2019 tarihleri arasında hastanemize başvuran ve anti-HCV serolojik test sonuçlarında reaktivite saptanan hastalar, tespit edilebilen HCV-RNA test sonuçları ile birlikte retrospektif olarak incelendi. Her hastanın saptanan ilk test sonucu çalışmaya dahil edildi; aynı hastanın tekrarlayan diğer test sonuçları çalışma dışı bırakıldı. Anti-HCV reaktifliği olan hastalar; 0-20 yaş, 21-40 yaş, 41-60 yaş ve ≥61 yaş olmak üzere dört gruba ayrılarak analiz edildi. HCV-RNA sonuçları da aynı yaş gruplarına göre değerlendirildi.
Çalışma, Balıkesir Üniversitesi Sağlık Bilimleri Girişimsel Olmayan Araştırmalar Etik Kurulu tarafından 23 Aralık 2020 tarih ve 2020/249 karar numarasıyla onaylanmıştır.
Serolojik Çalışmalar
Anti-HCV testleri, laboratuvarda rutin tanıda kullanılan Architecht I2000 SR immünotetkik analizörü (Abbott Diagnostics, Almanya) ile üretici firma talimatlarına uygun olarak çalışıldı ve anti-HCV reaktifliği için 1.0 mIÜ/ml eşik değer olarak alındı. Anti-HCV reaktifliği olan hastalar S/Co değerlerine göre; 1-5 mIÜ/ml, 5.1-10 mIÜ/ml ve ≥10.1 mIÜ/ml olmak üzere üç gruba ayrıldı. Hastalık Kontrol ve Korunma Merkezleri, HCV prevalansının düşük olduğu toplumlarda, anti-HCV yalancı pozitiflik oranı çok yüksek olabildiği için, anti-HCV reaktifliği eşik değerinin 1.0 mIÜ/ml yerine 3.8 mIÜ/ml olarak alınabileceğini bildirmiştir (2). Bu nedenle anti-HCV reaktif hastalar S/Co değerlerine göre 1.0-3.8 mIÜ/ml ve ≥3.9 mIÜ/ml olmak üzere iki gruba ayrıldı ve analiz edildi.
Moleküler Çalışmalar
HCV-RNA testleri laboratuvarda, rutin tanıda kullanılan gerçek zamanlı PCR temeline dayalı Bosphore HCV kantifikasyon/tespit kiti (Anatolia Geneworks, İstanbul, Türkiye) ile çalışıldı.
İstatistiksel Analiz
Verilerin analizi, SPSS (Statistical Package for the Social Sciences) versiyon 22.0 programı (IBM Corp., Armonk, NY, ABD) ile yapıldı. Kantitatif veriler yüzde ve ortalama±standart sapma (SS) olarak verildi. Grupların normal dağılım gösterip göstermediğine Kolmogorov-Smirnov ve Shapiro-Wilk testleri ile bakıldı. Gruplardan en az biri normal dağılıma uymadığında kantitatif verilerde bağımsız iki grubun karşılaştırılmasında Mann-Whitney U testi, üç ya da daha fazla grubun karşılaştırılmasında ise Kruskal-Wallis testi kullanıldı. Kalitatif veriler yüzde olarak verildi. Kalitatif verilerin bulunduğu bağımsız grupların karşılaştırılmasında χ² testi kullanıldı. Yaş ile anti-HCV düzeyi arasındaki korelasyona Spearman korelasyon katsayısı ile bakıldı; p<0.05 değerleri istatistiksel olarak anlamlı düzey olarak kabul edildi.
BULGULAR
Tablo 1. Anti-HCV Reaktif Hastaların Yaş Gruplarına Göre Dağılımı ve S/Co Değerlerinin Karşılaştırılması
Çalışmaya dahil edilen toplam 86 177 hastanın, 37 336 (%43.3)’sı erkek, 48 881 (%56.7)’i kadın olup hastaların yaş ortalaması 42.26±20.55 (0-101) yıl olarak tespit edildi. Hastaların tamamı içinde nonreaktif olan hasta sayısı 85 807 (%99.6) ve reaktif hasta sayısı 370 (%0.4) idi. Sonucu reaktif olan 370 hastanın 162 (%43.8)’si erkek, 208 (%56.2)’i kadındı. Anti-HCV reaktif hastalar incelendiğinde, erkek hastaların S\Co değerleri 1.01-17.87 mIÜ/ml (ortalama±SS=6.14±5.57) arasında, kadın hastaların ise 1.01-25.53 mIÜ/ml (ortalama±SS=5.75±5.50) arasında idi; fakat cinsiyete göre anti-HCV pozitif hastaların S\Co değerinin anlamlı fark göstermediği tespit edildi (p=0.756).
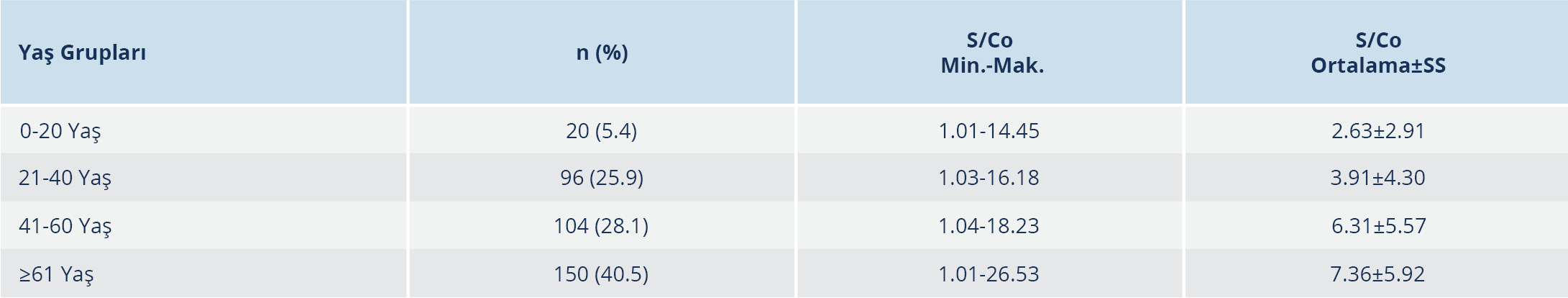
Ortalama S/Co değerlerinin yaş ile birlikte arttığı ve en yüksek ortalama değerin (7.36±5.92) 61 yaş ve üzerindeki hasta grubunda olduğu görüldü. Yaş ile anti-HCV düzeyi arasında düşük düzeyde ilişki olmakla birlikte (korelasyon katsayısı=0.238), bu ilişkinin istatistiksel olarak anlamlı olduğu tespit edildi (p≤0.001) (Tablo 1).
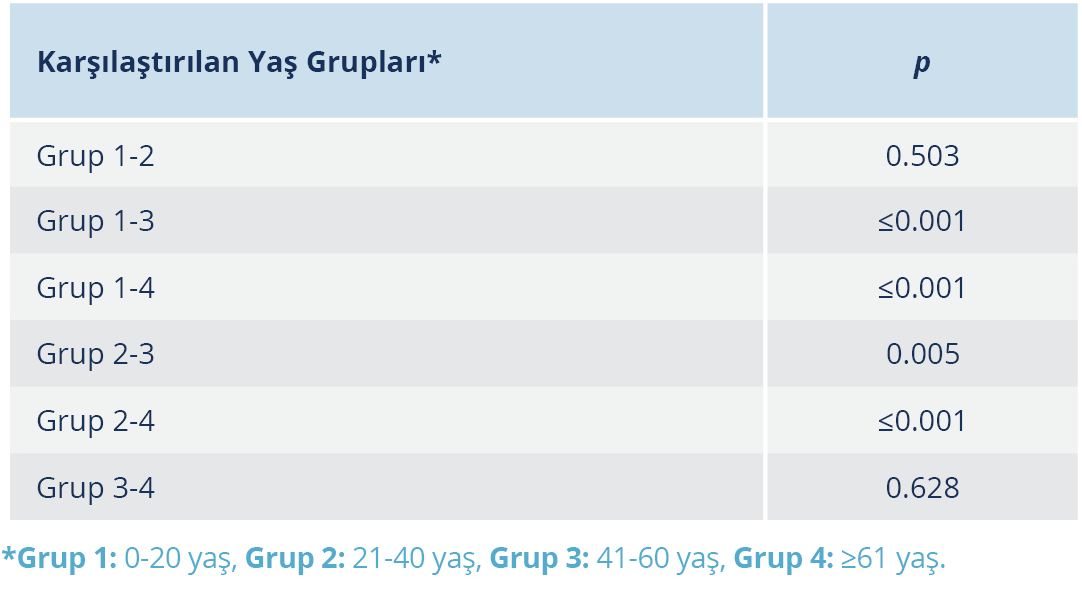
Yaş grupları kendi arasında ortalama S/Co değerleri açısından karşılaştırıldığında, 0-20 yaş ile 21-40 yaş arasında ve 41-60 ile ≥61 yaş arasında istatistiksel olarak anlamlı düzeyde fark bulunamazken, diğer tüm yaş grupları arasındaki farkın istatistiksel olarak anlamlı düzeyde olduğu tespit edildi (Tablo 2).
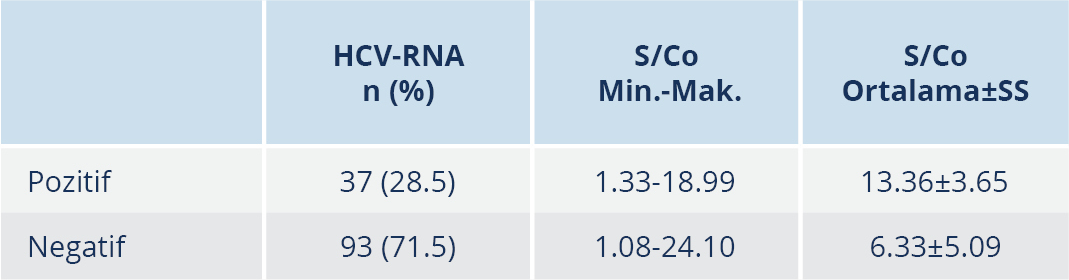
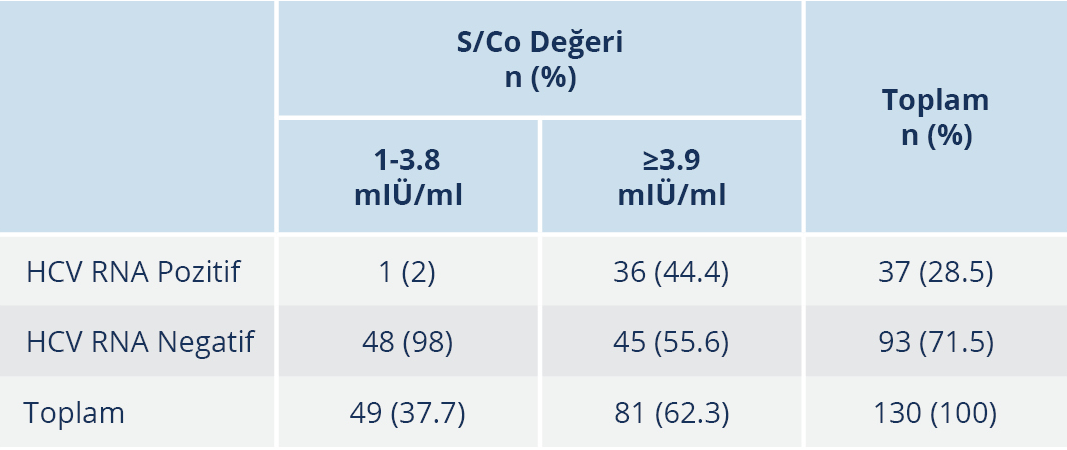
Anti-HCV reaktif olan 370 hastadan HCV-RNA sonuçlarına ulaşılabilen 130 hasta incelendiğinde, 37 (%28.5) hastanın HCV-RNA sonucu pozitif, 93 (%71.5) hastanın ise negatifti. Test sonucu HCV-RNA pozitif ve negatif olan hastaların S/Co değerleri karşılaştırıldığında, HCV-RNA pozitif hastalarda ortalama değer belirgin olarak yüksek tespit edildi; bu fark da istatistiksel olarak anlamlı düzeydeydi (p≤0.001) (Tablo 3).
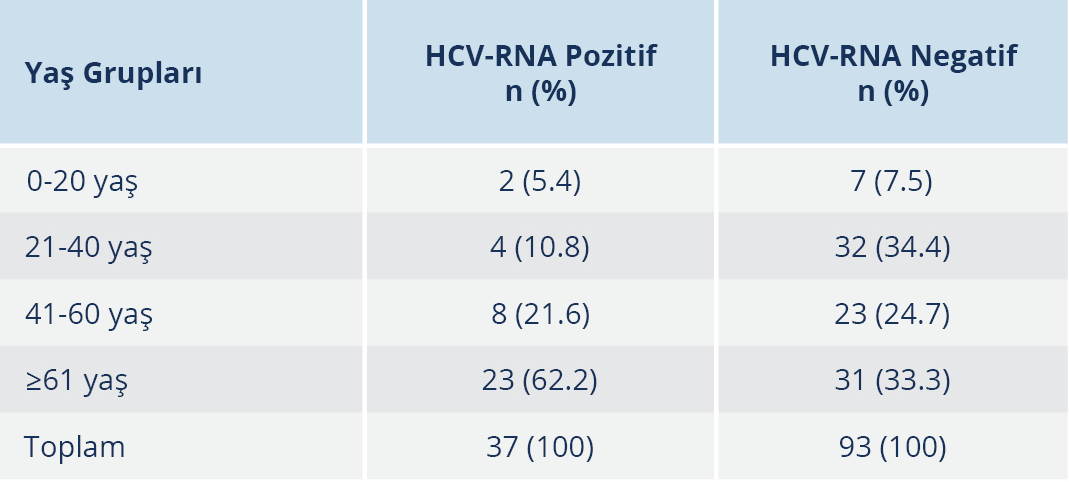
Çalışmamıza dahil edilen ve HCV-RNA sonucuna bakılan 130 hastanın yaş gruplarına göre dağılımı incelendiğinde, HCV-RNA pozitif hastaların en fazla ≥61 yaş (%62.2), en az ise 0-20 yaş (%5.4) olan grupta bulunduğu görüldü. Yaş gruplarına göre de HCV-RNA pozitifliği açısından istatistiksel olarak anlamlı düzeyde fark tespit edildi (p=0.012) (Tablo 4).
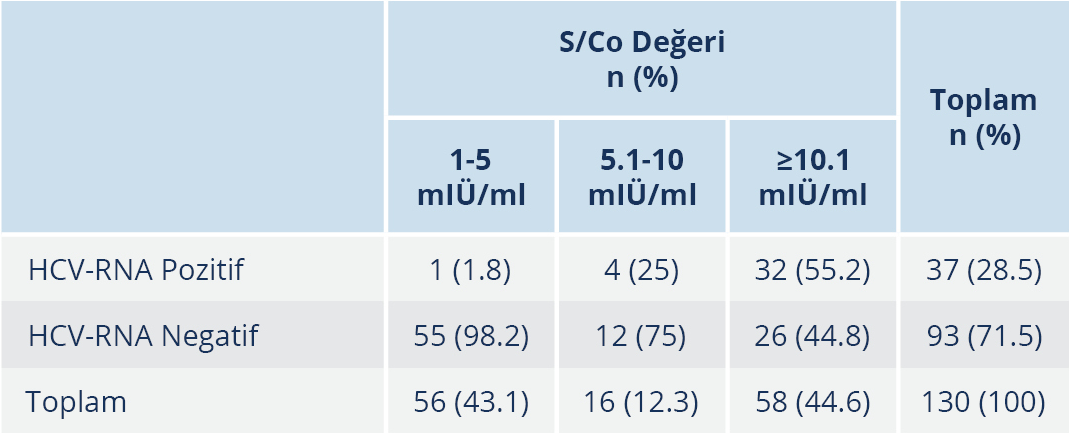
Anti-HCV reaktif hastalar S/Co değerlerine göre; 1-5 mIÜ/ml, 5.1-10 mIÜ/ml ve ≥10.1 mIÜ/ml olmak üzere üç grupta incelendi; S/Co değeri 1-5 mIÜ/ml olan 56 (%43.1) hasta, 5.1-10 mIÜ/ml olan 16 (%12.3) hasta ve ≥10.1 mIÜ/ml olan 58 (%44.6) hasta bulunmaktaydı (Tablo 5). S/Co değeri 1-5 mIÜ/ml arasında olan 56 hastanın sadece 1 (%1.8)’inde HCV-RNA pozitif saptanırken, S/Co değerinin 5.1-10 mIÜ/ml arasında olduğu grupta bu oran %25, S/Co değerinin ≥10.1 mIU/ml olduğu grupta ise %55.2 idi. Gruplar arasındaki bu fark istatistiksel olarak da anlamlı düzeydeydi (p≤0.001).
Hastalık Kontrol ve Korunma Merkezleri’nin önerisi doğrultusunda, anti-HCV reaktif hastalar HCV-RNA pozitifliği açısından S/Co değerlerine göre 1.0-3.8 mIÜ/ml ve ≥3.9 mIÜ/ml olmak üzere iki gruba ayrıldı (2); S/Co değeri 1-3.8 mIÜ/ml olan 49 (%37.7) hasta ve ≥3.9 mIÜ/ml olan 81 (%62.3) hasta mevcuttu. S/Co değeri 1-3.8 mIÜ/ml olan hastaların sadece 1 (%2)’inde HCV-RNA pozitif saptanırken, S/Co değeri ≥3.9 mIÜ/ml olan hastalarda HCV-RNA pozitifliği oranı %44.4 olarak tespit edildi; gruplar arasındaki bu fark istatistiksel olarak da anlamlı düzeydeydi (p≤0.001) (Tablo 6).
İRDELEME
Dünya Sağlık Örgütü’ne göre, dünya çapında 185 milyondan fazla birey HCV ile infekte olup her yıl yaklaşık 700 000’i hayatını kaybetmektedir. Türkiye’de yapılan farklı çalışmalarda ve toplum temelli ilk çalışma olan TURHEP’te HCV seroprevalansı ortalama %1 (%0.4-%1.5) olarak rapor edilmiştir (4-5). Çalışmamızda da 86 177 hastanın %0.4’ü anti-HCV reaktif tespit edildi. Balıkesir’de yapılan farklı bir çalışmada da ameliyat öncesi hastaların anti-HCV reaktivite oranları çalışmamıza benzer şekilde %0.33 olarak bildirilmiştir (6). Bunlar arasında yalancı pozitifliklerin de olduğu düşünüldüğünde Balıkesir bölgesinde HCV seroprevalansının oldukça düşük olduğu tahmin edilebilir.
Çalışmamızda, anti-HCV reaktif olan 370 hastanın 162 (%43.8)’si erkek, 208 (%56.2)’i kadındı. Türkiye’de yapılan farklı çalışmalarda da anti-HCV seropozitifliğinin cinsiyete göre dağılımında anlamlı düzeyde bir fark bulunamamıştır (4,7,8). Anti-HCV pozitif grupta erkek hastaların ortalama S\Co değeri de kadın hastalardan yüksek olmakla birlikte bu fark istatistiksel olarak anlamlı düzeyde bulunmadı. Anti-HCV reaktif olan hastalar yaş gruplarına göre karşılaştırıldığında, ortalama S/Co değerlerinin yaş ile birlikte arttığı, en yüksek ortalama değerin 61 yaş ve üzerindeki grupta olduğu görüldü (Tablo 1). Yaş ile anti-HCV düzeyi arasında düşük düzey ilişki olmakla birlikte bu ilişkinin istatistiksel olarak anlamlı düzeyde olduğu belirlendi. Sarıbaş ve arkadaşlarının (7) çalışmasında da yaş gruplarına bakıldığında en yüksek oran 40 yaş üzerinde bulunmuştur; Asan ve arkadaşlarının (9) çalışmasında ise hastaların %54’ünün 50 yaş ve üzeri olduğu görülmüştür. Bu sonuçlar bizim çalışmamızla uyumlu olup yaş ile birlikte artan, özellikle düşük düzey anti-HCV pozitifliğinin geçirilmiş infeksiyona bağlı olabileceği de öne sürülmektedir (10). TURHEP çalışmasında, risk faktörleri açısından erkek cinsiyet, düşük eğitim düzeyi, evli olmak, Güneydoğu Anadolu bölgesinde yaşamak, hepatitli hasta ile yakın temas, ortodental müdahaleler ve daha önce tek kullanımlık olmayan enjektör kullanımı incelenmiş ve artan HCV prevalansı ile ilişkili tek risk faktörünün 50 yaş üzerinde olmak olduğu bildirilmiştir (4).
Abbott HCV EIA 2.0 ve ORTHO® HCV ver. 3.0 ELISA özgüllüğünün >%99 olduğu bildirilmekle birlikte; anti-HCV prevalansının <%10 olduğu bağışıklığı yeterli popülasyonlarda ELISA testlerinde yalancı pozitifliğin yaklaşık %35 (%15-%60), bağışıklığı baskılanmış popülasyonlarda (örneğin hemodiyaliz hastaları) ise yalancı pozitif sonuçların yaklaşık %15 olduğu bildirilmiştir (11-18). Doğrulama için RIBA testleri kullanılmakta iken belirsiz sonuçların sık görülmesi nedeniyle 2013 yılında CDC tarafından HCV tanı algoritmasından çıkarılmış, tekrarlayan reaktivite durumunda HCV-RNA çalışılması önerilmiştir (19). Çalışmamızda, anti-HCV reaktif 370 hastadan HCV-RNA sonuçlarına ulaşılabilen 130 (%35.1) hasta incelendiğinde, 37 (%28.5) hastada HCV-RNA pozitif, 93 (%71.5) hastada ise negatif bulundu; ülkemizden yapılan çeşitli çalışmalarda da anti-HCV reaktif hastalarda HCV-RNA negatifliğinin %27.4 ile %63.5 arasında değiştiği görülmüştür (20). Bizim çalışmamızda anti-HCV yalancı pozitifliğinin daha yüksek olması bölgemizde HCV seroprevalansının Türkiye ortalamasının da altında olabileceğini düşündürmektedir fakat bunu kesin olarak söyleyebilmek için anti-HCV reaktif bütün hastalara HCV-RNA bakılmış olması, karaciğer fonksiyon testleri gibi diğer laboratuvar test sonuçlarının ve hastaların klinik bilgilerinin ve takiplerinin olması gerekmektedir. Çalışmamızda anti HCV pozitif hastaların sadece %35.1’inin HCV RNA verisine ulaşılabilmiş olması, diğer laboratuvar bulguları ve klinik verilerinin olmaması çalışmamızın kısıtlılıklarındandır.
HCV-RNA pozitif hastaların, en fazla ≥61 yaş olan grupta (%62.2), en az ise 0-20 yaş grubunda (%5.4) bulunduğu görüldü. Yaş gruplarına göre HCV-RNA pozitifliği açısından istatistiksel olarak anlamlı düzeyde fark bulundu. Anti-HCV prevalansının da yaş ile arttığı düşünüldüğünde, HCV infeksiyonunun göstergesi olan HCV-RNA pozitifliğinin de yaş ile artması beklenen bir sonuçtur. Fakat bu verinin daha geniş kapsamlı çalışmalarla doğrulanması gerekmektedir.
Üretici firmaların önerileri doğrultusunda S\Co değerlerinde 1 mIÜ/ml’den büyük sonuçlar reaktif kabul edildiğinde, düşük düzey anti-HCV reaktifliklerinde HCV-RNA negatifliğinin %86’ya kadar ulaştığı bildirilmiştir (21). Hastalık Kontrol ve Korunma Merkezleri’nin 2003 yılında yayımladığı rehber kapsamında, lisanslı “enzyme-immunoassay” (EIA) testlerde, ortalama S/Co oranları >3.8 mIÜ/ml olan numuneler için anti-HCV reaktif olarak rapor edilmesinin, gerçek anti-HCV durumunu yüksek oranda tahmin edeceği bildirilmiştir (2). Sayan ve arkadaşlarının (22) yaptıkları çalışmada, S/Co için en uygun eşik değer 3.8 mIÜ/ml olarak tespit edilmiştir. Memikoğlu ve arkadaşları (23) çalışmalarında, anti-HCV için eşik değerin ≥5 mIÜ/ml olarak da alınabileceğini ve doğrulama gerektirecek örnek sayısının çok daha az olacağını vurgulamıştır. Alter ve arkadaşları (2) tarafından 24 700 hasta ile yapılan çalışmada, eşik değer ≥3.8 mIÜ/ml olduğunda HCV-RNA pozitifliği %80’e, RIBA pozitifliği ise %97’ye yükselmiştir. Seo ve arkadaşları (24) anti-HCV testi reaktif 661 hasta ile yaptıkları çalışmada, viremi varlığını belirlemede en uygun “cut-off” değerini 10.9 mIÜ/ml tespit etmiş ve bu durumda duyarlılığın %94.4’e çıktığını bildirmiştir (24). Sarıbaş ve arkadaşları (7), bizim kullandığımız kitin aynısını kullanarak yaptıkları çalışmada, S/Co eşik değeri için 7.8 mIÜ/ml; Aydın ve arkadaşları (25) ise 7.13 mIÜ/ml önermiştir. Çalışmamızda, anti-HCV reaktif 370 hastadan HCV-RNA sonuçlarına ulaşılabilen 130 hasta incelendiğinde, HCV-RNA pozitif hastalarda ortalama S/Co değeri belirgin olarak yüksek tespit edildi ve bu fark da istatistiksel olarak anlamlı düzeydeydi; S/Co değeri 1.33 mIÜ/ml olup HCV-RNA pozitif olan 14 yaşında bir çocuk hasta dışında HCV RNA pozitif bulunanlarda minimum S\Co değerinin 6.4 mIÜ/ml olduğu görüldü.
Hastalık Kontrol ve Korunma Merkezleri’nin eşik değer önerisi doğrultusunda 130 hasta S/Co değerlerine göre 1.0-3.8 mIÜ/ml ve ≥3.9 mIÜ/ml olmak üzere iki gruba ayrıldığında, birinci grupta bulunan 49 hastanın sadece 1 (%2)’inde HCV-RNA pozitifliği saptanırken, S/Co değeri ≥3.9 mIÜ/ml olan 81 hastanın %44’ünün HCV-RNA pozitif olduğu ve gruplar arasındaki bu farkın istatistiksel olarak da anlamlı düzeyde olduğu bulundu. Hastalar S/Co değerlerine göre 1-5 mIÜ/ml, 5.1-10 mIÜ/ml ve ≥10.1 mIÜ/ml olmak üzere üç gruba ayrıldığında ise S/Co değeri 1-5 mIÜ/ml arasında olan 56 hastanın %1.8’inde, 5.1-10 mIÜ/ml arasında olan 16 hastanın %25’inde ve ≥10.1 mIÜ/ml olan 58 hastanın %55.2’sinde HCV RNA pozitif tespit edildi. Bir başka deyişle, çalışmamızda anti HCV pozitifliği için eşik değer 1 mIÜ/ml alındığında yalancı pozitiflik %71.5, 3.8 mIÜ/ml alındığında %56 ve 5 mIÜ/ml alındığında %51 olarak bulundu; yeni eşik değerler ile sadece bir hastanın yalancı negatif olarak saptanabildiği görüldü. Çalışmamızda, az sayıda hastanın HCV-RNA sonucuna ulaşılabilmiş olmasına rağmen eşik değerin 5.1 mIÜ/ml üzerinde olduğu durumlarda anti HCV testinin yalancı negatif olarak yorumlanacağı hastaların sayısının arttığı görülmektedir. Memikoğlu ve arkadaşları (23), anti-HCV için eşik değerin ≥5 mIÜ/ml olarak da alınabileceğini ve doğrulama gerektirecek örnek sayısının çok daha az olacağını vurgulamıştır; çalışmamızda da eşik değer 3.8 mIÜ/ml veya 5 mIÜ/ml alındığında yalancı negatiflik açısından fark görülemedi. Ancak çalışmamızda HCV-RNA sonucuna ulaşılabilen hasta sayısı az olduğu için bu sonucun daha kapsamlı çalışmalarla desteklenmesinin uygun olacağını düşünmekteyiz. Tüm bu veriler ve CDC’nin önerileri doğrultusunda; anti-HCV tarama testi S/Co oranları >3.8 mIÜ/ml olan tekrarlayan reaktif numuneler için sonuçların reaktif olarak rapor edilmesi ve mümkünse refleks tamamlayıcı test olarak HCV RNA bakılması şeklinde bir algoritmanın ulusal algoritmalar oluşturulana dek kullanılması uygun görünmektedir.
Çalışmamız bu konuda Balıkesir ilinde yapılmış olan ilk kapsamlı çalışma olmakla birlikte; retrospektif olması, nispeten küçük örneklem sayısı, çalışmaya dahil edilen anti-HCV reaktifliği saptanan hastaların tümüne HCV-RNA bakılamamış olması ve bu hastaların klinik verilerine/takiplerine erişilememiş olması çalışmamızın kısıtlılıklarını oluşturmaktadır. Literatürde de vurgulandığı üzere anti-HCV testleri için ülkelerin kendi popülasyonlarını temsil edecek şekilde kapsamlı çalışmalar yapması, yaygın kullanımda olan kitler için eşik değer belirlemesi ve bunu algoritmalarla uygulanabilir hale getirmesi büyük önem taşımaktadır.
Hasta Onamı
Olguların dosyaları retrospektif olarak incelendiği için hasta onamı alınmamıştır.
Etik Kurul Kararı
Çalışma, Balıkesir Üniversitesi Sağlık Bilimleri Girişimsel Olmayan Araştırmalar Etik Kurulu tarafından 23 Aralık 2020 tarih ve 2020/249 karar numarasıyla onaylanmıştır.
Danışman Değerlendirmesi
Bağımsız dış danışman
Yazar Katkıları
Fikir/Kavram – T.K.A., D.Ö.Y.; Tasarım – T.K.A., B.N.E.; Denetleme – T.K.A.; Malzemeler/Hastalar – D.Ö.Y., T.K.A.; Veri Toplama ve/veya İşleme – T.K.A., D.Ö.Y.; Analiz ve/veya Yorum – T.K.A., B.N.E.; Literatür Taraması – B.N.E.; Makale Yazımı – T.K.A., B.N.E.; Eleştirel İnceleme – T.K.A., D.Ö.Y., B.N.E.
Çıkar Çatışması
Yazarlar herhangi bir çıkar çatışması bildirmemiştir.
Finansal Destek
Yazarlar finansal destek beyan etmemiştir.
Referanslar
- Public Health Service inter-agency guidelines for screening donors of blood, plasma, organs, tissues, and semen for evidence of hepatitis B and hepatitis C. MMWR Recomm Rep. 1991;40(RR-4):1-17.
- Alter MJ, Kuhnert WL, Finelli L; Centers for Disease Control and Prevention. Guidelines for laboratory testing and result reporting of antibody to hepatitis C virus. MMWR Recomm Rep. 2003 Feb 7;52(RR-3):1-13.
- Recommendations for prevention and control of hepatitis C virus (HCV) infection and HCV-related chronic disease. Centers for Disease Control and Prevention. MMWR Recomm Rep. 1998;47(RR-19):1-39.
- Tozun N, Ozdogan O, Cakaloglu Y, et al. Seroprevalence of hepatitis B and C virus infections and risk factors in Turkey: a fieldwork TURHEP study. Clin Microbiol Infect. 2015;21(11):1020-6. [CrossRef]
- Aygen B, Keten D, Akalın H, et al. [Management of chronic hepatitis C virus ınfection: A consensus report of the study group for viral hepatitis of the Turkish Society of Clinical Microbiology and Infectious Diseases]. Klimik Derg. 2014;27(2):19-39. Turkish. [CrossRef]
- Duran A. Retrospective analysis of hepatitis b and hepatitis c viruses and HIV infections in patients presenting to the general surgery clinic and evaluated preoperatively. J Contemp Med 2022;12(2):373-6. [CrossRef]
- Sarıbaş A, Aksoy A. [Determination of anti-HCV scanning test cut-off value by HCV-RNA and Line Immunoassay tests]. Turk Hij Den Biyol Derg. 2020;77(3):319-24. Turkish. [CrossRef]
- Turan DB, Kuruoğlu T, Gümüş D, et al. Seroprevalence of HBsAg and anti- HVC for patients who admitted to third step hospital: Six-year retrospective data. Ege Tıp Derg. 2019;58(2):149-53. [CrossRef]
- Asan A, Akbulut A, Saçar S, Turgut H. [Evaluation of seroprevalence of HBsAg and anti-HCV in the patients admitted to the Tunceli State Hospital]. Viral Hepat J. 2011;17:52-6. Turkish.
- Zer Y, Karaoğlan I, Ciçek H, Karağoz ID, Sağlam M. [Evaluation of the patients with low levels of anti-HCV positivity]. Mikrobiyol Bul. 2009;43(1):133-9. Turkish.
- Kleinman S, Alter H, Busch M, et al. Increased detection of hepatitis C virus (HCV)-infected blood donors by a multiple-antigen HCV enzyme immunoassay. Transfusion. 1992;32(9):805-13. [CrossRef]
- Conry-Cantilena C, VanRaden M, Gibble J, et al. Routes of infection, viremia, and liver disease in blood donors found to have hepatitis C virus infection. N Engl J Med. 1996;334(26):1691-6. [CrossRef]
- Hyams KC, Riddle J, Rubertone M, et al. Prevalence and incidence of hepatitis C virus infection in the US military: a seroepidemiologic survey of 21,000 troops. Am J Epidemiol. 2001;153(8):764-70. [CrossRef]
- Alter MJ, Kruszon-Moran D, Nainan OV, et al. Prevalence of hepatitis C virus infection in the United States, 1988 through 1994. N Engl J Med. 1999;341:556-62. [CrossRef]
- Montecalvo MA, Lee S, DePalma H, et al. Seroprevalence of human immunodeficiency virus-1, hepatitis B virus, and hepatitis C virus in patients having major surgery. Infect Control Hosp Epidemiol. 1995;16:627-32.
- Goetz AM, Ndimbie OK, Wagener MM, et al. Prevalence of hepatitis C infection in health care workers affiliated with a liver transplant center. Transplantation. 1995;59(7):990-4. [CrossRef]
- Roome AJ, Hadler JL, Thomas AL, et al; Centers for Disease Control and Prevention (CDC). Hepatitis C virus infection among firefighters, emergency medical technicians, and paramedics–selected locations, United States, 1991-2000. MMWR Morb Mortal Wkly Rep. 2000;49(29):660-5.
- Gunn RA, Murray PJ, Ackers ML, et al. Screening for chronic hepatitis B and C virus infections in an urban sexually transmitted disease clinic: rationale for integrating services. Sex Transm Dis. 2001;28(3):166-70. [CrossRef]
- Us AD. Viral enfeksiyonların serolojik tanısı. In: Us AS, eds. Temel İmmünoloji ve Seroloji. 2. baskı. Ankara: Hipokrat Kitabevi, 2016: 241-5.
- Kayman T, Karakükçü Ç, Gödekderman A. [The evaluation of HCV RNA, serum transaminases and AST/ALT values of anti-HCV positive patients]. Viral Hepat J. 2013;19:99-102. [CrossRef]
- Dufour DR, Lott JA, Nolte FS, et al. Diagnosis and monitoring of hepatic injury. I. Performance characteristics of laboratory tests. Clin Chem. 2000;46(12):2027-49.
- Sayan M, Meriç M, Mutlu B, Celebi S, Willke A. [Low positive anti-HCV microparticle enzyme immunoassay results: do they predict hepatitis C virus infection?]. Mikrobiyol Bul. 2006;40(1-2):81-4. Turkish.
- Memikoğlu KO, Arabacı H, Azap A,Yeşilkaya A, Birengel S, Balık İ, Türkiye’de hepatit C tanısı: Nasıl yardımcı olur? Viral Hepat J. 2007;12(2):68-72.
- Seo YS, Jung ES, Kim JH, et al. Significance of anti-HCV signal-to-cutoff ratio in predicting hepatitis C viremia. Korean J Intern Med. 2009;24(4):302-8. [CrossRef]
- Aydın G, Adaleti R, Boz ES, Yücel FM, Özhan HK, Aksaray S. [Investigation of anti-HCV S/CO value in detecting viremia in patients with hepatitis C virus ınfection]. Mikrobiyol Bul. 2020;54(1):110-9. Turkish. [CrossRef]