En Çok Okunanlar
Özet
Amaç: İnsan immun yetmezlik virusu (HIV) / hepatit B virusu (HBV) koinfeksiyonu prevalansı veya insidansı, HIV ve HBV bulaşma risklerine, HBV aşılama programlarının uygulanmasına ve genel popülasyonda HBV infeksiyonunun farklı seviyelerde endemik olduğu coğrafi bölgelere göre büyük ölçüde değişebilir. HIV ile yaşayan bireylerde, akut HBV infeksiyonun kronikleşmesi genel popülasyona göre daha yüksektir. HIV/HBV koinfeksiyonunda siroza daha hızlı ilerleme ve karaciğere bağlı ölüm riski, HBV mono-infekte hastalara göre daha yüksektir. Bu nedenle HBV’ye karşı aşılama önerilmektedir. Çalışmamızda, HIV ile yaşayan bireylerde hepatit B aşılama oranlarını ve aşı yanıtına etki eden faktörleri değerlendirmeyi amaçladık.
Yöntemler: Çalışmaya, Ocak 2007- Ocak 2022 tarihleri arasında polikliniğimizde HIV/AIDS tanısıyla takip edilen, 18 yaş üstü 1394 hasta dahil edildi; laboratuvar sonuçları, poliklinik dosyaları ve hastane bilgi sistemi üstünden retrospektif olarak incelendi.
Bulgular: HIV ile yaşayan bireylerin 81 (%5.8)’inde kronik hepatit B infeksiyonu, 114 (%8.2)’ünde izole anti-HBc IgG pozitifliği, 274 (%19.6)’ünde geçirilmiş infeksiyon olduğu tespit edildi. Tanı öncesi hepatit B aşısı yapılan HIV ile yaşayan birey sayısı 248 (%17.7) idi; 673 (%48.2)’ünde HBsAg, anti-HBc IgG ve anti-HBs negatifti. İzole anti-HBc IgG pozitifliği olan 114 bireyin 63 (%55.2)’ü, HBV serolojisi negatif olan 673 bireyden 289 (%42.9)’u olmak üzere toplam 352 (%44.7) birey aşılanmıştı. Aşılananların 282 (%84.1)’sinde bağışıklık oluştuğu tespit edildi. Bağışıklık yanıtını belirleyen temel faktör tanı anında CD4+ T lenfosit sayısı olup CD4+ T lenfosit sayısından bağımsız bir şekilde antiretroviral tedavi verilme uygulamasının başladığı 2015 yılından itibaren, bağışıklık yanıt oranında anlamlı yükselme olduğu görüldü. Komorbiditelerin, yaşın, cinsiyetin ve cinsel yönelimin bağışıklık yanıtını anlamlı düzeyde etkilemediği gözlendi.
Sonuç: HIV ile yaşayan ve HBV serolojisi negatif olan bireylerde aşılanma çok önemli olup aşı için en ideal zaman, CD4+ T lenfosit sayısının >200 hücre/mm³ olduğu ve viral yükün baskılandığı süreçtir. Aşılanma durumunu yakından takip edecek sağlık personelinin bulunduğu aşı polikliniklerinin desteğiyle aşılanma oranının ve bağışıklık yanıtının artacağı göz önünde bulundurulmalıdır.
GİRİŞ
Hepatit B virusu (HBV) infeksiyonu, dünya çapında kronik hepatit, karaciğer sirozu ve hepatoselüler karsinomun en önemli nedenlerinden biridir (1,2). Dünya Sağlık Örgütü (DSÖ) küresel hepatit raporunda, 2015 yılında dünyada HBV infeksiyonu prevalansının %3.5 olduğunu ve yaklaşık 257 milyon kişide kronik hepatit B infeksiyonu görüldüğünü bildirmiştir. Yine aynı raporda, viral hepatitlere bağlı 1.34 milyon ölüm görüldüğü ve söz konusu ölümlerin %66’sının HBV infeksiyonu komplikasyonlarına bağlı olduğu belirtilmiştir (3).
İnsan immun yetmezlik virusu (HIV)/HBV koinfeksiyonu prevalansı veya insidansı; HIV ve HBV bulaşma risklerine, HBV aşılama programlarının uygulanmasına ve genel popülasyonda HBV infeksiyonunun farklı seviyelerde endemik olduğu coğrafi bölgelere göre büyük ölçüde değişebilir (1). Ortak bulaşma yolları (intravenöz ilaç kullanımı ve cinsel temas) nedeniyle HIV ile yaşayan kişilerde, HBV infeksiyonu riski genel popülasyondan daha yüksektir (2,4). Dünya Sağlık Örgütü, 2015 yılında küresel HIV/HBV koinfeksiyonu prevelansının %7.4 olduğunu ve HIV ile yaşayan 36.7 milyon kişiden yaklaşık 2.7 milyonunun aynı zamanda HBV ile koinfekte olduğunu bildirmiştir (3). Ülkemizde ise HIV/HBV koinfeksiyonu prevelansının %4 olduğu ve HIV ile yaşayan kişilerin %40’ının HBV ile karşılaştığı bildirilmiştir (5)
HIV ile yaşayan kişilerde, akut HBV infeksiyonunun kronikleşme olasılığı genel popülasyona göre daha yüksektir (2). HIV/HBV koinfeksiyonunda siroza daha hızlı ilerleme ve karaciğere bağlı ölüm riski, HBV mono- infekte hastalara göre daha yüksektir (2,4,6). Bu nedenle HBV’ye karşı aşılama önerilmektedir (5,7,8).
Çalışmamızda, polikliniğimizde takipli HIV ile yaşayan kişilerde hepatit B aşılama oranlarını ve aşı yanıtına etki eden faktörleri değerlendirmeyi amaçladık.
YÖNTEMLER
Çalışmamız kapsamında, 2007-2022 yılları arasında polikliniğimizde HIV/AIDS tanısıyla takip ve tedavi edilen, 18 yaş üstü 1566 hastanın laboratuvar sonuçları poliklinik dosyaları ve hastane bilgi sistemi aracılığıyla retrospektif olarak incelendi. HBV serolojisi eksiksiz olan 1394 HIV ile yaşayan kişi çalışmaya alındı. Hastaların; demografik verileri, HBV serolojisi sonuçları, serolojisi negatif olanlarda aşılanma oranları ve aşılananlarda aşı yanıtları değerlendirildi.
Verilerin analizinde SPSS (Statistical Package for the Social Sciences) versiyon 25.0 programı (IBM Corp., Armonk, ABD) kullanıldı. Grupların tanımlayıcı analizleri sayısal değişkenler için ortalama, standart sapma, minumum, maksimum, medyan, çeyrekler arası aralık ve kategorik değişkenler için sayı ve yüzde olarak verildi. Gruplar arası oranlar χ² testi ile karşılaştırıldı. Sayısal değişkenlerin bağımsız iki grupta karşılaştırmaları, normal dağılım koşulu sağlanmadığından Mann-Whitney U testi ile yapıldı. İstatistiksel alfa anlamlılık seviyesi p<0.05 olarak kabul edildi.
Çalışma, Haseki Eğitim ve Araştırma Hastanesi Klinik Araştırmalar Etik Kurulu tarafından 25 Ocak 2023 tarih ve 12-2023 karar numarasıyla onaylandı.
BULGULAR
Polikliniğimizde takip edilen ve HIV ile yaşayan 1394 kişinin 1252 (%89.8)’si erkek ve 47 (%3.4)’si yabancı uyruklu olup yaş ortalamaları 37.15 (18-79) idi; 81 (%5.8)’inde kronik hepatit B infeksiyonu, 4 (%0.2)’ünde okült HBV infeksiyonu, 114 (%8.2)’ünde izole anti-HBc IgG pozitifliği, 274 (%19.6)’ünde de geçirilmiş infeksiyon mevcuttu. Tanı öncesi hepatit B aşısı olan hasta sayısı 248 (%17.7) olup 673 (%48.2) hastada HBsAg, anti-HBc IgG ve anti-HBs negatifti.
İzole anti-HBc IgG pozitifliği olan 114 hastanın 63 (%55.2)’ü, HBV serolojisi negatif olan 673 hastanın 289 (%42.9)’u olmak üzere toplam 352 (%44.7) HIV ile yaşayan kişi aşılanmıştı. Aşı sonrası izole anti-HBc IgG pozitifliği olan beş, HBV serolojisi negatif olan 16 hastanın aşı yanıtına bakılmadığı tespit edildi. HBV serolojisi negatif olup aşılananların birinde anti-HBs’nin oluştuktan sonra kaybolduğu görüldü.
Aşılananların 282 (%84.1)’sinde bağışıklık oluşmuştu. Aşı yanıtına etki eden etmenler değerlendirildiğinde tanı anında CD4+ T lenfosit sayısı ve 2015 yılından sonra tanı almış olmak anlamlı faktörler olarak belirlendi. CD4+ T lenfosit sayısı <200 hücre/mm³ olan ve >350 hücre/mm³ olan kişilerin aşı yanıtı arasında istatistiksel olarak anlamlı düzeyde bir fark saptandı (%66.1 vs %85.9, p=0.008). Tanı yılının 2015’ten önce ve sonra olma durumuna bağlı olarak bağışıklık yanıt oranının anlamlı olarak yükseldiği görüldü (%74.7 vs %88.6, p<0.05). Cinsiyet, uyruk, yaş ve komorbiditelerin ise aşı yanıtı üzerine istatiksel olarak anlamlı düzeyde etkisi gösterilemedi. Cinsel yönelimi bilinenler arasında anlamlı fark yoktu. Anti-HCV (+) kişi sayısı az olduğu için değerlendirme yapılmadı.
Hastaların sayısının az olması ve normal dağılım göstermemesi nedeniyle izole anti-HBc IgG pozitifliği istatiksel olarak değerlendirilemedi. HIV ile yaşayan kişilerin takibi sırasında hiçbirinde akut HBV infeksiyonu gelişmediği tespit edildi. Aşı yanıtı bakılan hastaların demografik verileri ve yanıta etki eden faktörlerin değerlendirilmesi Tablo 1 ve 2’de verildi.
İRDELEME
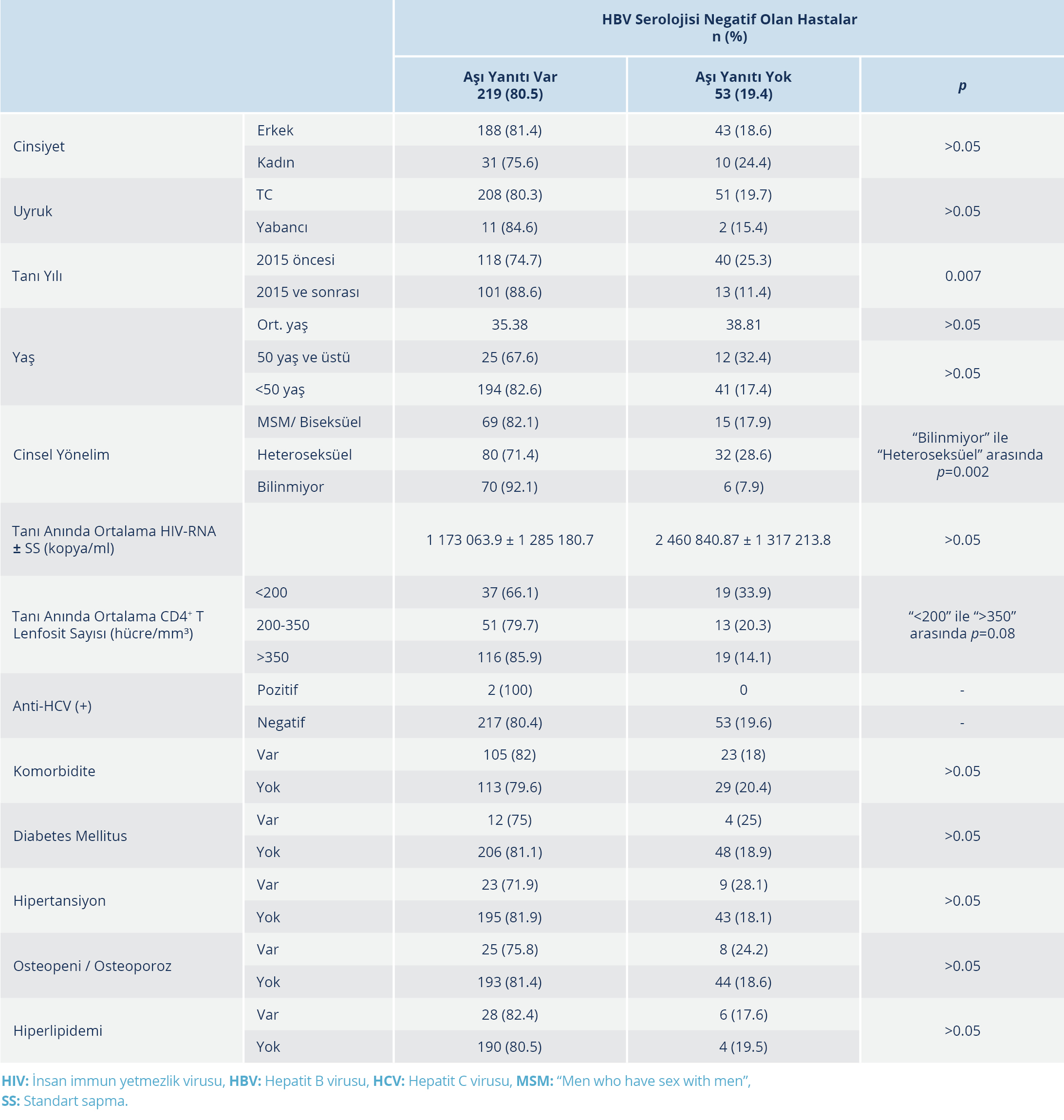
Tablo 1. HBV Serolojisi Negatif Olan Hastalarda Aşı Yanıtına Etki Eden Faktörlerin Karşılaştırılması
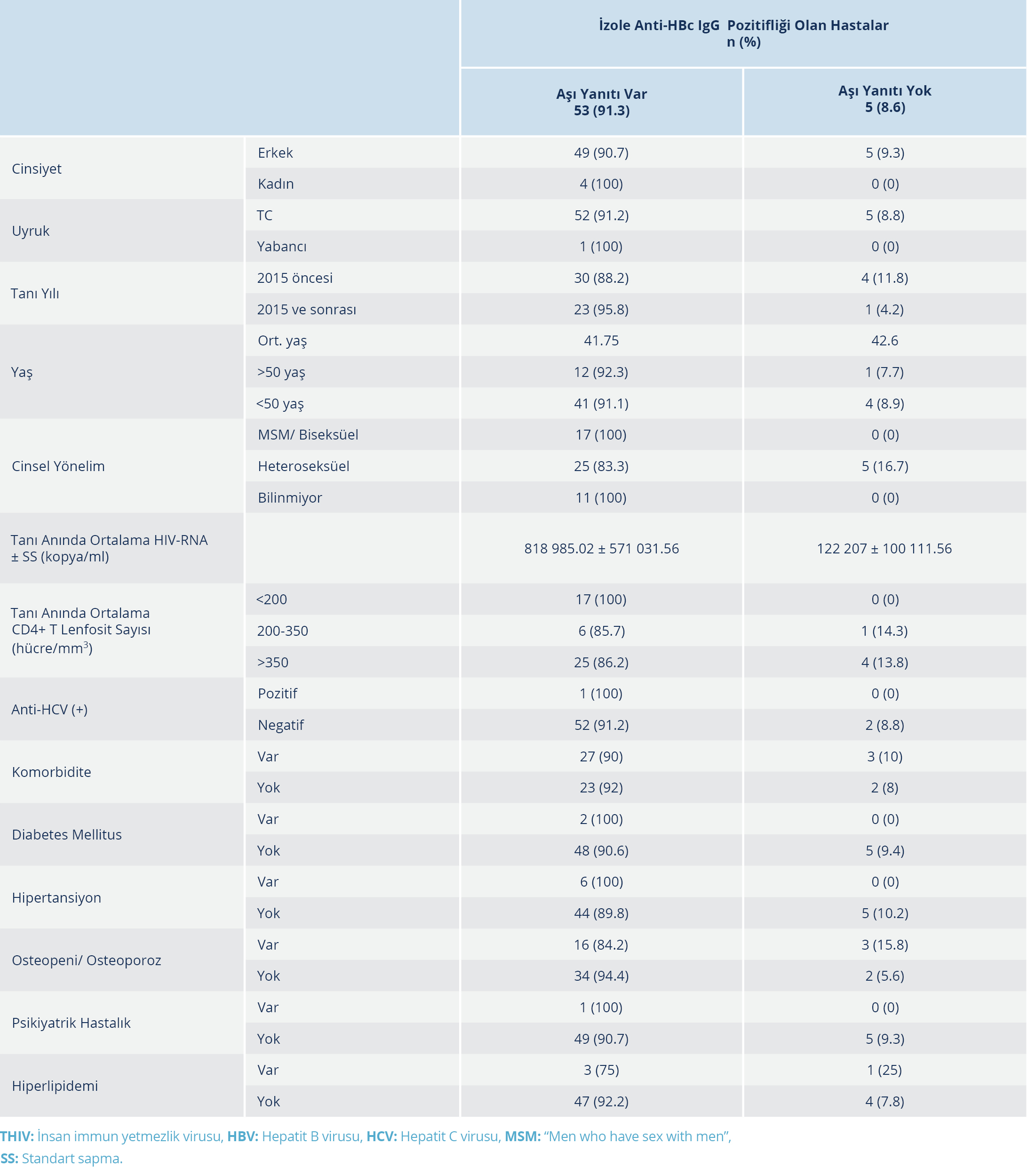
Tablo 2. İzole Anti-HBc IgG Pozitifliği Olan Hastalarda Aşı Yanıtına Etki Eden Faktörlerin Karşılaştırılması
HIV ile yaşayan kişilerde, benzer bulaşma yolları nedeniyle HBV infeksiyonu riski ve akut HBV infeksiyonun kronikleşmesi genel popülasyona göre daha yüksektir (2). HIV/HBV koinfeksiyonunda karaciğer hasarına bağlı morbidite ve mortalite riski, HBV mono-infekte hastalara göre daha yüksektir (2,4,6). Bu nedenle HIV ile yaşayan kişilerde HBV’ye karşı aşılama önerilmektedir (5,7,8).
Ülkemizde, hepatit B aşısı 1998’de çocukluk çağı aşı takvimine girmiş ve risk gruplarına da uygulanmaya başlanmıştır. HIV ile yaşayan kişilere de 0, 1 ve 6. ay olmak üzere standart aşılama şeması uygulanmaktadır (9).
Dünya Sağlık Örgütü küresel HIV/HBV koinfeksiyonu prevalansını %7.4 olarak bildirmiştir (3). Ülkemizde HIV/HBV koinfeksiyonu prevelansının %4 olduğu ama HIV ile yaşayan kişilerin %40’ının HBV ile karşılaştığı bildirilmiştir (5). Tozun ve arkadaşlarının (10) ülke genelinde yaptığı çalışmada, HBsAg pozitifliği %4, izole anti-HBc IgG pozitifliği %4.6, geçirilmiş HBV infeksiyonu %22 ve aşılanma oranı ise %8.4 olarak saptanmıştır. Karaosmanoğlu ve arkadaşları (11) yaptıkları çalışmada, HIV ile yaşayan kişilerde anti-HBc IgG pozitifliğini %19.1 bulurken karşılaştırma grubu olarak aldıkları kan bağışçılarında bu oranı %2.4 olarak tespit etmiştir. Çalışmamızda, HIV/HBV koinfeksiyonu prevalansı %5.8, izole anti-HBc IgG pozitifliği %8.2, geçirilmiş infeksiyon %19.6 ve aşılanma oranı ise %44.6 olarak bulundu. Diğer çalışmaların yürütülme tarihleri, zaman aralığı ve hasta sayısının farklı olması nedeniyle birbirinden farklı sonuçlar bulunduğu düşünüldü.
Ulusal ve uluslararası rehberlerde, kronik HBV infeksiyonu olmayan ve HBV’ye karşı bağışık olmayan tüm HIV ile yaşayan kişilere hepatit B aşısı önerilmektedir (7,8,12). Rehberlerde yıllar içinde güncellemeler yapılsa da aşılama zamanı ve aşı dozu ile ilgili tam bir görüş birliği halen yoktur. T.C. Sağlık Bakanlığı HIV/AIDS Tanı Tedavi Rehberi’nde aşının çift doz olarak 0-1-2 ve 6. aylarda uygulanması, CD4+ T lenfosit sayısı >200 hücre/mm³ oluncaya kadar mümkünse ertelenmesi, değilse aşının yapılıp CD4+ T lenfosit sayısı >200 hücre/mm³ olduktan sonra tekrarlanması, aşı yanıtı oluşmayanlarda aşıya devam edilmesi önerilmektedir. Rehberde izole anti-HBc IgG varlığında aşılama ile ilgili bilgi bulunmamaktadır (12). Amerika Birleşik Devletleri’nin Sağlık ve Sosyal Hizmetler Bakanlığı (United States Department of Health and Human Services – DHHS) Rehberi’nde CD4+ T lenfosit sayısı >350 hücre/mm³ olanlarda aşı yanıtının daha iyi olduğu yine de daha düşük CD4+ T lenfosit sayısı olanlarda aşılamanın ertelenmemesi gerektiği belirtilmekte ve aşı 0-1 ve 6. aylarda çift doz olarak önerilmektedir. İzole anti-HBc IgG varlığında standart bir doz hepatit B aşısının yapılması, anti-HBs <100 İÜ/lt gelirse aşı serisinin tamamlanması önerilmektedir (7). Avrupa AIDS Klinik Derneği (European AIDS Clinical Society – EACS) Rehberi’nde CD4+ T lenfosit sayılarına bakılmaksızın, ulusal rehber önerilerine göre anti-HBs ≥ 10-100 İÜ/lt olana kadar aşılamanın yapılması, aşı yanıtı olmayanlarda çift doz aşılamanın düşünülmesi önerilmektedir. İzole anti-HBc IgG varlığında aşılamanın etkisine ilişkin veri eksikliği nedeniyle aşılama önerilmemektedir (8). Çalışmanın yürütüldüğü merkez olan polikliniğimizde, yıllar içinde değişen rehberleri takip ederek hastalarımıza aşılama önerilerinde bulunduk. Aşılanan hastalarımızın tümü standart doz hepatit B aşısı ile 0-1 ve 6. aylarda aşılandı.
İsviçre HIV kohortu çalışmasında, hepatit B aşılamasında hemşire programının etkisi değerlendirilmiş ve aşılamanın hemşireler tarafından takip edildiği müdahale merkezinde bağışıklık %32’den %76’ya, hekim sorumluluğundaki kontrol merkezlerinde ise yalnızca %33’ten %39’a yükseldiği (p=0.001) gösterilmiştir (13). Hastanemizde aşı polikliniğinin bulunmaması nedeniyle, izlemin etkili bir şekilde yapılamadığını ve rehber önerilerinin de etkili bir şekilde uygulanamadığını düşünmekteyiz.
2009-2012 yılları arasında yapılan bir gözlem çalışmasında, çalışma başlangıcında aşılanması gereken HIV ile yaşayan kişilerin oranı %44.2 iken çalışma bittiğinde %36.7, aşılama oranın ise %9.6 olduğu bildirilmiştir. Yine aynı çalışmada Ryan White HIV/AIDS Programı tarafından finanse edilen tesislerdeki aşılanma oranının finanse edilmeyenlere göre daha yüksek olduğu bildirilmiştir (14). Birleşik Krallık HIV Kohortu’nda HBV serolojisi negatif olan HIV ile yaşayan kişilerde aşılanma oranı 1996’da %42 iken 2009’da bu oranın %58.2’ye yükseldiği bildirilmiştir (15). Güney Brezilya’da yapılan bir çalışmada, sağlıklı kişilerde aşılanma oranı %87.6-97.5 aralığındayken HIV ile yaşayan kişilerde bu oran %57.4 olarak bulunmuştur (16). Avrupa AIDS Klinik Derneği’nin aşılama önerilerine uyumu değerlendirmek için Almanya’da yapılan bir çalışmada, hepatit B aşılama oranı %64.3 olarak bulunmuş ve bunun genel popülasyondan daha yüksek olduğu belirtilmiştir (17). Çakır ve arkadaşlarının 2013-2021 yılları arasında takip ettikleri HIV ile yaşayan 79 kişiyi irdeledikleri çalışmada, aşılanma oranı %54.5 olarak saptamıştır (18). Daha önce yine merkezimizde yürütülen çalışmamızda (19) aşılama oranı %30 iken mevcut çalışmada aşılanma oranı %44.6 olarak tespit edildi. Tüm bu veriler ışığında aşılanma oranlarının; yıllara, ülkelerin aşılama politikalarına, HIV ile yaşayan kişilere sağlık hizmeti verenlerin farkındalıklarına ve sağlanan finansal desteğe göre değiştiği anlaşılmaktadır.
Standart hepatit B aşılamasından sonra sağlıklı yetişkinlerde koruyucu anti-HBs titresi %90-95 oranında oluşurken HIV ile yaşayan kişilerde bu oran %17.5-71 arasında değişmektedir (1). Öztürk ve arkadaşlarının (20) yürüttükleri çalışmada, 0-1 ve 6. aylarda standart doz aşılama yapılanlarda %79 bağışıklık oluşurken çift doz ile aşılama yapılanlarda bu oran %96 olarak bildirilmiştir. Uganda’dan yapılan bir çalışmada, standart aşılama sonrası aşı yanıtının %92.1 olduğu tespit edilmiştir (21). İnci ve arkadaşlarının (22) yaptığı çalışmada ise bağışıklık oranı %26.8 olarak bulunmuştur. Chaiwarith ve arkadaşlarının (23) çalışmasında, standart olarak üç kez aşılama yapılanlarda bağışıklık gelişme oranı %57.1 iken bu oran dört kez aşılama yapılanlarda %76.7 ve dört kez çift doz aşılama yapılanlarda %80.5 olarak bildirilmiştir. Daha önceki çalışmamızda (19) bağışıklık gelişme oranı %50 iken mevcut çalışmamızda bu oran %80.5 olarak saptandı. Çalışmalara dahil edilen hasta popülasyonlarının özelliklerinde ve aşı uygulama şemalarındaki farklılıklardan dolayı HIV ile yaşayan kişilerde bağışıklık yanıt oranlarının değişkenlik gösterdiği düşünülmektedir.
HIV ile yaşayan ve izole anti-HBc IgG pozitifliği olan kişilerin aşılanması konusunda rehberlerde bir görüş birliği yoktur. Yine de birçok merkez hastalarını aşılamayı tercih etmektedir. Piroth ve arkadaşlarının (24) yaptığı çalışmada, bir doz aşı sonrası bağışıklık oranı %46 iken anti-HBs titresi oluşmayanlarda üç kez çift doz aşılama sonrası bağışıklık gelişme oranı %89 olarak saptanmıştır; söz konusu çalışmada toplamda %90.7 oranında bağışıklık oluşmuşken 18. ayda hastaların %57.4’ünde koruyuculuğun devam ettiği bildirilmiştir. Laksananun ve arkadaşlarının (25) yaptığı çalışmada, hastalar iki gruba ayrılmış, ilk gruba standart üç doz aşılama yapılırken ikinci gruba 0-1-2 ve 6.aylarda tek doz aşılama yapılmıştır. İlk grupta ilk aşıdan sonra bağışıklık %25.9, aşılama tamamlandıktan sonra ise %85.2 iken ikinci grupta ilk aşıdan sonra bağışıklık %33.3 aşılama tamamlandıktan sonra ise %88.9 oranında saptanmış, iki grup arasında istatiksel olarak anlamlı düzeyde fark bulunmadığı bildirilmiştir. Çalışmamızda üç doz standart aşı uygulanması sonrası bağışıklık oranı %90.7 olup sonuç literatürle uyumluydu.
Aşı yanıtını; saptanabilir HIV-RNA, düşük CD4+ T lenfosit sayısı, yaş, HCV koinfeksiyonu, okült HBV infeksiyonu, aşırı alkol kullanımı ve komorbid durumların etkilediği düşünülmektedir (1). Aşılama şemasındaki değişikliklerin de aşı yanıtını etkilediği gösterilmiştir (23).
Launay ve arkadaşlarının (26) HIV ile yaşayan ve CD4+ T lenfosit sayısı >200 hücre/mm³ olan kişilerin dahil edildiği çalışmalarında, üç farklı aşılama şeması uygulanmış olup dört kez çift doz aşılama diğer aşı şemalarına göre daha etkin bulunmuştur. Fonseca ve arkadaşları (27) da çift doz aşılamanın standart aşılamaya göre daha etkili olduğunu göstermiştir. Söz konusu çalışmada, HIV ile yaşayan ve hem CD4+ T lenfosit sayısı <350 hücre/mm³ hem de viral yükü >10 000 kopya/ml olan kişilerde aşılama şemasının bağışıklık yanıtına etkisinin istatiksel olarak anlamlı düzeyde olmadığı bildirilmiştir. Lara ve arkadaşları (28) da aşılama sonrası bağışıklık oluşmayanlarda rapel dozların yapılmasının bağışıklık yanıtı ile ilişkili bağımsız tek faktör olduğunu göstermiştir. Polikliniğimizden takipli HIV ile yaşayan kişilerin tümüne aynı aşılama şeması uygulandığı için bu anlamda bir karşılaştırma yapılamadı.
Seremba ve arkadaşlarının (21) aşı yanıtını değerlendikleri çalışmalarında, çok değişkenli analiz sonucunda bağışıklık için CD4+ T lenfosit sayısının >200 hücre/mm³ olması anlamlı bulunmuştur. Öztürk ve arkadaşlarının (20) çalışmasında da hem tanı anında hem aşılama anında CD4+ T lenfosit sayısının >200 hücre/mm³ olması anlamlı bulunmuştur. Çalışmamızda, CD4+ T lenfosit sayısı <200 hücre/mm³ olan ile >350 hücre/mm³ olan kişilerin aşı yanıtı arasında literatürle uyumlu bir şekilde istatistiksel olarak anlamlı düzeyde bir fark saptandı.
Saptanabilir HIV-RNA, aşı yanıtını olumsuz etkileyen faktörlerden biridir (1,26,29). Ülkemizde 2015 yılından itibaren CD4+ T lenfosit sayısından bağımsız olarak herkese tedavi önerilmeye başlanmıştır. Bu durumun aşı yanıtına yansıyan sonuçları olmuştur. Yapılan istatistik analizinde, tanı yılının 2015’ten önce ve sonra olma durumuna bağlı olarak bağışıklık yanıt oranının anlamlı düzeyde yükseldiği görüldü.
Chaiwarith ve arkadaşları (23) çalışmalarının sonucunda, bağışıklığın oluşması için aşılamanın genç yaşta yapılmasını önermiş olmakla birlikte yapılan diğer çalışmalarda bağışıklık yanıtı için yaş istatiksel olarak anlamlı bulunmamıştır (20,21). Çalışmamızda da bağışıklık oluşması için yaş anlamlı bir faktör olarak bulunmadı.
Yapılan çalışmalarda, komorbiditelerin bağışıklık yanıtına etkisi istatiksel olarak anlamlı bulunmamıştır (23,29). Çalışmamızda da komorbiditelerin aşı yanıtına etkisi olmadığı gösterildi. Komorbiditelerin incelendiği çalışmalarda HIV ile yaşayan kişi sayılarının az olduğu dikkat çekmektedir; bu kapsamda daha çok katılımcıyla yapılacak çalışmalara ihtiyaç vardır.
Bazı çalışmalarda anti-HCV pozitifliğinin aşı yanıtına etkisi olmadığı gösterilmiş olmakla birlikte hastalarda HCV koinfeksiyonu olup olmadığına dair bilgi verilmemiştir (26,28,29). Çalışmamızda HIV ile yaşayan sadece iki kişide anti-HCV pozitifliği mevcuttu ve birinde kronik HCV infeksiyonu vardı. İkisinde de bağışıklık oluşmuştu. Hasta sayısının yeterli olmaması nedeniyle istatistiksel analiz yapılmadı.
Aşılanan ya da aşılanmayan, aşı yanıtı olan ya da olmayan hiçbir HIV ile yaşayan kişide akut HBV infeksiyonu gelişmedi. Bu durumun, omurga tedavide tenofovir içeren ilaçların tercih edilmiş olmasının koruyucu etkisine bağlı olabileceği düşünüldü.
Sonuç olarak; HIV ile yaşayan ve HBV serolojisi negatif olan kişilerdeaşılanma son derece önemlidir. Çalışmamızın sonucunda, aşı için en ideal zamanın CD4+ T lenfosit sayısının >200 hücre/mm³ olduğu ve viral yükün baskılandığı süreç olduğu görüldü. Ayrıca, aşılanma durumunu yakından takip edecek sağlık personelinin bulunduğu aşı polikliniklerinin desteğiyle aşılanma oranı ve bağışıklık yanıtının artacağı göz önünde bulundurulmalıdır.
Hasta Onamı
Veriler poliklinik dosyaları ve hastane bilgi sistemi aracılığıyla retrospektif olarak incelendiği için hasta onamı alınmamıştır.
Etik Kurul Kararı
Çalışma, Haseki Eğitim ve Araştırma Hastanesi Klinik Araştırmalar Etik Kurulu tarafından 25 Ocak 2023 tarih ve 12-2023 karar numarasıyla onaylanmıştır.
Danışman Değerlendirmesi
Bağımsız dış danışman
Yazar Katkıları
Fikir/Kavram – E.Z., İ.Y.N., F.P.; Tasarım – E.Z., İ.Y.N.; Denetleme – E.Z., İ.Y.N.; Kaynak ve Fon Sağlama – E.Z., İ.Y.N., F.P.; Malzemeler/Hastalar – E.Z., H.K.K., M.N.Ö.; Veri Toplama ve/veya İşleme – E.Z., H.K.K., M.N.Ö.; Analiz ve/veya Yorum – E.Z., İ.Y.N., F.P.; Literatür Taraması – E.Z., H.K.K., M.N.Ö.; Makale Yazımı – E.Z., F.P.; Eleştirel İnceleme – E.Z., İ.Y.N., H.K.K., M.N.Ö., F.P.
Çıkar Çatışması
Yazarlar herhangi bir çıkar çatışması bildirmemiştir.
Finansal Destek
Yazarlar finansal destek beyan etmemiştir.
Referanslar
- Sun HY, Sheng WH, Tsai MS, Lee KY, Chang SY, Hung CC. Hepatitis B virus coinfection in human immunodeficiency virus-infected patients: a review. World J Gastroenterol. 2014;20(40):14598-614. [CrossRef]
- Farooq PD, Sherman KE. Hepatitis B vaccination and waning hepatitis B immunity in persons living with HIV. Curr HIV/AIDS Rep. 2019;16(5):395-403. [CrossRef]
- Global Hepatitis Report, 2017 [Internet]. Geneva: World Health Organization. [erişim 6 Mart 2023]. https://www.who.int/publications/i/item/9789241565455
- Phung BC, Sogni P, Launay O. Hepatitis B and human immunodeficiency virus co-infection. World J Gastroenterol. 2014;20(46):17360-7. [CrossRef]
- Gündüz A, Kumbasar-Karaosmanoğlu H, Tabak F. HIV ile hepatit B ve hepatit C koenfeksiyonu [Internet]. In: Tabak F, eds. HIV/AIDS Tanı, İzlem ve Tedavi El Kitabı. Sürüm 2.0, Aralık 2021:106-16. [erişim 6 Mart 2023]. https://www.klimik.org.tr/wp-content/uploads/2022/03/HIV_AIDS-El-Kitabi_-Su%CC%88ru%CC%88m-2.pdf
- Tian Y, Hua W, Wu Y, et al. Immune response to hepatitis B virus vaccine among people living with HIV: A meta-analysis. Front Immunol. 2021;12:745541. [CrossRef]
- Hepatitis B virüs infection: Guidelines for the Prevention and Treatment of Opportunistic Infections in Adults and Adolescents with HIV. National Institutes of Health, Centers for Disease Control and Prevention, HIV Medicine Association, and Infectious Diseases Society of America. [erişim 6 Mart 2023]. https://clinicalinfo.hiv.gov/sites/default/files/guidelines/documents/adult-adolescent-oi/hepatitis-b-virus-hbv-adult-adolescent-oi.pdf
- EACS Guidelines version 11.0, October 2021. Brussels: European AIDS Clinical Society (EACS). [erişim 6 Mart 2023]. https://www.eacsociety.org/media/guidelines-11.1_final_09-10.pdf
- Türkiye Viral Hepatit Önleme ve Kontrol Programı 2018-2023 [Internet]. Ankara: T.C. Sağlık Bakanlığı. [erişim 9 Mart 2023]. https://batmanism.saglik.gov.tr/TR,142887/turkiye-viral-hepatit-onleme-ve-kontrol-programi-2018-2023.html
- Tozun N, Ozdogan O, Cakaloglu Y, et al. Seroprevalence of hepatitis B and C virus infections and risk factors in Turkey: a fieldwork TURHEP study. Clin Microbiol Infect. 2015;21(11):1020-6. [CrossRef]
- Karaosmanoglu HK, Aydin OA, Nazlican O. Isolated anti-HBc among HIV-infected patients in Istanbul, Turkey. HIV Clin Trials. 2013;14(1):17-20. [CrossRef]
- HIV/AIDS Tanı Tedavi Rehberi, 2019 [Internet]. Ankara: T.C. Sağlık Bakanlığı Halk Sağlığı Genel Müdürlüğü. [erişim 9 Mart 2023]. https://hsgm.saglik.gov.tr/depo/Yayinlarimiz/Programlar/HIV_AIDS_Kontrol_Programi.pdf
- Boillat Blanco N, Probst A, Da Costa VW, et al. Impact of a nurse vaccination program on hepatitis B immunity in a Swiss HIV clinic. J Acquir Immune Defic Syndr. 2011;58(5):472-4. [CrossRef]
- Weiser J, Perez A, Bradley H, King H, Shouse RL. Low prevalence of hepatitis B vaccination among patients receiving medical care for HIV infection in the United States, 2009 to 2012. Ann Intern Med. 2018;168(4):245-54. [CrossRef]
- Price H, Bansi L, Sabin CA, et al; UK Collaborative HIV Cohort Hepatitis Group, Steering Committee. Hepatitis B virus infection in HIV-positive individuals in the UK collaborative HIV cohort (UK CHIC) study. PLoS One. 2012;7(11):e49314. [CrossRef]
- Martins S, Livramento Ad, Andrigueti M, et al. Vaccination coverage and immunity against hepatitis B among HIV-infected patients in South Brazil. Braz J Infect Dis. 2015;19(2):181-6. [CrossRef]
- Breitschwerdt S, Schwarze-Zander C, Al Tayy A, et al. Implementation of EACS vaccination recommendations among people living with HIV. Infection. 2022;50(6):1491-7. [CrossRef]
- Çakır Y, İnce N, Çalışkan E. [Immunization status of HIV-positive patients followed in infectious disease clinic at a university hospital]. OTJHS. 2022;7(3):407-13. Turkish. [CrossRef]
- Zerdali E, Nakir IY, Surme S, Yildirim M. Hepatitis B virus prevalence, immunization and immune response in people living with HIV/AIDS in Istanbul, Turkey: a 21-year data analysis. Afr Health Sci. 2021;21(4):1621-8. [CrossRef]
- Öztürk S, Özel AS, Ergen P, Şenbayrak S, Ağalar C. Hepatitis B immunization data of patients living with HIV/AIDS: a multi-centre study. Cent Eur J Public Health. 2022;30(4):213-8. [CrossRef]
- Seremba E, Ocama P, Ssekitoleko R, et al. Immune response to the hepatitis B vaccine among HIV-infected adults in Uganda. Vaccine. 2021;39(8):1265-71. [CrossRef]
- İnci A, Fincancı M. Antibody response to a standard dose of hepatitis B vaccine in HIV-infected patients. Klimik Derg. 2014;27(1):12-4. Turkish. [CrossRef]
- Chaiwarith R, Praparattanapan J, Kotarathititum W, Wipasa J, Chaiklang K, Supparatpinyo K. Higher rate of long-term serologic response of four double doses vs. standard doses of hepatitis B vaccination in HIV-infected adults: 4-year follow-up of a randomised controlled trial. AIDS Res Ther. 2019;16(1):33. [CrossRef]
- Piroth L, Launay O, Michel ML, et al; ANRS HB EP03 CISOVAC Study Group. Vaccination against hepatitis B virus (HBV) in HIV-1-infected patients with isolated anti-HBV core antibody: The ANRS HB EP03 CISOVAC prospective study. J Infect Dis. 2016;213(11):1735-42. [CrossRef]
- Laksananun N, Praparattanapan J, Kotarathititum W, Supparatpinyo K, Chaiwarith R. Immunogenicity and safety of 4 vs. 3 standard doses of HBV vaccination in HIV-infected adults with isolated anti-HBc antibody. AIDS Res Ther. 2019 May 3;16(1):10. [CrossRef]
- Launay O, Rosenberg AR, Rey D, et al; ANRS HB03 VIHVAC-B (Trial Comparing 3 Strategies of Vaccination Against the Virus of Hepatitis B in HIV-Infected Patients) Group. Long-term immune response to hepatitis B virus vaccination regimens in adults with human immunodeficiency virus 1: Secondary analysis of a randomized clinical trial. JAMA Intern Med. 2016;176(5):603-10. [CrossRef]
- Fonseca MO, Pang LW, de Paula Cavalheiro N, Barone AA, Heloisa Lopes M. Randomized trial of recombinant hepatitis B vaccine in HIV-infected adult patients comparing a standard dose to a double dose. Vaccine. 2005;23(22):2902-8. [CrossRef]
- Lara AN, Sartori AM, Fonseca MO, Lopes MH. Long-term protection after hepatitis B vaccination in people living with HIV. Vaccine. 2017;35(33):4155-61. [CrossRef]
- Kim HN, Harrington RD, Van Rompaey SE, Kitahata MM. Independent clinical predictors of impaired response to hepatitis B vaccination in HIV-infected persons. Int J STD AIDS. 2008;19(9):600-4. [CrossRef]

































































































































