En Çok Okunanlar
Özet
Amaç: Tekrarlayan ve latent kalabilen bir infeksiyon etkeni olması nedeniyle sitomegalovirus (CMV) infeksiyonu ve hastalığını ayırt etmek güçtür. Sitomegalovirus varlığını araştıran testlerin pozitif olması her zaman aktif hastalığı göstermez. Hastalığı viral reaktivasyondan ayırt etmede, gerçek zamanlı kantitatif polimeraz zincir reaksiyonu (kPCR) yöntemiyle gerçekleştirilen plazma CMV-DNA ölçümleri için net bir eşik değer yoktur. Bu çalışmada HIV/AIDS hastalarında; CMV ile ilişkili klinik sendromları tanımlamak ve CMV infeksiyonu ile hastalığın ayrımını yapmak için sayısal bir değer belirlenmesi hedeflendi.
Yöntemler: Plazmada pozitif CMV viral yükü olan, 18 yaş ve üzeri HIV/AIDS hastaları çalışma kapsamına alındı. Sosyodemografik, klinik ve laboratuvar verileri hasta dosyalarından alındı. Sitomegalovirus hastalığı tanısı, diğer etiyolojiler ekarte edildikten, tutulan organ ile ilgili klinik belirtiler varlığında herhangi bir vücut sıvısında viral nükleik asidin tespiti ile konulurken CMV infeksiyonu tanısı CMV ile ilgili semptom veya bulgular olmaksızın, plazmada CMV-DNA kPCR pozitifliği ile konuldu. Sitomegalovirus infeksiyonu ile hastalığını ayırt etmek için ROC eğrisi oluşturularak, plazmada CMV-DNA kPCR eşik değeri belirlendi.
Bulgular: On sekiz hastada CMV ile ilişkili hastalık ve 18 hastada CMV infeksiyonu olduğu belirlendi. Her iki grubun klinik ve laboratuvar parametreleri karşılaştırıldı. Sitomegalovirus hastalığı olan grupta hedef organ tutulumları tespit edilmiş olup en sık olarak gastrointestinal tutulum saptandı. Sitomegalovirus hastalığı ve infeksiyonu olan hastalarda CMV-DNA kPCR eşik değeri 3154 kopya/ml olarak tespit edildi. CD4+ T lenfosit sayısının azalması ve HIV viral yükünün artmasıyla CMV hastalığı riskinin arttığı bulundu.
Sonuç: Sitomegalovirus hastalığı hayatı tehdit eden sonuçlara yol açabileceği için doğru ve erken teşhis son derece önemlidir. Antiviral tedavi ile CMV infeksiyonuna bağlı morbidite ve mortalite önlenebilir. Bu çalışmada saptanmış olan CMV-DNA kPCR eşik değeri hastalığın erken tanısında klinisyenlere yol gösterici olacaktır.
GİRİŞ
Sitomegalovirus, Herpesviridae ailesinin Betaherpesvirinae alt ailesinden çift sarmallı bir DNA virusudur (1,2). Sitomegalovirus (CMV) infeksiyonu, immün sistemi normal olan bireylerde genellikle asemptomatiktir. Viremi ile karakterize primer infeksiyondan sonra çoğu zaman latent olarak kalmakta, ileri evre insan immün yetmezlik virusu (HIV) infeksiyonu gibi immün sistemin baskılandığı durumlarda, yeniden reaktive olabilmektedir (3).
İnsan immün yetmezlik virusu, 1980’lerin başlarında tanımlandığından beri yaklaşık 40 milyondan fazla ölüme neden olmuştur (4,5). Ülkemizde 1985’ten 31 Aralık 2021 tarihine kadar doğrulama testi pozitif tespit edilerek bildirimi yapılan 30 293 HIV ile yaşayan kişi ve 2083 HIV/AIDS hastası bildirilmiştir (6). HIV/AIDS tanısı alan hasta sayısı birçok ülkede azalma eğiliminde iken ülkemizde artış göstermektedir (7,8). 1996 yılından itibaren, virusu baskılamak için antiretroviral tedavi (ART)’nin kullanılması, hastalığın ilerlemesini yavaşlatarak CMV hastalığının insidansının azalmasına katkıda bulunmuştur (9-11). Ancak ART kullanımına rağmen, CMV infeksiyonu, hedef organ hastalığı ve HIV/AIDS ile ilişkili mortalite için önemli bir risk faktörü olmaya devam etmektedir. HIV/AIDS hastalarında, CD4+ T lenfosit sayısı 50/µl’nin altına düştüğünde CMV’ye bağlı göz, gastrointestinal sistem, sinir sistemi, karaciğer, böbrekler, adrenaller ve akciğerlerde tutulum ortaya çıkabilir (12-14).
Etkenin tekrarlayabilmesi ve latent kalabilmesi nedeniyle CMV hastalığının tanısı güçtür. Virusun varlığını araştıran testlerin pozitif olması her zaman aktif hastalığı göstermez. Hastalığın tanısı için CMV hastalığı ile uyumlu semptom ve bulguların varlığı ile beraber doku biyopsisinde CMV inklüzyon cisimciklerinin veya antijenin gösterilmesi gerekmektedir (15). Doku biyopsisi mümkün olmadığında, daha az spesifik olmakla birlikte, gerçek zamanlı kantitatif polimeraz zincir reaksiyonu (kPCR) CMV-DNA testi tanıda kullanılmaktadır. Hastalığı viral reaktivasyondan ayırt etmek için net bir eşik plazma CMV viral yük değeri yoktur.
Bu çalışmada, HIV/AIDS hastalarında CMV ile ilişkili sık görülen klinik sendromları tanımlamak, olası sonuçları değerlendirmek, CMV infeksiyonu ve hastalığının ayrımını yapmak için CMV-DNA kPCR eşik değerinin belirlenmesi hedeflendi.
YÖNTEMLER
Ocak 2016-Ocak 2022 tarihleri arasında servisimize yatırılarak izlenen, 18 yaş üstü 115 HIV/AIDS olgusu geriye dönük olarak incelendi ve plazmada CMV-DNA kPCR değeri herhangi bir titrede pozitif olan 36 olgu çalışmaya dahil edildi. Söz konusu 36 olgunun yatırılarak takip edildiği görüldü.
Çalışma verilerine, HIV/AIDS hastaları için kullanılan poliklinik izlem formlarından ve hastane veri tabanından ulaşılarak demografik, laboratuvar ve klinik veriler toplandı. Sitomegalovirus hastalığı gelişimi için risk faktörlerini belirlemek amacıyla; HIV-RNA PCR değerleri, CD4+ T lenfosit sayıları, CMV-DNA kPCR değerleri ve CMV IgM ve IgG antikor düzeyleri kaydedildi. Doku biyopsilerinin patolojik inceleme sonuçları hastane veri tabanından elde edildi; çalışma için biyopsi örnekleri tekrar değerlendirilmedi. Histopatolojik incelemeye ek olarak immünohistokimyasal boyamanın tüm biyopsi örneklerine yapıldığı tespit edildi.
Sitomegalovirus hastalığı tanısı, diğer etiyolojiler ekarte edildikten sonra, tutulan organ ile ilgili klinik belirtiler varlığında herhangi bir vücut sıvısında viral nükleik asidin tespiti ile konulurken CMV infeksiyonu tanısı CMV ile ilgili semptom veya bulgular olmaksızın, plazmada CMV-DNA kPCR pozitifliği ile konuldu (16). Sitomegalovirus retiniti tanısının göz hastalıkları konsültasyonu yapılarak oftalmolojik muayene ile konulduğu görüldü.
Sitomegalovirus pnömonisi tanısı ise; hasta kliniği, plazmada ve bronkoalveoler lavaj (BAL) sıvısında CMV DNA PCR pozitifliği, radyolojik incelemede akciğerlerde CMV uyumlu tutulum saptanması, göğüs hastalıkları ve radyoloji konsültasyonları, antiviral tedaviye yanıt alınması ile konulmuştu. Tanıyı doğrulamak için Göğüs Hastalıkları Kliniği tarafından hastalara bronkoskopi ve BAL’dan aside dirençli boyama (ARB) yapılmış, tüberküloz ve viral infeksiyonlar için PCR örnekleri alınmış ve galaktomannan düzeyi gönderilmişti; invazif bir işlem olması nedeni ile patolojik inceleme için akciğer biyopsisi yapılmamıştı.
Plazmada anti-CMV IgM ve anti-CMV IgG tespiti ELISA yöntemi ile çalışılmış olup plazmada CMV viral yük düzeyinin tespiti Artus® CMV QS-RGQ Kiti (QIAGEN, Almanya) kullanılarak gerçek zamanlı PCR yöntemiyle üreticinin talimatlarına uygun olarak gerçekleştirilmişti.
Çalışma için Bakırköy Dr. Sadi Konuk Eğitim ve Araştırma Hastanesi, Klinik Araştırmalar Etik Kurulu’ndan 26 Haziran 2022 tarih ve 2022-12-22 karar numarasıyla onay alındı.
İstatistiksel Analiz
Verilerin analizi, SPSS (Statistical Package for the Social Sciences) versiyon 23.0 programı (IBM Corp., Armonk, NY, ABD) ile yapıldı. Çalışmada yer alan kesikli değişkenler χ2 ve Fisher kesin testiyle, sürekli değişkenler ise Kolmogorov-Smirnov testiyle test edilerek Mann-Whitney U testiyle incelendi; p<0.05 değeri anlamlı düzey olarak kabul edildi. Sitomegalovirus infeksiyonu ile hastalığını ayırt etmek için ROC eğrisi oluşturularak, plazmada CMV-DNA kPCR eşik değeri belirlendi.
BULGULAR
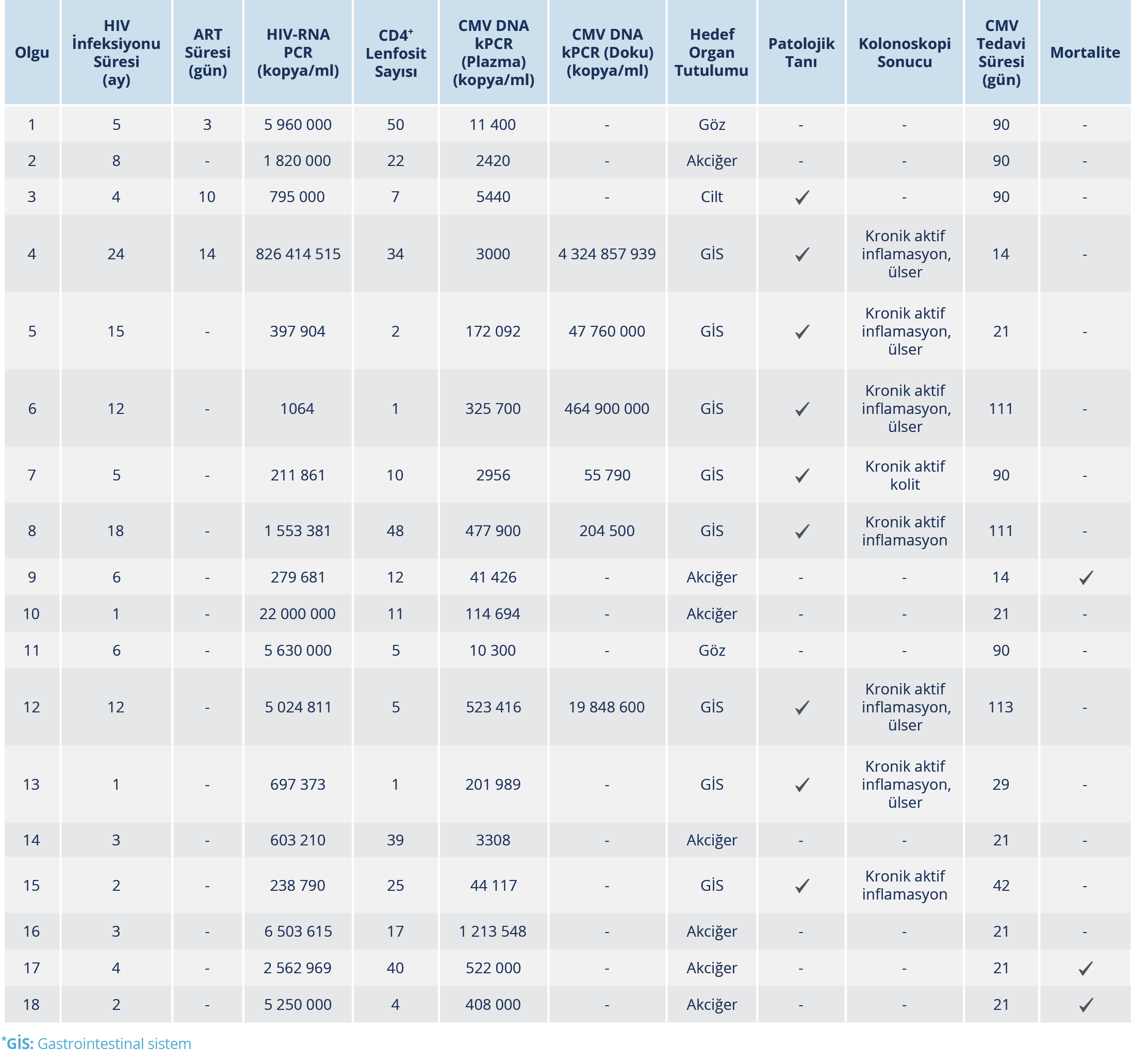
Çalışmaya dahil edilen 115 HIV/AIDS hastasının 36 (% 31.3)’sında plazmada CMV-DNA PCR pozitifliği saptandı. On sekiz hastada CMV hastalığı ve yine 18 hastada CMV infeksiyonu belirlendi. Hastaların 31 (% 86.1)’i erkek olup yaşları 20-66 (ortalama yaş=46±13) yıl arasındaydı. Hem CMV hastalığında hem infeksiyonunda erkek cinsiyet baskındı ve yaş ortalamaları benzer bulundu. Sitomegalovirus hastalığı olan grupta CD4+ T lenfosit sayısının daha düşük ve HIV viral yükünün daha yüksek olduğu görüldü (Tablo 1).
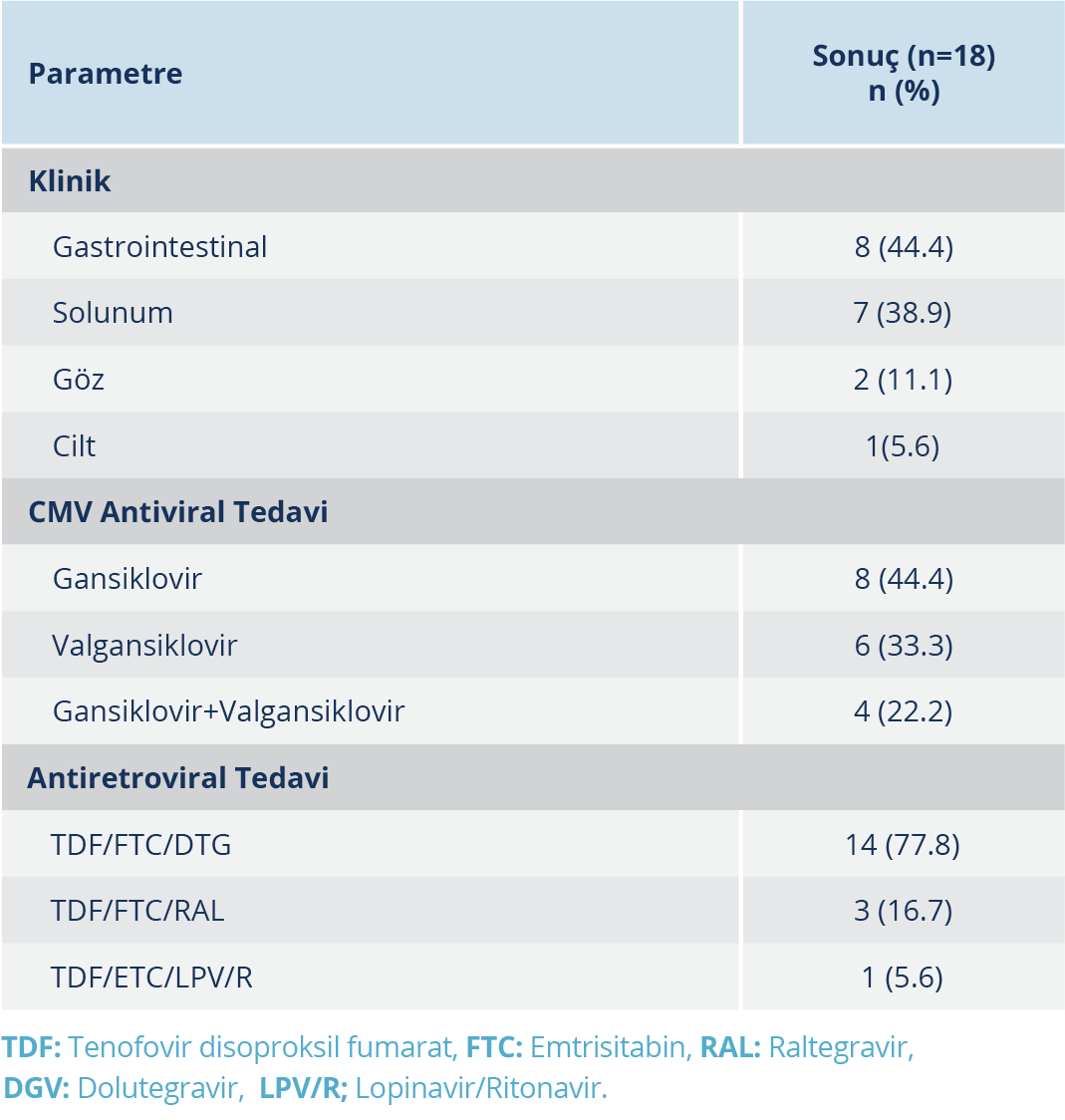
Hastaların CMV serolojileri değerlendirildiğinde; anti-CMV-IgM pozitiflik oranı %5.5 idi. Sitomegalovirus hastalığı olan grupta CMV IgM pozitiflik oranı CMV ile infekte gruba kıyasla daha düşüktü. Her iki grupta da CMV IgG, tüm hastalarda pozitif olarak belirlendi. Sitomegalovirus hastalığı olan grupta CMV viral yükü, CMV infeksiyonu olan gruptan daha yüksek saptandı. Hastalığa sahip olan grupta en sık olarak sırasıyla gastrointestinal, solunum, göz ve cilt tutulumu saptandı. Toplam sekiz gastrointestinal tutulum olan hastanın 6’sında (%75) kolon biyopsilerinde CMV PCR pozitifliği saptandı. Gastrointestinal tutulum saptanan olguların hepsinde ve cilt tutulumu olan bir olguda patolojik tanı mevcuttu. Cilt tutulumu olan olguda başka bir sistemik tutulum yoktu.
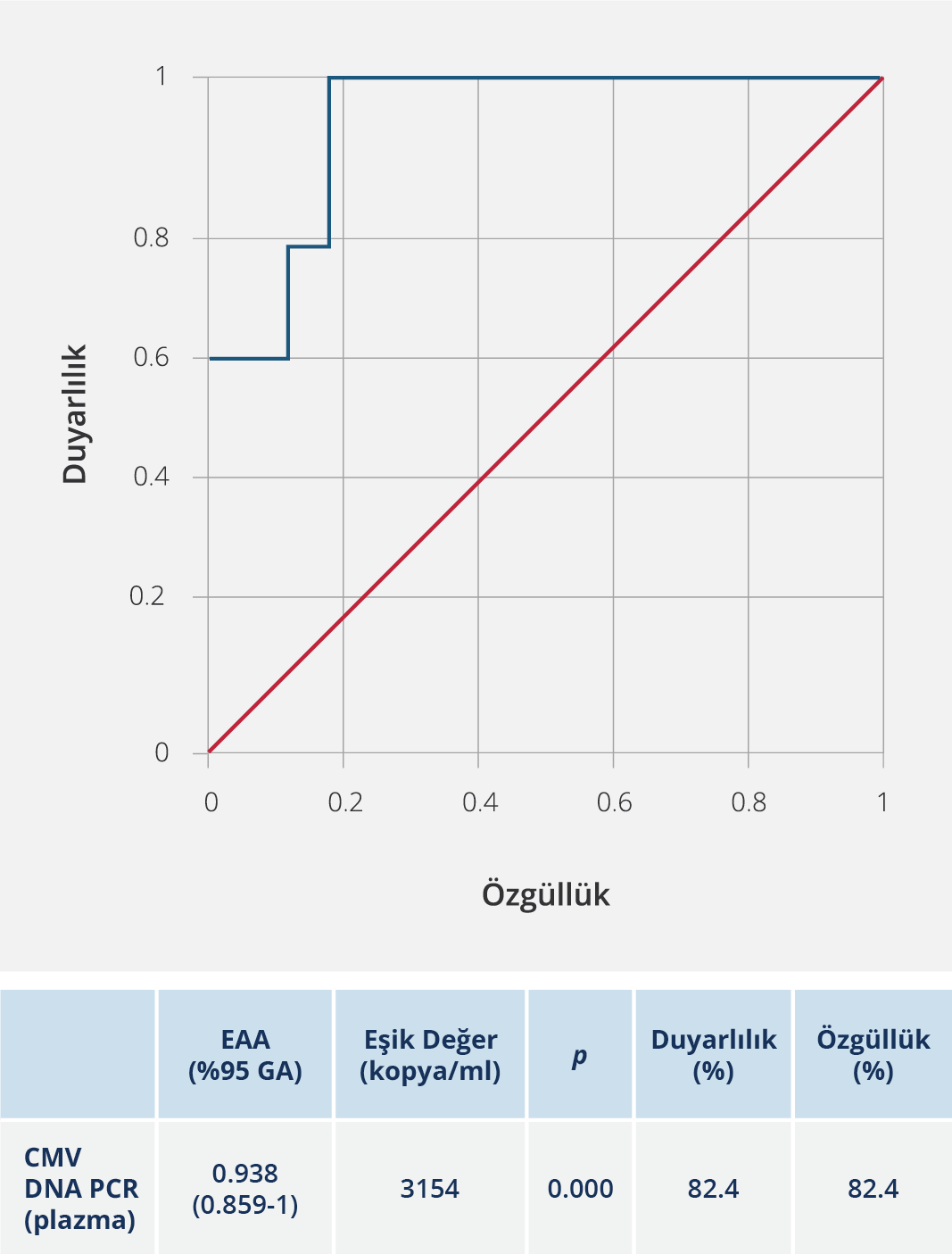
İnfekte hastaları CMV ile ilgili hastalığı olanlardan ayırt etmek için ROC analizi yapıldı; CMV viral yükü eşik değeri 3154 kopya/ml, özgüllük ve duyarlılık %82.4 bulundu (Şekil 1). Antiretroviral tedavide en sık tenofovir disoproksil fumarat (TDF), emtrisitabin (FTC) ve dolutegravir (DTG) kombinasyonu kullanılmıştı (Tablo 1). Hastaların hiçbiri sekonder profilaksi almamıştı. Sitomegalovirus hastalığının tedavisinde, gansiklovir, valgansiklovir veya gansiklovirin ardından valgansiklovir kullanılmıştı; antiviral tedavi süresi ortalama 56.11±39.765 (14-113) gün olarak bulundu. Klinik ve laboratuvar parametrelerinin karşılaştırması Tablo 2’de verildi. Üç olguda mortalite gelişmiş olup hepsinde CMV hastalığına bağlı olarak tutulan organ akciğerdi. CMV hastalığı olan olguların klinik ve laboratuvar değerlendirmeleri Tablo 3’te verildi.
İRDELEME
Sitomegalovirus, bağışıklığı baskılanmış bireylerde dissemine ya da lokal hedef organ hastalığı yapar; geçirilmiş fırsatçı infeksiyonlar, CMV viremisinin yüksekliği, yüksek plazma HIV RNA düzeyi, CD4+ T lenfosit hücre sayısının <50 hücre/mm3 olması ve ART alınmaması risk faktörleridir (17,18). HIV/AIDS olgularında, CMV retiniti saptanan grupta CD4+ T lenfosit sayısının, CMV retiniti saptanmayan gruba göre daha düşük bulunduğu çalışmalar mevcuttur (19,20).
HIV/AIDS hastalarında CMV hastalığının erken teşhisi önemlidir. Sitomegalovirus replikasyonunu saptayan tanı testleri yaygın olarak kullanılmakla birlikte sonuçların değerlendirilmesinde zorluklar yaşanmaktadır (21). Türkiye’de yetişkinlerde CMV seroprevalansı %85-95 arasında bildirilmektedir (22). Bu durum ülkemizdeki HIV ile infekte kişilerin de virusun reaktivasyonu için yüksek risk altında olduğu anlamına gelmektedir. Anti-CMV-IgM antikoru sıklıkla aktif viral infeksiyonun bir belirteci olarak kullanılmaktadır. Zhao ve arkadaşlarının (23) ve Udeze ve arkadaşlarının (24) çalışmalarında anti-CMV-IgM pozitiflik oranı sırası ile %11.7 ve %10.4 bulunmuştur. Çalışmamızda, anti-CMV-IgM pozitifliği oranının %5.5 olarak daha düşük bulunmasının nedeni çalışmaya alınan HIV/AIDS hastalarında virusun reaktivasyon sonucu hastalık oluşturmasıdır.
Sitomegalovirus infeksiyonunun en sık karşılaşılan hedef organ tutulumları retinit, ardından özofajit ve kolit olarak bildirilmektedir (25). Caplan ve arkadaşlarının (26) çalışmasında gastrointestinal tutulum oranı %68 olarak tespit edilirken bu oran Perello ve arkadaşlarının (27) çalışmasında %14’tür. Çalışmamızda CMV ile ilişkili hastalığı olan grupta gastrointestinal tutulum oranı %44.4 idi. Hedef organ tutulumunun kesin tanısı biyopsi ve dokuda CMV varlığının gösterilmesidir ancak biyopsi işlemi her zaman kolay yapılamamaktadır. Merkezimizde hastalar multidisipliner bir yaklaşımla değerlendirilerek invazif işlemlere ve biyopsiye erişim kolaylıkla sağlanabildiğinden CMV hastalığı tanısının konulabilmesi de mümkündür.
HIV/AIDS hastalarında CMV retiniti bugün hala bir sorundur ve erken dönemde ART kullanımı ile önlenebilir. Virus, hematojen yolla retinaya yayıldığı için plazma CMV yükü yüksek olan hastalarda retinit gelişme riski yüksektir. Hastalara ART ve CMV ‘ye yönelik antiviral tedavi başlanmazsa retinit lezyonları giderek genişler ve geri dönüşü olmayan görme kaybına yol açabilir (28,29). Çalışmamızda HIV/AIDS hastalarında önceki çalışmalara benzer şekilde CMV retinit oranı %11.1 olarak belirlendi (30,31).
HIV/AIDS hastalarında sağkalımı artırmak ve antiviral tedavi kararı için CMV viral yük değerinin saptanması ve hedef organ tutulumunun araştırılması gereklidir. McCoy ve arkadaşları (32) önceden biyopsi sonuçları histolojik olarak negatif olan kolitli hastalarda CMV PCR testinin artmış duyarlılığını göstermiştir. Bu nedenle, biyopsi sonuçları CMV için negatifse ve güçlü bir klinik CMV infeksiyonu şüphesi varsa PCR yönteminin kullanımı önerilmiştir. Bununla birlikte, gastrointestinal sistem biyopsilerinde PCR için bir sınır tanımlamaya hala ihtiyaç vardır. Toplam olgu sayımızın düşük olması ve her hastadan alınmış olan kolon biyopsi örneğinden PCR sonucu gönderilmediği için sadece plazmada CMV-DNA kPCR eşik değeri belirlendi. Daha önce yapılan çalışmalarda, plazmada CMV-DNA kPCR eşik değeri 3800-5010 kopya/ml arasında bulunmuştur (33,34).
Çalışmamızın sınırlılıkları; retrospektif bir çalışma olması, CMV infeksiyonu veya hastalığı olan grupların örneklem büyüklüğünün yetersiz olması, yalnızca yatan hastaların çalışmaya dahil edilmesi, farklı patologlar tarafından değerlendirme yapılması ve doku tanısı için biyopsilerin tekrar incelenmemiş olmasıdır. Sitomegalovirus pnömonisinin çalışmamızda literatürün aksine yüksek oranda bulunması, CMV pnömonisi tanısının doku biyopsisi ile konulmayıp, klinik ve görüntüleme bulguları uyumlu hastalarda diğer etkenlerin dışlanmış olması yoluyla konulması da diğer önemli sınırlılığıdır.
Çalışmamızda her iki grupta da plazmada CMV-DNA kPCR eşik değeri 3154 kopya/ml bulundu. Kullanılan örnek çeşidindeki farklılıklar (tam kan, lökosit veya plazma), dahil edilen bağışıklık sistemi baskılanmış hastaların türü ve kontrol grubunun özellikleri, CMV’nin kantitatif ölçüm tekniği nedeni ile saptadığımız eşik PCR değeri daha düşük olabilir.
Hayatı tehdit eden sonuçlara yol açabilen CMV hastalığında doğru ve erken teşhis çok önemlidir. Sitomegalovirus tanısı için altın standart yöntem biyopsi örneklerinde CMV ile ilgili histopatolojik bulguların gösterilmesi ve immünohistokimyasal inceleme ile tanının doğrulanmasıdır. Histopatoloji sonuçlanma süresinin uzun olması, hastanın girişimsel işlemi reddetmesi veya altta yatan hastalıklardan dolayı yapılamaması gibi nedenlerle noninvazif, erken sonuç veren moleküler testler tanıda kullanılmaktadır. Sitomegalovirus viral yükünün belirlenmesi erken tanı ve tedavi için gereklidir. CMV-DNA kPCR eşik değerinin belirlenmesinin, tanısal ve prognostik açıdan uygunluğu konusunda daha fazla araştırma yapılması gereklidir.
Hasta Onamı
Veriler retrospektif olarak incelendiği için hasta onamı alınmamıştır.
Etik Kurul Kararı
Çalışma için Bakırköy Dr. Sadi Konuk Eğitim ve Araştırma Hastanesi, Klinik Araştırmalar Etik Kurulu’ndan 26 Haziran 2022 tarih ve 2022-12-22 karar numarasıyla onay alındı.
Danışman Değerlendirmesi
Bağımsız dış danışman
Yazar Katkıları
Fikir/Kavram – D.B.; Tasarım – D.B., S.Ş.; Y.E.Ö.; Denetleme – D.B., Z.Y.; H.G., K.K.Y. Kaynak ve Fon Sağlama – D.B., E.C.Ü.; Malzemeler/Hastalar – Z.Y., Y.E.Ö.; Veri Toplama ve/veya İşleme – E.C.Ü.; Analiz ve/veya Yorum – D.B., S.Ş.; H.G., K.K.Y. Literatür Taraması – Y.E.Ö., Z.Y.; E.C.Ü.; Makale Yazımı – D.B.; H.G., S.Ş.; Eleştirel İnceleme – S.Ş., K.K.Y.
Çıkar Çatışması
Yazarlar herhangi bir çıkar çatışması bildirmemiştir.
Finansal Destek
Yazar finansal destek beyan etmemiştir.
Referanslar
- Fakhreddine AY, Frenette CT, Konijeti GG. A Practical review of cytomegalovirus in gastroenterology and hepatology. Gastroenterol Res Pract. 2019;2019:6156581. [CrossRef]
- Fulkerson HL, Nogalski MT, Collins-McMillen D, Yurochko AD. Overview of human cytomegalovirus pathogenesis. Methods Mol Biol. 2021;2244:1-18. [CrossRef]
- Skipper C, Schleiss MR, Bangdiwala AS, et al. Cytomegalovirus viremia associated with increased mortality in cryptococcal meningitis in Sub-Saharan Africa. Clin Infect Dis. 2020;71(3):525-31. [CrossRef]
- Global HIV & AIDS statistics – Fact sheet [Internet]. Geneva: Joint United Nations Programme on HIV/AIDS (UNAIDS). [erişim 2 Ocak 2023]. https://www.unaids.org/en/resources/fact-sheet
- GBD 2017 HIV collaborators. Global, regional, and national incidence, prevalence, and mortality of HIV, 1980-2017, and forecasts to 2030, for 195 countries and territories: a systematic analysis for the Global Burden of Diseases, Injuries, and Risk Factors Study 2017. Lancet HIV. 2019;6(12):e831-59. [CrossRef]
- HIV/AIDS istatistikleri [Internet]. Ankara: T.C. Sağlık Bakanlığı Halk Sağlığı Genel Müdürlüğü, Bulaşıcı Hastalıklar Dairesi Başkanlığı. [erişim Ocak 2024]. https://hsgm.saglik.gov.tr/depo/birimler/bulasici-hastaliklar-ve-erken-uyari-db/Dokumanlar/Istatistikler/hiv-aids-2023.pdf
- HIV/AIDS surveillance in Europe 2022- 2021 data [Internet]. Copenhagen: WHO Regional Office for Europe. [erişim Ocak 2024]. https://www.ecdc.europa.eu/sites/default/files/documents/2022-Annual_HIV_Report_final.pdf
- Guliyeva G, Akyol D, Pullukçu H, Gökengin D. [Care and management of Aegean University HIV cohort: Change over time]. Klimik Derg. 2023;36(1):45-51. Turkish. [CrossRef]
- Heslin KC, Elixhauser A. HIV Hospital Stays in the United States, 2006–2013 [Internet]. Rockville (MD): Agency for Healthcare Research and Quality (US). [erişim 2 Ocak 2023]. https://www.ncbi.nlm.nih.gov/books/NBK379715/
- Mocroft A, Ledergerber B, Katlama C, et al; EuroSIDA study group. Decline in the AIDS and death rates in the EuroSIDA study: an observational study. Lancet. 2003;362(9377):22-9. [CrossRef]
- Albasanz-Puig A, Suanzes P, Esperalba J, et al. Low frequency of cytomegalovirus (CMV) disease despite high prevalence of CMV viraemia in patients with advanced HIV infection: a clinical and immunological 48-week follow-up study. HIV Med. 2021;22(8):682-9. [CrossRef]
- Šimeková K, Nováková E, Rosoľanka R, Masná J, Antolová D. Clinical course of opportunistic infections-toxoplasmosis and cytomegalovirus infection in HIV-infected patients in Slovakia. Pathogens. 2019;8(4):219. [CrossRef]
- Qian Y, Wang L, Jiang J, et al. Cytomegalovirus-immune recovery retinitis after initiation of highly active antiretroviral therapy: a case series. Front Med (Lausanne). 2022;9:807013. [CrossRef]
- Grønborg HL, Jespersen S, Hønge BL, Jensen-Fangel S, Wejse C. Review of cytomegalovirus coinfection in HIV-infected individuals in Africa. Rev Med Virol. 2017;27(1). [CrossRef]
- Ljungman P, Boeckh M, Hirsch HH, et al; Disease Definitions Working Group of the Cytomegalovirus Drug Development Forum. Definitions of cytomegalovirus infection and disease in transplant patients for use in clinical trials. Clin Infect Dis. 2017;64(1):87-91. [CrossRef]
- Kotton CN, Kumar D, Caliendo AM, et al; The Transplantation Society International CMV Consensus Group. The Third International Consensus Guidelines on the Management of Cytomegalovirus in Solid-organ Transplantation. Transplantation. 2018;102(6):900-31. [CrossRef]
- Levi LI, Sharma S, Schleiss MR, et al; INSIGHT ANRS study groups. Cytomegalovirus viremia and risk of disease progression and death in HIV-positive patients starting antiretroviral therapy. AIDS. 2022;36(9):1265-72. [CrossRef]
- Kirkoyun Uysal H, Koksal MO, Sarsar K, et al. Distribution of opportunistic pathogens in people living with HIV at a university hospital in İstanbul over a one-year treatment period and its association with CD4 T Cell counts. Pathogens. 2023;12(10):1226. [CrossRef]
- Tang Y, Sun J, He T, et al. Clinical features of cytomegalovirus retinitis in HIV infected patients. Front Cell Infect Microbiol. 2020;10:136. [CrossRef]
- Du KF, Huang XJ, Chen C, et al. High blood cytomegalovirus load suggests cytomegalovirus retinitis in HIV/AIDS patients: a cross-sectional study. Ocul Immunol Inflamm. 2022;30(7-8):1559-63. [CrossRef]
- Özkarata E, Özbek ÖA, Avkan Oğuz V, Sayıner AA. [Comparison of the CMV antigenemia test and CMV-DNA PCR results in solid organ transplant recipients]. Mikrobiyol Bul. 2016;50(1):44-52. Erratum in: Mikrobiyol Bul. 2016;50(2):352. Özkarataş, Emre [corrected to Özkarata, Emre]. Turkish. [CrossRef]
- Ataman S, Colak D, Günseren F, et al. [Investigation of cytomegalovirus seroepidemiology in Antalya with a population-based cross-sectional study and review of related data in Turkey]. Mikrobiyol Bul. 2007;41(4):545-55. Turkish.
- Zhao M, Zhuo C, Li Q, Liu L. Cytomegalovirus (CMV) infection in HIV/AIDS patients and diagnostic values of CMV-DNA detection across different sample types. Ann Palliat Med. 2020;9(5):2710-15. [CrossRef]
- Udeze A, Odebisi-Omokanye M, Ajileye T. Cytomegalovirus infection among human immunodeficiency virus (HIV) infected individuals on highly active anti-retroviral therapy in North-Central Nigeria. Afr Health Sci. 2018;18(4):1057-65. [CrossRef]
- Chatterjee A, Roy D, Mukherjee S, Ghosh H, et al. A comparative analysis depicting the disease characteristics and phylogenetic signature of human cytomegalovirus infection in human immunodeficiency virus 1 seropositive patients with end-organ retinitis and gastro-enteric diseases. Sci Rep. 2022;12(1):7617.
- Caplan MR, Wilson EMP, Schechter M, et al. High prevalence of gastrointestinal manifestations among cytomegalovirus end-organ disease in the combination antiretroviral era. J Virus Erad. 2021;7(3):100052. [CrossRef]
- Perello R, Vergara A, Monclus E, et al. Cytomegalovirus infection in HIV-infected patients in the era of combination antiretroviral therapy. BMC Infect Dis. 2019;19(1):1030. [CrossRef]
- Munro M, Yadavalli T, Fonteh C, Arfeen S, Lobo-Chan AM. Cytomegalovirus retinitis in HIV and non-HIV individuals. Microorganisms. 2019;8(1):55. [CrossRef]
- Lalonde RG, Boivin G, Deschênes J, et al. Canadian consensus guidelines for the management of cytomegalovirus disease in HIV/AIDS. Can J Infect Dis Med Microbiol. 2004;15(6):327-35. [CrossRef]
- Jabbari MR, Soleimanjahi H, Shatizadeh Malekshahi S, Gholami M, Sadeghi L, Mohraz M. Frequency of cytomegalovirus viral load in Iranian human immunodeficiency virus-1-infected patients with CD4+ counts <100 cells/mm3. Intervirology. 2021;64(3):135-9. [CrossRef]
- Leenasirimakul P, Liu Y, Jirawison C, et al. Risk factors for CMV retinitis among individuals with HIV and low CD4 count in northern Thailand: importance of access to healthcare. Br J Ophthalmol. 2016;100(8):1017-21. [CrossRef]
- McCoy MH, Post K, Sen JD, et al. qPCR increases sensitivity to detect cytomegalovirus in formalin-fixed, paraffin-embedded tissue of gastrointestinal biopsies. Hum Pathol. 2014;45(1):48-53. [CrossRef]
- Mondaca R, Fica A, Delama I, Olivares F, Navarrete M. Cytomegalovirus infection in AIDS patients. An illustrative case series. Rev Med Chil. 2020;148(6):778-86. [CrossRef]
- Carstensen S, Raboni SM, França JCB, Teixeira F. Standardization of antigenemia and qPCR cut-off values in whole blood for the detection of cytomegalovirus disease in HIV patients. Rev Soc Bras Med Trop. 2019;52:e20180457. [CrossRef]