En Çok Okunanlar
Özet
Amaç: Daha önce primer immün yetmezlik (PİY) olarak adlandırılan doğuştan bağışıklık hataları (“inborn errors of immunity” – IEI), doğal ve/veya adaptif immün sistem bileşenlerini etkileyen kalıtsal bozukluklardır; PİY’li heterojen hasta grubunda karşılaşılan en sık bulgu infeksiyonlar olup artan morbidite ve mortalite ile ilişkilidir. Bu retrospektif çalışmanın amacı, immünoglobulin replasman tedavisi (İGRT) alan heterojen bir hasta grubundaki infeksiyonları tanımlamaktır.
Yöntemler: Son beş yıl içinde kliniğimizde takip edilen ve İGRT alan PİY tanılı hastaların tıbbi kayıtları geriye dönük olarak incelendi.
Bulgular: Çalışmaya dahil edilen 45 PİY hastasında (%55.6’sı erkek, yaş ortalaması 38.4±11.6 yıl) en sık tanı %88.8 ile primer antikor eksikliği idi. Hastaların ortalama tanı yaşı 26.8±14.8 yıl, ortanca tanı gecikme süresi altı yıldı. Hastaların 20 (%44.4)’sinde bronşektazi olduğu görüldü. Hepsi İGRT almış olup %82.2’si antimikrobiyal profilaksi (%66.7’si trimetoprim-sulfametoksazol) ile tedavi edilmişti. Tanı öncesinde yıllık ortanca infeksiyon sayısı dört iken, tedavi sonrasında bire düşmüştü (p<0.001); İGRT ile tanı öncesine göre pnömoni ve üst solunum yolu infeksiyonu sıklığında önemli bir azalma görüldü (sırasıyla; %75.6 ve %22.2, p<0.001; %66.7 ve %31.1, p=0.003). Hastaların %37.8’inin tedavi altında infeksiyon nedeniyle hastane yatışı mevcuttu. Hastane yatışı olan hastalarda hastane yatışı olmayanlara göre inaktif influenza ile aşılanma oranı ve vücut kitle indeksi (VKİ) ortalaması anlamlı düzeyde düşük bulundu (sırasıyla; %20 ve %53.8, p=0.034; 20.5 ve 24.1 kg/m2, p=0.019). Bronşektazisi olan hastalarda tanı öncesi pnömoni geçirme oranı anlamlı olarak daha yüksekti (%95 ve %60, p=0.012). Düşük VKİ, bronşektazi ve tedavi uyumsuzluğu olanlarda tedavi altında görülen infeksiyonlar daha fazlaydı.
Sonuç: PİY’in erken tanısı, tedavisi ve hastaların tedavi uyumlarının artırılması ile infeksiyonlar başta olmak üzere birçok komplikasyonun önüne geçilebilir. Bu nedenle, PİY’e ilişkin farkındalığın hem toplumda hem de her uzmanlık alanından hekimlerde artırılması, hastaların erken dönemde tanı almalarını sağlayacak ve hastaneye yatışı, mortaliteyi, morbiditeyi azaltacaktır.
Anahtar Kelimeler: primer immün yetmezlik, immünoglobulin replasman tedavisi, solunum yolu infeksiyonları
GİRİŞ
Daha önce primer immün yetmezlik (PİY) olarak adlandırılan doğuştan bağışıklık hataları (“inborn errors of immunity” – IEI), doğal ve/veya adaptif immün sistem bileşenlerini etkileyen kalıtsal bozukluklardır; infeksiyonlara duyarlılık ve immün disregülasyon ile karakterize olabilirler (1). Uluslararası İmmünoloji Dernekleri Birliği (International Union of Immunological Societies- IUIS) IEI Komitesi yaptığı son güncelleme ile PİY’leri fenotiplerine göre 10 sınıfa ayırmıştır (2). Primer immün yetmezliğin temsil ettiği hastalık grubu heterojen olmakla birlikte, klinik olarak en belirgin bulgu artmış infeksiyonlardır. Bu infeksiyonların en önemli özellikleri ise tekrarlamaları, tedaviye iyi cevap vermemeleri, ağır ve komplike seyretmeleridir (3,4). Bunun sonucu olarak da hastalar artmış morbidite ve mortalite ile karşı karşıya kalmaktadır (1,3,4). Bu nedenle infeksiyon hastalıklarına karşı koruyucu tedbirlerin uygulanması hayati önem taşımaktadır. Bu koruyucu tedbirlerin başlıcaları; immünoglobulin replasman tedavisi (İGRT), antimikrobiyal ilaç profilaksisi, etkilenen immün sistem bileşenine özel bireyselleştirilmiş bir aşılama programı, beslenme desteği ve hijyen kurallarına uyumdur (5,6).
Yetişkin PİY hasta grubunda en yaygın semptomatik fenotip, primer antikor eksikliği (PAE) alt grubunda yer alan yaygın değişken immün yetmezlik (common variable immunodeficiency – CVID)’tir; bu hasta grubunda Haemophilus influenzae tip B veya Streptococcus pneumoniae başta olmak üzere kapsüllü bakteriler tekrarlayan sinopulmoner infeksiyonların başlıca etkenleridir (7-9). Söz konusu hasta grubunda merkezi sinir sistemi, sindirim sistemi, cilt ve yumuşak doku infeksiyonları da görülebilir. Her ne kadar bu hastalık antikor eksikliği ön planda olan bir bozukluk olmakla birlikte değişen derecelerde T hücre disfonksiyonu CVID’e eşlik etmekte ve bu hastaları viral ve bazen de fırsatçı infeksiyonlara duyarlı hale getirebilmektedir (2). Ayrıca geç başlangıçlı kombine immün yetmezlik (late-onset combined immune deficiency – LOCID) CVID’nin yakın zamanda tanımlanmış bir varyantı olup fırsatçı infeksiyonlar (Pneumocystis jiroveci, Cytomegalovirus- CMV) ve/veya düşük CD4+ T lenfosit sayıları (<200 hücre/μ) ile başvuran yetişkin hastalarla karşımıza çıkar (10). İnfeksiyona yol açan ajanın türü, PİY’den etkilenen immün sistem bileşeni konusunda klinisyenlere yol gösterici olabilmektedir (2,3).
İmmünoglobulin replasman tedavisi PİY’li hastalarda infeksiyon sıklığını belirgin olarak azaltmakla birlikte bazı hastalar kalıcı akciğer hasarına neden olabilen solunum yolu infeksiyonlarını geçirmeye devam ederler (7,11,12). Bu nedenle ideal çukur immünoglobulin G (IgG) seviyesinin hastaların klinik özelliklerine (infeksiyon sayısı, şiddeti, bronşektazi varlığı, vb. faktörler) göre bireyselleştirilerek takip edilmesi önerilmektedir (13). Primer immün yetmezliğin erken tanı ve tedavisi ile birçok komplikasyonun yanı sıra özellikle infeksiyonlar ve infeksiyonların etkilediği organlarda meydana gelen kalıcı hasarlar önlenebilir (6). Bu nedenle bu özel hasta grubunun erken tanı alabilmesi için farkındalığın artırılması oldukça önemlidir. Araştırmamızın amacı, PİY hasta grubumuzdaki tanı öncesi infeksiyon sıklığını ve tuttuğu bölgeleri tanımlamak ve tedavi altındaki değişimleri saptamaktır.
YÖNTEMLER
Çalışmamız 2017-2022 yılları arasında Erişkin İmmünoloji ve Alerji Hastalıkları Kliniği’nde İGRT alan PİY tanılı, 18 yaşından büyük hastalar ile gerçekleştirilmiş olup demografik özellikler, laboratuvar ve görüntüleme yöntemi sonuçları, kültür sonuçları ile klinik bulguları içeren veriler elektronik kayıt sisteminden ve hasta dosyalarından retrospektif olarak alındı. Tespit edilen 51 hastanın altısının verileri eksikti; çalışma 45 hastanın verileri ile gerçekleştirildi.
Çalışma kapsamındaki hastalar, Avrupa Bağışıklık Yetmezliği Derneği (European Society for Immunodeficiencies – ESID) tarafından belirlenen kriterlere göre tanı almış olup IUIS-IEI Komitesi tarafından önerilen fenotiplemeye uygun olarak sınıflandırılmıştır (2,14). Kliniğimizde tedavi alan PİY tanılı hastalar, rutin olarak 3-4 haftada bir tedavi almak için başvurdukları planlı vizitlerde veya farklı şikayetlerle başvurdukları plansız vizitlerde infeksiyon ve infeksiyon dışı komorbiditeler açısından detaylı olarak değerlendirilmiştir.
Hastaların tanı almadan önce yaşadıkları fırsatçı ve/veya inatçı infeksiyonlar, infeksiyon bölgeleri ve sayıları ile tanı sonrasındaki takip süreçlerinde aldıkları tedaviler (antibiyotik profilaksisi, IgG uygulamasının yolu/dozu, aşılama durumu); tedavi sürecindeki infeksiyonlar, infeksiyon bölgeleri, infeksiyon sayıları, hastaneye yatış durumları ve infeksiyon sonrası antimikrobiyal profilaksi tedavilerinde yapılan değişikliklere ilişkin tüm veriler analiz edildi.
Dünya Tabipler Birliği Helsinki Bildirgesi’ne uygun olarak yürütülen çalışma için Ankara Üniversitesi Tıp Fakültesi İnsan Araştırmaları Etik Kurulu’ndan 30 Aralık 2022 tarih ve İ11-684-22 karar numarasıyla onay alındı.
İstatistiksel Analiz
Verilerin analizi, SPSS (Statistical Package for the Social Sciences) versiyon 27.0 programı (IBM Corp., Armonk, NY, ABD) ile yapıldı. Tanımlayıcı analizler kategorik değişkenlerde sıklık ve yüzde, sürekli değişkenlerde ise ortalama±standart sapma (SS) veya ortanca (minimum-maksimum) değerleri ile sunuldu. Sürekli değişkenlerin normal dağılıma uygunluğu görsel (histogram ve olasılık grafikleri) ve analitik yöntemlerle (Kolmogorov-Smirnov/Shapiro-Wilk testleri) incelendi. Kategorik değişkenlerde bağımsız grup karşılaştırmaları χ2 veya Fisher testleri kullanılarak yapıldı. Sürekli değişkenler ise Mann-Whitney U veya Student t testi ile analiz edildi. Tanı öncesi ve tedavi sonrası infeksiyon oranları McNemar, yıllık infeksiyon sayıları ise Wilcoxon testi kullanılarak karşılaştırıldı. İstatistiksel anlamlılık için tip-1 hata düzeyi %5 olarak belirlendi.
BULGULAR
Hasta Özellikleri
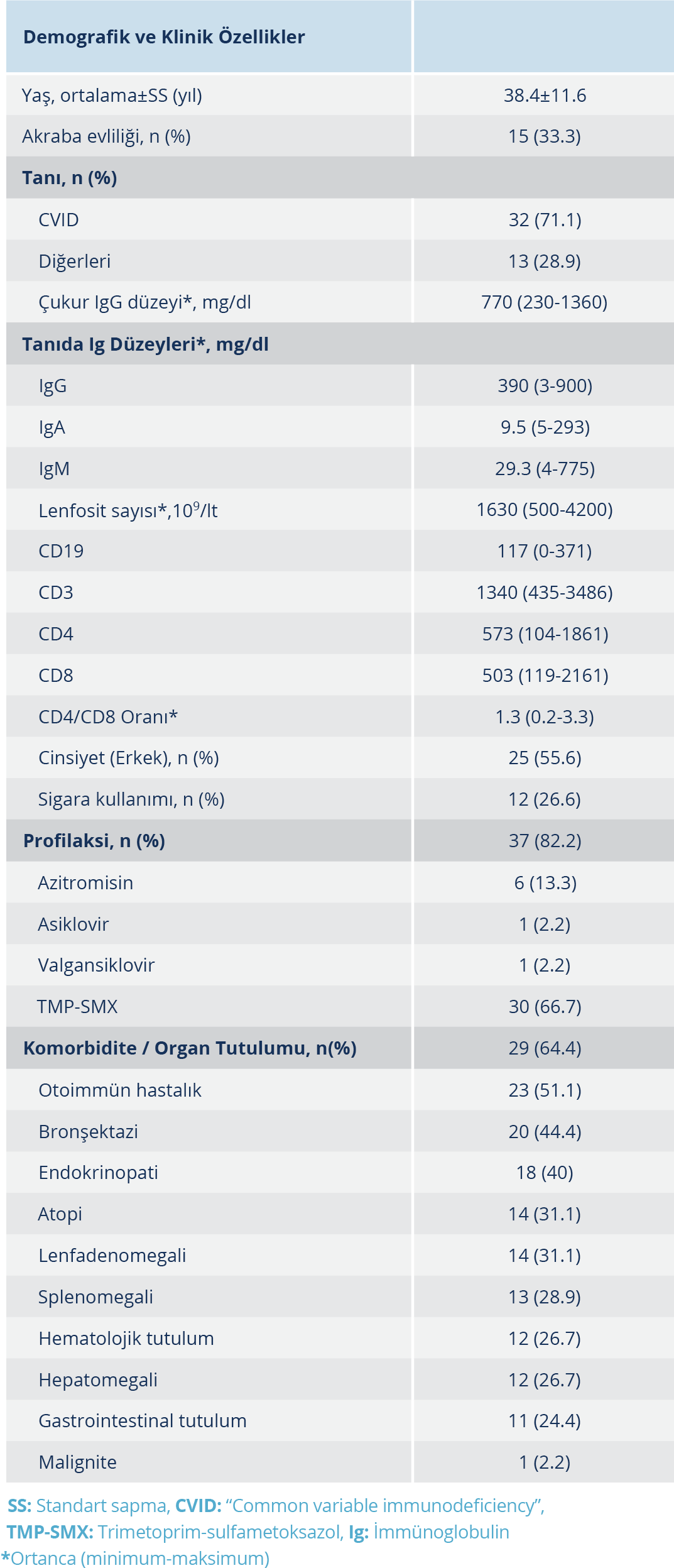
Çalışmaya dahil edilen toplam 45 hastanın [25 (%55.6) erkek ve 20 (%44.4) kadın] yaş ortalaması 38.4±11.6 yıl, ortalama vücut kütle indeksi (VKİ) 22.8±4.7 kg/m2 idi. En sık karşılaşılan immün yetmezlik tanısı (%88.8) primer antikor eksikliği idi ve 5 (%11.1) hastada genetik tanı çalışılmıştı (Şekil 1). Hastaların ortalama tanı yaşı 26.8±14.8 yıl olup ortanca tanı gecikme süresi 6 (0-33) yıl idi. Bronşektazi tanısı alan hasta sayısı 20 (%44.4) olup; 40 (%88.9) hastaya intravenöz immünoglobulin (İVİG), 5 (%11.1) hastaya ise subkutan immünglobulin tedavisi uygulanmaktaydı. En sık kullanılan antimikrobiyal profilaksinin trimetoprim-sulfametoksazol (TMP-SMX) (%66.7) olduğu görüldü. Tablo 1’de hastaların demografik, klinik özellikleri ve tanı sırasında ortanca IgG, IgA ve IgM düzeyleri, lenfosit sayıları ve periferik lenfosit alt grupları ile tedavi sonrası ortanca çukur IgG düzeyleri ve antimikrobiyal profilaksileri ayrıntılı olarak verildi. Toplam 41 hastanın aşılama verilerine erişilmiş olup hastaların %78’inin koronavirus hastalığı 2019 (COVID-19) aşısı, %46.3’ü pnömokok aşısı, %41.5’i ise mevsimsel inaktif influenza aşısı (İİA) olduğu tespit edildi. İmmünoglobulin replasman tedavisi alan 17 (%37.8) hasta infeksiyon nedeniyle hastanede yatmış, 2 (%4.4) hasta infeksiyon nedeniyle kaybedilmiş ve 14 (%31.1) hastanın tedavisinde infeksiyon sonrası değişiklik yapılmıştı.
Tablo 3. Tedavi Altında İnfeksiyon Nedenli Hastane Yatışı Olan ve Olmayan Hastaların Özelliklerinin Karşılaştırılması (N=45)

Şekil 3.Bronşektazi Gelişen ve Gelişmeyen Hastalarda İmmünoglobulin Düzeyleri (Gruplar arasındaki fark istatistiksel olarak anlamlıdır)
Tedavi Öncesi ve Sonrası Karşılaştırma
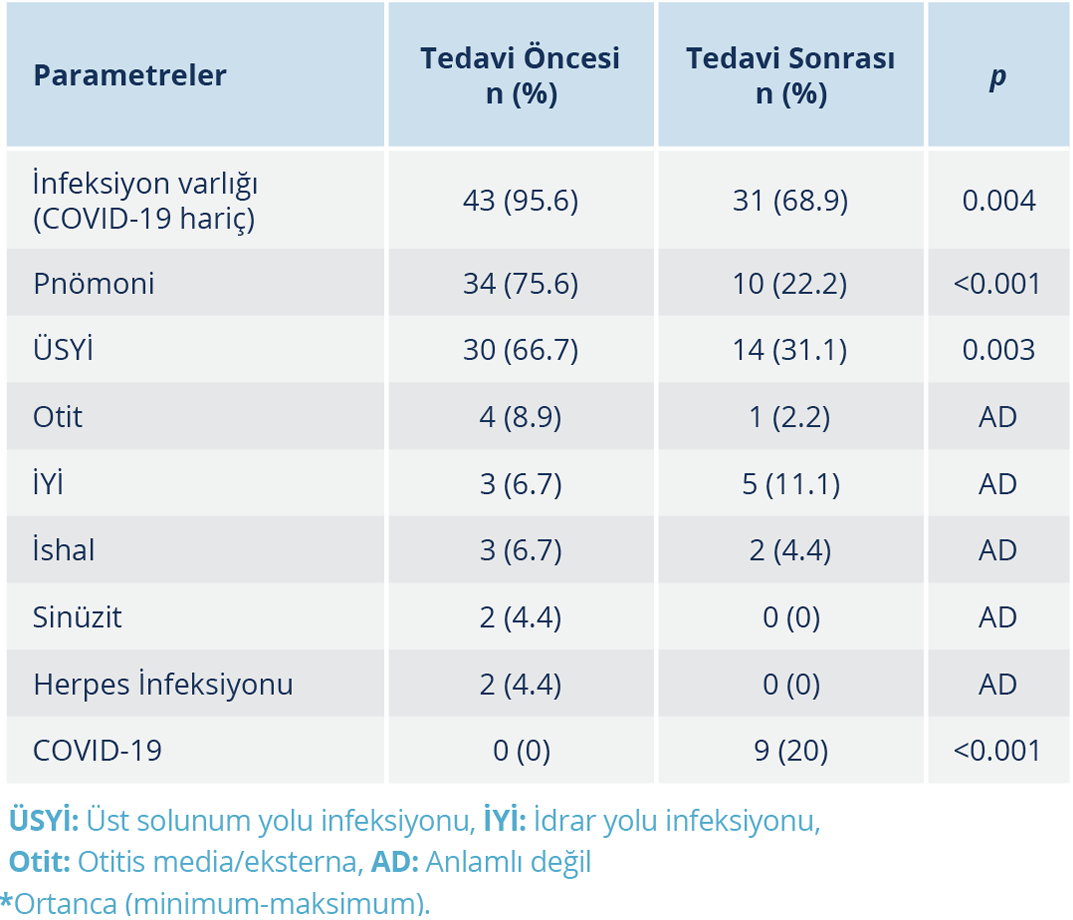
Tanı öncesi 43 (%95.6) hastada tekrarlayan infeksiyon öyküsü ve/veya bulguları varken, tedavi altında 31 (%68.9) hastada infeksiyon meydana gelmişti (p=0.004). Tanı sonrası düzenli İGRT alan hastalarda, tanı öncesine göre pnömoni ve üst solunum yolu infeksiyonu (ÜSYİ) sıklığında anlamlı düzeyde düşüş tespit edildi [sırasıyla; n=34 (%75.6) vs n=10 (%22.2), p<0.001; n=30 (%66.7) vs n=14 (%31.1), p=0.003]. Tedavi altında 9 (%20) hastada semptomatik COVID-19 infeksiyonu gelişmişti (pandeminin henüz ortaya çıkmadığı, tedavi öncesi dönem ile karşılaştırma yapmak uygun olmadığı için p değeri verilmedi). Tanı öncesinde hastaların yılda ortanca infeksiyon sayısı 4 (0-10) iken tedavi sonrasında bu sayı 1 (0-3)’e gerilemişti (p<0.001) (Tablo 2).
Hastane Yatışı Olan Hastaların ve İnfeksiyonların Özellikleri
İnfeksiyon nedeniyle hastaneye yatış öyküsü olan 17 (%37.8) hastadan beşinin infeksiyon nedeniyle birden fazla hastaneye yatış öyküsü olduğu görüldü. Bu beş hastadan ilki CVID tanılıydı ve bronşektazi ile otoimmünite (vitiligo, çölyak hastalığı) gibi iki komorbiditesi vardı. Hasta tip 1 solunum yetmezliği nedeniyle uzun süreli oksijen tedavisi almıştı; İVİG ve TMP-SMX profilaksi tedavisine uyum göstermeyen hastanın çoklu hastane yatışları, pnömonisi ve balgam kültürlerinde genişlemiş spektrumlu beta-laktamaz (GSBL) üreten Escherichia coli, Klebsiella spp., Pseudomonas aeruginosa üremeleri olduğu tespit edildi. Meropenem, ertapenem ve piperasilin-tazobaktam kullanım öyküsü mevcuttu. Son başvurusunda sepsis nedeni ile vefat etmişti. İkinci hasta CVID tanılıydı ve bronşektazi ile otoimmünite (otoimmün hepatite bağlı siroz ve hipersplenizme sekonder pansitopeni) komorbiditeleri vardı. Hasta İVİG tedavisi ile izlemde nötropenisi ve lenfopenisi olduğu dönemde perianal apse, atipik pnömoni ve Salmonella infeksiyonları geçirmişti; COVID-19 pandemisinin başında COVID-19 pnömonisi nedeniyle kaybedilmişti. Üçüncü hasta “late onset combined immune deficiency” (LOCID) tanılı olup bronşektazi komorbiditesi vardı. Hasta pandemi sırasında İVİG ve TMP-SMX profilaksi tedavilerini bırakmış, solunum sıkıntısı ile acil servise başvurmuştu. Hasta bilateral CMV pnömonisi ile hastaneye yatırılmış; tedavi sonrasında düzenli İVİG, TMP-SMX ve valgansiklovir profilaksi tedavileri ile taburcu edilmişti. Tedavi altında bir defa hastaneye yatış gerektiren Influenza A virus infeksiyonu, bir defa ayaktan yönetilebilen COVID-19 infeksiyonu geçirmişti. Dördüncü hasta NFkB eksikliği tanılıydı ve bronşektazi ile otoimmünite (adrenal yetmezlik) komorbiditeleri vardı; İVİG ve TMP-SMX profilaksisi ile takip edilen hastanın pnömoni nedeniyle birden fazla hastaneye yatışı mevcuttu. Balgam kültürlerinde P. aeruginosa üremeleri olup meropenem kullanımı ve devamında karbapenem direnci ile amikasin kullanımı mevcuttu. Taburculukta profilaksi amaçlı inhale tobramisin tedavisi başlanmış ancak hasta tedavi uyumsuzluğu nedeniyle kullanmamıştı. Beşinci hasta CVID tanılıydı ve mukokutanöz kandidiyazis, otoimmünite (adrenal yetmezlik, hipoparatiroidi) komorbiditesi vardı; İVİG, TMP-SMX ve posakonazol profilaksisi almıştı. Posakonazol profilaksi kullanımına uyum göstermediği dönemlerde oral Candida infeksiyonu nedenli antifungal tedavi amaçlı hastane yatışı mevcuttu.
Hastane Yatışı ile İlişkili Faktörler
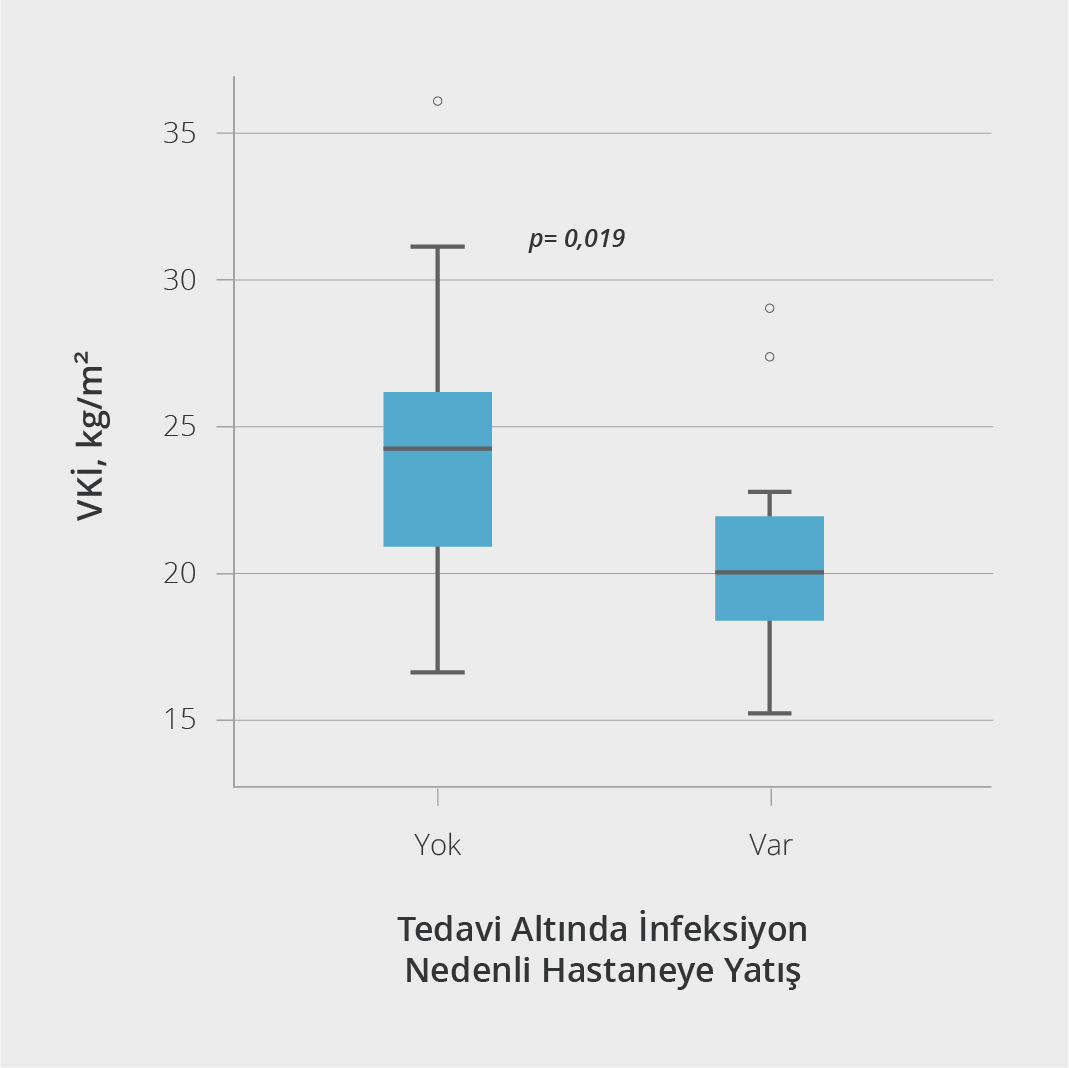
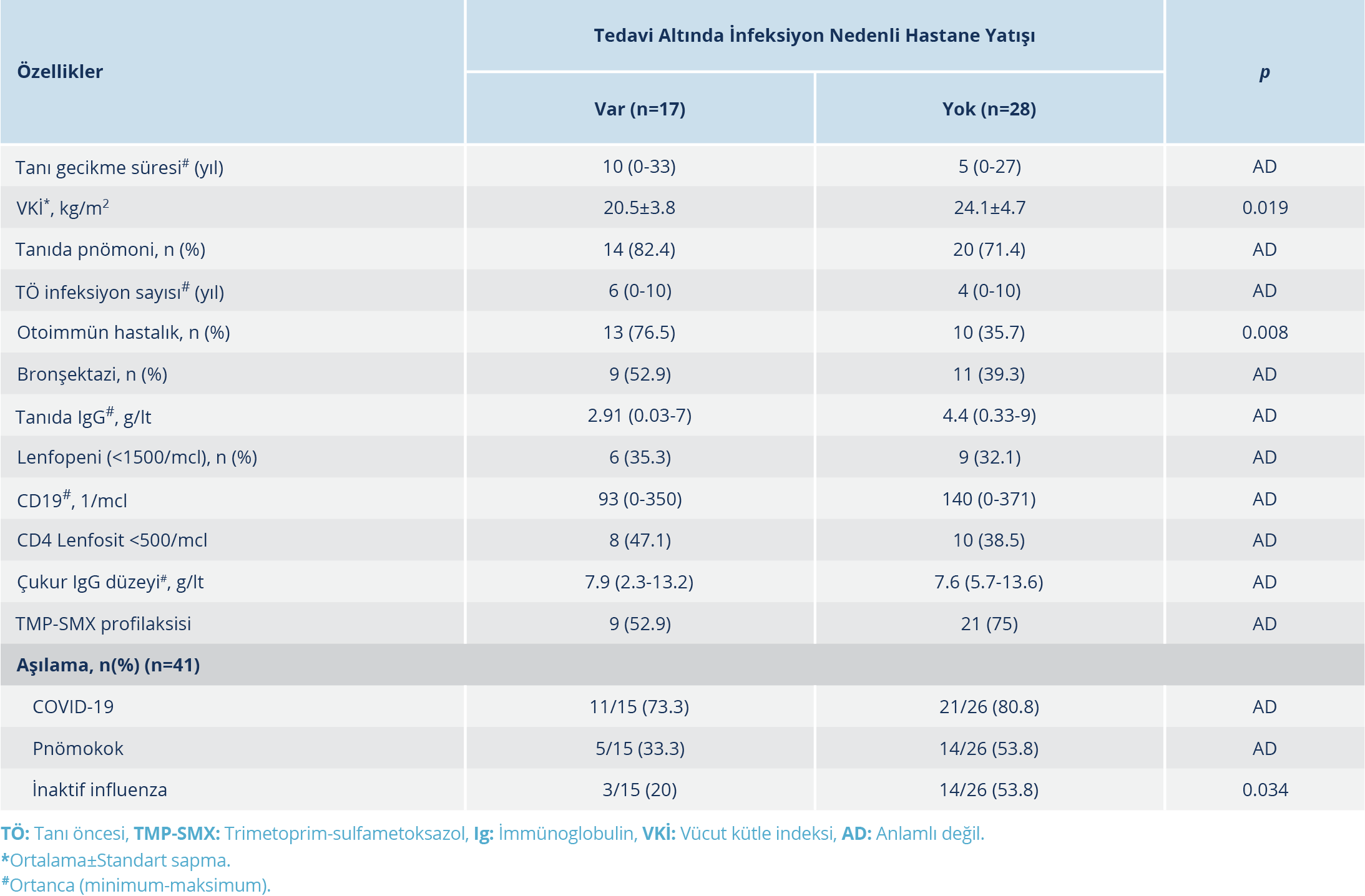
Düzenli İGRT altında infeksiyon nedeniyle hastane yatışı olan 17 hasta [pnömoni (n=10), selülit/abse (n=2), üriner sistem infeksiyonu (n=2), ishal (n=1), kriptik tonsillit (n=1) ve malign otitis eksterna (n=1)] tespit edildi. Hastaneye yatış gerektiren infeksiyonları olan (n=17) ve olmayan (n=28) hastalar karşılaştırıldığında; cinsiyet, yaş, tanı yaşı, tanı esnasında öyküde tekrarlayan pnömoni varlığı, sigara kullanımı, tanı anında IgG düzeyi, CD19 lenfosit sayısı, çukur IgG düzeyi ve TMP-SMX profilaksisi kullanımı açısından istatistiksel olarak anlamlı düzeyde farklılık saptanmadı. Hastane yatışı olan hastaların ortanca tanı gecikme süresi ve tanı öncesi yıllık infeksiyon sayısı hastane yatışı olmayanlara göre yüksek görülmekle birlikte fark istatistiksel olarak anlamlı düzeyde değildi (sırasıyla; p=0.129 ve p=0.09). Komorbidite ve organ tutulumları incelendiğinde, hastane yatışı olan hastalarda otoimmun hastalık sıklığının hastane yatışı olmayanlara göre istatistiksel olarak anlamlı düzeyde yüksek olduğu görüldü (%76.5 ve %35.7; p=0.008). Aşılama oranlarına bakıldığında; hastane yatışı olan grupta düzenli olarak mevsimsel İİA ile aşılanma oranının hastane yatışı olmayanlara göre anlamlı düzeyde düşük olduğu tespit edildi (%20 ve %53.8; p=0.034) (Tablo 3). Bununla birlikte, hastane yatışı olan hastaların VKİ ortalaması hastane yatışı olmayanlara göre anlamlı düzeyde düşüktü (sırasıyla; 20.5 ve 24.1 kg/m2; p=0.019; Şekil 2).
Bronşektazi ile İlişkili Faktörler
Bronşektazisi olan (n=20) ve olmayan (n=25) hastalar karşılaştırıldığında, bronşektazi ile takipli hastalarda tanı öncesi pnömoni geçirme oranı %95 iken bronşektazisi olmayan grupta bu oran %60 olarak saptandı (p=0.012). Komorbidite ve organ tutulumları incelendiğinde ise bronşektazisi olanlarda lenfadenomegali ve splenomegali görülme sıklığı bronşektazisi olmayan hastalara göre anlamlı düzeyde yüksek izlendi (sırasıyla; p=0.014 ve p=0.033). Bronşektazili hastalarda ortanca IgG, IgA ve IgM düzeyleri bronşektazisi olmayanlara göre düşük görülmekle birlikte bunlardan sadece IgM farkı istatistiksel olarak anlamlı bulundu (p=0.003; Şekil 3).
İRDELEME
Çalışmamıza dahil olan 45 hastada [(25 (%55.6) erkek ve 20 (%44.4) kadın, ortalama yaş 38.4±11.6 yıl)], düzenli İGRT ile yılda ortanca infeksiyon sayısının 4 (0-10)’ten 1 (0-3)’e dramatik bir şekilde azaldığını gözlemledik.
Demografik verilere baktığımızda, global ölçekte yapılan epidemiyolojik çalışmalar, PİY prevalansının coğrafi bölgeye, etnik kökene ve PİY’in fenotipine göre farklılık gösterdiğini ortaya koymaktadır. Ülkemizin verilerinin de yer aldığı ve 4918 hastanın değerlendirildiği bir araştırmaya göre; Orta Doğu ve Kuzey Afrika bölgelerinde PİY prevalansının 0.8-30.5/100 000 arasında değiştiği, akraba evliliği oranının %20-56 ve aile bireylerinde PİY öyküsünün %20-30.5 arasında olduğu bildirilmiştir (15). Ülkemizde yapılan çalışmalarda ise akraba evliliği oranı %12.9-30 arasında saptanmıştır (16,17). Çalışmamızdaki hastaların akraba evliliği ve aile bireylerinde PİY öyküsü oranı ülkemizden bildirilen sonuçlarla benzerdir.
Primer immün yetmezlik tanısı alan hastalar sık tekrarlayan, tedaviye geç yanıt veren, ağır ve komplike seyreden infeksiyonlar yaşamalarına rağmen geç tanı almaktadırlar; buna bağlı olarak bu hastalarda bronşektazi başta olmak üzere etkilenen organlarda kalıcı fonksiyon kayıpları yaşamaktadır (1,3,4). Hastalarımızın %95.6’sında tanı öncesi yılda ortanca 4 (0-10) sık tekrarlayan, tedaviye geç yanıt veren, ağır ve/veya komplike seyreden infeksiyon tanısı vardı; tanı gecikmesi ortanca 6 (0-33) yıldı. Hastalarımızda bronşektazi görülme oranı Oksenhendler ve arkadaşlarının (7) bulgusuna (%44.4) yakındı; ancak oranın daha yüksek ve düşük olduğu çalışmalar da mevcuttur (16,18).
Heterojen hasta grubumuzdaki en sık karşılaşılan fenotip (%88.8 ile PAE; %71.1 ile alt grubu olan CVID), erişkinlerde en sık karşılaşılan semptomatik fenotip olan PAE idi (8).Hastaların hepsi İGRT almış olup kullanılan Ig dozu klinik takip parametreleri ve çukur IgG düzeylerine göre ayarlanmıştı; infeksiyonu olmayan sekiz hasta dışındaki hastalara (37, %82.2) antimikrobiyal profilaksi (30 hasta TMP-SMX) önerilmişti. Çalışmamızdaki hastaların antimikrobiyal profilaksi kullanım oranı, Muşabak ve arkadaşları (16) ile Thickett ve arkadaşlarının (19) (sırasıyla %43 ve %41.9) çalışmalarının sonuçlarına göre daha yüksekti.
Bu durum, çalışmamızdaki hastaların İGRT altında daha fazla infeksiyon geçiren bir grup olduğu şeklinde yorumlanabilir; ancak merkezimizde PİY ile takipli hastalarda İGRT’den bağımsız bir şekilde karşılaşılan infeksiyonlarda daha erken antibiyotik profilaksisi başlamaya yönelik bir eğilimin olduğu da düşünülebilir. Bu yaklaşımın olası nedeni PİY ile takipli hassas hasta popülasyonunda mortalite ve morbiditeyi azaltmaktır.
Çalışmamızda, en sık karşılaşılan infeksiyonlar mevcut verilerle uyumlu olarak üst ve alt solunum yolu infeksiyonları idi. İmmünoglobulin replasman tedavisinin öncesi ve sonrasında infeksiyon görülme sıklığı açısından diğer çalışmalarla da uyumlu bir şekilde çalışmamızda da ortanca infeksiyon sayısı, pnömoni ve ÜSYİ görülme sıklığı istatistiksel olarak anlamlı düzeyde idi ve dikkat çekici bir oranda azalmıştı (7,11). Pandemi süresince en az bir kez nazofarengeal sürüntü ile elde edilen SARS-CoV-2 polimeraz zincir reaksiyonu testi ile doğrulanmış COVID-19 sıklığı %20 idi. Tedavi öncesi dönem, çoğu hastada pandemi öncesine denk geldiğinden COVID-19 özelinde tedavinin etkinliği açısından karşılaştırma yapmak uygun olmayacaktır. Tedavi altında hastaneye yatış gerektiren infeksiyonu olan ve olmayan hastalarımızın klinik özelliklerini karşılaştırdığımızda; hastane yatışı olanlarda mevsimsel İİA ile aşılanma oranı ve VKİ ortalaması hastane yatışı olmayanlara göre anlamlı düzeyde düşük bulundu. Bu bulgular PİY’li hastaların takip süreci için yapılan önerilenlere de uygun olarak (6,20-22); yatış gerektiren infeksiyon komplikasyonlarından korunmak için hastaların enerji-protein malnutrisyonu açısından her vizitte düzenli olarak takip edilmesinin ve destek sağlanmasının, immün yetmezlik bileşenine uygun aşılama yapılmasının oldukça önemli olduğunu bize gösterdi.
Yapılan diğer çalışmalarla (7,11,12) benzer şekilde, hasta grubumuzda da İGRT infeksiyon sıklığını azaltmakla birlikte solunum yolu infeksiyonları görülmeye devam etmişti. Primer immün yetmezliği olan hastalarda hastaneye yatış gerektiren infeksiyonları incelediğimizde öncelikli olarak karşımıza çıkan infeksiyon ajanları GSBL+ E. coli, Klebsiella spp., P. aeruginosa, CMV ve SARS-CoV-2 idi. Komorbidite ve organ tutulumları incelendiğinde, hastane yatışı olan hastalarda otoimmün hastalık sıklığının hastane yatışı olmayanlara göre istatistiksel olarak anlamlı düzeyde yüksek olduğu görüldü. Bu hastalara özellikle bronşektazi daha sık eşlik etmekteydi. Bu durum, daha çok ön planda antikor eksikliği ile takipli olan hastaların multipl komorbiditesi olan alt grubunda, eşlik eden daha ağır T hücre disfonksiyonu olabileceğini düşündürmektedir.
Oksenhendler ve arkadaşlarının (7) çalışmasına benzer şekilde hastaneye yatış gerektiren infeksiyonları olan ve olmayan iki grubun çukur IgG düzeylerini karşılaştırdığımızda istatistiksel olarak anlamlı düzeyde fark saptamadık. Çalışmamızda İGRT’nin önemi öne çıkmakla birlikte, özellikle antimikrobiyal profilaksiye uyumsuzluğun infeksiyon riskini artırdığını gözlemledik. Ayrıca; bronşektazisi olan ve olmayan hastalar arasında tanı öncesi pnömoni geçirme oranı istatistiksel olarak anlamlı düzeyde yüksekti. Bu bulgu, erken tanı ve tedavinin komplikasyonların önlenmesinde oldukça önemli olduğunu göstermektedir.
Çalışmanın retrospektif yapılması, sınırlı örneklem büyüklüğü, tanı öncesindeki infeksiyon bölgelerinin ve sayıların hastaların yıllarca süregelen öykülerine dayalı elde edilmesi, bazı hastaların yaşadığı yerlerin il dışında olması nedeniyle dış merkezdeki yatış süreçlerine dair detaylı bilgi ve belgelere erişim eksikliği ve sınırlı genetik test imkanları çalışmamızın en önemli kısıtlılıklarıdır. Ayrıca, hastaların tedavilere uyumunun sonuçları; antimikrobiyal profilaksi öncesinde ve sonrasında infeksiyon sayılarının yanı sıra hastane yatışlarının etkisini değerlendirmemizde ciddi kısıtlılıklar yarattı. Ancak çalışmamız PİY’li hastaların tedavisinde malnütrisyonun ve/veya malabsorbsiyonun önemine, klinik takipte önemli bir sorun oluşturan tedavi uyumsuzluğuna ve tanı alana kadar geçirilen uzun sürelerin infeksiyonla ilgili komplikasyonları artırdığına dikkat çekmektedir. Bu durum, CVID tanısının sık bir komplikasyonu olan (bizim çalışmamızda hasta öyküsüne dayalı gastrointestinal sistem tutulumu sıklığı %24.4 idi) CVID ilişkili enteropatiye yönelik uygun yönetimin önemine dikkat çekmektedir.
Bu çalışmada PİY hastalarının tanı alma sürecindeki semptomları, tanısal gecikmelerden kaynaklanan morbidite oranları ve İGRT, aşılama ve antimikrobiyal profilaksi sonrasında meydana gelen değişiklikler sunuldu. Sonuç olarak; PİY’in erken tanısı, tedavisi ve hastaların tedavi uyumlarının artırılması ile infeksiyonlar başta olmak üzere birçok komplikasyonun önüne geçilebilir. Bu nedenle, PİY’e ilişkin farkındalığın hem toplumda hem de her uzmanlık alanından hekimlerde artırılması, hastaların erken dönemde tanı almalarını sağlayacak ve hastaneye yatışı, mortaliteyi, morbiditeyi azaltacaktır.
Hasta Onamı
Veriler retrospektif olarak incelendiği için hasta onamı alınmamıştır.
Etik Kurul Kararı
Çalışma için Ankara Üniversitesi Tıp Fakültesi İnsan Araştırmaları Etik Kurulu’ndan 30 Aralık 2022 tarih ve İ11-684-22 karar numarasıyla onay alınmıştır.
Danışman Değerlendirmesi
Bağımsız dış danışman
Yazar Katkıları
Fikir/Kavram – M.S.B.D.; Tasarım – M.S.B.D., S.A., G.K.; Denetleme – M.S.B.D., S.A., G.K.; Malzemeler/Hastalar – M.S.B.D., D.G.U., S.A., G.K.; Veri Toplama ve/veya İşleme – D.G.U., M.S.B.D.; Analiz ve/veya Yorum – D.G.U., M.S.B.D., S.A., G.K.; Literatür Taraması – D.G.U., M.S.B.D., S.A., G.K.; Makale Yazımı – D.G.U., M.S.B.D., S.A., G.K.; Eleştirel İnceleme – M.S.B.D., S.A., G.K.
Çıkar Çatışması
Yazarlar herhangi bir çıkar çatışması bildirmemiştir.
Finansal Destek
Yazar finansal destek beyan etmemiştir.
Referanslar
- Pieniawska-Śmiech K, Pasternak G, Lewandowicz-Uszyńska A, Jutel M. Diagnostic challenges in patients with inborn errors of immunity with different manifestations of immune dysregulation. J Clin Med. 2022;11(14):4220. [CrossRef]
- Tangye SG, Al-Herz W, Bousfiha A, et al. Human inborn errors of immunity: 2022 update on the classification from the International Union of Immunological Societies Expert Committee. J Clin Immunol. 2022;42(7):1473-1507. [CrossRef]
- Ercan N, Bostancı İ. Enfeksiyonlar. In: Kartal Ö, ed. Primer İmmün Yetmezliklerde Yandaş Hastalıklar ve Yönetimleri. Ankara: Türkiye Klinikleri, 2019: 7-13.
- Muşabak HU. Geç Başlangıçlı Primer İmmün Yetmezlikler: Ülkemizde ve Dünyadaki Durum. In: Muşabak HU, ed. Geç Başlangıçlı Primer İmmün Yetmezlikler Özel Sayısı. Ankara: Türkiye Klinikleri, 2017: 49-53.
- Wasserman RL. Immunoglobulin replacement for primary immunodeficiency: Indications for initiating and continuing treatment. Allergy Asthma Proc. 2021;42(6):489-94. [CrossRef]
- Muşabak U. İmmün Yetmezlikler. In: Kalpaklıoğlu F, Baççıoğlu A, eds. Alerji ve İmmünoloji Hastalıkları Güncel Tanı ve Tedavi. İstanbul: EMA Tıp Kitapevi, 2022: 601-19.
- Oksenhendler E, Gérard L, Fieschi C, et al; DEFI Study Group. Infections in 252 patients with common variable immunodeficiency. Clin Infect Dis. 2008;46(10):1547-54. [CrossRef]
- Gathmann B, Grimbacher B, Beauté J, et al; ESID Registry Working Party. The European internet-based patient and research database for primary immunodeficiencies: results 2006-2008. Clin Exp Immunol. 2009;157 Suppl 1(Suppl 1):3-11. [CrossRef]
- Madkaikar M, Mishra A, Ghosh K. Diagnostic approach to primary immunodeficiency disorders. Indian Pediatr. 2013;50(6):579-86. [CrossRef]
- Malphettes M, Gérard L, Carmagnat M, et al; DEFI Study Group. Late-onset combined immune deficiency: a subset of common variable immunodeficiency with severe T cell defect. Clin Infect Dis. 2009;49(9):1329-38. [CrossRef]
- Busse PJ, Razvi S, Cunningham-Rundles C. Efficacy of intravenous immunoglobulin in the prevention of pneumonia in patients with common variable immunodeficiency. J Allergy Clin Immunol. 2002;109(6):1001-4. [CrossRef]
- Guevara-Hoyer K, Saz-Leal P, Diez-Rivero CM, et al. Trained immunity based-vaccines as a prophylactic strategy in common variable immunodeficiency. A proof of concept Study. Biomedicines. 2020;8(7):203. [CrossRef]
- Wasserman RL. Personalized therapy: Immunoglobulin replacement for antibody deficiency. Immunol Allergy Clin North Am. 2019;39(1):95-111. [CrossRef]
- Seidel MG, Kindle G, Gathmann B, et al; ESID Registry Working Party and collaborators. The European Society for immunodeficiencies (ESID) registry working definitions for the clinical diagnosis of inborn errors of immunity. J Allergy Clin Immunol Pract. 2019;7(6):1763-70. [CrossRef]
- Al-Mousa H, Al-Saud B. Primary immunodeficiency diseases in highly consanguineous populations from Middle East and North Africa: Epidemiology, diagnosis, and care. Front Immunol. 2017;8:678. [CrossRef]
- Muşabak UH, Demirel F, Yeşillik S, et al. Adults with common variable immunodeficiency: a single-center experience. Turk J Med Sci. 2017;47(1):1-12. [CrossRef]
- Ardeniz O, Başoğlu OK, Günşar F, et al. Clinical and immunological analysis of 23 adult patients with common variable immunodeficiency. J Investig Allergol Clin Immunol. 2010;20(3):222-36.
- Patuzzo G, Mazzi F, Vella A, et al. Immunophenotypic analysis of B lymphocytes in patients with common variable immunodeficiency: identification of CD23 as a useful marker in the definition of the disease. ISRN Immunology. 2013:512527. [CrossRef]
- Thickett KM, Kumararatne DS, Banerjee AK, Dudley R, Stableforth DE. Common variable immune deficiency: respiratory manifestations, pulmonary function and high-resolution CT scan findings. QJM. 2002;95(10):655-62. [CrossRef]
- Rubin LG, Levin MJ, Ljungman P, et al; Infectious Diseases Society of America. 2013 IDSA clinical practice guideline for vaccination of the immunocompromised host. Clin Infect Dis. 2014;58(3):309-18. Erratum in: Clin Infect Dis. 2014;59(1):144. [CrossRef]
- Sobh A, Bonilla FA. Vaccination in primary immunodeficiency disorders. J Allergy Clin Immunol Pract. 2016;4(6):1066-75. [CrossRef]
- Bonilla FA. Update: Vaccines in primary immunodeficiency. J Allergy Clin Immunol. 2018 Feb;141(2):474-81. [CrossRef]