En Çok Okunanlar
Özet
Amaç: Kan dolaşımı infeksiyonları (KDİ’ler) önde gelen morbidite ve mortalite nedenlerinden biri olmaya devam etmektedir. Çalışmamızda KDİ olan hastalarda başlanan ampirik antimikrobiyal tedavilerin uygunluğu, erken ve uygun antimikrobiyal tedavinin mortalite ve hastanede kalış süresi üzerine etkisi araştırıldı.
Yöntemler: Çalışmaya, KDİ tanısı konan, 18 yaş ve üzeri 100 hasta dahil edildi. Hastaların sosyodemografik özellikleri, klinik ve mikrobiyolojik verileri, ampirik başlanan tedavileri, uygun tedaviye kadar geçen süreleri, 10. gün (erken dönem) ile hastane yatış sonu mortaliteleri ve hastanede kalış süreleri kaydedildi. Verilerin analizinde; Pearson χ², Fisher’in kesin testi, eğilim (“trend”) için χ² testi, Mann-Whitney U testi kullanıldı. Değişkenlerin mortaliteye etkisi lojistik regresyon analizi ile değerlendirildi ve p <0.05 istatistiksel anlamlı düzey olarak kabul edildi.
Bulgular: Hastaların medyan yaşı 64 (min.-mak.=19-94) yıl olup %51’i kadındı. Ampirik tedavisi uygun olan ve olmayan gruplar arasında; yaş, cinsiyet, takip eden klinik ve Charlson komorbidite indeksi (CCI)’ne göre komorbidite derecesi ve mevcut klinik şiddeti açısından anlamlı düzeyde fark saptanmadı; mikroorganizma dağılımı açısından da anlam düzeyde fark tespit edilmedi ancak ampirik tedavisi uygun olmayan hastalarda çok ilaç dirençli etkenler istatistiksel olarak anlamlı düzeydeydi (p=0.001). Tespit edilen KDİ’lerin %57’si hastane kaynaklı, %43’ü toplum başlangıçlı idi; primer KDİ’lerin oranı %55’ti. Ampirik tedavi uygunluğuna göre iki grup arasında, KDİ kazanım yeri ve kaynağı açısından fark yoktu. Ampirik tedavi uygunluğu %57 olarak tespit edildi. Uygun olmayan ampirik tedavide ana faktör etken mikroorganizmalardaki dirençti. Erken dönem (10. gün) mortalite %26, hastane yatış sonu mortalite %41 olup ampirik tedavi uygunluğu ve uygun tedaviye kadar geçen süre ile mortalite arasında anlamlı ilişki saptanmadı. Yalnızca immünokompetan kişilerde ampirik tedavi uygun başlanmadığında hastane yatış sonu mortalite anlamlı düzeyde daha yüksek bulundu (p=0.033). Ampirik tedavisi uygun olan hastaların hastanede kalış süresi uygun olmayanların kalış süresinden anlamlı düzeyde kısa idi (p=0.035).
Sonuç: Çalışmamızda, antimikrobiyal tedavi uygunluğunun ve uygun tedaviye kadar geçen sürenin mortalite üzerine etkisi bulunmamış iken hastanede kalış süresini anlamlı şekilde kısalttığı tespit edildi.
GİRİŞ
Kan dolaşımı infeksiyonları (KDİ’ler), güçlü antimikrobiyal ajanlar ve destek tedavi olanaklarına rağmen morbidite ve mortalitenin önemli bir nedeni olmaya devam etmektedir; KDİ insidansının yüksek gelirli ülkelerde 140-160/100 000 olduğu tahmin edilmektedir (1). Avrupa’da, tahmini yıllık KDİ sayısı 1.2 milyon civarındadır (2). Nozokomiyal KDİ, Amerika Birleşik Devletleri (ABD)’nde yıllık olarak tahmini 250 000 olgu ile morbidite ve mortalitenin önemli bir nedenidir (3,4). Dünya genelinde birçok ülkede sürveyans çalışmalarında ve metodoloji standartlarında eksiklikler olmasına rağmen Dünya Sağlık Örgütü (DSÖ), hem sağlık bakım ilişkili hem toplum kaynaklı infeksiyonlarda yüksek direnç oranları olduğunu bildirmiştir (5). Çeşitli bakteriyel patojenlerde çoklu ilaç direnci son yıllarda pandemik seviyeye ulaşmıştır (6). Amerika Birleşik Devletleri’nde her yıl iki milyondan fazla kişinin antibiyotiğe dirençli mikroorganizmalarla infekte olduğu ve bu infeksiyonlar nedeniyle en az 23 bin kişinin öldüğü tahmin edilmektedir (7). Hastanede yatış gerektiren hastaların durumunun, komorbidite, yeni tedavi seçenekleri, yeni ilaçlar ve uzayan yatış süreleri gibi faktörler nedeniyle artan karmaşıklığı, yaşlanan nüfus ve invazif cihazların yaygın kullanımı, bakteriyemi için yüksek riskler oluşturmaktadır. Artan antimikrobiyal direnç, bakteriyemi gibi ciddi infeksiyonu olan hastalarda, hasta yönetimini zorlaştırmaktadır. Mikrobiyolojik sonuçların elde edilmesi 24-72 saati bulacağından infeksiyon için ilk tedavi genellikle ampiriktir. Ampirik tedavi seçimi; geniş spektrumlu antibiyotiklerin kullanımıyla ilişkili maliyet, yan etki ve direnç gibi faktörlerin göz önünde bulundurulması ile patojene karşı etkililik arasında bir denge gerektirir. Sepsis kliniğindeki ve nötropenik ateş atağındaki hastalarda, geniş spektrumlu antimikrobiyallerin erken uygulanması önerilmektedir (8,9). Bunun yanında sepsis ve septik şok kliniğindeki hastalarda, uygun antimikrobiyal uygulamasının önemi kanıtlanmıştır (10-14). Uygun antimikrobiyal tedavinin, KDİ gelişen hastalar üzerine etkisi hakkındaki yayınlar bu alanda gelişmiş metodolojilerin kullanıldığı yeni çalışmalara olan ihtiyacı ortaya koymuştur (15,16). Çalışmamızda KDİ olan hastalarda başlanan ampirik antimikrobiyal tedavilerin uygunluğu değerlendirildi; erken ve uygun antimikrobiyal tedavinin mortalite ve hastanede kalış süresi üzerine etkisi araştırıldı.
YÖNTEMLER
Prospektif kohort nitelikte olan çalışmamıza, Ankara’da üçüncü basamak bir hastanede Mart-Mayıs 2017 tarihleri arasında yatırılarak takip edilen, KDİ tanısı konan, 18 yaş ve üzeri 100 hasta dahil edildi. Hastalar, yattıkları kliniklerde yatış süreleri boyunca izlendi ve sosyodemografik özellikleri, klinik ve mikrobiyolojik verileri, ampirik başlanan tedavileri, uygun tedaviye kadar geçen süreleri, 10. gün (erken dönem) ile hastane yatış sonu mortaliteleri ve hastanede kalış süreleri kaydedildi.
Komorbid hastalıkların derecelendirmesi Charlson komorbidite indeksi (CCI) kullanılarak yapıldı. Hastalık ciddiyeti, kan kültüründe üreme sinyalinin alındığı günde sepsis veya septik şok varlığı Glasgow koma skoru (GKS) ve yoğun bakım ünitelerinde (YBÜ’lerde) yatan hastalar için ardışık (sepsis ilişkili) organ yetmezliği değerlendirmesi (sequential organ failure assessment – SOFA) skorundaki değişim / YBÜ dışında hızlı SOFA (quick-SOFA – qSOFA) skorları ile değerlendirildi. Sepsis ve septik şok tanıları sepsis-3 ilkelerine dayanarak yapıldı (17). Bactec aerop ve anaerop kan kültür şişelerine (Becton, Dickinson and Company, ABD) ekilerek Tıbbi Mikrobiyoloji Laboratuvarı’na gönderilen ve BD BACTECTM FX40 (Becton, Dickinson and Company, ABD) otomatize kan kültürü sisteminde inkübe edilen örneklerin tür düzeyinde tanımlanması “matrix-assisted laser desorption ionization-time of flight mass spectrometry” (MALDI-TOF; Bruker Daltonics, ABD) otomatize sistemiyle ve antibiyotik duyarlılıkları da BD PhoenixTM (Becton, Dickinson and Company, ABD) ile çalışıldı. Antibiyotik duyarlılıkları için Avrupa Antimikrobiyal Duyarlılık Testleri Komitesi (Europe Committee on Antimicrobial Susceptibility Testing – EUCAST) önerileri ve sınır değerleri kullanıldı (18). Bir bakteriyemik atakta birden fazla mikroorganizmanın izolasyonu polimikrobiyal bakteriyemi olarak tanımlandı. Üreyen mikroorganizma, o mikroorganizma için etkili antibiyotik sınıfından üç veya daha fazla antibiyotiğe dirençli olması halinde çok ilaç dirençli (ÇİD) (multidrug resistant) olarak, en fazla iki grupta yer alan antibiyotiğe duyarlı ve diğer tüm antibiyotiklere dirençli olması halinde yaygın ilaç dirençli (YİD) (extensively drug resistant) olarak, tüm antibiyotik sınıflarına dirençli olması halinde ise tüm ilaçlara dirençli (pandrug resistant) olarak sınıflandırıldı (19). Hastane yatışından ≥48 saat sonra gelişen infeksiyonlar hastane kaynaklı (HK) KDİ (HK-KDİ); yatışının ilk 48 saati içinde gelişenler toplum başlangıçlı (TB) KDİ (TB- KDİ) olarak gruplandırıldı. Toplum başlangıçlı KDİ’ler, son 30 gün içinde sağlık bakımı maruziyeti varlığında sağlık bakım ilişkili (SBİ) veya sağlık bakımı maruziyeti yoksa toplum kaynaklı (TK) olarak ayrıldı (20,21). Hastadan alınan bir veya daha fazla kan kültüründe saptanan mikroorganizmanın, vücudun bir başka bölgesindeki infeksiyonla ilişkisinin olmaması, primer KDİ olarak tanımlandı (22). Kateter ilişkili (Kİ) KDİ (Kİ-KDİ) tanısı; Amerika İnfeksiyon Hastalıkları Derneği (Infectious Diseases Society of America – IDSA)’nin 2009 yılı İntravasküler Kateter İlişkili İnfeksiyonun Tanı ve Yönetimi Kılavuzu’nda yer alan kriterlere uygun olarak, intravasküler kateteri olan, infeksiyonun klinik bulguları bulunan ve infeksiyon odağı olabilecek başka bir kaynak bulunmayan hastada, pozitif periferal kan kültürü ile birlikte kateterden alınan kan kültüründe aynı mikroorganizmanın saptanmasıyla kondu (23). Kan kültüründe üreyen mikroorganizma, vücudun bir başka bölgesindeki infeksiyon ile ilişkili ise sekonder KDİ olarak gruplandırıldı. Sekonder KDİ tanısı için, infeksiyon odağından alınan kültürde bulunan ve kan kültüründen izole edilen mikroorganizmanın aynı olması şartı arandı (22,24). Klinik ve/veya radyolojik olarak infeksiyon odağı saptanmış ancak etkeni mikrobiyolojik olarak kanıtlanmamış olgular da sekonder KDİ’lere dahil edildi.
Uygun ampirik antibiyotik tedavisi; kan kültürünün alındığı gün veya öncesinde uygulanmaya başlanan, üreyen mikroorganizmanın in vitro duyarlı göründüğü en az bir antibiyotik ile intravenöz tedavi olarak tanımlandı. Hastaya bu zaman diliminde başlanan tedavi, duyarlılık test sonucuna göre dirençli bulunmuş ise, olası mikroorganizmaya etkili bir gruptan antibiyotik seçilmemişse ve hasta kan kültürü öncesinde veya kan kültürünün alındığı gün herhangi bir antibiyotik almıyorsa, tedavi uygun olmayan ampirik tedavi olarak değerlendirildi. Prognoz değerlendirmesi; erken dönem mortalite (10. gün), hastaneden çıkış şekli (taburculuk, ölüm) ve hastanede kalış süresi ile yapıldı.
Etik kurul onayı, Sağlık Bilimleri Üniversitesi Ankara Numune Sağlık Uygulama ve Araştırma Merkezi Bilimsel Araştırmalar Değerlendirme Komisyonu’nun 22 Şubat 2017 tarih ve 1233/2017 karar numarasıyla alındı. Ayrıca hastaların kendilerinden ve yoğun bakımda veya entübe olan hastalar içinse yakınlarından onam alındı.
İstatistiksel Analiz
Verilerin analizi, SPSS (Statistical Package for the Social Sciences) versiyon 24.0 programı (IBM Corp., Armonk, NY, ABD) ile yapıldı. Kategorik verilerin gruplar arasında karşılaştırılmasında Pearson χ², Fisher’in kesin testi ve eğilim (“trend”) için χ² testi; sürekli verilerin iki grup arasında karşılaştırılmasında Mann-Whitney U testi kullanıldı. Değişkenlerin mortaliteye etkisi lojistik regresyon analizi ile değerlendirildi ve p <0.05 istatistiksel olarak anlamlı düzey olarak kabul edildi.
BULGULAR
Çalışmaya alınan 100 hastada ortanca yaş 64 (min.-mak.=19-94) yıl olup olguların %51’ini kadınlar oluşturdu. Hastaların %51’i YBÜ’lerde, %36’sı dahili kliniklerde ve %13’ü cerrahi kliniklerde takip edildi. Olguların %47’sinde immünosüpresif hastalık mevcuttu; klinik şiddetleri değerlendirildiğinde, %59’unun sepsiste ve %27’sinin septik şokta olduğu gözlendi. Ampirik antibiyotik tedavisi uygunluğuna göre gruplar arasında; cinsiyet, yaş, immünosüpresyon varlığı ve hastalık ciddiyeti parametreleri açısından istatistiksel olarak anlamlı düzeyde farklılık saptanmadı (Tablo 1).
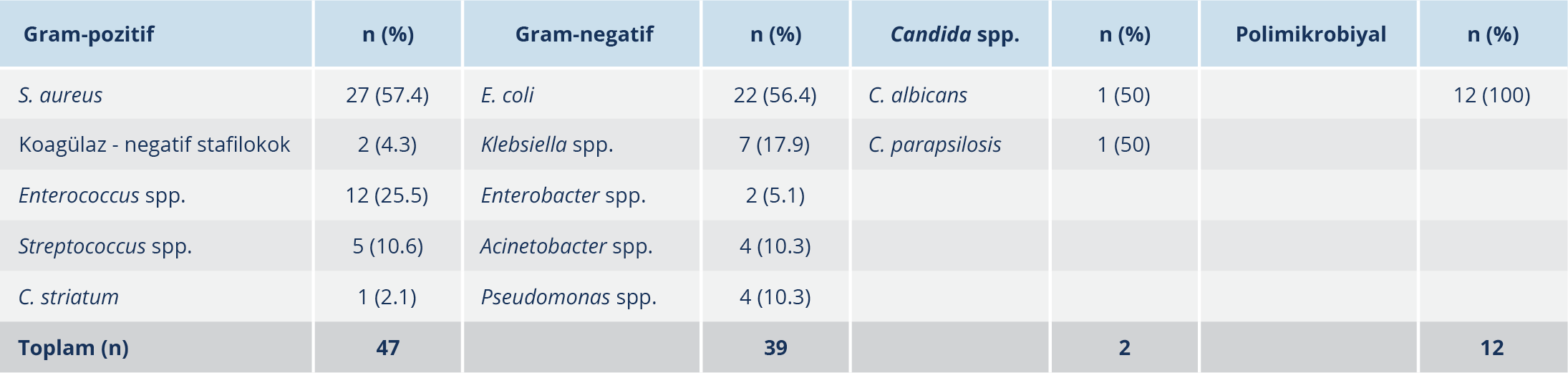
Polimikrobiyal KDİ oranı %12 bulundu. Gram-pozitif mikroorganizmalar %47, Gram-negatifler %39 ve mayalar %2 oranlarında etken olarak saptandı. Gram-pozitif bakterilerden en sık saptanan etken Staphylococcus aureus (%57.4, n=27) iken Gram-negatiflerde en sık etken Escherichia coli (%56.4, n=22) idi. Hiçbir mikroorganizma türü ampirik tedavi uygunluğu ile istatistiksel olarak ilişkili bulunmadı (p >0.05) (Tablo 2).
Polimikrobiyal KDİ etkenleri de dahil olmak üzere takibe alınan 100 hastada toplam 114 mikroorganizma saptandı. Polimikrobiyal etken saptanan 12 hastadaki mikroorganizmaların dağılımı; E. coli (n=8), S. aureus (n=5), Enterococcus faecalis (n=4), Acinetobacter baumannii (n=3), Candida glabrata (n=2), Morganella morganii (n=1), Streptococcus spp. (n=1), Serratia marcescens (n=1), Achromobacter spp. (n=1) şeklinde olup tamamı infeksiyon etkeni olarak kabul edildi. Bu mikroorganizmaların 57 (%50)’si ÇİD değildi; geriye kalan %50’sinin dağılımı ise 45 ÇİD ve 12 YİD şeklindeydi. Ampirik tedavisi uygun olan hastalarda, ÇİD olmayan etkenler; uygun olmayanlarda ise ÇİD etkenler istatistiksel olarak anlamlı düzeyde daha fazla bulundu (p=0.001). Hastaların tamamındaki KDİ’lerin %57’si hastane kaynaklı, %43’ü toplum başlangıçlı idi. Toplum başlangıçlı KDİ’lerin 20 (%46.5)’si sağlık bakımı ilişkili ve 23 (%53.4)’ü toplum kaynaklı KDİ’lerden oluşmaktaydı. Ampirik tedavi uygunluğuna göre KDİ gelişim yerleri açısından, gruplar arasında anlamlı düzeyde farklılık saptanmadı (p=0.166). Takip edilen olgular, infeksiyonun kaynağına göre gruplandırıldığında; primer KDİ tüm olguların %55’inde görülürken, sekonder KDİ %45’inde saptandı. Primer KDİ’lerin beşi (tüm KDİ’lerin %5’i) kateter ilişkili idi. Sekonder KDİ kaynakları sıklık sırasına göre, üriner sistem (n=21), gastrointestinal sistem (n=11), solunum sistemi (n=12) ve deri ve yumuşak doku (n=1) olarak tespit edildi. Kaynağına göre KDİ ve ampirik tedavi uygunluğu arasında anlamlı düzeyde bir ilişki saptanmadı (p=0.340) (Tablo 1).
Çalışmamızda ampirik tedavide en sık kullanılan üç antibiyotik grubu; beta-laktam / beta-laktamaz inhibitörü (%37.7), sefalosporinler (%16.6) ve karbapenemler (%13.3) idi. Olguların 25 (%27.7)’nde ampirik tedavi kombine başlanmıştı. En sık kombine antibiyotik grubu beta-laktam + glikopeptid / lipopeptid kombinasyonuydu. Kolistin + tigesiklin (n=1) ve siprofloksasin + metronidazol (n=2) kombinasyonları dışındaki tüm kombinasyonlarda (n=22) beta-laktam antibiyotikler ile kombinasyon yapıldı.
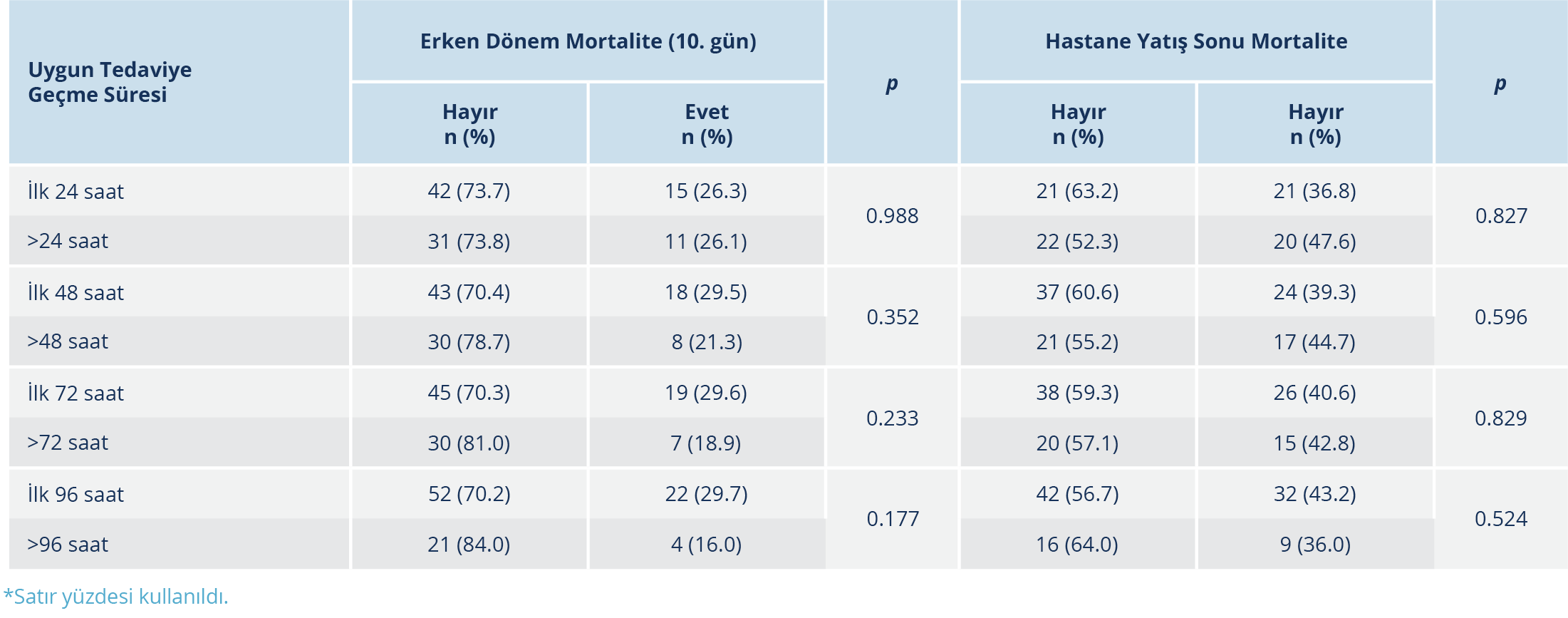
Çalışmaya alınan hastaların %57’sine uygun ampirik tedavi başlanmıştı. Ampirik antibiyotik tedavisi uygun olmayan 43 hastanın, 12’sinde uygun tedaviye taburculuk veya ölüm nedeniyle geçilememişti; kalan 31 hastada uygun tedaviye geçiş süresi ortalama 4.0±2.3 gündü. Ölüm (n=6) ve başka merkeze nakil / kendi isteği ile taburculuk (n=6) nedeniyle uygun tedaviye hiç geçilemeyen hastaların özelliklerine bakıldığında; taburcu edilen hastaların tamamının GKS’sinin 15 olduğu, sepsiste olmadıkları ve hiç entübe edilmedikleri görüldü. Üç hastada genişlemiş spektrumlu beta laktamaz (GSBL) pozitif E. coli, iki hastada metisiline dirençli S. aureus (MRSA) ve bir hastada duyarlı E. faecalis üremeleri olmuştu. Ampirik olarak üç hastaya piperasilin tazobaktam, bir hastaya ampisilin sulbaktam + siprofloksasin, bir hastaya amoksisilin klavulonat ve bir hastaya siprofloksasin başlanmıştı. Takipte ölen altı hastanın tamamının YBÜ’de takip edilen hastalar olduğu, GKS’lerinin düşük olduğu [medyan=3 (min.-mak.=3-13)], biri hariç diğerlerinin entübe edildiği, tamamının sepsiste ve beşinin septik şokta olduğu görüldü. Tamamında gelişen KDİ tipi hastane kaynaklı olup üreyen etkenlerin MRSA (n=4), YİD Klebsiella pneumoniae (n=1), ÇİD Enterococcus faecim (n=1) gibi dirençli etkenler olduğu kaydedildi. Hastaların tamamında, uygun tedaviye kadar geçen süre ile erken ve taburculuk sonu mortaliteleri arasında anlamlı düzeyde ilişki saptanmadı (Tablo 3).
Şifa ile taburculuk, ampirik tedavisi uygun olan grupta (%61.4), olmayan gruba göre (%48.8) daha yüksekti; ancak fark istatistiksel olarak anlamlı düzeyde bulunmadı (p=0.417). Hastaların tamamında erken dönem mortalite %26, hastane yatış sonu mortalite %41 idi. Ampirik tedavisi uygun olsun veya olmasın tüm hastalarda hem erken dönem hem hastane yatış sonu mortalite arasında anlamlı düzeyde farklılık saptanmadı (p=0.934, p=0.330). Ampirik tedavisi uygun olan hastaların hastanede kalış süresi (medyan: 25 gün) uygun olmayanların kalış süresinden (medyan: 14 gün) anlamlı düzeyde kısa bulundu (p=0.035) (Tablo 1).
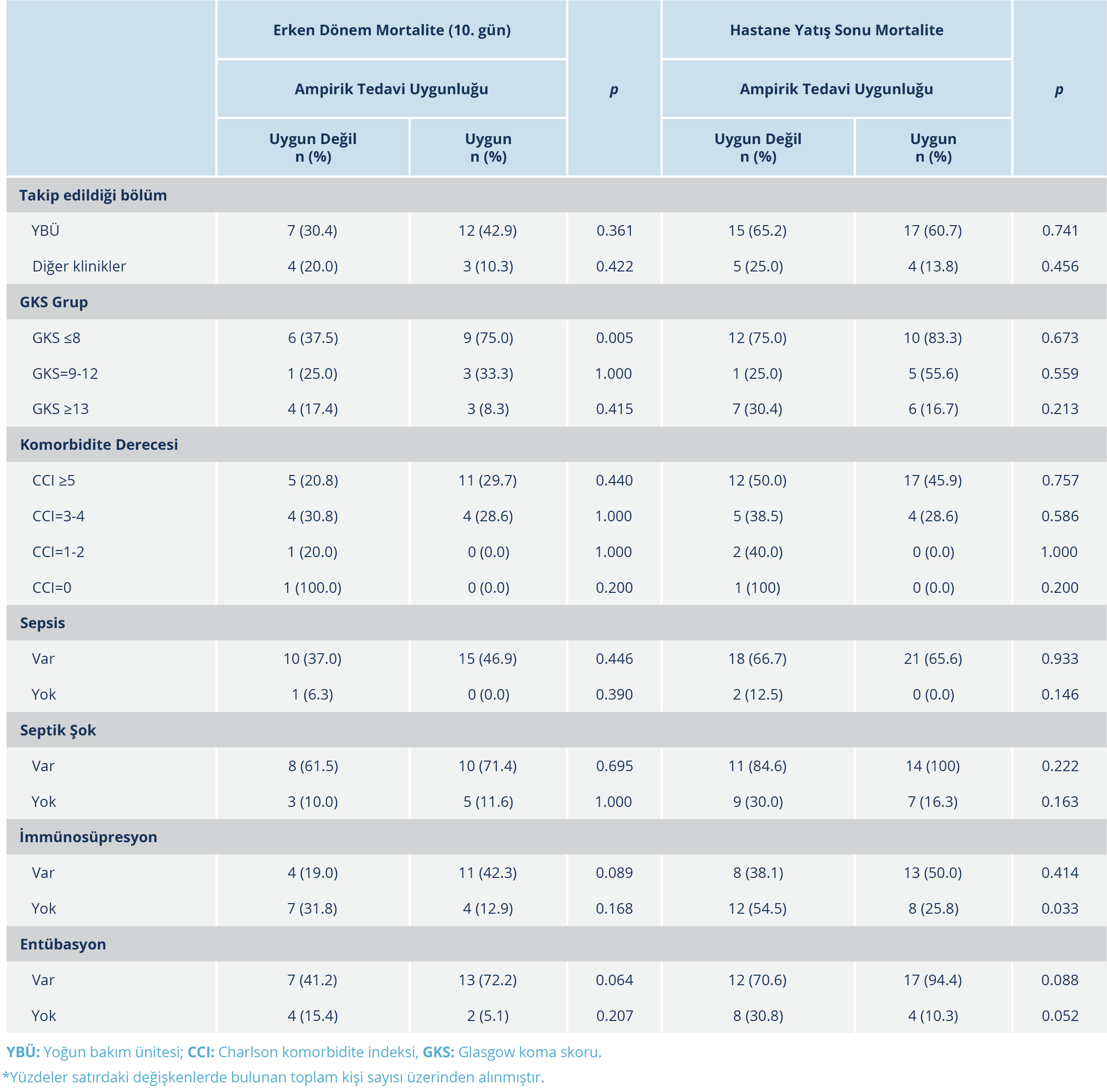
Mortalite üzerine etkisi olabilecek faktörlere göre ampirik tedavi uygunluğu ve mortalite arasındaki ilişki değerlendirildiğinde; yoğun bakımda yatan hastalarda erken dönem ve hastane yatış sonu mortalite ampirik tedavisi uygun olan ve olmayanlar arasında benzer bulundu. Bu durum GKS, CCI’ya göre komorbidite derecesi, sepsis, septik şok, entübasyon ve infeksiyon gelişme yeri için de aynı şekilde sonuçlandı. Yalnızca immünokompetan kişilerde ampirik tedavi uygun başlanmadığında hastane yatış sonu mortalite anlamlı düzeyde daha yüksekti (p=0.033) (Tablo 4).
Değişkenlerin mortaliteye etkisi üzerine yapılan lojistik regresyon analizinde; ampirik tedavi uygunluğu ve uygun tedaviye kadar geçen sürenin erken dönem ve hastane yatış sonu mortalite etkisi anlamlı düzeyde değildi (p >0.05). Mikroorganizmada direnç varlığı, dirençli olmayan patojenlere göre hastane yatış sonu mortalite riskini 2.44 kat artırmıştı [%95 güven aralığı (GA)=1.07-5.58; p=0.033].
İRDELEME
Çalışmamızda, KDİ’lerde başlanan ampirik tedavilerin uygunluğu değerlendirildi ve ampirik tedavi zamanlaması ve uygunluğunun tüm nedenlere bağlı mortaliteye ve hastanede kalış süresine etkisi araştırıldı. Hastalar, takip edildikleri klinik, komorbid durumları, hastalık ciddiyetine göre gruplandırılarak uygun ampirik tedavinin mortalite üzerine etkisi araştırıldı. Tüm gruplardan yalnızca immünokompetan hasta grubunda, uygun olmayan ampirik tedavi ile hastane yatış sonu mortalite, uygun ampirik tedavi alanlara göre istatistiksel olarak anlamlı düzeyde yüksek bulundu (%54.5 ve %25.8) (p=0.033). İmmünosüprese hasta grubunda, ampirik tedavi uygun başlanmış olsa dahi takipte mortalite gelişmişti. Bu sonuç çalışma grubumuz için mortalite üzerinde immünosüpresyonun, uygun ampirik antibiyotik tedavisinden daha önemli bir belirleyici olduğunu düşündürdü. Çalışmamızdan farklı olarak Migiyama ve arkadaşlarının (12) çalışmasında immünosüprese hastalarda, uygun başlanmayan ampirik tedavi grubuna göre uygun başlanan tedavi ile 30 günlük mortalite daha düşük bulunmuş; ancak immünkompetan hastalarda bu ilişki gösterilememiştir. Benzer bulgu nötropenik olan ve olmayan hastaların karşılaştırıldığı Kang ve arkadaşlarının (11) çalışmasında da gösterilmiş, nötropenik olmayan hasta alt grubunda uygun tedavideki gecikmenin mortaliteyi etkilemediği bildirilmiştir.
Çalışmamızda sepsis ve / veya septik şok saptanan hastalarda, ampirik tedavi uygunluğunun hastanede kalış süresini ve iki sonlanım noktası için de mortaliteyi etkilemediği görüldü. Ampirik tedavisi uygun ve GKS ≤8 olan grupta, mortalitenin daha yüksek olduğu gözlendi. Bu durum, ağır hastalığı olan olguların antimikrobiyal tedaviden bağımsız olarak yüksek mortalite riski taşıdığına işaret edebilir.
Hattori ve arkadaşlarının (28) KDİ gelişen hastalar ile yürüttükleri çalışmalarında, KDİ gelişim yeri ve kaynağı ile ampirik tedavi uygunluğu arasında anlamlı ilişki bildirilmiştir. Söz konusu çalışmada, farklar istatistiksel olarak anlamlı düzeyde olmamakla birlikte, hastane kaynaklı infeksiyonlarda, toplum başlangıçlı infeksiyonlara göre uygun olmayan ampirik tedavinin daha sık başladığı (%65.1 ve %34.9) gösterilmiş olup TB-KDİ’lerin yaklaşık olarak 2/3’üne uygun tedavi başlandığı bildirilmiştir. Moehring ve arkadaşlarının (21) çalışmasında, sağlık bakımı ile ilişkili ve hastane kaynaklı infeksiyonlar, toplum kaynaklı infeksiyonlara göre, uygun antibiyotik tedavisinde gecikmelerle ilişkili bulunmuştur. Lueangarun ve arkadaşlarının (29) çalışmasında da toplum kaynaklı ve sağlık bakım ilişkili infeksiyona kıyasla nozokomiyal infeksiyon ve ilaca dirençli mikroorganizma varlığı uygun olmayan ampirik antimikrobiyal başlangıcı ile anlamlı düzeyde ilişkili olarak bildirilmiştir. Bizim çalışmamızda ise ilaca dirençli mikroorganizma varlığı, uygun olmayan ampirik tedavi ile ilişkili bulundu; ancak infeksiyon kaynağı ve gelişme yeri, ampirik tedavi uygunluğu ile ilişkili bulunmadı.
Çalışmamızda, en sık karşılaşılan mikroorganizmalar Gram-pozitif bakterilerdi (%47). Bunu %39 oranı ile Gram-negatif bakteriler izledi; Candida infeksiyonlarının oranı yalnızca %2 idi. Polimikrobiyal bakteriyemi ise hastaların %12’sinde saptandı. Mikroorganizma bazında en sık tespit edilen etkenler sırasıyla S. aureus, E. coli ve Enterecoccus spp. idi. SENTRY Antimikrobiyal Sürveyans Programı 2010-2016 çalışmasında; ABD’de KDİ izolatlarının %50.1’inin, Avrupa’da ise %40.6’sının Gram-pozitif mikroorganizmalardan kaynaklandığı gösterilmiştir (30). CAESAR 2017 yıllık raporunda Türkiye’de E. coli (%24.1) KDİ’lerde en sık izole edilen patojen olarak bildirilmiştir. Çalışmamızdaki S. aureus (%27.0) sıklığı CAESAR 2017 yılı Türkiye verilerinin (%15.1) üzerindedir (31). Çalışmamızda beşi Kİ-KDİ olmak üzere toplamda 55 primer KDİ’nin 24 (%43.6)’ünde S. aureus saptanmışken; 45 sekonder KDİ’nin 3 (%6.7)’ünde S. aureus saptandı. Primer KDİ’lere yönelik ampirik tedavi başlanırken S. aureus öncelikle düşünülmesi gereken mikroorganizmalardan biridir. Çalışmamızdaki Enterococcus spp. sıklığı (%12), Avrupa (%9.4) ve ABD (%10.6) verileriyle uyumlu (28) olup CAESAR 2017 Türkiye verilerinin (%18.8) altındadır (31).
Çalışmamızda saptanan etkenlerin %50’sinde çoklu veya yaygın ilaç direnci olduğu görüldü. Ampirik tedavisi uygun olmayan hastalarda, ÇİD etkenler istatistiksel olarak anlamlı düzeyde daha fazla saptandı. Lojistik regresyon analizinde çoklu ilaç direncinin mortaliteyi artırdığı tespit edildi. Benzer şekilde, içinde Türkiye’nin de bulunduğu EUROBACT uluslararası kohort çalışmasında, ÇİD Gram-negatif bakterilerin, son yirmi yılda KDİ’de ana neden olarak saptanan Gram-pozitif ve mayalara rağmen yeniden ortaya çıktığı gösterilmiş; ÇİD / YİD organizma varlığının, uygun tedaviye geçişteki sürenin uzamasına ve mortalitenin artmasına neden olduğu bildirilmiştir (32).
Çalışmamızda, KDİ nedeniyle ampirik tedavide en çok kullanılan antibiyotik %37.7 oranı ile beta-laktam / beta-laktamaz inhibitörleri olarak tespit edildi. Kombine ampirik antibiyotik olarak 25 (%27.7) hastaya uygulanmıştı. En sık uygulanan kombinasyon beta-laktam + glikopeptid / lipopeptid kombinasyonu idi. Hiçbir antibiyotikte veya antibiyotik grubunda, uygun olmayan ampirik tedavi ile doğrudan ilişki gözlenmedi. Lueangarun ve arkadaşlarının (29) çalışmasında, kolistin uygun ampirik tedavi ile anlamlı düzeyde ilişkili olarak bildirilmiştir.
Çalışmamızda, tüm hastalar için uygun olmayan ampirik tedavi oranı %43 olarak saptandı. Bu konuda yapılan farklı çalışmalarda bu oran %9-73.5 aralığında bildirilmiştir (15,27,29,33-44). Oranlardaki geniş yelpaze ülkeler arası ve hastaneler arası direnç profillerindeki (37,45), sağlık bakım ilişkili nozokomiyal infeksiyon oranlarındaki ve düşük maliyeti nedeniyle ampirik tedavide önerilen ilaçlardaki farklılıklardan kaynaklanmış olabileceği gibi (37), yalnızca MRSA veya karbapenem dirençli Enterobacterales bakteriyemisi gibi ÇİD’i olan hastaların dahil edildiği çalışmalardan (41,44) da kaynaklanmış olabilir. Bunun yanı sıra bir başka faktör, uygun ampirik antimikrobiyal tedavi tanımındaki zamanın, bazı çalışmalarda çalışmamızdan farklı olarak indeks kan kültürünün alınmasından sonraki 48 saate uzatılmış olması da olabilir (40,44).
Çalışmamızda uygun olmayan ampirik tedavide ana faktör dirençli mikroorganizmalar olarak tespit edildi. Uygun olmayan ampirik tedavi nedeni; 43 hastanın 33 (%76.7)’ünde etkene uygun olmayan antimikrobiyal seçiminden, 10 (%23.3)’unda ise kan kültürü alındıktan sonraki 24 saat içinde antimikrobiyal başlanmamasından kaynaklanmıştı.
Hekimlerin KDİ ve sepsis klinik belirti ve bulgularının yanı sıra risk faktörlerine dair farkındalık düzeylerinin artırılmasının, bu alanda iyileştirme ihtiyacı olan en önemli konular olduğunu düşünüyoruz. Etken mikroorganizmaya uygun olmayan ampirik tedavi verilen 33 hastada izole edilen etkenlerden, 2 (%6.1)’sinde Candida, 23 (%69.7)’ünde ÇİD, 8 (%24.2)’inde ise YİD etken olarak saptandı. Ampirik tedavi planında, bölge veya ülke verilerinin yanı sıra yerel duyarlılık verileri de dikkate alınmalıdır.
Birçok çalışma bakteriyemili hastalarda uygun olmayan ampirik antibiyotik kullanımının ve uygun tedaviye geçişteki gecikmenin mortalite ile ilişkili olduğunu göstermektedir (15,29,36-39,46). Uygun ampirik antimikrobiyal tedavinin KDİ’si olan hastaların sonuçları üzerine etkisinin tahmin edilebilmesi, akut hastalık şiddeti ve altta yatan komorbid hastalık gibi antimikrobiyal tedavi dışındaki değişkenlerin etkisi nedeniyle zor olmaktadır. Cain ve arkadaşları (47) çalışmalarında, mortalite skoru yüksek olan grupta, uygun olmayan antimikrobiyal tedavinin mortaliteyi artırdığını ancak skoru <5 olan grupta uygun olmayan tedavi ile mortalite arasında bir ilişki olmadığını bildirmişlerdir. Leibovici ve arkadaşlarının (34) çalışmasında da uygun antibiyotik tedavisinin yararı, fonksiyonel kapasitesi düşük olan hastalarda, yüksek olanlara göre daha yüksek bildirilmiştir. Çalışmamızda ise uygun olmayan ampirik tedavinin ve uygun tedaviye kadar geçen sürenin mortalite ile ilişkisi gösterilemedi. Uygun olmayan ampirik tedavinin mortaliteye katkısı yalnızca immünosüpresyonu olmayan hasta alt grubunda gösterildi. Bu grupta uygun olmayan ampirik tedavi alan hastalarda, uygun ampirik tedavi alanlara göre hastane yatış sonu mortalite oranı daha yüksek saptandı. Diğer durumlarda; hastaların komorbid koşulları, infeksiyon ciddiyet dereceleri, infeksiyon kaynakları ve gelişme yerleri ve etken mikroorganizmalar eşleştirildiğinde dahi uygun tedavinin mortalite üzerine etkisi tespit edilemedi. Bu ilişkinin gösterildiği birçok çalışmada hasta popülasyonunun, çalışmamıza oranla daha geniş olduğu dikkati çekmektedir (15,34,35,37,47,48). Akyol ve arkadaşlarının (49) septik şok gelişen hastalar üzerinde yaptığı çalışmalarında, uygun olan ve olmayan ampirik tedavi başlanan hastalarda 30 günlük mortalitede anlamlı düzeyde farklılık saptanmamıştır. Farklı yayınlarla benzer şekilde, çalışmamızda da uygun olmayan ampirik tedavinin hastanede kalış süresini istatistiksel olarak anlamlı düzeyde uzattığı gösterildi (34,40).
Çalışmamızın en önemli kısıtlılıkları, üçüncü basamak bir hastane olan tek merkezde ve nispeten az sayıda hasta dahil edilerek yapılmış olmasıdır. Ayrıca, sekonder KDİ kaynağı dışında ek infeksiyon odakları, birden fazla bakteriyemi atağı, araya giren infeksiyon dışı komplikasyonlar ve klinik durumlar gibi ölçülmemiş değişkenlerin etkisi ekarte edilmedi. Uygun antimikrobiyal tedavinin sonuç üzerine etkisinin değerlendirilmesi; mevcut hastalık ciddiyeti, komorbid hastalıklar ve araya giren komplikasyonlar gibi antimikrobiyal tedavi dışındaki değişkenlerin etkisi nedeniyle zor olmaktadır. Diğer yanda yapılan çalışmalarda kullanılan farklı tanımlamalar nedeniyle de sonuçları karşılaştırmalı olarak değerlendirmek zorlaşmaktadır. Benzer çalışmalar düzenlenirken standardize edilmiş bir şekilde “uygun antimikrobiyal” tanımını kullanmak, çalışmalar arası kıyası kolaylaştıracaktır. Tedavi etkinliğini değerlendirmede önemli olan bir diğer nokta ise sonlanım noktalarıdır. İki grup arasında prognozdaki farkın ortaya konması için örneklem büyüklüğünün artırılması veya mortalite yerine, sağkalım ve hastane kalış süresi ile korele önceden tanımlanmış “klinik kür kriterlerinin” sonlanım noktası olarak kullanılması yararlı olacaktır.
Sonuç olarak; erken ve uygun ampirik antimikrobiyal tedavinin KDİ’lerde mortalite üzerine etkisini araştırdığımız çalışmamızda, immünokompetan bireylerde uygun olmayan ampirik tedavi ile hastane içi mortalite, uygun tedavi alanlara göre daha yüksek tespit edildi. Bu durumun, uygun ampirik antibiyotik tedavisinin mortalite üzerine herhangi bir etkisinin olmamasından ziyade sınırlı örneklem büyüklüğünün bir sonucu olabileceği kanaatindeyiz. Diğer yanda çalışmamızda, başlangıç antimikrobiyal tedavi uygunluğunun, tüm hastalarda hastanede kalış süresini anlamlı şekilde kısalttığı tespit edildi.
Hasta Onamı
Hastaların kendilerinden ve yoğun bakımda veya entübe olan hastalar içinse yakınlarından onam alınmıştır.
Etik Kurul Kararı
Çalışma için Sağlık Bilimleri Üniversitesi Ankara Numune Sağlık Uygulama ve Araştırma Merkezi Bilimsel Araştırmalar Değerlendirme Komisyonu’nun 22 Şubat 2017 tarih ve 1233/2017 karar numarasıyla alınmıştır.
Danışman Değerlendirmesi
Bağımsız dış danışman
Yazar Katkıları
Fikir/Kavram – S.K., B.D., İ.M., H.A.; Tasarım – S.K., B.D., İ.M., H.A.; Denetleme – B.D., İ.M., H.A., S.K.; Kaynak ve Fon Sağlama – B.D., İ.M.; Malzemeler/Hastalar – B.D., İ.M.; Veri Toplama ve/veya İşleme – S.K., B.D., H.A., İ.M.; Analiz ve/veya Yorum – B.D., İ.M., S.K., A; Literatür Taraması – S.K., H.A., B.D.; Makale Yazımı – S.K., B.D., İ.M., H.A.; Eleştirel İnceleme – S.K., B.D., İ.M., H.A.
Çıkar Çatışması
Yazarlar herhangi bir çıkar çatışması bildirmemiştir.
Finansal Destek
Yazar finansal destek beyan etmemiştir.
Bilimsel Etkinlik
26-30 Mayıs 2021 tarihinde gerçekleştirilen 21. Türk Klinik Mikrobiyoloji ve İnfeksiyon Hastalıkları Kongresi’nde sözlü sunum olarak sunulmuştur.
Referanslar
- Laupland KB. Incidence of bloodstream infection: a review of population-based studies. Clin Microbiol Infect. 2013;19(6):492-500. [CrossRef]
- Goto M, Al-Hasan MN. Overall burden of bloodstream infection and nosocomial bloodstream infection in North America and Europe. Clin Microbiol Infect. 2013;19(6):501-9. [CrossRef]
- Maki DG, Kluger DM, Crnich CJ. The risk of bloodstream infection in adults with different intravascular devices: a systematic review of 200 published prospective studies. Mayo Clin Proc. 2006;81(9):1159-71. [CrossRef]
- Pittet D, Li N, Woolson RF, Wenzel RP. Microbiological factors influencing the outcome of nosocomial bloodstream infections: a 6-year validated, population-based model. Clin Infect Dis. 1997;24(6):1068-78. [CrossRef]
- Antimicrobial resistance. global report on surveillance, 01 April 2014 [Internet]. Geneva: World Health Organization (WHO). [erişim 22 Haziran 2024]. https://www.who.int/publications/i/item/9789241564748
- Akova M. Epidemiology of antimicrobial resistance in bloodstream infections. Virulence. 2016;7(3):252-66. [CrossRef]
- Antibiotic resistance threats in the United States, 2013 [Internet]. Atlanta: Centers for Disease Control and Prevention (CDC). [erişim 22 Haziran 2024]. https://stacks.cdc.gov/view/cdc/20705
- Taplitz RA, Kennedy EB, Bow EJ, et al. Outpatient management of fever and neutropenia in adults treated for malignancy: American Society of Clinical Oncology and Infectious Diseases Society of America Clinical Practice Guideline update. J Clin Oncol. 2018;36(14):1443-53. [CrossRef]
- Rhodes A, Evans LE, Alhazzani W, et al. Surviving sepsis campaign: International Guidelines for Management of Sepsis and Septic Shock: 2016. Intensive Care Med. 2017;43(3):304-77. [CrossRef]
- Garnacho-Montero J, Garcia-Garmendia JL, Barrero-Almodovar A, Jimenez-Jimenez FJ, Perez-Paredes C, Ortiz-Leyba C. Impact of adequate empirical antibiotic therapy on the outcome of patients admitted to the intensive care unit with sepsis. Crit Care Med. 2003;31(12):2742-51. [CrossRef]
- Kang CI, Kim SH, Kim HB, et al. Pseudomonas aeruginosa bacteremia: risk factors for mortality and influence of delayed receipt of effective antimicrobial therapy on clinical outcome. Clin Infect Dis. 2003;37(6):745-51. [CrossRef]
- Migiyama Y, Yanagihara K, Kaku N, et al. Pseudomonas aeruginosa bacteremia among immunocompetent and immunocompromised patients: relation to initial antibiotic therapy and survival. Jpn J Infect Dis. 2016;69(2):91-6. [CrossRef]
- Schechner V, Gottesman T, Schwartz O, et al. Pseudomonas aeruginosa bacteremia upon hospital admission: risk factors for mortality and influence of inadequate empirical antimicrobial therapy. Diagn Microbiol Infect Dis. 2011;71(1):38-45. [CrossRef]
- Vallés J, Rello J, Ochagavía A, Garnacho J, Alcalá MA. Community-acquired bloodstream infection in critically ill adult patients: impact of shock and inappropriate antibiotic therapy on survival. Chest. 2003;123(5):1615-24. [CrossRef]
- Retamar P, Portillo MM, López-Prieto MD, et al; SAEI/SAMPAC Bacteremia Group. Impact of inadequate empirical therapy on the mortality of patients with bloodstream infections: a propensity score-based analysis. Antimicrob Agents Chemother. 2012;56(1):472-8. [CrossRef]
- McGregor JC, Rich SE, Harris AD, et al. A systematic review of the methods used to assess the association between appropriate antibiotic therapy and mortality in bacteremic patients. Clin Infect Dis. 2007;45(3):329-37. [CrossRef]
- Singer M, Deutschman CS, Seymour CW, et al. The third international consensus definitions for sepsis and septic shock (Sepsis-3). JAMA. 2016;315(8):801-10. [CrossRef]
- Clinical breakpoints – breakpoints and guidance [Internet]. European Society of Clinical Microbiology and Infectious Disease, European Committee on Antimicrobial Susceptibility Testing (EUCAST). [erişim 22 Haziran 2024]. https://www.eucast.org/clinical_breakpoints
- Magiorakos AP, Srinivasan A, Carey RB, et al. Multidrug-resistant, extensively drug-resistant and pandrug-resistant bacteria: an international expert proposal for interim standard definitions for acquired resistance. Clin Microbiol Infect. 2012;18(3):268-81. [CrossRef]
- Que YA. Management of S. aureus Bloodstream Infection. In: Mandell GL, Bennett JE, Dolin R, eds. Mandell, Douglas, and Bennett’s Principles and Practice of Infectious Diseases. 9th ed. Philadelphia, PA: Elsevier, 2020: 2393-431.
- Moehring RW, Sloane R, Chen LF, et al. Delays in appropriate antibiotic therapy for Gram-negative bloodstream infections: a multicenter, community hospital study. PLoS One. 2013;8(10):e76225. [CrossRef]
- Bloodstream Infection Event (Central Line-Associated Bloodstream Infection and Non-central Line Associated Bloodstream Infection) [Internet]. National Healthcare Safety Network. [erişim 22 Haziran 2024]. https://www.cdc.gov/nhsn/PDFs/pscManual/4PSC_CLABScurrent.pdf
- Mermel LA, Allon M, Bouza E, et al. Clinical practice guidelines for the diagnosis and management of intravascular catheter-related infection: 2009 Update by the Infectious Diseases Society of America. Clin Infect Dis. 2009;49(1):1-45. Erratum in: Clin Infect Dis. 2010;50(7):1079. Dosage error in article text. Erratum in: Clin Infect Dis. 2010;50(3):457. [CrossRef]
- Horan TC, Andrus M, Dudeck MA. CDC/NHSN surveillance definition of health care-associated infection and criteria for specific types of infections in the acute care setting. Am J Infect Control. 2008;36(5):309-32. Erratum in: Am J Infect Control. 2008;36(9):655. [CrossRef]
- Corona A, Bertolini G, Lipman J, Wilson AP, Singer M. Antibiotic use and impact on outcome from bacteraemic critical illness: the BActeraemia Study in Intensive Care (BASIC). J Antimicrob Chemother. 2010;65(6):1276-85. [CrossRef]
- Dat VQ, Long NT, Hieu VN, et al. Clinical characteristics, organ failure, inflammatory markers and prediction of mortality in patients with community acquired bloodstream infection. BMC Infect Dis. 2018;18(1):535. [CrossRef]
- Fitzpatrick JM, Biswas JS, Edgeworth JD, et al; United Kingdom Clinical Infection Research Group. Gram-negative bacteraemia; a multi-centre prospective evaluation of empiric antibiotic therapy and outcome in English acute hospitals. Clin Microbiol Infect. 2016;22(3):244-51. [CrossRef]
- Hattori H, Maeda M, Nagatomo Y, et al. Epidemiology and risk factors for mortality in bloodstream infections: A single-center retrospective study in Japan. Am J Infect Control. 2018;46(12):e75-9. [CrossRef]
- Lueangarun S, Leelarasamee A. Impact of inappropriate empiric antimicrobial therapy on mortality of septic patients with bacteremia: a retrospective study. Interdiscip Perspect Infect Dis. 2012;2012:765205. [CrossRef]
- Mendes RE, Sader HS, Castanheira M, Flamm RK. Distribution of main Gram-positive pathogens causing bloodstream infections in United States and European hospitals during the SENTRY Antimicrobial Surveillance Program (2010-2016): concomitant analysis of oritavancin in vitro activity. J Chemother. 2018;30(5):280-9. [CrossRef]
- Central Asian and eastern European Surveillance of Antimicrobial Resistance: Annual Report 2017 [Internet]. Geneva: World Health Organization (WHO). Regional office in Europe. [erişim 22 Haziran 2024]. Available from: https://iris.who.int/handle/10665/342131
- Tabah A, Koulenti D, Laupland K, et al. Characteristics and determinants of outcome of hospital-acquired bloodstream infections in intensive care units: the EUROBACT International Cohort Study. Intensive Care Med. 2012;38(12):1930-45. [CrossRef]
- Kaasch AJ, Rieg S, Kuetscher J, et al; preSABATO study group. Delay in the administration of appropriate antimicrobial therapy in Staphylococcus aureus bloodstream infection: a prospective multicenter hospital-based cohort study. Infection. 2013;41(5):979-85. [CrossRef]
- Leibovici L, Shraga I, Drucker M, Konigsberger H, Samra Z, Pitlik SD. The benefit of appropriate empirical antibiotic treatment in patients with bloodstream infection. J Intern Med. 1998;244(5):379-86. [CrossRef]
- Robineau O, Robert J, Rabaud C, et al. Management and outcome of bloodstream infections: a prospective survey in 121 French hospitals (SPA-BACT survey). Infect Drug Resist. 2018;11:1359-68. [CrossRef]
- Yamaga S, Shime N. Association between appropriate empiric antimicrobial therapy and mortality from bloodstream infections in the intensive care unit. J Infect Chemother. 2018;24(4):267-71. [CrossRef]
- Yang CJ, Chung YC, Chen TC, et al. The impact of inappropriate antibiotics on bacteremia patients in a community hospital in Taiwan: an emphasis on the impact of referral information for cases from a hospital affiliated nursing home. BMC Infect Dis. 2013;13:500. [CrossRef]
- Lee CC, Chen PL, Ho CY, Hong MY, Hung YP, Ko WC. Prompt antimicrobial therapy and source control on survival and defervescence of adults with bacteraemia in the emergency department: the faster, the better. Crit Care. 2024;28(1):176. [CrossRef]
- De la Rosa-Riestra S, Martínez Pérez-Crespo PM, Pérez Rodríguez MT, et al; PROBAC group. Mortality impact of further delays in active targeted antibiotic therapy in bacteraemic patients that did not receive initial active empiric treatment: Results from the prospective, multicentre cohort PROBAC. Int J Infect Dis. 2024;145:107072. [CrossRef]
- Battle SE, Bookstaver PB, Justo JA, Kohn J, Albrecht H, Al-Hasan MN. Association between inappropriate empirical antimicrobial therapy and hospital length of stay in Gram-negative bloodstream infections: stratification by prognosis. J Antimicrob Chemother. 2017;72(1):299-304. [CrossRef]
- Yoon YK, Park DW, Sohn JW, et al. Effects of inappropriate empirical antibiotic therapy on mortality in patients with healthcare-associated methicillin-resistant Staphylococcus aureus bacteremia: a propensity-matched analysis. BMC Infect Dis. 2016;16:331. [CrossRef]
- Zaragoza R, Artero A, Camarena JJ, Sancho S, González R, Nogueira JM. The influence of inadequate empirical antimicrobial treatment on patients with bloodstream infections in an intensive care unit. Clin Microbiol Infect. 2003;9(5):412-8. [CrossRef]
- Honda H, Higuchi N, Shintani K, Higuchi M, Warren DK. Inadequate empiric antimicrobial therapy and mortality in geriatric patients with bloodstream infection: A target for antimicrobial stewardship. J Infect Chemother. 2018;24(10):807-11. [CrossRef]
- Li C, Li Y, Zhao Z, Liu Q, Li B. Treatment options and clinical outcomes for carbapenem-resistant Enterobacteriaceae bloodstream infection in a Chinese university hospital. J Infect Public Health. 2019;12(1):26-31. [CrossRef]
- Anderson DJ, Moehring RW, Sloane R, et al. Bloodstream infections in community hospitals in the 21st century: a multicenter cohort study. PLoS One. 2014;9(3):e91713. [CrossRef]
- Ma Z, Lai C, Zhang J, et al. High mortality associated with inappropriate initial antibiotic therapy in hematological malignancies with Klebsiella pneumoniae bloodstream infections. Sci Rep. 2024;14(1):13041. [CrossRef]
- Cain SE, Kohn J, Bookstaver PB, Albrecht H, Al-Hasan MN. Stratification of the impact of inappropriate empirical antimicrobial therapy for Gram-negative bloodstream infections by predicted prognosis. Antimicrob Agents Chemother. 2015;59(1):245-50. [CrossRef]
- Miglis C, Rhodes NJ, Liu J, Gener J, Hang E, Scheetz MH. Quantifying the importance of active antimicrobial therapy among patients with Gram-negative bloodstream infections: Cefepime as a representative agent. Int J Antimicrob Agents. 2019;53(1):95-7. [CrossRef]
- Akyol D, Çankayalı İ, Ersel M, et al. Impact of the empirical therapy timing on the clinical progress of septic shock patients. Diagn Microbiol Infect Dis. 2024;108(3):116149. [CrossRef]