En Çok Okunanlar
Özet
Amaç: Bu çalışmada, hastanemizin tıbbi mikrobiyoloji laboratuvarında izole edilen Escherichia coli, Staphylococcus aureus ve Pseudomonas aeruginosa izolatlarının antimikrobiyal direncinin konvasiyonel disk difüzyon yöntemi ve hızlı antibiyotik duyarlılık testi ile doğruluk ve zaman açısından karşılaştırmalı olarak ölçülmesi amaçlandı.
Yöntemler: Çalışmaya, standart suş dahil olmak üzere 51 E. coli, 26 S. aureus ve 25 P. aeruginosa izolatı alındı. Tüm izolatlar Kirby-Bauer disk difüzyon yöntemi ile Avrupa Antimikrobiyal Duyarlılık Testi Komitesi (EUCAST) 2023 yılı rehberindeki kurallara uygun olarak çalışıldı. Hızlı antibiyotik duyarlılık testi için ise AST FAST ES ve AST FAST NF besiyerleri (Diagnotis A.Ş., Türkiye) kullanıldı ve üretici firmanın talimatlarına ve EUCAST’ın sınır değer tablosuna uygun olarak ayrı ayrı değerlendirildi.
Bulgular: Tüm E. coli izolatlarının antibiyotik duyarlılık testleri gerçekleştirildiğinde çok büyük hata (ÇBH) oranı ampisilin, sefuroksim, seftriakson, seftazidim, gentamisin, amikasin ve trimetoprim-sülfametoksazol (SXT) için %1.96 ve sefepim için %3.92 olarak hesaplandı. Amoksisilin-klavulanik asit, siprofloksasin ve meropenem için ise ÇBH oranı saptanmadı. Büyük hata (BH) oranı ampisilin için %5.88, sefuroksim ve seftazidim için %3.92 ve meropenem için %1.96 idi. E. coli izolatları için kategorik uyum (KU) oranı tüm antibiyotiklerde kabul edilme kriteri olan %90’ın üzerinde saptandı. S. aureus izolatlarının sonuçları incelendiğinde klindamisin, gentamisin ve moksifloksasinde 1 (%3.85), eritromisin ve sefoksitinde 4 (%15.38) suşta ÇBH oranı tespit edilirken fusidik asit, SXT, mupirosin, linezolid ve amikasin için ÇBH oranı saptanmadı. Büyük hata oranları SXT’de %19.23, sefoksitinde %11.53 ve moksifloksasinde %3.85 idi. Klindamisin, fusidik asit, gentamisin, mupirosin, linezolid ve amikasine karşı KU oranı %90’nın üzerinde iken sefoksitin (%73.08), SXT (%80.77) ve eritromisinde (%84.61) kabul edilebilir değerin altında saptandı. P. aeruginosa’da ÇBH oranları meropenem için %11.5 ve amikasin için %3.9 idi; BH oranı saptanmadı. Kategorik uyum oranları ise amikasin-aztreonam ve imipenem için kabul edilebilir değerlerin üzerindeydi.
Sonuç: Çalışmamızda, tıbbi mikrobiyoloji laboratuvarlarında hızlı antibiyotik duyarlılık testinin E. coli’nin duyarlılık sonuçlarının erken tespiti için kullanılabileceği ancak ÇBH oranları ile karşılaşılması nedeniyle sonuçların standart yöntemlerle de doğrulanması gerektiği gösterildi. Diğer yanda P. aeruginosa ve S. aureus’da elde edilen verilerin daha çok örnekle çalışılarak desteklenmesi ve kullandığımız hızlı antibiyotik duyarlılık test besiyerinin standardizasyon çalışmalarına devam edilmesi gerektiğini düşünüyoruz.
GİRİŞ
Antibiyotik direnci hem toplumsal hem de nozokomiyal infeksiyonların tedavisinde her geçen gün artan bir sorun olarak karşımıza çıkmaktadır. Son on yıl içinde pek çok bakteri, infeksiyon hastalıklarının tedavisinde ilk seçenek olan antibiyotiklere karşı direnç geliştirmiştir (1). Bakteriyel infeksiyonlarda antimikrobiyal tedaviye en kısa sürede başlanması gerekmektedir. Bu nedenle, birçok hekim bakteriyel infeksiyon hastalıklarında ampirik antibiyotik tedavisine başlamaktadır. Ancak yapılan çalışmalar, ampirik olarak başlanan tedavilere sıklıkla yanlış antibiyotikle veya patojenin doğru teşhisi olmadan başlandığını göstermektedir. Bu nedenle, hızlı antimikrobiyal duyarlılık testini mümkün kılan yöntem ve teknolojilere yönelik artan bir talep vardır (2,3). İnfeksiyon etkenlerinin izolasyonu, tanımlanması ve özellikle antimikrobiyallere karşı duyarlılıklarının hızlı, doğru ve zamanında belirlenmesi, hastaların morbidite ve mortalite oranlarının yanı sıra ekonomik kayıpların ve hastanede yatış sürelerinin önemli derecede azalmasına katkı sağlamaktadır (4). Bu nedenle antibiyotik duyarlılık sonuçlarının tespitinin hızlandırılması amacıyla; 4-6 saat gibi kısa bir sürede sonuç verebilen “Autobac disc elution” sistemi (Pfizer Diagnostics, ABD), tanımlama da dahil dört saatte sonuç verebilen MS-2 sistemi (Abbott Diagnostics, Division of Abbott Laboratories, ABD) ve VITEK® 2 otomatize sistemi (bioMérieux, Fransa) gibi cihazlar geliştirilmiştir (5). Söz konusu otomatize sistemler sayesinde konvansiyonel yöntemlere kıyasla daha az iş gücüne ihtiyaç duyulmakta ve daha kısa sürede sonuç alınmaktadır. Ancak, otomatize sistemlerin yüksek maliyeti nedeniyle bugün klinik laboratuvarlarda çoğunlukla disk difüzyon yöntemi ile antimikrobiyal duyarlılık testleri yapılmakta ve 18-24 saatte sonuç alınmaktadır (6,7).
Bu çalışmada, hastanemizin tıbbi mikrobiyoloji laboratuvarında izole edilen Escherichia coli, Staphylococcus aureus ve Pseudomonas aeruginosa izolatlarının antimikrobiyal direncinin konvansiyonel disk difüzyon yöntemi ve hızlı antibiyotik duyarlılık testi ile doğruluk ve zaman açısından karşılaştırmalı olarak ölçülmesi amaçlandı.
YÖNTEMLER
Çalışmaya, standart suş dahil olmak üzere 51 E. coli, 26 S. aureus ve 25 P. aeruginosa izolatı alındı. Tüm izolatlar Kirby-Bauer disk difüzyon yöntemi ile Avrupa Antimikrobiyal Duyarlılık Testi Komitesi (EUCAST) 2023 yılı rehberindeki kurallara uygun olarak çalışıldı. Hızlı antibiyotik duyarlılık testi için ise AST FAST ES ve AST FAST NF besiyerleri (Diagnotis A.Ş., Türkiye) kullanıldı ve üretici firmanın talimatlarına ve EUCAST’ın sınır değer tablosuna uygun olarak ayrı ayrı değerlendirildi (8).
AST FAST ES besiyeri Enterobacteriacea ve Staphylococcus suşları için, AST FAST NF Pseudomonas suşları için kullanıldı. Çalışmaya her iki yöntem için kontrol suşu olarak alınan standart suşlar E. coli (ATCC 25922), P. aeruginosa (ATCC 27853) ve S. aureus (ATCC 25923) idi. Duyarlılık zonları; AST FAST ES besiyeri ile E. coli suşlarında 4-6 saat arasında, S. aureus suşlarında 6-8 saat arasında değerlendirilirken AST FAST NF besiyeri ile P. aeruginosa suşlarında 10 saat içerisinde değerlendirildi.
Çalışmada; kategorik uyum (KU), çok büyük hata (ÇBH) ve büyük hata (BH) değerleri hesaplanarak antibiyotik duyarlılık testlerinin kabul edilme kriterleri (ÇBH ve BH %3’ün altında ve KU %90’ın üzerinde) belirlendi (9). Kategorik uyum, antibiyotik duyarlılık testi yorumlama sonucunun (duyarlı/dirençli) referans yöntem ile olan uyumudur. Çok büyük hata, ticari testin duyarlı olarak saptadığı izolatın referans yöntemde dirençli olarak (hatalı duyarlı) saptanması durumunda, BH ise ticari testte dirençli olarak saptanan bir izolatın referans yöntemde duyarlı olarak saptanması (hatalı dirençli) durumunda hesaplandı.
Dünya Tabipler Birliği Helsinki Bildirgesi’ne uygun olarak yürütülen çalışma için Selçuk Üniversitesi Tıp Fakültesi Klinik Araştırmalar Etik Kurulu’ndan 26 Mart 2024 tarih ve 2024/183 karar numarasıyla onay alındı.
BULGULAR
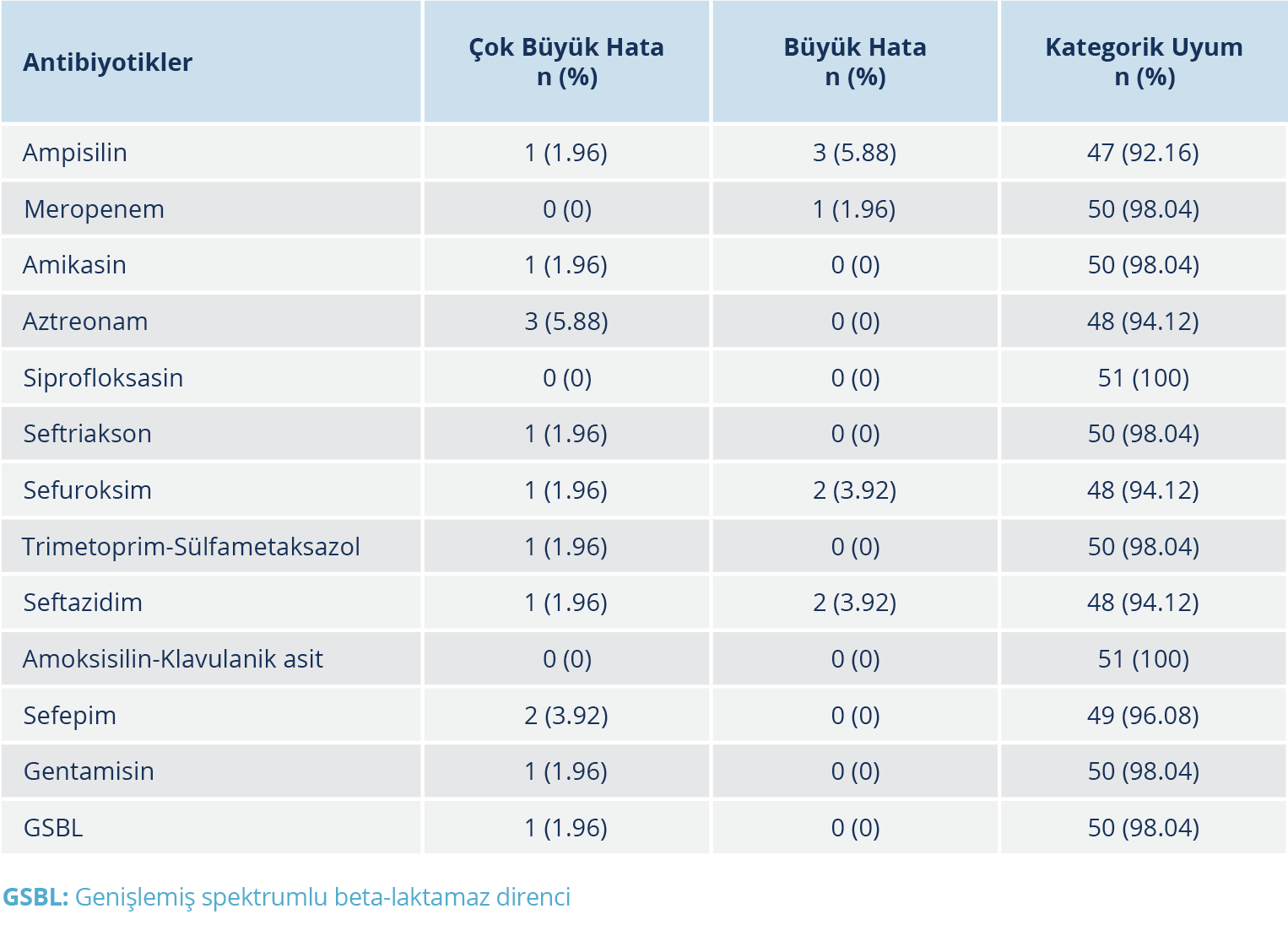
Tablo 1. E. coli Suşlarının Kromojenik Agar ve Kirby-Bauer Disk Difüzyon Yöntemi ile Elde Edilen Sonuçları
Standart suşlar dahil toplam 51 E. coli izolatının antibiyotik duyarlılık testi değerlendirildiğinde; ÇBH oranı ampisilin, sefuroksim, seftriakson, seftazidim, gentamisin, amikasin ve trimetoprim-sülfametoksazol (SXT) için %1.96, sefepim için %3.92 olarak tespit edildi. Amoksisilin-klavulanik asit, siprofloksasin ve meropenem için ÇBH oranı saptanmadı; BH oranı ise ampisilin için %5.88, sefuroksim ve seftazidim için %3.92 ve meropenem için %1.96 idi. E. coli izolatları için KU oranlarının tüm antibiyotiklerde kabul edilme kriteri olan %90’ın üzerinde olduğu tespit edildi (Tablo 1).
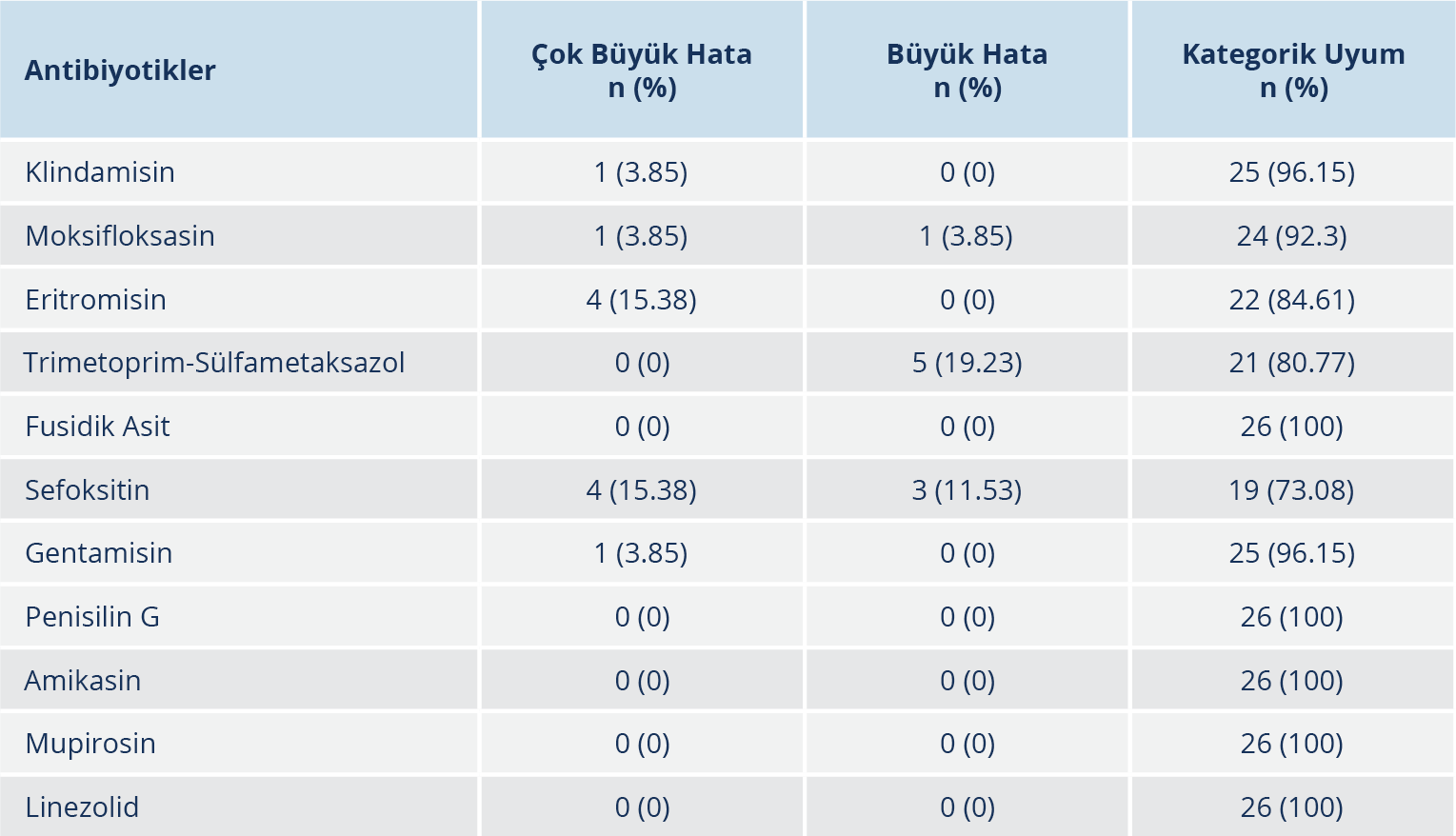
Tablo 2. S. aureus İzolatlarının Kromojenik Agar ve Kirby-Bauer Disk Difüzyon Yöntemi ile Elde Edilen Sonuçları
S. aureus izolatlarının sonuçları incelendiğinde; klindamisin, gentamisin ve moksifloksasinde 1 (%3.85), eritromisin ve sefoksitinde 4 (%15.38) izolatta ÇBH oranları tespit edildi. Fusidik asit, SXT, mupirosin, linezolid ve amikasinde ÇBH oranı saptanmadı. Büyük hata oranları SXT’de %19.23, sefoksitinde %11.53 ve moksifloksasinde %3.85 idi. Kategorik uyum oranı; klindamisin, fusidik asit, gentamisin, mupirosin, linezolid ve amikasinde %90’nın üzerinde iken sefoksitin (%73.08), SXT (%80.77) ve eritromisinde (%84.61) kabul edilebilir değerin altında saptandı (Tablo 2).
P. aeruginosa’da ÇBH oranları meropenem için %11.5 ve amikasin için %3.9 idi; BH oranı saptanmadı. Kategorik uyum oranları amikasin-aztreonam ve imipenem için kabul edilebilir değerlerin üzerinde iken meropenem ve seftazidim için %88.5, levofloksasin ve sefepim için %84.6 olarak tespit edildi.
İRDELEME
Antibiyotik duyarlılık test sonuçları, kullanılan konvansiyonel yöntemler ile yaklaşık 18-24 saat içerisinde verilmektedir. Kirby-Bauer disk difüzyon, sıvı dilüsyon ve agar dilüsyon testleri konvansiyonel duyarlılık test yöntemleri olarak kabul edilmektedir (10). Disk difüzyon yönteminin farklı bir uygulaması olan gradyan test yöntemi de konvansiyonel yöntemlerden biridir. Bu yöntemler ile en erken 18-24 saatte sonuç alınmakta ve raporlanmaktadır (7). Antimikrobiyal test sonucunun uzun sürmesi acil olgularda ve hayati önem arz eden ciddi infeksiyonlarda, tedavi başarısını olumsuz yönde etkilemektedir. Günümüzde, geliştirilen otomatize sistemlerle, antibiyotik duyarlılık test sonuçları 4-6 saatte verilebilmektedir (5,11). Ancak, otomatize sistemlerle konvansiyonel yöntemler arasında önemli bir maliyet farkı vardır. Bu nedenle araştırmacılar konvansiyonel yöntemlerde değişiklikler yaparak daha hızlı, doğru, aynı zamanda kolay uygulanabilir ve ucuz antimikrobiyal testler geliştirmeye yönelmiş ve farklı yöntemler geliştirilmiştir (3,12-14).
Coban ve arkadaşları (15) yaptıkları çalışmada, S. aureus izolatlarında metisilin direncinin hızlı tespiti için Quicolor (QC) ES agar besiyerinin kullanımını değerlendirmiştir. Söz konusu çalışmada, metisilin duyarlı S. aureus izolatlarında oksasilin ve sefoksitin sonuçları QC ES’de 4-7 saat (ortalama 5 saat) içinde alınırken, metisiline dirençli S. aureus izolatlarında her iki antibiyotik için 5-9 saatte (ortalama 6 saat) alındığı ve sonuçların Muellar-Hinton Agar (MHA) besiyerinde yapılan disk difüzyon test sonuçlarıyla uyumlu olduğu bildirilmiştir. Ercis ve arkadaşları (16) tarafından Klinik ve Laboratuvar Standartları Enstitüsü (Clinical and Laboratory Standards Institute – CLSI)’nün kriterleri izlenerek fenotipik doğrulama testi ile 50’si genişlemiş spektrumlu beta-laktamaz (GSBL) pozitif/negatif olarak önceden belirlenmiş 100 izolat ile yapılan çalışmada, GSBL’nin saptanmasında MHA besiyeri ile QC besiyeri karşılaştırılmıştır. Tüm izolatlar için QC agar ile 4-6 saat içinde elde edilen GSBL sonuçlarının standart besiyeri sonuçları ile benzer olduğu bildirilmiştir. Temel ve arkadaşları (17) yaptıkları çalışmada, kromojenik AST Fast ES/NF besiyerinin EUCAST standart disk difüzyon metoduyla antibiyotik duyarlılıklarının saptanmasında kullanımının uygunluğunu araştırmışlardır. Çalışma sonucunda; AST Fast ES/NF besiyerinde inhibisyon zon çaplarının 4-6 saat içerisinde ölçülebilir duruma geldiği ve üretici firmanın önerilerine uygun şekilde izolatların duyarlılıklarını belirledikleri bildirilmiştir. Aynı çalışmada, MHA kullanılarak gerçekleştirilen disk difüzyon test sonuçlarının, AST Fast ES/NF agar kromojenik besiyeriyle elde edilen sonuçlar ile büyük oranda uyumlu olduğu da raporlamıştır. Çalışmamızda, AST FAST ES besiyeri ile E. coli izolatlarının duyarlılık zonları 4-6 saat arasında ve S. aureus izolatlarının 6-8 saat arasında değerlendirilirken AST FAST NF besiyeri ile P. aeruginosa izolatlarının duyarlılık zonları 10 saat içerisinde değerlendirildi. Kirby-Bauer disk difüzyon yöntemi ile elde edilen veriler AST Fast ES/NF agar kromojenik besiyeriyle elde edilen sonuçlar ile büyük oranda benzerdi.
Sonuç olarak; kromojenik besiyeri acil durumlarda E. coli antimikrobiyal duyarlılık sonuçlarının erken tespiti için kullanılabilir; ancak ÇBH oranı ihtimali nedeniyle sonuçların standart bir yöntemle doğrulanması gerekmektedir. P. aeruginosa ve S. aureus’da elde edilen verilerin ise daha çok örnekle çalışılarak desteklenmesi ve kullandığımız hızlı antibiyotik duyarlılık test besiyerinin standardizasyon çalışmalarının devam etmesi gerektiğini düşünüyoruz.
Hasta Onamı
Veriler retrospektif olarak değerlendirildiği için hasta onamı alınmamıştır.
Etik Kurul Kararı
Çalışma için Selçuk Üniversitesi Tıp Fakültesi Klinik Araştırmalar Etik Kurulu’ndan 26 Mart 2024 tarih ve 2024/183 karar numarasıyla onay alınmıştır.
Danışman Değerlendirmesi
Bağımsız dış danışman.
Yazar Katkıları
Fikir/Kavram – N.Ç., H.T.D.; Tasarım – N.Ç., H.T.D.; Denetleme – N.Ç., H.T.D., U.A.; Kaynak ve Fon Sağlama – H.T.D., U.A., N.Ç.; Malzemeler/Hastalar – N.Ç., B.Ç.; Veri Toplama ve/veya İşleme – N.Ç., B.Ç.; Analiz ve/veya Yorum – N.Ç., H.T.D., U.A., B.Ç.; Literatür Taraması – N.Ç., B.Ç.; Makale Yazımı – N.Ç., B.Ç., H.T.D.; Eleştirel İnceleme – N.Ç., B.Ç. H.T.D., U.A.
Çıkar Çatışması
Yazarlar herhangi bir çıkar çatışması bildirmemiştir.
Finansal Destek
Yazar finansal destek beyan etmemiştir.
Teşekkür
Çalışmada kullanılan besiyerilerinin temini konusunda desteklerinden ötürü Diagnotis A.Ş.’ye teşekkür ederiz.
Referanslar
- Gülay Z. [Interpretive reading of susceptibility tests]. Thorac Res Pract. 2002;3:75-88. Turkish.
- Collignon PJ, Conly JM, Andremont A, et al. World Health Organization ranking of antimicrobials according to their importance in human medicine: A critical step for developing risk management strategies to control antimicrobial resistance from food animal production. Clin Infect Dis. 2016;63(8):1087-93. Erratum in: Clin Infect Dis. 2016;63(11):1536. [CrossRef]
- Kaprou GD, Bergšpica I, Alexa EA, Alvarez-Ordóñez A, Prieto M. Rapid methods for antimicrobial resistance diagnostics. Antibiotics (Basel). 2021;10(2):209. [CrossRef]
- Erdoğan G, Karakoç AE, Yücel M, Yağcı S. [Evaluation of EUCAST direct rapid antimicrobial susceptibility test method in blood culture bottles with positive signal]. Mikrobiyol Bul. 2021;55(4):626-34. Turkish. [CrossRef]
- Wheat PF. History and development of antimicrobial susceptibility testing methodology. J Antimicrob Chemother. 2001;48 Suppl 1:1-4. [CrossRef]
- Felmingham D, Brown DF. Instrumentation in antimicrobial susceptibility testing. J Antimicrob Chemother. 2001;48 Suppl 1:81-5. [CrossRef]
- Bilgehan H. Klinik Mikrobiyolojik Tanı, 5. baskı. İzmir: Barış Yayınları Fakülteler Kitabevi, 2009: 175-9.
- Breakpoint tables for interpretation of MICs and zone diameters. Version 13.1. [Internet]. In: European Committee on Antimicrobial Susceptibility Testing (EUCAST) web site. [erişim 04 Haziran 2024]. https://www.eucast.org/clinical_breakpoints
- International Organization for Standardization (ISO). Clinical laboratory testing and in vitro diagnostic test systems — Susceptibility testing of infectious agents and evaluation of performance of antimicrobial susceptibility test devices — Part 2: Evaluation of antimicrobial susceptibility test devices. Technical Committee ISO/TC 212, 2007.
- El-Bouri K, Johnston S, Rees E, et al. Comparison of bacterial identification by MALDI-TOF mass spectrometry and conventional diagnostic microbiology methods: agreement, speed and cost implications. Br J Biomed Sci. 2012;69(2):47-55.
- Yamakawa H, Kosai K, Kawamoto Y, et al. Performance evaluation of BD Phoenix™, an automated microbiology system, for the screening of IMP-producing Enterobacteriaceae. J Microbiol Methods. 2018;145:47-9. [CrossRef]
- McAdams D, Wollein Waldetoft K, Tedijanto C, Lipsitch M, Brown SP. Resistance diagnostics as a public health tool to combat antibiotic resistance: A model-based evaluation. PLoS Biol. 2019;17(5):e3000250. [CrossRef]
- Giordano C, Piccoli E, Brucculeri V, Barnini S. A Prospective evaluation of two rapid phenotypical antimicrobial susceptibility technologies for the diagnostic stewardship of sepsis. Biomed Res Int. 2018;2018:6976923. [CrossRef]
- Vasala A, Hytönen VP, Laitinen OH. Modern tools for rapid diagnostics of antimicrobial resistance. Front Cell Infect Microbiol. 2020;10:308. [CrossRef]
- Coban AY, Demirpek U, Yıldırım T, et al. Rapid detection of methicillin resistance in Staphylococcus aureus isolates; evaluation of colorimetric Quicolor ES agar and determination of breakpoint inhibition zone diameters of cefoxitin. World J Microbiol Biotechnol. 2011:27;1901-04.
- Ercis S, Sancak B, Kocagöz T, Kocagöz S, Hasçelik G, Bolmström A. Rapid 4 to 6 hour detection of extended-spectrum beta-lactamases in a routine laboratory. Scand J Infect Dis. 2007;39(9):781-5. [CrossRef]
- Temel A, Tekintaş Y, Limoncu-Hoşgör M, Çilli F. [Evaluation of AST fast ES/NF agar medium for rapid detection of imipenem resistance in clinical Klebsiella pneumoniae and Acinetobacter baumannii isolates]. Ankara Ecz Fak Derg. 2023;47(2):430-7. Turkish. [CrossRef]

































































































































