En Çok Okunanlar
Özet
Türk Klinik Mikrobiyoloji ve İnfeksiyon Hastalıkları Derneği Viral Hepatit Çalışma Grubu (VHÇG) tarafından, ilki 2014 yılında yayımlanan kronik hepatit D virus (HDV) infeksiyonu yönetimine ilişkin uzlaşı raporunun, günümüzde kullanıma giren ve geliştirilmekte olan yeni tedavi seçenekleri nedeniyle güncellenmesine ihtiyaç duyulmuştur. Bu nedenle VHÇG bünyesinde bir çalışma alt grubu oluşturulmuş; mevcut literatür ve uluslararası kanıta dayalı rehberler gözden geçirilerek yeni bir uzlaşı raporu hazırlanmıştır.
Bu raporda ana hatlarıyla vurgulanan önemli noktalar şunlardır: HDV infeksiyonu ile siroz ve hepatoselüler karsinom (HSK) gelişme riski hepatit B virus ile monoinfekte hastaya kıyasla daha yüksektir. HDV ile infekte bireylerde daha genç yaşta siroz, HSK, hepatik dekompanzasyon gelişebilir. Hastaların büyük çoğunluğunda tanı anında ileri evre karaciğer hastalığı ve/veya siroz mevcuttur. Bu nedenle yalnızca risk gruplarının değil, HBsAg pozitif tüm hastaların HDV açısından taranması ve HDV farkındalığının artırılması büyük önem taşımaktadır.
Tanı testlerinde standardizasyon sorunu devam etmektedir. Anti-HDV pozitif saptanan tüm hastalarda, duyarlı bir reverse-transkriptaz testiyle HDV RNA çalışılmalıdır. Tedavide, 48 haftalık pegile interferon (PEG-IFN) tedavisi önerilmektedir. PEG-IFN’nin kompanse sirotik hastalarda dikkatle kullanılması, dekompanse hastalarda ise kontrendike olduğu vurgulanmaktadır. Nükleoz(t)ide analogları (NA), sirotik hastalarda saptanabilir HBV DNA varlığında önerilmekle birlikte HDV tedavisinde önerilmemektedir.
Avrupa’da 2020 yılında onay alan bulevirtid (BLV), kompanse sirotik hastalar da dâhil olmak üzere güvenli kullanımı, uzun süreli tedavideki etkisi ve PEG-IFN ile kombinasyonundaki virolojik yanıt artışı nedeniyle umut vadetmektedir. Ancak, BLV’nin hem klinik çalışmalar hem de gerçek yaşam verileriyle etkinliği kanıtlanmış olmakla birlikte yalnızca onaylandığı ülkeler için bir tedavi seçeneğidir.
Lonafarnib ve nükleik asid polimerlerine (NAP) yönelik faz çalışmaları devam etmektedir. Faz 2 ve faz 3 çalışmalarında ortaya çıkan gastrointestinal yan etki sıklığı, doz azaltımı ve/veya tedaviye ara verme gerekliliği gibi durumlar lonafarnib için kullanımı sınırlamaktadır; pegile interferon lambda (PEG IFNλ) ile yapılan bir faz 3 çalışması ise yan etkiler nedeniyle sonlandırılmıştır.
HDV ile HSK sıklığında artış gözlenmesine rağmen 6 ayda bir abdominal ultrasonografi ile tarama önerilmekte, alfa-fetoprotein istemi ise hekimin tercihine bırakılmaktadır. HDV patogenezinin daha iyi anlaşılması ile birlikte, virus yaşam döngüsünü hedefleyen ilaçların kullanımının artması ve faz çalışmalarının sürdürülmesi sayesinde, kısıtlı tedavi şansı olan kronik HDV infeksiyonu hastalarının komplikasyonlarının azaltılması mümkün olabilecektir. Bu uzlaşı raporunun, ülkemizde halen önemli bir sorun olan delta hepatitinin tanı ve tedavisine katkı sağlayacağına inanıyoruz.
GİRİŞ
İlk defa 2014 yılında Türk Klinik Mikrobiyoloji ve İnfeksiyon Hastalıkları Derneği Viral Hepatit Çalışma Grubu (VHÇG) tarafından yayımlanan kronik hepatit D virus (HDV) infeksiyonu yönetimine ilişkin uzlaşı raporunun, son yıllarda kullanıma giren ve geliştirilmekte olan yeni tedavi seçenekleri nedeniyle güncellenme ihtiyacı doğmuştur. Bu nedenle VHÇG bünyesinde bir çalışma alt grubu oluşturulmuş; güncel literatür ve uluslararası kanıta dayalı rehberler gözden geçirilerek yeni bir uzlaşı raporu hazırlanmıştır.
Hepatit B yüzey antijeni (HBsAg) pozitif bireylerde HDV prevalansının küresel olarak %4.5-14.6 arasında değiştiği tahmin edilmektedir. Dünya Sağlık Örgütü (DSÖ), HBV’nin küresel yaygınlığını 296 milyon kişi olarak belirtmekte ve bu bireylerin yaklaşık %5’inin, yani 14 milyondan fazlasının HDV ile infekte olduğunu tahmin etmektedir (1,2). Ülkemizde ve tüm dünyada önemini koruyan bir hepatit virusu olan HDV özellikle hastalığın agresif seyri ile birlikte tanı ve tedavide yaşanan zorluklar nedeniyle yönetimi güç olan bir klinik tablo oluşturmaktadır. HDV patogenezinin daha iyi anlaşılması ile ilk kez HDV’ye spesifik tedavi seçenekleri gündeme gelmiştir. BLV ve lonafarnib için çalışmalar devam etmektedir.
Bu uzlaşı raporunda; HDV’nin yapısı, yaşam döngüsü, epidemiyolojisi, tarama yaklaşımları, klinik bulguları, tanı testleri, tedaviye başlama kriterleri, tedavi seçenekleri, tedavi sonlanım noktaları, tedavi alan ve almayan hastaların izleminde kullanılan göstergeler, karaciğer nakli sonrası profilaksi ve korunma stratejileri ele alınmıştır. Raporun, ülkemizde halen önemli bir sorun olan delta hepatitinin tanı ve tedavisine katkı sağlayacağına inanıyoruz.
HEPATİT D VİRUSU
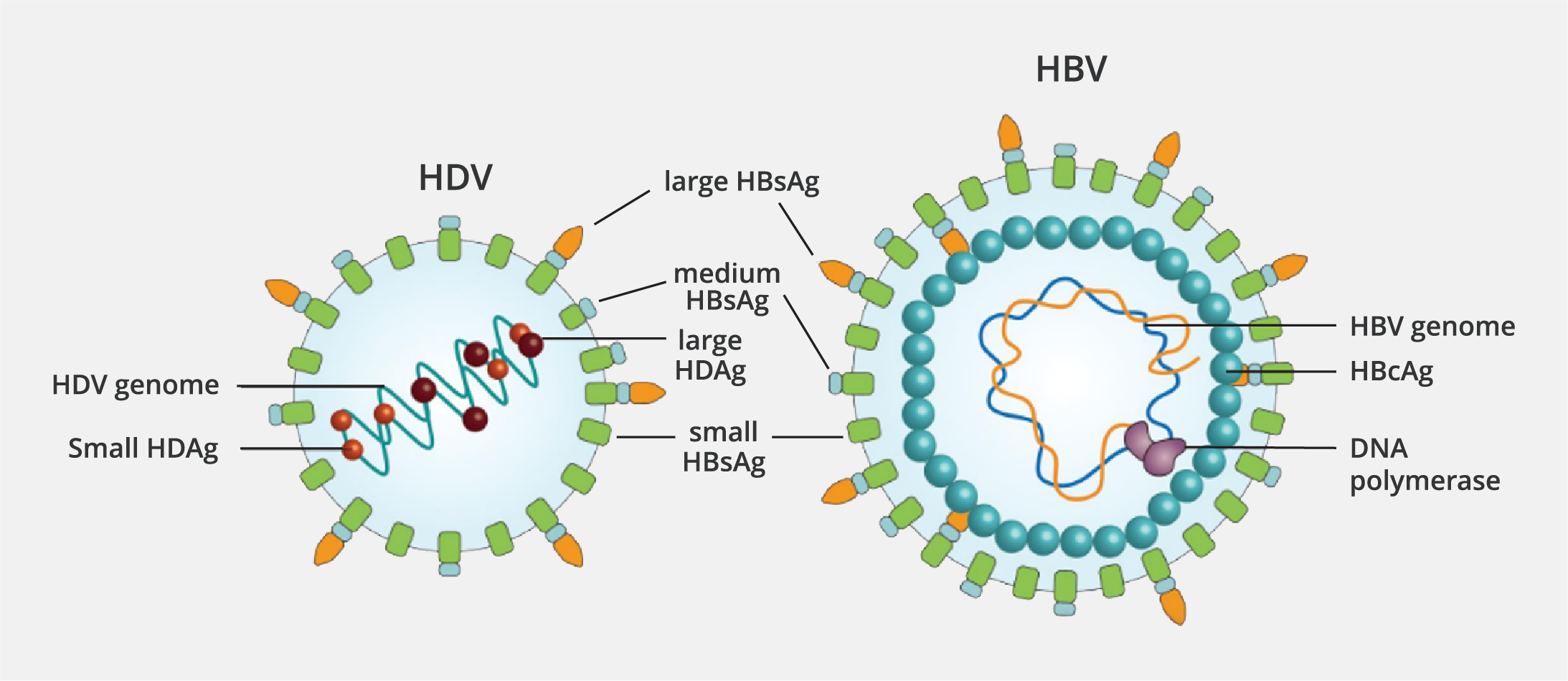
Şekil 1. Hepatit B Virusu (HBV), Küçük, Orta ve Büyük Hepatit B Yüzey Antijenlerini (HBsAg) Hepatit D Virusu (HDV) ile Paylaşır (Kaynak 4’ten alınmıştır).
Hepatit D (Delta) virusu (HDV) RNA yapısında olan ve insanlarda infeksiyona yol açtığı bilinen en küçük hepatit virusudur. Yapılan son çalışmalarda, Ribozyviria aleminin bir parçası olan Kolmioviridae ailesinin Deltavirus cinsinde sınıflandırılması önerilmektedir (1). HDV infeksiyonuna, yapısal olarak kusurlu bir virus neden olur. HDV otonom olarak çoğalabilme kapasitesine sahip olmakla birlikte, viryon oluşumu ve salgılanmasının tamamlanması için hepatit B virusu (HBV)’nun eş zamanlı varlığı gereklidir. HDV, yaklaşık 1700 nükleotidden oluşan negatif polariteli, tek sarmallı bir RNA genomuna sahiptir. HDV viryonu; bir RNA genomu, HDV tarafından kodlanan tek bir antijen (hepatit D antijeni – HDAg) ve HBV tarafından sağlanan bir lipoprotein zarf olmak üzere üç temel bileşenden oluşur. HDV ile ilişkili tek antijen olan HDAg, viryonun yapısal bir bileşenidir. Her bir HDV RNA molekülü, yaklaşık 70 HDAg molekülü ile kompleks oluşturarak viral ribonükleoprotein yapısını meydana getirir. HBV ve HDV’nin yapısal özellikleri Şekil 1’de sunulmuştur (2). HDAg’nin iki formu, infekte bireylerde birlikte eksprese edilir: küçük form (S-HDAg) ve büyük form (L-HDAg). Replikasyon için gerekli olan S-HDAg, konak hücre RNA polimeraz II aracılığıyla açık okuma çerçevesinin (ORF) transkripsiyonu yoluyla üretilir. Transkripsiyon sırasında, adenozin deaminaz-1 aracılığıyla bir durdurma kodonunun kodlayıcı triptofana dönüştürülmesi sonucu L-HDAg formu oluşur ve böylece antijen dizisi yaklaşık 19 amino asite kadar uzar. L-HDAg’nin uzatılmış bölgesinde bulunan prenilasyon bölgesi, HDV’nin viryon birleştirme işleminin bir gereği olarak antijenin farnesilasyona uğramasına olanak sağlar. Bu bölgedeki bozulma, L-HDAg’nin HBsAg ile etkileşime girmesini veya salgılanan parçacıklar oluşturmasını engeller (1,2). HDV’nin lipoprotein zarfı HBV kaynaklıdır ve HBV viryonlarında da bulunan üç yüzey proteininden (büyük – L, orta – M ve küçük – S) oluşur. Bu proteinlerin göreli oranları, HBV replikasyon düzeyine bağlı olarak değişiklik gösterebilir. HDV infeksiyonu her zaman HBV ile birlikte, yani koinfeksiyon veya süperinfeksiyon şeklinde görülür. HDV ile infekte bireylerde, HBV replikasyonu tam olarak bilinmeyen bir mekanizma ile baskılanırken, HDV hepatositlerde çok yüksek düzeylerde çoğalabilir (2).
Yaşam Döngüsü
HBV’nin konağa girişte kullandığı reseptör olan sodyum taurokolat ile birlikte taşınan polipeptit (NTCP), HDV için de giriş reseptörü olarak tanımlanmıştır. HDV’nin yaşam döngüsünde ilk adım, viryonun HBsAg içeren zarf yapısının, hücre yüzeyinde bulunan NTCP’nin dış halkalarına bağlanmasıdır. Bu transmembran protein, safra asitlerinin hücre içine alınmasını sağlayarak dolaşımdan uzaklaştırılmasına aracılık eder. NTCP ile bağlanma endositoza yol açar ve böylece ribonükleoprotein (RNP) kompleksinin hepatosit sitoplazmasına girmesi mümkün olur. Ardından, HDV RNP kompleksi çekirdeğe taşınır; burada HDAg mRNA’nın transkripsiyonu ve HDV RNA replikasyonu gerçekleşir. L-HDAg, çekirdeğe yeniden taşınmadan önce hücresel bir farnesiltransferaz enzimi tarafından farnesilasyona uğrar. S- ve L-HDAg, sitoplazmaya aktarılan yeni sentezlenmiş genomik RNA ile etkileşime girerek viral RNP komplekslerini oluşturur. Bu RNP’ler, endoplazmik retikulum yüzeyinde bulunan HBsAg’nin sitozolik kısmı ile etkileşerek zarflanır. Bunu takiben HDV viryonları hepatositten salgılanarak yaşam döngüsünü tamamlar (3).
Epidemiyoloji
HDV antijeni 1977 yılında keşfedilmiştir. O tarihten bu yana yapılan çalışmalar, kronik HDV infeksiyonunun viral hepatitin en şiddetli formunu oluşturduğunu ortaya koymuştur. HBV ile monoinfekte hastalarla karşılaştırıldığında, HBV-HDV koinfeksiyonu olan hastalarda ilerleyici fibroz, siroz ve hepatoselüler karsinom (HSK) gelişme riski daha yüksektir. HDV, karaciğer hastalığı yüküne önemli düzeyde katkıda bulunmakta olup HBV infeksiyonu olanlarda sirozun %18’inden ve HSK’nin %20’sinden sorumlu olduğu tahmin edilmektedir (3,5,6). Dünya Sağlık Örgütü (DSÖ), HBV’nin küresel yaygınlığının 296 milyon olduğunu ve bunların tahminen %5’inin veya 14 milyondan fazlasının HDV ile infekte olduğunu bildirmiştir (7). Uyuşturucu kullanan bireyler, geçmişte birden fazla kan nakli yapılmış olanlar, güvenli olmayan cinsel davranışlarda bulunanlar, erkeklerle seks yapan erkekler ve HDV infeksiyonu prevalansının yüksek olduğu ülkelerden göç etmiş bireyler HDV için riskli gruplardır. HDV epidemiyolojisi ile ilgili mevcut veriler, büyük oranda süperinfeksiyon geçirmiş, yani kronik HBV infeksiyonu üzerine kronik HDV infeksiyonu gelişmiş hastalardan elde edilmiştir. Bu hastalarda anti-HDV antikor düzeyleri yüksek olduğundan, kronik HDV infeksiyonunun prevalansı güvenilir bir şekilde belirlenebilmektedir (2). HDV prevalansında gözlenen geniş coğrafi farklılıklar; bulaşma yollarındaki çeşitlilik, hijyenik ve sosyoekonomik koşullar, HBV aşılamasının yaygınlığı ve zamanlaması, göç hareketleri ve ayrıca HDV heterojenliği (HDV genotiplerinin virülansındaki farklılıklar veya genetik duyarlılık) gibi faktörlerden kaynaklanmaktadır (1). HDV’nin dünya genelinde dağılımı eşit değildir ve HDV infeksiyonunun coğrafi dağılımı da HBV ile paralellik göstermemektedir. Akdeniz Havzası, Moğolistan, Moldova ve Sahra Altı Afrika’daki bazı ülkelerde yüksek HDV prevalans bildirilirken, HBV infeksiyonunun yaygın olduğu pekçok Asya ülkesi de dahil olmak üzere diğer bölgeler HDV açısından daha düşük risklidir (2).
HBsAg pozitif bireylerde HDV prevalansı küresel ölçekte %4.5 ile 14.6 arasında değişmektedir (6,8). Yakın tarihli, popülasyona göre uyarlanmış bir çalışmada; coğrafi dağılım, hastalık evresi ve özel popülasyonlara göre yapılan düzeltmeler sonrasında HBsAg pozitif bireyler arasında HDV prevalansı %2.2 olarak hesaplanmıştır (9). Türkiye’de yapılan bir çalışmada, HDV prevalansı üç farklı zaman diliminde irdelenmiş olup ilk dönem olan 1999 ve öncesinde %8.3, ikinci dönem olan 2000-2009 arasında %4.8 ve üçüncü dönem olan 2010 ve sonrasında %5.5 olarak hesaplanmıştır (10). Yapılan bir diğer çalışmada, HBsAg pozitif bireylerde prevalans ülkemizin batısında %1.8-6.8, Doğu ve Güneydoğu’da %4-19.5 ve İç Anadolu’da ise %1-4.2 olarak bildirilmiştir (11).
Hastalık, HDV yönünden düşük prevalansa sahip ülkelerde dahi göç hareketleri nedeniyle artış göstermektedir. Öte yandan, damar içi uyuşturucu kullanan bireyler, özellikle “human immune deficiency virus” (HIV) ile koinfekte olanlar, HDV açısından yüksek riskli gruplardır. HDV/HIV koinfeksiyonuna ilişkin prevalans dünya genelinde %5-10.6, Kuzey Amerika ve Avrupa’da %6-14, Asya ve Afrika’da %10-20 olarak bildirilmiştir (12,13). Soriano ve arkadaşlarının (14) Avrupa’daki 16 597 HIV hastasını kapsayan çalışmalarında, 1319 (%7.9) hastada HBsAg pozitifliği saptanmıştır. Aynı çalışmada, kronik HBV infeksiyonu ve HIV koinfeksiyonu olan hastaların 422 (%14.5)’sinde HDV pozitifliği de saptanmıştır. Yapılan bir çalışmada, parayla seks yapan kadınlar arasındaki HBsAg pozitif bireylerde HDV prevalansı damar içi ilaç kullananlarda %21 iken damar içi olmayan yolla ilaç kullananlarda ise %6 olarak tespit edilmiştir. Yine aynı çalışmada, mahkûm hastalar arasında damar içi ilaç kullanımının HBV ve HDV belirteçlerinin saptanmasında en güçlü risk faktörü olduğu bildirilmiştir (15).
Genotipler
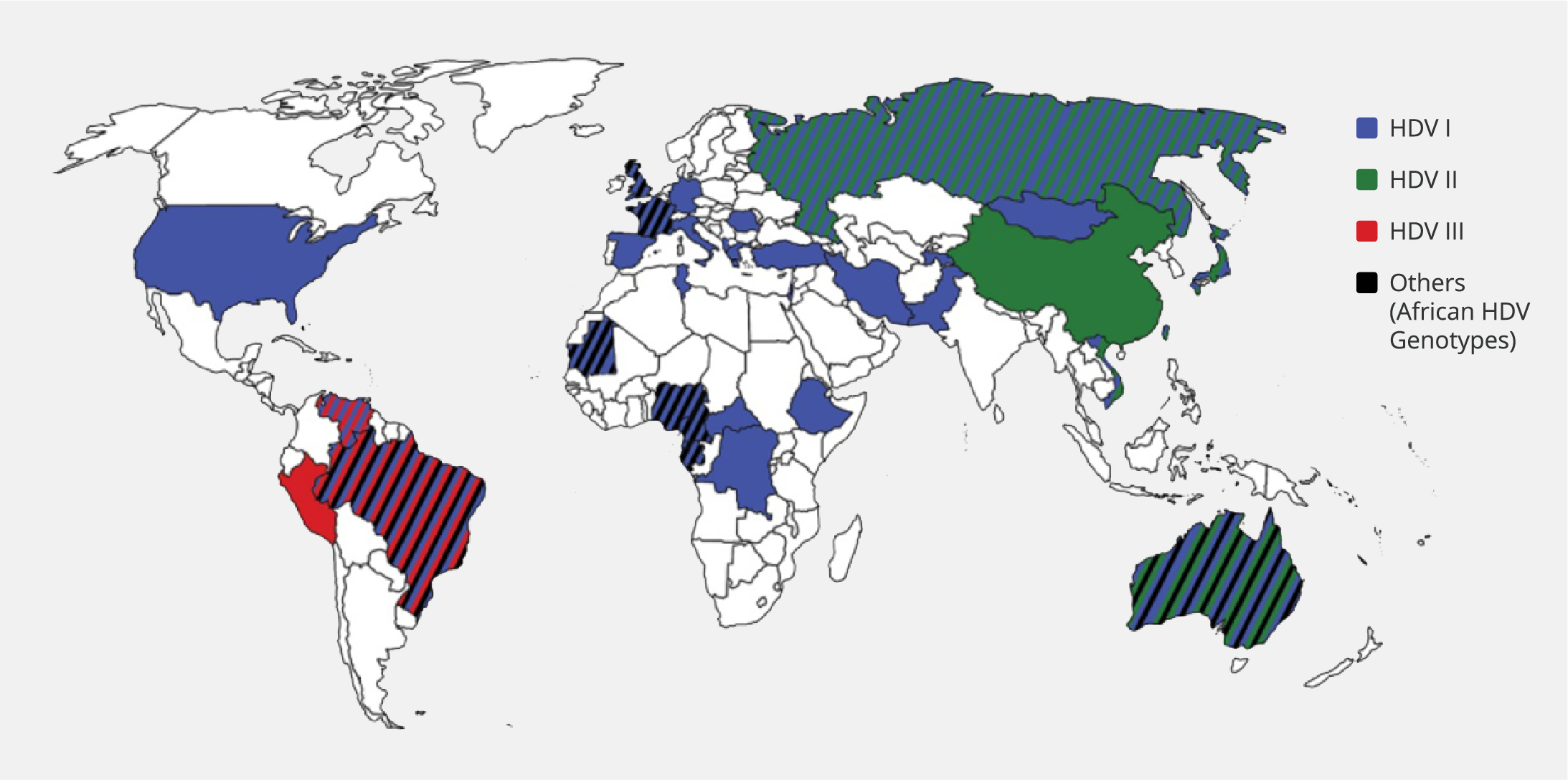
HDV genetik olarak birbirinden farklı sekiz ayrı genotipe sahiptir. Bu genotipler, aralarında yaklaşık %35 oranında sekans farklılığı gösterirler ve her biri iki ila dört alt tip içerebilir. Coğrafi bir bölgede baskın olan genotip, hem genotipler arasındaki hem de genotip içindeki genetik çeşitliliğe bağlı olarak değişiklik gösterebilir.
Genotip 1, dünya genelinde en yaygın olandır ve Avrupa ve Kuzey Amerika’da baskındır. Türkiye’de de en sık saptanan HDV genotipi genotip 1’dir. Genotip 2, Asya ve Orta Doğu’da yaygındır. Genotip 1 ile karşılaştırıldığında genotip 2’nin hastalık şiddeti daha düşüktür. Genotip 3 ciddi karaciğer hastalığıyla ilişkililendirilmiştir ve Amazon Havzası’nda bulunur. Genetik açıdan diğer genotiplerden en fazla farklılık gösteren tiptir. Genotip 4, Tayvan ve Çin’de tespit edilmiştir. Genotip 5, 6, 7 ve 8 Afrika kıtasında, özellikle Batı Afrika’da görülmektedir. Ancak son yıllarda, genotip 5, 6 ve 7’nin Avrupa’da da saptandığı bildirilmiştir (4,11).
Sonuç olarak; HDV genotip 1 küresel bir dağılım gösterirken, genotip 2 esas olarak Doğu Asya’da, genotip 3 yalnızca Güney Amerika’da ve Afrika genotipleri (5–8) çoğunlukla Batı Afrika ile sınırlıdır (16) (Şekil 2).
Tarama
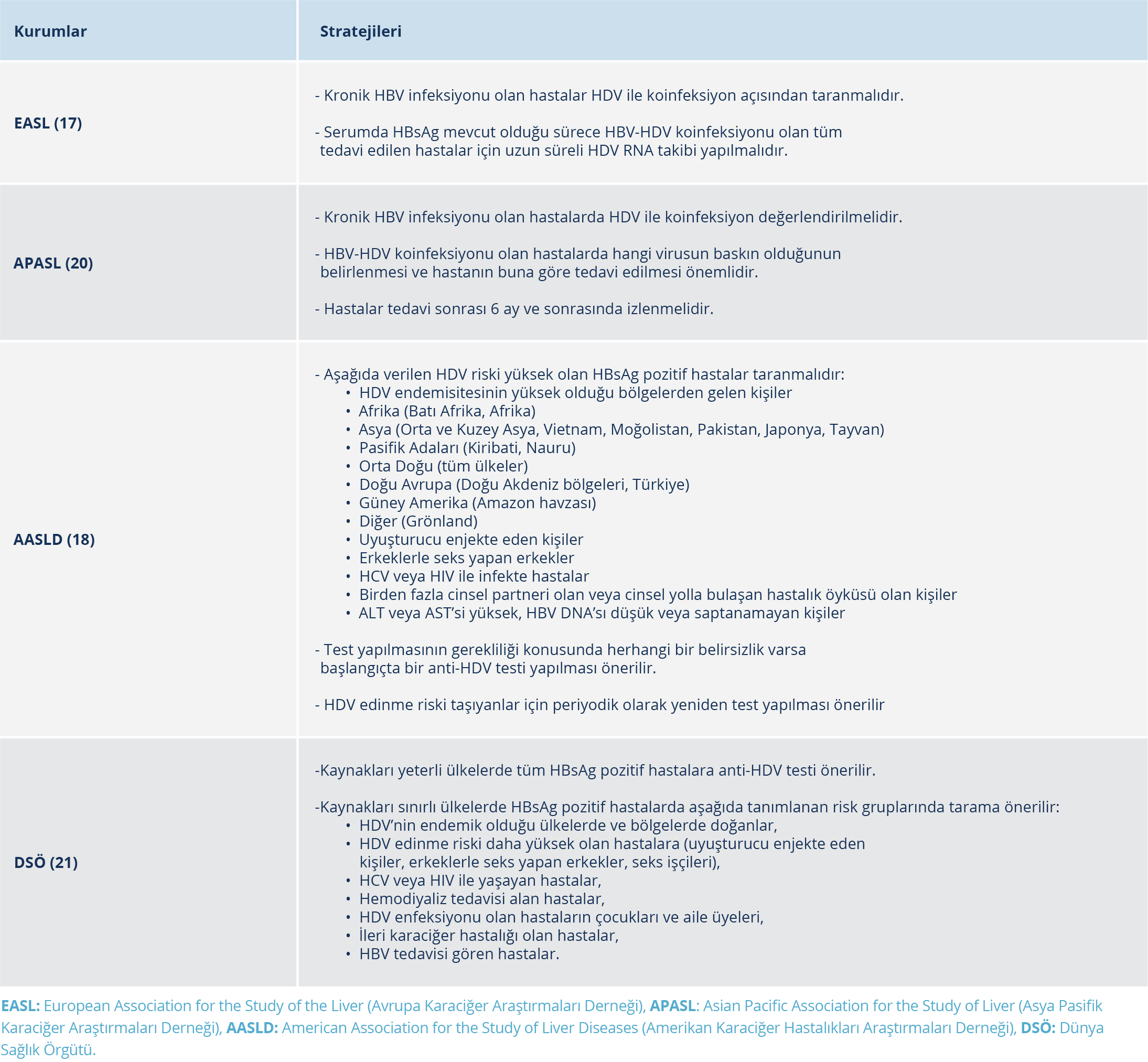
Avrupa Karaciğer Araştırmaları Derneği (The European Association for the Study of the Liver – EASL) ve Asya Pasifik Karaciğer Araştırmaları Derneği (Asian Pacific Association for the Study of Liver – APASL), tüm HBsAg pozitif hastalar için HDV taramasını önerirken, Amerikan Karaciğer Hastalıkları Araştırmaları Derneği (The American Association for the Study of Liver Diseases – AASLD) yalnızca risk bazlı tarama önermektedir. Dünya Sağlık Örgütü ise ülkelerin kaynaklarına göre farklılaştırılmış bir yaklaşım benimsemektedir: kaynakların yeterli olduğu bölgelerde tüm HBsAg pozitif hastaların taranması tavsiye edilirken kaynakların sınırlı olduğu bölgelerde risk bazlı tarama yapılabileceği bildirilmiştir. Ancak hastaların tamamının taranmasının önünde bazı engeller bulunmaktadır; sağlık çalışanlarının HDV hakkındaki bilgi ve farkındalık eksikliği, HDV tanı testlerine erişimdeki kısıtlılıklar ve HDV RNA testlerinin standardizasyon eksikliği en önemli engellerdir.
HDV’nin küresel epidemiyolojik değerlendirmesinde karşılaşılan bir diğer önemli zorluk ülkeler arasındaki tahmin değerlerinin değişkenliğidir. Ayrıca, yapılan çalışmalarda prevalansın düşük saptanması, coğrafi heterojenite, etkin tedavi olmayışı tarama stratejilerinin önündeki bir diğer engel olarak görünmektedir (1,4,17,18-21).
Yapılan son çalışmalar, riske dayalı tarama yapılmasının çok sayıda HDV olgusunun gözden kaçmasına neden olduğunu ortaya koymuştur. Ayrıca, HDV taramasının önerildiği ülkelerde bile, HBsAg pozitif hastaların yalnızca küçük bir bölümüne anti-HDV testi uygulandığı gösterilmiştir. Bu durum bize HBsAg pozitif hastalarda HDV taramasının yapılması konusunda farkındalığın artırılması gerektiğini göstermektedir.
Sonuç olarak, HBsAg pozitif hastalarda HDV süperinfeksiyonu riski göz önünde bulundurularak aşağıdaki gruplarda taramanın tekrar edilmesi önerilmektedir (1):
- Yüksek riskli davranış öyküsü olanlar,
- HDV prevalansının yüksek olduğu ülkelerde veya topluluklarda yaşayanlar,
- Nedeni açıklanamayan aminotransferaz alevlenmeleri ya da karaciğer hastalığı dekompansasyonu gelişenler.
- HDV tarama stratejileri Tablo 1’de sunulmuştur (4).
Öneriler
- HBsAg pozitif hastaların tamamı, en az bir kez anti-HDV antikoru açısından taranmalıdır.
- HBsAg pozitif hastalar için anti-HDV antikoru klinik olarak endike olan durumlarda veya risk durumuna göre yıllık olarak istenebilir.
KLİNİK SEYİR
Akut HBV-HDV koinfeksiyonu, HBV infeksiyonuna duyarlı bireylerde görülebilir. Klinik olarak klasik akut HBV infeksiyonundan ayırt edilemez; genellikle kendi kendini sınırlayan geçici bir infeksiyondur. Bu hastaların %90’ından fazlası hem HBV hem de HDV infeksiyonunu spontan olarak elimine eder. Ancak akut HBV-HDV infeksiyonu, akut HBV monoinfeksiyonundan daha yüksek oranda akut karaciğer yetmezliği riski ile ilişkilidir.
HDV infeksiyonunun kalıcı hale gelmesi, HBV infeksiyonunun kalıcılığına bağlıdır. Süperinfeksiyon, kronik HBV infeksiyonu olan bireylerde HDV infeksiyonu olarak ortaya çıkar. Bu durum, daha önce fark edilmemiş bir HBV taşıyıcısında, ciddi bir akut hepatit olarak ya da mevcut kronik HBV infeksiyonun alevlenmesi şeklinde ortaya çıkabilir. Hastaların %80’inden fazlasında kronik HDV infeksiyonu gelişir. Klinik tablo bu hastalarda spesifik olmayan semptomlarla ortaya çıkabildiği gibi, asemptomatik de olabilir. Hastaların çoğunda HDV replikasyonu HBV replikasyonunu baskılar. Her iki virusun da benzer düzeyde replikasyon gösterdiği veya daha nadir bir şekilde HBV replikasyonunun baskın olduğu durumlar da görülebilir (4). Akut HDV infeksiyonu, 3-7 haftalık bir kuluçka döneminin ardından ortaya çıkar; klinik belirtiler bulantı, yorgunluk, anoreksi ve spesifik olmayan grip benzeri semptomlardır. Akut HBV-HDV infeksiyonundan ayırt edilmesi zor olmakla birlikte serolojik testler ile bu ayrım yapılabilir (4, 22).
Kronik HDV infeksiyonu genel olarak sirozun hızla ilerlemesi ve HSK riskinin artmasıyla ilişkilidir. HBV monoinfeksiyonu ile karşılaştırıldığında, hastalardaki siroza doğru ilerleme daha hızlıdır (23). Kronik HDV infeksiyonunda HSK riskinde artış görülmekle birlikte klinik seyir değişiklik gösterebilir ve bazı hastalarda HDV ile ilişkili kronik karaciğer hastalığı yavaş bir seyir izler. Klinik seyir, kalıcı HDV replikasyonu ve HDV genotipi gibi çeşitli faktörlerden etkilenmektedir (1). HDV ile infekte hastalarda; erkek cinsiyet, kronik infeksiyon/karaciğer hastalığı ve antiviral tedavi eksikliği, düşük albümin, ileri yaş, yüksek gamma-glutamil transferaz (GGT) ve düşük kolinesteraz ilerlemiş fibroz/siroz ile ilişkilidir (24).
Kronik HDV infeksiyonunda uzun vadeli sonuçları belirleyen faktörlerin değerlendirmesini amaçlayan geniş prospektif çalışmalar mevcut değildir, ancak kohort çalışmalarında, HDV ve HBV infeksiyonunun farklı profillerinin, karaciğer hastalığının aktivitesinin, evresinin, hasta demografik özelliklerinin, koinfeksiyonların ve kofaktörlerin hastalığın sonuçları ve mortalite üzerinde etkili olduğu gösterilmiştir (1). Devam eden HDV viremisi olan hastalar ile viremik olmayan hastaların karşılaştırıldığında bir çalışmada, viremik hastalarda siroz gelişme riskinin daha yüksek olduğu bildirilmiştir (25). HDV genotipleri ve hastanın doğum yeri de hastalığın şiddetini belirleyen faktörler arasındadır. Genotip 1 ve 3 daha kötü seyire neden olurken, genotip 5 Afrika kökenli hastalarda daha iyi seyir ve interferona iyi yanıt ile ilişkilidir; ancak aynı durum genotip 5 ile infekte Avrupa’lı hastalarda gözlenmemiş olup genotip 5 bu hastalarda kötü seyirle ilişkilendirilmiştir (9,25,26). Altta yatan HBV viremisi ve HIV, HCV gibi koinfeksiyonların varlığının hastalığın daha agresif seyretmesine neden olduğunu gösteren çalışmalar da mevcuttur (1,27-29). Ayrıca, yüksek aminotransferaz ve yüksek GGT düzeyi (dismetabolik sendromla ilişkilendirilebilir) siroz riskini artıran faktörler olarak tespit edilmiştir. Yüksek GGT düzeyi, özellikle yağlı karaciğer, obezite ve diyabet gibi komorbiditeleri olan HDV hastalarında sık görülmektedir; bu da kofaktörlerin yönetiminin, siroza ilerlemenin önlenmesinde önemli rol oynayabileceğini göstermektedir (25,30-32).
Öneriler
Kronik HDV infeksiyonu olan hastalarda, aminotransferaz ve GGT düzeylerinde artış, HDV viremisinin kalıcılığı, yüksek serum HBV DNA düzeyleri, viral koinfeksiyonlar, alkol kullanımı, obezite, diyabet varlığı gibi kofaktörler kronik karaciğer hastalığının ilerleme riskini artırmaktadır.
TANI
HBV-HDV Koinfeksiyonunda Tanı
Akut HBV infeksiyonu olan hastalarda, alışılmadık derecede şiddetli veya uzun süreli hepatit tablosu ile başvuran ve HDV için risk faktörleri taşıyan bireylerde HDV koinfeksiyonu açısından test yapılmalıdır. Akut HBV-HDV koinfeksiyonu yönünden değerlendirilen hastalarda HBsAg, anti-HBc IgM, serum HDV RNA ve HDV antikoru test edilmelidir. Akut HBV infeksiyonunda HBsAg pozitiftir ve anti-HBc IgM titreleri yüksektir. HDV koinfeksiyonu olan hastalarda, serum HDV RNA’sı genellikle başvuru sırasında pozitif saptanırken anti-HDV testi genel olarak negatiftir. HDV RNA testi mevcut değilse, anti-HDV serokonversiyonunu belgelemek amacıyla anti-HDV (total veya IgM) testi tekrarlanmalıdır. HBV replikasyon belirteçleri, HDV’ye ait belirteçlerden önce ya da sonra ortaya çıkabilir (2).
HDV Süperinfeksiyonunda Tanı
Etiyolojisi bilinmeyen akut hepatiti olan kronik HBV hastaları, HDV süperinfeksiyonu açısından değerlendirilmelidir. Bu hastalara serum HDV RNA ve anti-HDV testleri yapılmalıdır. Daha önce tanımlanmamış kronik HBV infeksiyonu olan bireylerde, kişinin HDV süperinfeksiyonuna mı, yoksa HDV koinfeksiyonuna mı sahip olduğunu belirlemek zor olabilir. HBsAg her iki durumda da mevcuttur ancak akut HDV süperinfeksiyonunda anti-HBc IgM negatif olmalıdır. HDV süperinfeksiyonu, HBV replikasyonunun geçici olarak baskılanmasına neden olabilir ve bu durum çok düşük ya da nadiren saptanamayan HBsAg düzeyleri ile sonuçlanabilir.
HDV’ye karşı IgM antikorları, semptomların başlamasından yaklaşık 2-4 hafta sonra serumda tespit edilebilir ve genellikle akut infeksiyondan 2 ay sonra kaybolurlar. Bununla birlikte kronik HDV infeksiyonunda alevlenmeler sırasında IgM düzeyleri yükselebilir; bu nedenle anti-HDV IgM düzeyleri akut ve kronik infeksiyon arasında ayrım yapmak için kullanılamaz (4).
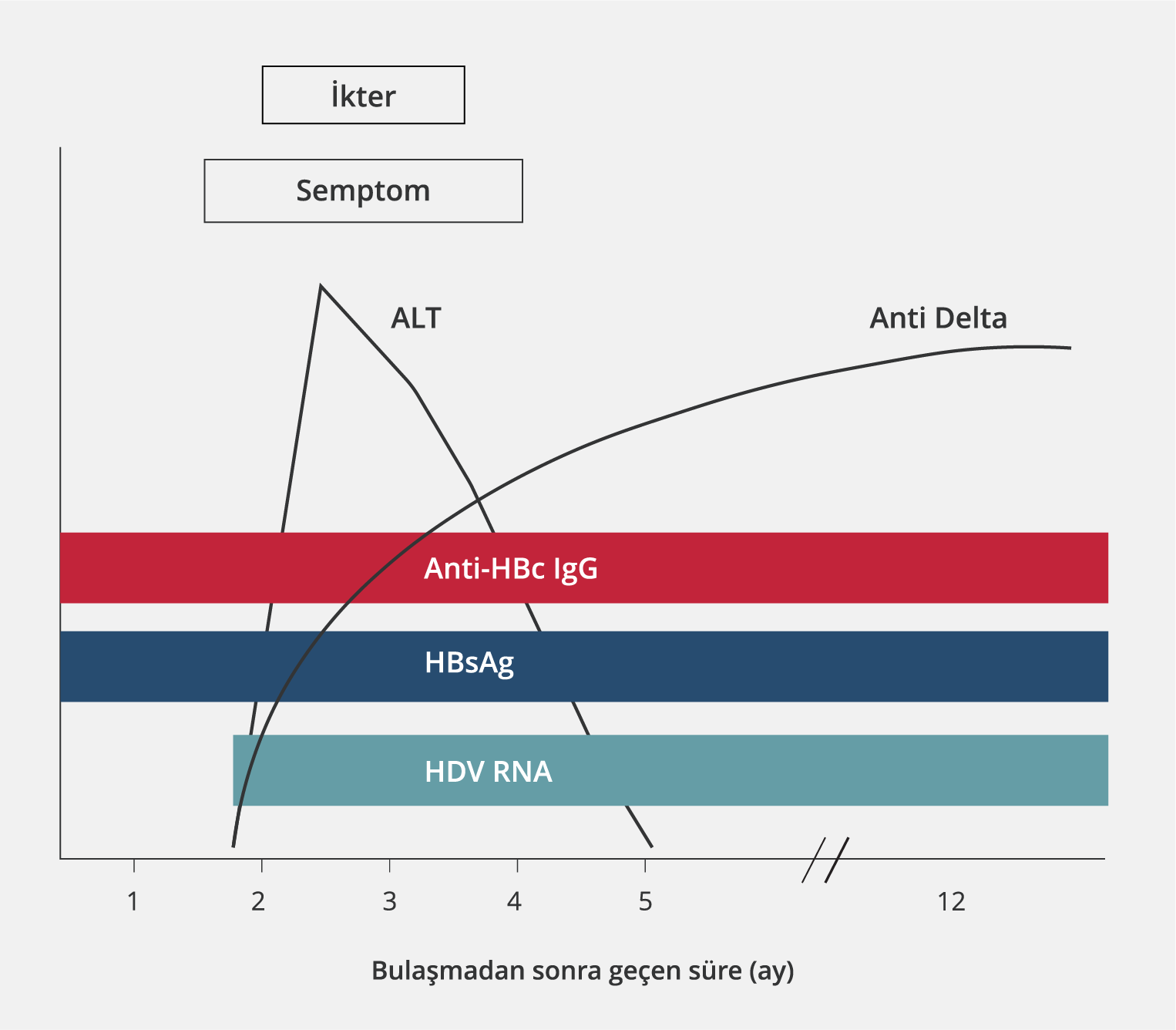
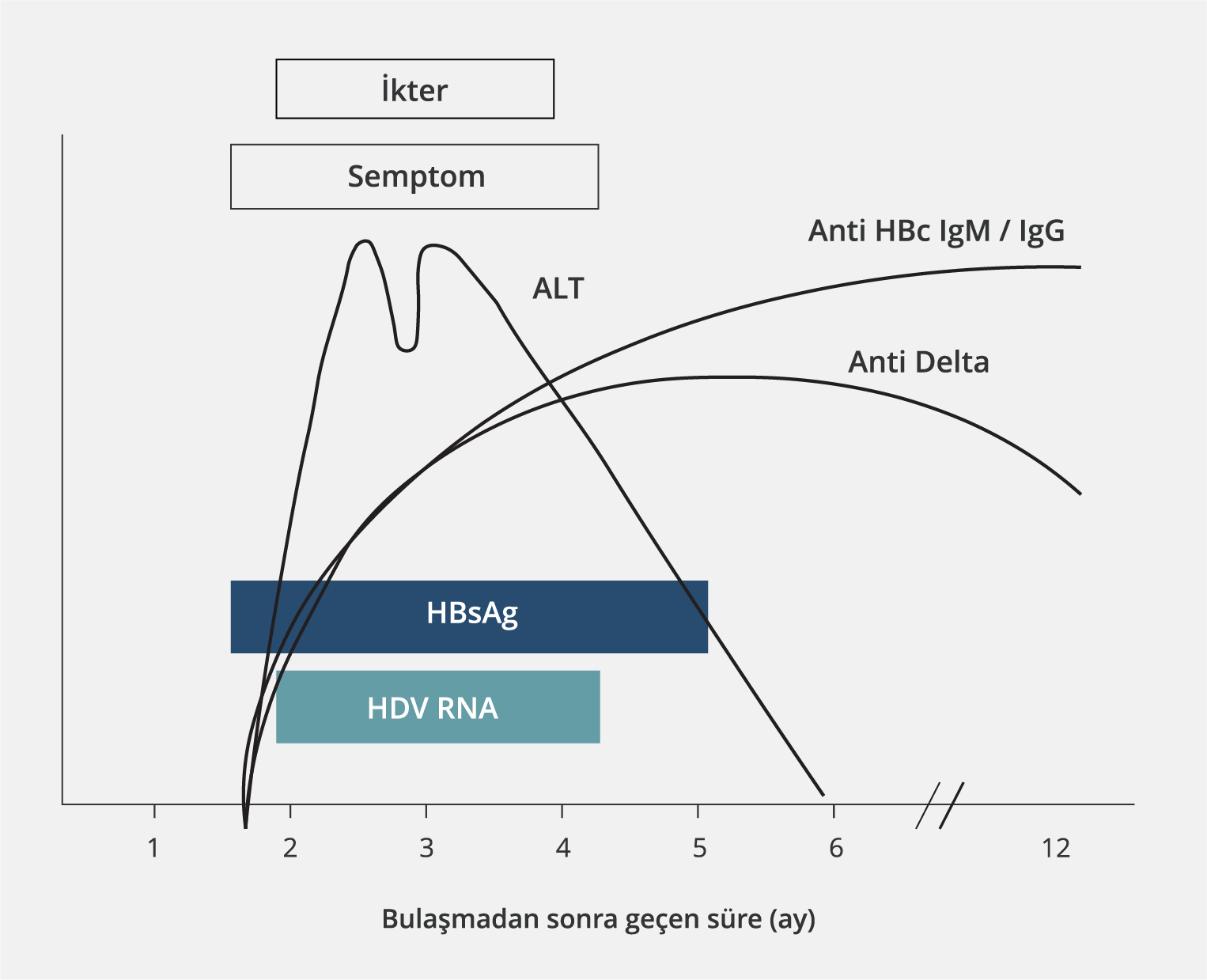
HDV ve HBV’nin serolojik paternlerinin değerlendirilmesi, süperinfeksiyonu koinfeksiyondan ayırt edebilir; prognoz ve tedavi açısından önemlidir. Akut HBV-HDV koinfeksiyonu olan hastalarda olduğu gibi, akut HDV süperinfeksiyonu olan hastaların da başvuruları sırasında serumlarında genellikle saptanabilir düzeyde HDV RNA bulunur. Bununla birlikte, akut koinfeksiyonun aksine, akut HDV süperinfeksiyonu, serumda HDV RNA’nın kalıcı olarak saptanması ve hızla artan anti-HDV titreleri (total ve IgM) ile karakterizedir (2). Anti-HDV IgM antikor serum düzeyleri, HDV’ye bağlı inflamasyon ve biyokimyasal hastalık aktivitesiyle ilişkilidir. Ancak karaciğer hastalığının evresi ile HDV RNA düzeyleri arasında doğrudan bir ilişki yoktur (2). HDV süperinfeksiyonu ve koinfeksiyonuna ait serolojik profillerin seyri Tablo 2, Şekil 3 ve Şekil 4’te sunulmuştur (35).
Kronik HDV İnfeksiyonunda Tanı
Kronik HDV infeksiyonunda tanı sıklıkla anti-HDV IgM ile ilişkili yüksek anti-HDV IgG düzeylerinin ve serum HDV RNA’nı saptanmasıyla konur. Aktif HBV infeksiyonunun varlığı hem HDV infeksiyonunun sonucu hem de hastalık seyri üzerinde kritik bir etkiye sahip olduğundan HBV infeksiyonunun doğru bir şekilde tanımlanması gerekir. HBV e antijeni (HBeAg)/anti-HBe durumu ve HBV DNA kantitasyonu yapılmalıdır. Özellikle HBeAg pozitif olan kronik HDV infeksiyonu olan hastaların serumunda HDV RNA ve HBV DNA’da dalgalanmalar olduğu gösterilmiştir. Bu nedenle hem HBeAg durumu hem de HBV DNA, özellikle takip sırasında yeniden test edilmelidir (1,33,34).
Tanı Testleri
HDV infeksiyonunun tanısı, anti-HDV antikorlarının (IgG ve IgM) saptanmasına ve HDV RNA miktarının belirlenmesine dayanır. Anti-HDV serolojisine yönelik birçok test, tanısal performans (duyarlılık ve özgüllük) açısından önemli farklılıklar göstermektedir (36). HDV RNA, ters transkripsiyon polimeraz zincir reaksiyonu (RT-PCR) temelli analizlerle serumda tespit edilebilir. RT-PCR analizleri çok hassastır ve mL başına 10 genom kadar düşük viral yükleri tespit edebilir (2). Bununla birlikte, farklı HDV izolatlarının geniş dizilimsel heterojenliği, HDV genomunda yalnızca sınırlı sayıda korunmuş bölge mevcut olduğundan, HDV RNA’nın amplifikasyonu için uygun primer seçilimini zorlaştırmaktadır. Ayrıca, HDV RNA’nın ikincil ve üçüncül yapısı, yüksek oranda korunmuş bölgelerde bile etkili amplifikasyonu engelleyebilir (2). Aynı kit kullanılsa bile farklı ekstraksiyon yöntemleri aynı analizde farklı sonuçlara yol açabilir (36). Tüm HDV genotiplerini kapsayan kantitatif HDV RNA değerlendirmesi için güvenilir testlerin yanı sıra, tam otomatik analizlere duyulan ihtiyaç yalnızca HDV tanısı için değil, aynı zamanda antiviral tedavinin tüm sonlanım noktalarının izlenmesi açısından da önemlidir. Tanı için tek bir HDV RNA ölçümü yeterli değildir; testin tekrarlanması gerekir ve testlerin 3-6 ay aralıklarla yapılması önerilir (33,37).
En iyi test verimliliği, HDAg’yi kodlayan bölgenin C-terminal yarısının amplifikasyonu ile elde edilmektedir. HDV infeksiyonu olan hastaların tedavi öncesinde ve sırasında serumda HDV RNA düzeyinin ölçümüne olanak sağlayan otomatik testler ticari olarak mevcut olsa da (33,38), bunların hiçbiri Amerika Birleşik Devletleri Gıda ve İlaç Dairesi (U.S. Food and Drug Administration (Amerika Birleşik Devletleri Gıda ve İlaç Dairesi – FDA) tarafından klinik kullanım için onaylanmamıştır ve bu testlerin performansı değişkendir. Ayrıca numune çıkarma ve işleme prosedürlerindeki farklılıklar da HDV RNA testinin doğruluğunu etkileyebilir. Birçok laboratuvar, şirket içi kitler kullanmakta olup örnek hacmi, manuel uygulama gibi teknik değişkenler HDV RNA ölçüm sürecini etkileyebilmektedir. Otomatik ekstraksiyon, dahili kontrol, kantifikasyon standardı, amplifikasyonda kullanılan cihazlar ile primer ve prob dizileri gibi birçok teknik değişken nedeniyle PCR ile kantitasyonda halen standardizasyon sağlanamamıştır (36). Dünya Sağlık Örgütü’nün HDV RNA’ya yönelik uluslararası standardı HDV genotip 1-pozitif plazmadan elde edilirken, HDV genotip 2–8 için henüz uluslararası standart bulunmamaktadır (36). HDV RNA kantitasyon sonucu İÜ/ml cinsinden raporlanmalıdır (1). HDV genotiplemesi doğrudan dizileme yöntemiyle yapılabilir; ancak klinik önemi belirsiz olduğundan bu test rutin olarak önerilmez (2).
Total (IgM ve IgG) anti-HDV antikorları, enzim immünoassay (EIA) veya radyoimmünoassay (RIA) ile tespit edilebilir. Akut HDV infeksiyonunda total anti-HDV antikoru genellikle dört haftalık süreç sonunda ortaya çıkar. Tekrarlanan testler yapılmadığı takdirde klinik değeri sınırlıdır. İyi belgelenmiş bir anti-HDV serokonversiyonu, diğer HDV infeksiyonu belirteçlerinin yokluğunda, akut HDV infeksiyonunu teşhis etmenin tek yolu olabilir. Ancak mevcut veriler, kronik HBV infeksiyonu gelişmeyen hastalarda anti-HDV’nin kısa ömürlü olduğunu göstermektedir. Kronik HDV infeksiyonunda, yüksek titreli IgG sınıfı anti-HDV bulunur. Bu antikor, devam eden HDV replikasyonu ile iyi korelasyon gösterir ve mevcut HDV infeksiyonunun geçirilmiş infeksiyondan ayırt edilmesine yardımcı olabilir. Akut HDV infeksiyonu kendi kendini sınırladığında, anti-HDV IgM geçicidir; ancak bu antikor bazen akut HDV infeksiyonunun tek serum belirteci olabilir (2). Anti-HDV IgM, kronik HDV infeksiyonu sırasında yüksek titrelerde bulunabilir. Bu düzeyler, HDV replikasyonu ve karaciğer hastalığının ciddiyeti ile ilişkili olmakla birlikte HDV replikasyonu en doğru şekilde serumdaki HDV RNA’nın ölçülmesiyle değerlendirilir. Anti-HDV IgM, HDV replikasyonunun doğrudan göstergesi olmadığı gibi takip için de uygun değildir (1,2).
HDAg, EIA veya RIA yöntemleriyle tespit edilebilir. Ancak bu testler nadiren kullanılır. Akut HDV infeksiyonunda serum HDAg erken ortaya çıkar; EIA ile tespiti kısa ömürlüdür. Kronik HDV infeksiyonunda ise yüksek titrelerde anti-HDV bulunmasına rağmen HDAg’nin anti-HDV ile kompleks oluşturması nedeniyle EIA ile tespiti mümkün olmayabilir. Bu koşullarda serum HDAg en iyi şekilde daha duyarlı olan immünoblot testiyle tespit edilir; bu test teknik açıdan zor olmanın yanı sıra zaman ve emek gerektirir. Histopatolojik değerlendirme için rutin olarak işlenen karaciğer biyosi materyallerinde hem HDAg hem de HDV RNA tespit edilebilir. HDAg, immünofloresan veya immünohistokimya ile doğrudan tespit edilebilir. Başlangıçta mevcut HDV infeksiyonunun tanısında “altın standart” olarak önerilmekle birlikte 10 yıl veya daha uzun süredir infekte olan hastalardan alınan karaciğer biyopsi örneklerinin yaklaşık %50’sinde HDAg sonucunun negatif olabildiği, HDV replikasyonunun zamanla azalabildiği belirtilmiştir (2).
HBV infeksiyonu tanısında ve tedavisinde kullanılan yeni biyobelirteçlerden bir olan hepatit B çekirdek antijeni (HBcrAg) düzeyinin, HDV prognozu ile ilişki olduğu saptanmıştır. Yüksek HBcrAg düzeyine sahip hastalarda hem karaciğer hasarı hem de HSK riskinin yüksek olduğu gösterilmiştir. Bu bulgular, HDV’nin patojenitesinin sürdürülebilmesi için “covalently closed circular” DNA (cccDNA)’nın da aktif bir şekilde transkripsiyonunun devam etmesi gerektiğini göstermektedir (36).
İnvaziv Olmayan Testler ve Karaciğer Biyopsisi
HDV infeksiyonu sıklıkla şiddetli seyredebildiğinden, karaciğer hastalığının evrelenmesi önemlidir. HDAg immünohistokimyası ve HDV RNA tespiti, HDV infeksiyon yükünün tahmin edilmesine katkıda bulunur; ancak bu ek testler çoğu patoloji laboratuvarında mevcut değildir. Kronik HDV infeksiyonu olan hastalarda, hastalık derecesi ve evresinin tanımı bireysel hastaların klinik-terapötik yönetiminin değiştirilmesine yardımcı olabileceğinden (örneğin görüntüleme ve kan testleri çelişkili olduğunda veya birden fazla kofaktör bulunan hastalarda) karaciğer biyopsisi yapılabilir. Karaciğer biyopsileri geleneksel olarak fibrozu değerlendirmek için kullanılmakla birlikte, invazif işlem olmaları ve komplikasyonları nedeniyle sınırlamaları olabilir. İnvaziv olmayan testler arasında serum belirteçleri (AST–trombosit oranı indeksi [APRI], fibroz indeksi 4 [FIB-4], AST / ALT oranı [AAR], yaş-trombosit indeksi [API], Göteborg Üniversitesi siroz indeksi [GUCI] ve Lok indeksi, [CDS] ve histolojik aktivite indeksi [HUI]) ile “transient” elastografi (TE) yöntemiyle yapılan karaciğer sertliği ölçümleri yer alır (4). İnvaziv olmayan testlerin avantajı, kompanse ileri kronik karaciğer hastalığının gelişmesinden önce ve sonra genel hastalık yükünün dinamik olarak izlenmesine olanak sağlamalarıdır. Dezavantajı ise çok merkezli çalışmalarla tutarlı bir şekilde doğrulanmamış olmamalarıdır. Ayrıca, yalnızca fibrozdan değil, inflamasyon ve konjesyon gibi değişkenlerden de etkilenen parametrelerin varlığı nedeniyle fibroz skoru olduğundan yüksek çıkabilir (1).
Serum fibrozu belirteçlerinin, genotip 1 hastalarında yalnızca HBV veya HCV hastalarına kıyasla daha düşük performans doğruluğuna sahip olduğu bildirilmiştir. Ancak genotip 3’te APRI ve FIB-4 skorlarının önemli fibrozu tanımlayabileceğini gösteren kanıtlar mevcuttur (4). Serum biyobelirteçleri ve TE’nin sirozu öngörmedeki eşik değerlerinin belirlenmesi için daha büyük hasta serileri içeren ve daha iyi karakterize edilmiş hasta gruplarıyla yapılan çalışmalara ihtiyaç vardır. Genel olarak, mevcut çalışmalar, TE’nin kronik delta hepatitinde sirozu dışlamada sirozu öngörmeye kıyasla daha iyi performans gösterdiğini bildirmiştir (33,38). HBV-HDV’de hepatik inflamasyonun şiddetinin artması nedeniyle hem serum belirteçleri hem de TE, fibroz skorunu olduğundan fazla tahmin edebilmektedir (39,40). Bununla birlikte, nekroinflamasyonun sertlik değerleri üzerindeki etkisi fibrozun artmasıyla birlikte azaldığından, kompanse ileri kronik karaciğer hastalığı ve klinik olarak anlamlı portal hipertansiyonu olan hastaları tanımlamak için TE’nin kullanılması daha uygundur (41). Serum biyobelirteçleri ile TE’nin birlikte kullanıldığı skorlama sistemleri, TE içermeyen sistemlerle karşılaştırıldığında sirozun öngörülmesinde umut vadetmektedir; ancak bu alanda da daha büyük hasta serileriyle yapılan çalışmalara ihtiyaç vardır (1).
Hepatoselüler Karsinom Taraması
Kronik HDV infeksiyonunda tedaviden bağımsız olarak, ilerlemiş fibroz (METAVIR F3 veya Ishak evre 4–5) veya siroz (METAVIR F4, Ishak evre 6) varlığında HSK sürveyansı her 6 ayda bir ultrasonografi ile yapılmalıdır. HBV-HDV koinfekte hastalarda HSK gelişme riski HBV monoinfekte hastalara göre daha yüksektir. Yapılan bir meta-analizde, HDV koinfeksiyonu HBV monoinfeksiyonu ile karşılaştırıldığında, HSK riskini iki kat artırdığı gösterilmiştir (29). Siroz, hem kronik hepatit B hem de C infeksiyonunda hepatokarsinogenez için önemli bir risk faktörü olmasına rağmen, bu ilişki kronik delta virus hepatitinde kesin olarak gösterilememiştir. Hepatoselüler karsinom yönetimi ile ilgili olarak EASL, karaciğer hastalığının etiyolojisinden bağımsız biçimde, sirotik olmayan evre 3 fibrozlu hastalar ile kronik HBV infeksiyonu olan ve PAGE-B (Platelet, Age, Gender – HBV) skoru >10 olan sirotik olmayan hastalarda, bireysel değerlendirmeye dayalı HSK sürveyansını düşük kanıt düzeyinde önermektedir. Sirotik olmayan kronik HDV infeksiyonu olan hastalarda HSK insidansına ilişkin yeterli veri bulunmamakla birlikte, köprüleşme fibrozu olan olgularda ve özellikle alkol, tütün kullanımı, obezite, aflatoksin maruziyeti, HIV ve HCV koinfeksiyonu ile aile öyküsü gibi diğer HSK için ek risk faktörleri mevcutsa HSK sürveyansı önerilmesi makul görünmektedir. HIV, HCV koinfeksiyonu veya HBV-HDV-HCV üçlü infeksiyonu, artmış HSK riski ile ilişkilidir. HDV RNA düzeyi ya da genotip ile HSK gelişimi arasında bir ilişkili gösterilmemiştir (1). Altı ayda bir yapılması önerilen abdominal ultrasonografiye ek olarak alfa-fetoprotein (AFP) ölçümü, erken tanıyı destekleyebilir; ancak hem AASLD hem de EASL, AFP ölçümünü hekimin tercihine bırakmaktadır (42,43). Karaciğerin ultrasonografi ile değerlendirilmesinin teknik olarak zor olduğu durumlarda (örneğin ciddi obezite veya hepatik steatoz varlığında) bilgisayarlı tomografi veya kontrastlı manyetik rezonans görüntüleme gibi diğer yöntemler düşünülebilir (42).
ÖNERİLER
- Aktif HDV infeksiyonunun tanısı için standart ve duyarlı RT-PCR testi kullanılarak tüm anti-HDV pozitif hastalarda HDV RNA test edilmelidir.
- Akut hepatit hastalarında, HBV-HDV koinfeksiyonu olan bireyleri, HDV ile süperinfekte olmuş HBsAg pozitif hastalardan ayırmak için anti-HBc IgM kullanılmalıdır.
- Aktif HBV infeksiyonunun varlığı HDV infeksiyonunun sonucunu kötüleştirebileceğinden HBeAg/anti-HBe durumu ve HBV DNA düzeyleri test edilmelidir.
- Kronik HDV infeksiyonu olan hastalarda invaziv olmayan testlerin kullanımına ilişkin yayınlanmış veriler sınırlıdır ve olguların önemli bir kısmında karaciğer histolojisi ile korelasyon yetersizdir. Bu testler, ilerlemiş karaciğer hastalığını değerlendirmek için kullanılabilir; ancak spesifik eşik değerler henüz tam olarak belirlenmemiştir.
- Sirozun klinik belirtileri veya dolaylı bulguları yoksa ve hastanın tedavisi ya da karaciğer hastalığının derecelendirilmesi/evrelenmesi açısından katkı sağlayacaksa karaciğer biyopsisi önerilir.
- HDV tedavisinden bağımsız olarak, ilerlemiş fibroz veya sirozu olan kronik HDV infeksiyonlu hastalarda her 6 ayda bir abdominal ultrasonografi ile HSK sürveyansı yapılmalıdır.
TEDAVİ
Kronik HDV infeksiyonu olan hastalar, karaciğer sirozu ve HSK açısından yakından izlenmelidir. Hasta kohortlarının yüksek heterojenliğine rağmen, mevcut veriler hastaların en az %25’inin ilk değerlendirme sırasında sirotik olduğunu ve sirozun genç yaşta gelişebileceğini göstermektedir (6,25,28). Tedavi öncesi değerlendirmede, noninvaziv tanısal testlerin standardizasyonunun olmaması nedeniyle, karaciğer hastalığının hasta bazında doğru bir şekilde karakterize edilebilmesi için, klinik öykü, kan testleri (hastalık aktivitesi, karaciğer fonksiyonu ve trombosit sayısı), ultrasonografi bulguları (karaciğer boyutu, kapsül konturu, parankimal eko paterni, dalak boyutu) birlikte değerlendirilmelidir (1).
Kronik HDV infeksiyonu olan tüm hastalar antiviral tedavi için potansiyel adaydır (1). İleri fibroz veya siroz varlığına bakılmaksızın; saptanabilir HDV RNA pozitifliği ile birlikte karaciğer enzim yüksekliği ve/veya karaciğer biyopsisinde kronik hepatit bulguları olan hastalarda tedavi önerilmektedir (18,44). Günümüzde kronik HDV infeksiyonu için kullanılan antiviral seçenekler pegile interferon alfa (PEG-IFN-α) ve bulevirtid (BLV) tedavileridir (1). PEG-IFN-α tedavisi, majör ekstrahepatik komorbiditeleri bulunan veya dekompanse karaciğer hastalığı olan hastalarda kontrendikedir (45-47). Bulevirtidin optimum tedavi süresi henüz tanımlanmamış olmakla birlikte HDV baskılayıcı etkisi birlikte nedeniyle kronik HDV infeksiyonunun yönetiminde umut vadetmektedir (1). Ancak, ülkemiz de dahil olmak üzere çok sayıda ülkede henüz erişilebilir olmaması nedeniyle, BLV tedavisi yaygın olarak uygulanamamaktadır. Yakın gelecekte kullanılması muhtemel antiviral ajanlara ait çalışmalar sürdürülmektedir (1,44).
Dekompanse sirozu olan hastalar için ruhsatlı bir tedavi seçeneği henüz mevcut değildir. Bu hastalar, karaciğer transplantasyonu açısından değerlendirilmelidir (48). Hepatoselüler karsinom gelişmişse, öncelik HSK için optimal tedaviye (karaciğer transplantasyonu dahil) verilmelidir; antiviral tedaviye ise potansiyel faydaları ve prognoza etkisi olgu bazında değerlendirilerek başlanabilir. Günümüzde, antiviral tedavi verilmeyen hastalarda, HDV RNA düzeylerinin prognozla ilişkili olduğunu destekleyen veriler yetersiz olmakla birlikte ticari olarak temin edilebilen standardize edilmiş güvenilir ve kantitatif testler ile HDV viremisinin izlenmesi önerilmektedir. Bu nedenle, antiviral tedavi başlanmayan hastalarda HDV RNA düzeylerinin yılda en az bir kez ölçülmesi; viral replikasyondaki dalgalanmalar ile HDV klirensini ayırt etmek için ise 3-6 ayda tekrar test yapılması önerilmektedir (33,37,49-51).
İleri fibroz veya sirozlu hastalarda, HDV RNA klirensinden bağımsız olarak karaciğer hasarı devam edebileceğinden, klinik, biyokimyasal ve görüntüleme yöntemleri ile takip sürdürülmelidir (49). Serumda HBV DNA ve HBsAg düzeyleri, yıllık olarak veya HDV RNA düzeylerinde büyük dalgalanmalar gözlemlendiğinde ya da ALT alevlenmeleri görüldüğünde izlenmelidir. HDV klirensi durumunda bazen HBV replikasyonunun nüks edebilmesi veya HDV RNA’nın ≥2 log azalması veya klirensi durumunda da serumda HBsAg düzeyinin azalması veya kaybın gelişebilmesi nedeniyle bu parametrelerin takibi gereklidir (49,52,53).
ÖNERİLER
- Kronik HDV infeksiyonu olan hastalar, antiviral tedavi almasa bile en az 6-12 ayda bir karaciğer hastalığı açısından izlenmelidir.
- Takip sürecinde HBsAg, HBV DNA ve HDV RNA düzeyleri değerlendirilmelidir.
- Kronik HDV infeksiyonu olan tüm hastalar antiviral tedavi için değerlendirilmelidir.
- Dekompanse sirozu olan hastalar karaciğer nakli için değerlendirilmelidir.
- Hepatoselüler karsinom tanılı hastalar karaciğer nakli ve olgu bazlı olarak da antiviral tedavi için değerlendirilmelidir.
TEDAVİ SEÇENEKLERİ
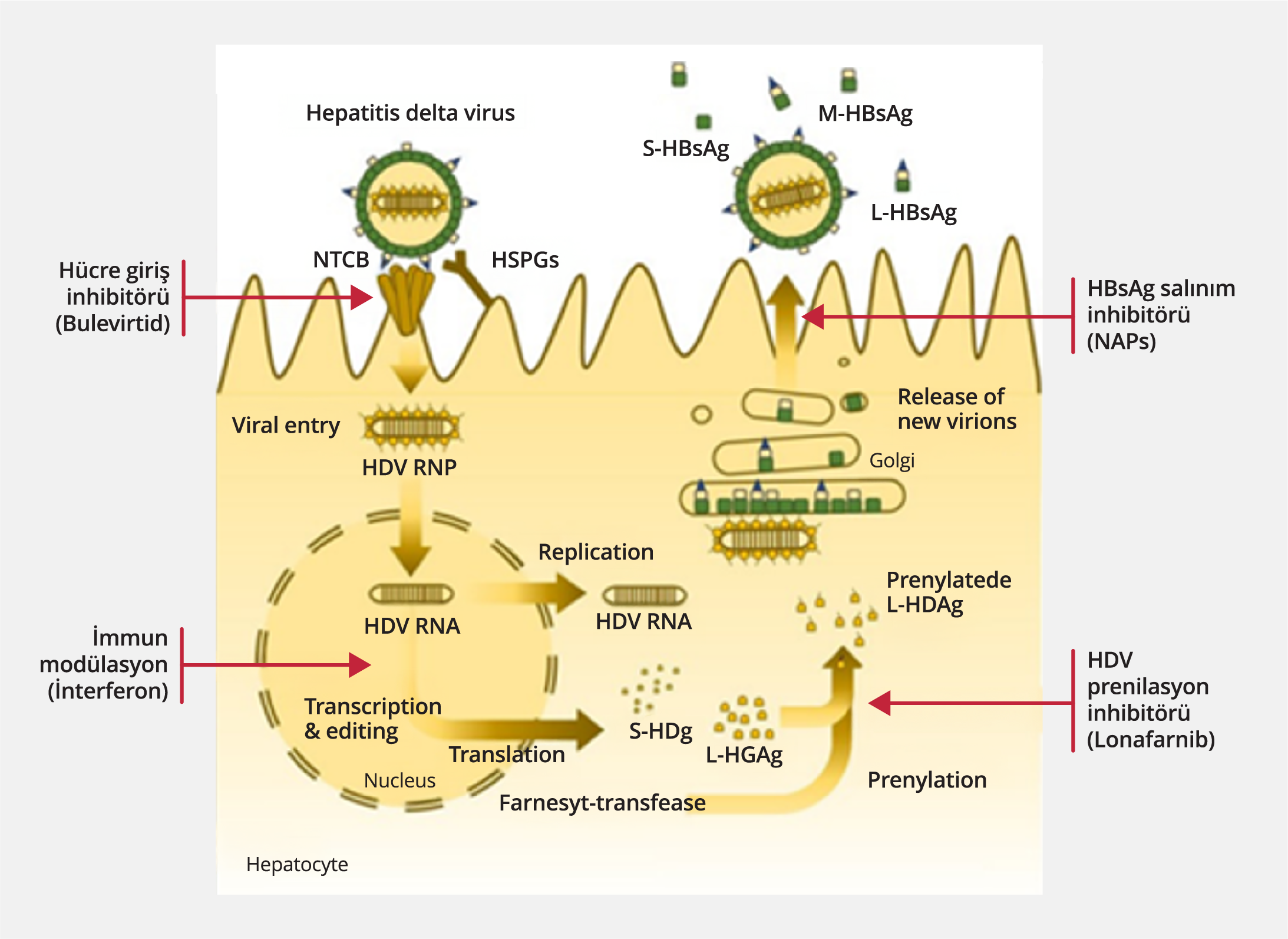
Şekil 5. HDV Tedavisindeki İlaç Hedefleri (Kaynak 103’ten uyarlanmıştır). Bulevirtid (BLV), viral reseptör NTCP’ye etkili bir şekilde bağlanarak de novo infeksiyonu engeller. Lonafarnib (LNF), farnesil transferazı inhibe ederek L-HDAg’nin prenilasyonunu önler ve sonuç olarak HDV birleşmesini ve salgılanmasını bozar. Nükleik asit polimeri (NAP) HDV viryonlarının ve/veya HDV ribonükleoprotein birleşiminin doğrudan HDAg ile etkileşimi yoluyla birleşmesini/salınmasını engelleyebilir.
Pegile IFN-Alfa
Yakın zamana kadar standart ve PEG-IFN preparatları kronik HDV infeksiyonu için tek tedavi seçeneği olarak kabul edilmekteydi. IFN-α’nın antiviral ve immünomodülatör etkileri arasındaki sinerjinin, kronik HDV infeksiyonunun kontrolünde önemli bir rol oynadığına inanılmaktadır (1). Başarılı bir IFN-α tedavisi hem HBV hem de HDV belirteçlerinin azalmasıyla ilişkilidir ve bu da HDV infeksiyonunun etkin kontrolü için iki viral infeksiyon üzerinde kombine bir etki sağlanmasının gerekli olduğunu düşündürmektedir (47,54,55). IFN-α’nın HDV üzerindeki spesifik etki mekanizması tam olarak tanımlanmamıştır. In vitro çalışmalar, IFN-α ‘nın HDV ile infekte hücrelerdeki viral replikasyonu engellediğini ileri sürmektedir (48,56). Güncel bir çalışmada, HDV-1p ve HDV-3 ile infekte insan karaciğer kimerik farelere PEG-IFN-α verildiğinde HDV viremisinin etkili bir şekilde baskılandığı, ancak HDV-1 (şempanzelerde ve dağ sıçanlarında seri pasajlardan sonra klonlanan ilk HDV) ile infekte olanlarda vireminin devam ettiği gösterilmiştir. Bu nedenle PEG-IFN-α’nın etkisinin viral suşa bağlı olabileceği ileri sürülmüştür (57). Ayrıca, son yıllarda in vitro çalışmalar, IFN’lerin yeni işlevlerini de ortaya çıkarmıştır (56,58). Özellikle hem IFN-α’nın hem de interferon‐lambda (IFN-λ)’nın infeksiyonun erken bir aşamasında verildiğinde viral giriş inhibitörü olarak etki göstererek HDV infeksiyonunu önemli ölçüde azalttığı bildirilmiştir (56). Dahası, her iki IFN de HDV replikatif ara ürünlerinin ortadan kaldırılmasını artırarak HDV yayılımını baskılamaktadır (Şekil 5) (58).
Kronik HDV infeksiyonunda IFN etkinliğini değerlendiren iki randomize kontrollü çalışmanın yanı sıra çok sayıda farklı tasarıma sahip prospektif ve retrospektif çalışma mevcuttur. Bu çalışmalarda, tedavi yanıtına ilişkin değerlendirmeler (tedavinin bitiminden 24 hafta sonra HDV RNA saptanamaması) benzer olmakla birlikte HDV RNA saptama limitlerindeki çok büyük farklılıklar (6 İÜ ile >1000 İÜ arasında değişen) sonuçların karşılaştırılabilir olmasını mümkün kılmamaktadır (1). Bir çalışmada, PEG-IFN-α ile tedavi edilen 120 hastadan alınan 372 serum örneği önce kurum içi PCR ile değerlendirilmiş ve ardından daha hassas bir PCR analiziyle yeniden test edilmiştir. Önceki analizlerde negatif olarak sınıflandırılan örneklerin %31’inde HDV RNA sonucunun pozitif saptanması suboptimal duyarlılığa sahip testlerin yanlış sınıflandırma potansiyelini göstermesi açısından dikkat çekicidir (59). IFN çalışmalarında, PEG-IFN-α tedavisinin standart IFN tedavisinden daha etkili olduğu gösterilmiştir (IFN-α yanıt oranı %17, PEG-IFN-α %25). On üç çalışmanın sonuçlarının incelendiği güncel bir meta-analizde, PEG-IFN-α alan hastaların, tedavi sonrası 24. haftada virolojik yanıt oranı %29 (%17-47) olarak bildirilmiştir (60). Ancak, tedavi sonrası 24. haftada virolojik yanıt sağlanan hastaların %50’den fazlasında, 10 yıl içinde nüks gelişmiştir (30,61).
Yapılan bazı çalışmalarda, PEG-IFN-α tedavisinin 96 haftaya uzatılmasının, virolojik yanıt oranında artışa yol açmadığı gösterilmiştir (62-64). Ancak olgu bildirimleri ve kohort çalışmaları, kronik HDV infeksiyonu olan bazı hastalarda uzun süreli veya tekrarlanan tedaviler ile daha yüksek HBsAg kaybı ve daha yüksek HDV RNA klirensi sağlanabileceğini göstermektedir (47,65). Tedaviye iyi uyum sağlayan, yavaş virolojik yanıt veren veya ilerleyici HBsAg düşüşü olan hastalarda IFN-α ile uzun süreli veya yeniden tedavi düşünülebilir (47,54,55,65). IFN-α tedavisinde, HDV genotip 5 ile infeksiyon, tedavi başlangıcında düşük HDV RNA ve HBsAg düzeylerinin daha yüksek virolojik yanıt oranlarıyla ilişkili olduğu gösterilmiştir (26,47,54,62).
İleri evre veya ileri evre olmayan karaciğer hastalığında IFN-α tedavisinin eşit derecede etkili olduğunu öne süren çalışmalar olmakla birlikte veriler çelişkilidir (46,62). Ancak, klinik olarak ciddi portal hipertansiyonu olan siroz hastaları arasında tedaviye yanıt oranı daha düşük gözlenebilir (51). HDV infeksiyonu tedavisinde yanıt/yanıtsızlık öngörücülerini belirlemeye yönelik çalışmalar mevcuttur. Ancak tedavi sırasında HDV RNA kinetiğinin yüksek oranda değişkenlik göstermesi, viral yük düşüşünün zamanlamasının hasta bazında tedaviyi yönlendirmek için nasıl kullanılacağının net olmayışı bu öngörücüleri belirlemeyi zorlaştırmaktadır (66). Tedavinin 24. haftasındaki serum HDV RNA düzeyleri, yanıtın en güçlü öngörücüsü gibi görünmektedir; 24. haftada tespit edilemeyen HDV RNA düzeyi, tedavinin bitiminden sonraki 24. haftada virolojik yanıtın tanımlanması için %100’lük bir pozitif prediktif değere (PPD’e) sahiptir. Tedavinin 24. haftasında HDV RNA düzeyinde 1 log veya daha az düşüş olması, tedaviye yanıtsızlık açısından %67 duyarlılık, %85 özgüllük, %67 PPD ve %91 negatif prediktif değer (NPD) ile ilişkilidir (67). Öte yandan, tedavinin 24. haftasında önemli HDV RNA düşüşü olmayan hastaların çoğu, tedavi sonrası 24. haftada düşük bir yanıt olasılığına sahip olsa dahi bazı hastalar tedavinin ilk 6 ayından sonra halen tedaviye yanıt verebilmektedir. Giderek artan sayıda çalışma, HDV RNA, HBsAg ve HBcrAg belirteçlerinin bir kombinasyonunun, PEG-IFN-α tedavisini hasta düzeyinde bireyselleştirmek için algoritmalar geliştirmek amacıyla kullanılabileceğini öne sürmektedir (54,55).
Tedavinin 24. haftasında serum HBsAg düzeyinin 1000 İÜ’nün altında olmasının; tedavi yanıtı olan (takip sonunda hem HBsAg hem de HDV RNA’nın saptanamaması) ve kısmi tedavi yanıtı olan (takip sonunda HBsAg’nin saptanması ve HDV RNA’nın saptanamaması), hastaları tedaviye yanıt vermeyen hastalardan ayırt ettiği gösterilmiştir (%59’a karşı %10, p<0.001). Ayrıca 24. haftada 1.61 log’luk HDV RNA düşüşünün, tedaviye yanıt veren veya kısmi yanıt veren hastaları tedaviye yanıt vermeyen hastalardan ayırt etmek için, en iyi eşik değer olduğu, bu değerin “area under the receiver operating characteristic curve” (AUROC)=0.791 ile %86 duyarlılık ve özgüllük %68 özgüllüğe sahip olduğu bildirilmiştir (54). Yapılan çalışmalarda, IFN-α tedavisinin, tedavi edilmeyen veya sadece nükleozid/nükleotid analogları ile (NA) yapılan tedavilere kıyasla, kronik HDV infeksiyonunun doğal seyrini olumlu yönde etkilediği ve karaciğer biyopsilerinde nekroinflamasyonun ve fibrozun azalmasıyla karakterize histolojik iyileşme olduğu gösterilmiştir. Ek olarak, özellikle başlangıçta sirozu olmayan ve tedaviye yanıt veren hastalarda, yanıt vermeyenlere kıyasla, uzun vadeli klinik komplikasyonlar ve karaciğer hastalığı ilişkili ölümün daha az sıklıkla geliştiği bildirilmiştir (13,30,46).
Kompanse sirozu olan hastalarda, ciddi portal hipertansiyon ve özofagus varislerinin varlığına dikkat edilmelidir. Bu hasta alt grubunda, tedavi sırasında majör yan etki riskinin daha yüksek olması nedeniyle PEG-IFN-α tedavisinin kar-zarar dengesi değerlendirilmelidir. Kronik HDV infeksiyonunda IFN-α tedavisinin 48 haftayı aşması, diğer viral hepatit formlarına kıyasla daha iyi tolere edilmektedir ve tedavinin kesilme oranı daha düşüktür (62,68). Ancak, IFN’lerin yaygın yan etkilerine ek olarak, kronik HDV infeksiyonunda otoimmün hepatiti indükleyebilme riski de dikkate alınmalıdır (68-70). Özellikle, kronik HDV infeksiyonu olan hastalarda sıklıkla tespit edilen anti-“liver kidney microsomal” tip 3 (anti-LKM-3) antikorlarının (bazı İtalyan kohortlarında %13’e kadar) otoimmün hepatit ile ilişkili olabileceği bildirilmiştir (71,72).
Bulevirtid
Daha önce Myrcludex B olarak bilinen peptit giriş inhibitörü olan BLV hem HBV hem de HDV’nin hücre giriş reseptörü olan sodyum (Na) taurokolat kotransporter polipeptite (NTCP’ye) bağlanmasını engelleyerek etki gösterir (Şekil 5). Bu şekilde, HDV’nin hepatositlere girişini ve ardından virusun yayılmasını önler. Bulevirtid, deri altı enjeksiyonlar şeklinde uygulanan, 47 amino asitten oluşan kimyasal olarak sentezlenmiş bir lipopeptittir (36, 73).
Klinik Araştırmalar
BLV’nin farklı dozları (2, 5 ve 10 mg), monoterapi (örneğin MYR-202, MYR-203 D-F kolları, MYR 204 D kolu) veya PEG-IFN-α ile kombine tedavi (örneğin MYR 203 B-C-E kolları, MYR-204 B-C kolları) şeklinde, farklı sürelerde (24, 48 ve 96 hafta) kullanımı çeşitli çalışmalar ile araştırılmıştır (74-79).
Çok merkezli, randomize, açık etiketli bir faz 2 çalışması olan MYR202’de, kronik HDV infeksiyonu olan hastalarda (sirotik hastalar dahil), 2, 5 ve 10 mg BLV’nin tenofovir disoproksil fumarat (TDF) ile kombinasyonu, TDF monoterapisi ile karşılaştırılmıştır. Birincil sonlanım noktası, 24. haftada HDV RNA’nın saptanamaması veya 2 log10 İÜ/ml veya daha fazla bir azalma olarak belirlenmiştir. Hastalar tedavi sonrasında 24 hafta izlenmiştir. Yirmi dördüncü haftada birincil sonlanım noktasına ulaşma oranı, TDF monoterapi kolundaki hastalarda %4, 2 mg BLV+TDF kolundaki hastalarda %54, ,5 mg BLV+TDF kolunda %50, 10 mg kolunda ise %77 olarak bildirilmiştir. Tedavinin kesilmesi sonrasında HDV RNA düzeylerinde “rebound” artışlar görülmüştür. Tedavi sırasında bilirubin, AST ve ALT değerlerinde artış gözlenmiş, tedavi ilişkili ölüm gerçekleşmemiştir. Çalışmanın sonucunda, farklı kombinasyonlar ve/veya uzun tedavi sürelerinin etkinlik için araştırılması gerektiği bildirilmiştir (76).
MYR301 çalışmasında, 2 ve 10 mg BLV tedavisi alan grup, tedavi almayan grup ile karşılaştırılmış ve 48 hafta sonuçlarında 2 ve 10 mg BLV tedavisi ile virolojik yanıt elde etme oranı tedavisiz gruba üstün bulunmuştur. 48 hafta tedavi verilmeyen grup, 10 mg BLV ile tedavi edildiği, 2 ve 10 mg BLV kollarının ise tedavilerinin 96 haftaya uzatıldığı faz 3 çalışmasında ise özellikle BLV ile 24. hafta sonunda virolojik ve biyokimyasal yanıt geliştiremeyen hastalarda daha iyi bir yanıt elde edip edilemeyeceği de araştırılmıştır. Bu çalışmada, 2 ve 10 mg BLV ile benzer kombine, virolojik ve biyokimyasal yanıt oranları elde edilmiştir. Kırksekiz haftalık tedavinin, 2 ve 10 mg BLV kollarında 96 haftaya tamamlanması ile virolojik yanıtlar da artış gözlenmiştir. Yirmi dördüncü haftada virolojik yanıt elde edilemeyen hastalardan: yanıt vermeyenlerin %43’ü ve kısmi yanıt verenlerin %82’si 96. haftada virolojik yanıta ulaşmıştır. Bu çalışmada, uzun süreli BLV tedavisinin iyi tolere edildiği, ek olarak 24. haftada suboptimal yanıtı olan hastalarda da tedavi süresinin uzatılmasının virolojik yanıt oranını artırdığı bildirilmiştir (74).
MYR203 çalışmasında, 48 hafta boyunca PEG-IFN-α monoterapisi, 2 mg BLV ile PEG-IFN-α, 5 mg BLV ile PEG-IFN-α, 2 mg BLV verilmiştir. Tedavinin sonunda, virolojik yanıt (HDV RNA saptanamayan düzeyde) sırasıyla %13, %60, %40, %13 olarak tespit edilmiştir. En yüksek virolojik yanıt oranı 2 mg BLV ile PEG-IFN-α kombinasyonunda saptanmıştır. Tedavi sonrasındaki 24 haftalık tedavisiz takip sonuçlarında ise virolojik yanıtın devam etme oranları sırasıyla %0, %53, %27, %0’dır. HBsAg kaybı sadece 2 mg BLV’nin PEG-IFN-α kombine edildiği grupta görülmüş olup 48. hafta sonundaki oran %20, 72. hafta sonundaki oran ise %26 olarak bildirilmiştir. BLV bu çalışmada iyi tolere edilmiş, hiçbir hastada yan etki nedeniyle tedavi kesilmesi gerçekleşmemiştir (77).
MYR204 çalışmasında, kronik HDV infeksiyonu olan (kompanse sirotikler dahil) hastalar 48 hafta boyunca PEG-IFN-α monoterapisi, 48 hafta boyunca PEG-IFN-α + BLV (2 veya 10 mg) kombine tedavisini takiben 48 hafta BLV monoterapisi ve 96 hafta boyunca 10 mg BLV monoterapisi alacak şekilde randomize edilmiştir. Tedavi bitimini takiben 48. hafta sonunda HDV RNA negatifliği PEG-IFN-α grubundaki hastaların %25’inde, 2 mg BLV+PEG-IFN-α grubundaki hastaların %26’sında, 10 mg BLV+PEG-IFN-α grubundaki hastaların %46’sında ve 10 mg BLV grubundaki hastaların %12’sinde saptanmıştır (78).
Bir başka faz 2 çalışmasında, PEG-IFN-α monoterapisi, BLV (2, 5, 10 mg) + PEG-IFN-α kombinasyonu, BLV 2 mg monoterapisi, BLV (5 mg)+TDF kombinasyonu ile karşılaştırılmış, 48 haftalık tedaviyi takiben 24. haftalık takip sonuçlarında en yüksek virolojik yanıt oranı %53 ile BLV (2 mg) + PEG-IFN-α kombinasyonunda izlenmiştir. Hiçbir tedavi grubunda tedavi kesmeyi gerektirecek nitelikte ciddi bir yan etki görülmemiştir. BLV verilen tedavi gruplarında en sık görülen yan etki serum bilirubin değerlerinde artış olup bu artış en yüksek oranda 10 mg BLV alan grupta görülmüştür (80).
Gerçek Yaşam Verileri
Temmuz 2020’de, Avrupa ilaç Ajansı (European Medicines Agency – EMA) onayı ile Avrupa’da kompanse karaciğer hastalığı olan HDV hastalarında erken erişim programı ile kullanıma giren BLV (2 mg), Avrupa’daki klinik çalışmaların sonucunda Temmuz 2023 itibariyle üç yaş ve üzeri, on kilogramı geçmiş çocukları da içine alacak şekilde onay almıştır (81).
Fransa’da yürütülen erken erişim programı kapsamında, kronik HDV infeksiyonu olan hastalar (kompanse sirotik hastaların oranı %63) arasında bir gruba BLV 2 mg/gün monoterapisi (n=77) verilirken diğer gruba BLV 2 mg/gün ile PEG-IFN-α kombinasyonu (n=68) verilerek virolojik yanıt oranları (HDV RNA’nın tespit edilememesi veya başlangıç seviyesinden ≥2 log İÜ düşüşü) değerlendirilmiş; 24. haftada oranlar sırasıyla %52 ve %84, 48. haftada ise %68 ve %94 olarak bildirilmiştir. En sık gözlenen laboratuvar anormalliği iki grup için de bilirubin değerlerindeki artıştır. BLV monoterapi grubunda iki (rektal kanser, asit nedenli, BLV+ PEG-IFN-α grubunda ise 3 (asit, varis kanaması nedenli) hastada tedavi sonlandırılmıştır. Çalışmada hiçbir hastada ölüm görülmemiştir. (82).
İtalya’da yapılan prospektif kohort çalışmasında, ciddi portal hipertansiyonu olan kompanse sirotik 18 hastaya ait 48 hafta süreyle BLV monoterapisi verilmiş olup hastalar virolojik yanıt ve yan etkiler açısından izlenmiştir. Kırk sekiz hafta sonunda hastaların %78’inde ≥2 log HDV RNA düşüşü, %23’ünde HDV RNA’nın saptanamaz düzeylere inmesi sağlanmıştır. Protrombin zamanı, trombosit sayısı tedavinin ilk 48 haftasında değişme göstermemiş olmakla birlikte, AST, GGT değerlerinde düzelme, albümin değerlerinde artış ve karaciğer sertliği değerlerinde azalma görülmüştür (16.4 kPa,13.7 kPa). Tedavi süresince hiçbir hastada dekompanse siroz veya HSK gelişmediği bildirilmiştir. Ayrıca, yan etki nedeniyle hastaların hiçbirinde ilaç kesilmemiş ve bilirubin değerlerinde başlangıç değerine göre artış gözlenmiştir (başlangıç bilirubin değerleri hastaların hepsinde normalin üzerindedir). Bu ciddi portal hipertansiyonu olan kompanse sirotik hasta grubunda BLV 2 mg monoterapisinin iyi tolere edildiği bildirilmiştir (83).
Avusturya gerçek yaşam verisinde, 23 kronik HDV infeksiyonu olan (kompanse sirotik hastalar dahil) hastaya BLV monoterapisi başlanmıştır. Çalışmada, bir hasta hariç tüm hastaların göçmen olduğu, bunlardan beşinin Türk kökenli olduğu belirtilmiştir. Yirmi dördüncü haftada BLV monoterapisiyle virolojik yanıt elde edilen hastalarda BLV monoterapisine devam edilmiş, HDV RNA düzeyi üç farklı ölçümde tespit sınırının altındaysa tedavinin sonlandırıldığı bildirilmiştir. Yirmi dördüncü ile 48. haftalar arasında HDV RNA düzeyinde ilave düşüş saptanmayan sekiz hastanın tedavisine, yanıt sınıflandırmasından bağımsız olarak hastalarda PEG-IFN eklenmesi sonrası 12. haftada HDV RNA düzeylerinde azalma sağlanmıştır. BLV tedavisine devam edilen hastalarda 48 ve 60 hafta sonu virolojik yanıt oranları sırasıyla %65 ve %69’dur. Bu çalışmada uzun süreli BLV monoterapisinin güvenli olduğu ve sirozu olan hastalarda dahil olmak üzere HDV RNA düzeyini etkili bir şekilde azalttığı bildirilmiştir. Ayrıca, BLV tedavisinin tek başına veya PEG-IFN-α ile birlikte uygulanmasında, optimal tedavi süresinin belirlenmesi ve tedavinin yanıta göre bireyselleştirilmesini sağlayacak algoritmaların geliştirilmesi gerektiği belirtilmiştir (84).
Almanya’da 16 hepatoloji merkezinin katılımıyla yürütülen erken erişim programında, 114 kronik HDV infeksiyonu olan hastaya ait veriler değerlendirilmiştir. Bu hastaların %52’si kompanse veya dekompanse sirotik, %85’i Kafkas kökenli ve %50’si daha önce PEG-IFN-α tedavisi almış bireylerden oluşmaktadır. BLV monoterapisi alan hastaların 24. hafta sonu virolojik yanıt oranı (HDV RNA saptanamayan düzeylere inmesi) %58 olarak bildirilmiştir. Yine 24. haftada HDV RNA düzeyinde 2 log’luk bir azalma ise hastaların %76’sında elde edilmiştir. Hiçbir hastada HBsAg kaybı izlenmemiştir. Bu çalışmada yer alan altı hastanın tedavileri sonlandırılmıştır ancak bu durum ilaç ile ilişkilendirilmeyip hepatik yetmezlik, yeni gelişen HSK, vb. klinik nedenlere bağlanmıştır (85).
Çok sayıda Avrupa ülkesinin katıldığı SAVE-D çalışmasında yer alan 244 hasta (%85’i Kafkas kökenli, %95’i Child-Pugh A evresinde, %54’ünde özofagus varisi, %6’sında HSK mevcut) 2 mg/gün dozunda BLV tedavisi almış olup medyan tedavi süresi 92 (71-96) hafta olarak bildirilmiştir. Tedavinin 48. haftasında virolojik yanıt oranı %65 iken 96. haftada %79’a yükselmiştir. HDV RNA’nın saptanamayan düzeylere inme oranı 48. haftanın sonunda %28, 96. hafta sonunda ise %48’dir. Tedavi boyunca, AST, GGT, albümin değerleri ile karaciğer sertliği ölçümleri izlenmiş ve tüm değerlerde anlamlı düzeyde düzelme görülmüştür. Tedavinin 96. haftasının sonunda kümülatif de-novo HSK ve dekompansasyon riski sırasıyla %3 ve %2.8 olarak raporlanmıştır. Hastaların %10’unda bilirubin yükselmesinden bağımsız olarak hafif ve geçici kaşıntı bildirilmiştir. Bir hasta tedaviyi 24. Haftanın sonunda bırakmak zorunda kalmış, ancak bu hastada da 24. hafta sonunda virolojik yanıt elde edilmiştir. Bu çalışma, 96 haftaya kadar uygulanan BLV 2 mg/gün monoterapisinin HDV’ye bağlı sirozu olan hastalarda güvenli ve etkili olduğunu göstermiştir (86).
Almanya, Avusturya ve İtalya’dan sağlanan ortak gerçek yaşam verisinde, dekompanse sirozu olan 19 hastada BLV monoterapisinin 24. haftasının sonundaki virolojik yanıt oranı %64 (7/11), biyokimyasal ve virolojik kombine yanıt oranı %36 (4/11) olarak kaydedilmiştir. Hastaların %27’sinde (3/11) Child-Pugh B’den, Child-Pugh A sınıfına geçiş sağlanabilmiştir. Bu çalışmada, hastalara “off-label” olarak BLV tedavisi uygulanmış, hepatik fonksiyonlarda ve portal hipertansiyon bulgularında iyileşme sağlandığı bildirilmiş ancak bu etkinin tüm hastalarda görülmediğine dikkat çekilmiştir (87).
Sonuç olarak, kronik HDV infeksiyonu olan hastalarda BLV’nin güvenliği ve etkinliği, sirozu olan hastalar da dahil olmak üzere gerçek yaşam verileriyle desteklenmiştir. BLV tedavisine PEG-IFN-α eklenmesinin HBsAg kaybı açısından faydalı olabileceği, uzun süreli BLV monoterapisinin ise sirozu olan hastalarda dekompanzasyon riskini azaltabileceği görülmüştür. Günümüzde diğer tedavi seçeneklerinin onaylanması beklenmekle birlikte, Avrupa ülkeleri için 2 mg BLV tedavisi, HDV infeksiyonunda onaylanmış tek seçenek olarak öne çıkmaktadır (88).
Nükleozid/Nükleotid Analogları
Son yirmi yıldır yapılan çalışmalar, NA’ların hem monoterapi olarak hem de IFN-α ile kombinasyon halinde kullanıldıklarında, HDV infeksiyonunun kontrolü açısından düşük etkinliğe sahip olduklarını ortaya koymuştur (62,68,89,90). Benzer şekilde, PEG-IFN-α ile kombinasyon halinde verildiklerinde de virolojik yanıt oranlarında artış izlenmemiştir; ancak adefovir ile yapılan kombinasyon, HBsAg düzeyinde gerçekleşen düşüş ile ilişkilendirilmiştir (68). Bu bulgu, TDF kullanımı için doğrulanamamıştır (62). Diğer yanda, HIV-HDV koinfekte hastalarda yapılan bazı istisnai çalışmalarda, uzun süreli TDF tedavisinin HDV RNA düzeylerinde düşüş ve karaciğer sertliğinde iyileşmeler ile ilişkili olduğu bildirilmiştir (91,92). HDV RNA üzerindeki bu etkinin, HBV-HDV’ye doğrudan bir antiviral etkiden çok, bağışıklığın yeniden düzenlenmesi yoluyla HDV infeksiyonunun daha iyi kontrol altına alınmasına olanak sağlaması nedeniyle ortaya çıkabileceği öne sürülmüştür (93). Ancak, bu bulgular küçük ve retrospektif kohortlara dayanmaktadır; sonuçları henüz başka kohort çalışmaları ile doğrulanmamıştır. Bu nedenle, günümüzde NA’lar, kronik HDV infeksiyonunu doğrudan hedefleyen antiviral tedavilerin bir parçası olarak görülmemektedir (1).
NA’lar, aktif HBV replikasyonu varlığı (HBV DNA >2000 İÜ/ml) ve HBV reaktivasyonu olmak üzere iki klinik senaryoda endikedir. Önemli düzeyde HBV replikasyonu doğrudan karaciğer hasarına katkıda bulunabilir ve ayrıca, kronik HDV infeksiyonu olan hastaların hastalık seyrinde olumsuz bir etkiye sahip olduğu gösterilmiştir. Bu nedenle, HBV DNA inhibisyonu amacıyla NA tedavisi önerilmektedir (17). HDV ve HBV replikasyon düzeylerinde zaman içerisinde büyük dalgalanmalar meydana gelebilmektedir (53,94). HDV viral yükündeki düşmenin yavaş olmasının ve klirensin karaciğer hastalığının daha ileri evrelerinde gerçekleşmesinin, HBV replikasyonunda tekrarlamalar ile ilişkili olabileceği gösterilmiştir (33). Bu nedenle, HBV viremisinin varlığından bağımsız olarak, tüm dekompanse hastalara ve serumda tespit edilebilir düzeyde HBV DNA bulunan kompanse sirozlu hastalara NA tedavisi başlanmalıdır (17). Hem HBV hem de HDV’nin hepatositlere girişini engelleyen ve dolayısıyla her iki virusun yaşam döngüsüne müdahale eden BLV tedavisinin kesilmesi durumunda, HBV reaktivasyonu riski bulunmaktadır (74). Bu nedenle, BLV tedavisi kesildiğinde, HBV reaktivasyonu gelişirse NA tedavisi başlanmalıdır (1).
ÖNERİLER
- Kronik HDV infeksiyonuna bağlı kompanse karaciğer hastalığı olan tüm hastalar (sirotik/nonsirotik) PEG-IFN-α tedavisi için değerlendirilmelidir.
- PEG-IFN-α tedavisi 48 hafta süreyle uygulanmalıdır.
- Tedavi süreleri, HDV RNA ve HBsAg kinetiğine ve tedavi toleransına bağlı olarak kişiselleştirilebilir.
- Kronik HDV infeksiyonuna bağlı kompanse karaciğer hastalığı olan tüm hastalar BLV tedavisi açısından değerlendirilmelidir.
- PEG-IFN-α intoleransı veya kontrendikasyonu olmayan hastalarda PEG-IFN-α ile BLV kombinasyonu düşünülebilir.
- NA’lar, kompanse sirozlu ve serumda tespit edilebilir düzeyde HBV DNA’sı bulunan hastalara verilmelidir.
GELİŞTİRİLMEKTE OLAN YENİ TEDAVİ AJANLARI
Nükleik Asit Polimerleri
Nükleik asit polimerleri (NAP’lar), etki mekanizmaları tam aydınlatılmamış olsa da, HBsAg’nin hidrofobik yüzeyiyle etkileşime giren ve subviral parçacıkların birleşmesini ve/veya salgılanmasını seçici olarak dengesizleştiren ve hücre içi HBsAg’nin lizozomal yolla parçalanmasına yol açan amfipatik fosforotioat oligonükleotidlerdir (Şekil 5).
Kronik HDV infeksiyonu olan (nonsirotik) hastalarda NAP kullanımıyla ilgili ve randomize olmayan bir faz 2 çalışmasında, 15 hafta boyunca haftada bir kez 500 mg intravenöz (İV) REP 2139, bunu takiben 15 hafta boyunca haftada bir kez 250 mg İV REP 2139 ve PEG-IFN-α 2a subkutan (SC) kombinasyon tedavisi, ardından da 33 hafta boyunca haftada bir kez PEG-IFN-α 2a monoterapisi uygulanmıştır. Toplam 12 hastanın dahil olduğu bu çalışmada, dokuz hastada tedavi sonunda HDV RNA negatifliği izlenmiş, bir yıllık takip sonunda da dokuz hastanın virolojik yanıtının devam ettiği bildirilmiştir. Dokuz hastada HBV DNA negatifliği izlenirken beş hastada ise HBsAg düzeylerinin tedavi sonunda 50 İÜ/ml’nin altına indiği saptanmış ve bir yıllık takip sonunda yanıtın korunduğu görülmüştür. Ayrıca, altı hastanın tedavisinin sonrasında anti-HBs titrelerinin 10 İÜ’ml’nin üzerinde olduğu bildirilmiştir. Hastalar arasında en sık bildirilen yan etkiler; anemi, nötropeni, trombositopeni ve aminotransferaz değerlerinde anormallik, bilirubin değerlerinde yükselmedir; dört hastada ciddi advers olay izlenmiştir. Bu çalışma sonucunda, REP 2139 ve PEG-IFN-α 2a kombinasyonunun, nonsirotik kronik HDV infeksiyonu olan hastalarda yeni bir tedavi seçeneği olabileceği bildirilmiştir (95). Söz konusu çalışmanın takip süresi 3.5 yıla çıkarıldığında, 11 hastanın yedisinde HDV RNA negatifliğinin devam ettiği, dört hastada ise HBsAg kaybının korunduğu raporlanmıştır. Takip süresi boyunca laboratuvar sonuçlarında herhangi bir anormallik izlenmemiş olup HBV-HDV fonksiyonel kürüne ulaşan hastalarda karaciğer sertliği değerlerinde düzelme saptanmıştır. Az sayıda hasta ile gerçekleşmesine rağmen ilk sonuçlar hem HDV fonksiyonel kürü (tedavi sonu HDV RNA negatifliği) hem de HBV fonksiyonel kürü (tedavi sonu HBV DNA negatifliği, HBsAg <0.05 İÜ/ml) açısından umut vericidir (96).
PEG IFNλ
Pegile interferon lambda (PEG IFNλ), IFN-α ile aynı hücre içi sinyal yolunu aktive eder ve benzer biyolojik aktiviteyi korur; ancak hepatositler için daha spesifik bir reseptör kompleksine bağlanması ve daha az yan etki profiline sahip olması nedeniyle farklılık gösterir.
LIMT-1 faz 2 çalışmasında, 33 hasta PEG IFNλ’nın 120 μg ve 180 μg dozları ile 48 hafta tedavi edilmiş. Tedavinin sonunda HDV RNA düzeylerinin saptanabilir sınırın altına inme oranları 120 μg alan grupta %16, 180 μg alan grupta ise %36 olarak bildirilmiştir. Tedavi bitimini izleyen 24. haftanın sonunda, tedavi yanıtı alınan hastaların tümünün virolojik yanıtlarını korudukları gözlenmiştir. Hastalarda en sık gözlenen yan etkiler aminotransferaz ve bilirubin düzeylerindeki artıştır. Hastaların %51’inde doz ayarlaması, tedaviye ara verme ve sonlandırmayı gerektirecek ciddi yan etkiler gözlenmiştir. Her iki tedavi grubunda da hastaların %25’inin mevcut yan etkiler nedeniyle ilacı bırakmak zorunda kaldığı bildirilmiştir. PEG IFNλ’nın faz 3 çalışması olan LIMT-2, dört hastada hepatobilyer yan etkilere bağlı karaciğer dekompanzasyonu gelişmesi nedeniyle, 7 Eylül 2023 tarihinde durdurulmuştur (97, 98).
Lonafarnib
Lonafarnib (LNF), HDV infeksiyonunda farnesiltransferaz aktivitesini inhibe ederek viryon birleşimi için zorunlu olan uzun form hepatit D antijeninin (L-HDAg’nin) farnesilasyonunu engeller (Şekil 5).
LOWR HDV-1 çalışmasında, karşılaştırılan tedavi grupları; LNF 400 mg oral (PO) 12 hafta, LNF 600 mg 12 hafta, LNF 300 mg 5 hafta, LNF 200 mg + PEG-IFN-α 180 μg haftada bir kez 8 hafta ve LNF 200 mg + ritonavir (RTV) 100 mg 8 hafta şeklindedir. Çalışmada tolerans ve etkinlik değerlendirilmiştir. Artan LNF dozlarının, daha güçlü HDV RNA düşüşü ile ilişkili olduğu; ancak daha yüksek dozlarda ishal, bulantı, kusma, anoreksi ve kilo kaybı gibi daha şiddetli yan etkilerin gözlemlendiği bildirilmiştir. Bu çalışmayla, majör LNF metabolize edici enzim olan sitokrom P450 3A4’ü inhibe eden RTV’nin eklenmesiyle daha düşük LNF dozlarının kullanılabileceği, bunun da istenmeyen olayları önemli ölçüde azaltırken antiviral etkinliği korunmaya yardımcı olabileceği bildirilmiştir (99).
LOWR HDV-2 çalışmasında ise farklı dozlarda LNF (yüksek ve düşük doz) RTV kombine edilerek 2 ayrı tedavi grubuna verilmiş, bir diğer tedavi grubuna ise düşük doz LNF ve PEG-IFN-α kombinasyonu uygulanmıştır. Böylelikle hem LNF için optimum dozun belirlenmesi hem de PEG-IFN-α eklenmesinin tedavi etkinliğine getireceği katkı araştırılmıştır. LNF 50 mg günde 2 kez (BID) + RTV tedavisi verilen 13 hastanın altısında (%46), LNF (50 veya 25 mg BID + RTV) ve PEG-IFN-α kombinasyonu ile tedavi edilen dokuz hastanın sekizinde (%89) virolojik yanıt elde edilmiştir. Yüksek doz LNF alan hastaların %49’unda, düşük doz LNF alan hastaların ise %22’sinde 2. ve 3. derece gastrointestinal advers olaylar meydana gelmiştir. Bu çalışmanın sonucunda, RTV ile desteklenen LNF’nin oral tedavi seçeneği olarak umut vadettiği ve PEG-IFN-α eklenmesinin virolojik yanıt oranını artırdığı bildirilmiştir (100).
D-LIVR faz 3 çalışmasında, 407 hasta randomize şekilde plasebo, LNF-RTV 50 mg, LNF-RTV 50 mg + PEG-IFN-α ve PEG-IFN-α olarak dört gruba ayrılmış ve 48 hafta boyunca tedavi edilmişlerdir. Tedavi gruplarında ≥2 log HDV RNA azalması olarak tanımlanan virolojik yanıt oranı sırasıyla %3.8, %14.6, %32 ve %36.5 olarak raporlanmıştır. Virolojik ve biyokimyasal yanıtın birlikte elde edilme oranları ise sırasıyla %1.9, %10.1, %19.2 ve %9.6’dır. Histolojik iyileşme (fibroz kötüleşmesi olmaksızın hepatik aktivite indeksinde ≥2 puanlık düzelme) hastaların sırasıyla %28, %33, %53 ve %38’inde gözlenmiştir. Bu çalışmanın sonucunda, LNF ve PEG-IFN-α’nın kombinasyon halinde uygulandığı grupta hem virolojik hem de biyokimyasal yanıtın beraber elde edilme oranı, ayrıca histolojik iyileşme oranı en yüksek olarak saptanmıştır. Tedaviyle ilişkili ortaya çıkan istenmeyen olayların sıklığı sırasıyla %4, %8, %14 ve %10 olarak bildirilmiştir. Doz azaltımı gereken hastaların oranları ise %0, %26, %52 ve %44 şeklindedir. Çalışma sürecinde dört hasta hayatını kaybetmiştir; bunlardan ikisi PEG-IFN-α monoterapi olarak alan grupta olup ölümlerin tedavi ilişkili olduğu bildirilmiştir. Diğer iki ölüm LNF monoterapi ve LNF + PEG-IFN-α kombinasyonu verilen iki grupta gerçekleşmiştir (101).
Bir başka çalışmada, LNF (50 mg) / RTV (100 mg) BID tedavisinin, haftada bir kez uygulanan PEG IFNλ (24 hafta boyunca 180 mcg) ile kombinasyonu değerlendirilmiştir. Bu çalışmada tedavi sonu 11 hastada (%42) HDV RNA saptanmayan düzeylere gerilemiş, %96’sında HDV RNA’da >2 log azalma elde edilmiştir. Ancak özellikle gastrointestinal yan etkiler belirgin olup dört hastada tedavinin kesilmesine yol açmıştır (102).
Tüm bu çalışmalar değerlendirildiğinde, LNF’nin monoterapi ve PEG-IFN-α ile kombine tedavide başarılı sonuçlar elde etmesi ve oral uygulama kolaylığı nedeniyle, kronik HDV infeksiyonu tedavisi için bir seçenek olabileceği düşünülmektedir. Ancak güvenilirliğini değerlendirmek için daha fazla sayıda hasta ile yapılmış, uzun süreli takip verilerine sahip çalışmalara ihtiyaç vardır. HDV tedavisindeki ilaç hedefleri Şekil 5’te sunulmuştur (103).
Tedavi Sonlanım Noktaları
Kronik HDV infeksiyonu tedavisinde ideal sonlanım noktası, HBsAg kaybının sağlanmasıdır. HBsAg pozitif hastalarda ise karaciğer biyopsisi ile karaciğerde HDV RNA replikasyonun olmadığını göstermek alternatif bir sonlanım noktasıdır; ancak bu yaklaşım biyopsi gerektirdiğinden klinik olarak uygulanabilir değildir. Daha pratik ve yaygın olarak tercih edilen birincil sonlanım noktası; tedavi sırasında, tedavi sonunda ve tedavi kesildikten 24 hafta sonra, duyarlı ve spesifik bir PCR testiyle, serum veya plazmada HDV RNA’sının tespit sınırının altında olduğunu göstermektir. Ancak, IFN tabanlı tedavilerden sonra geç dönem virolojik nüks riski yüksek olduğundan, tedaviden sonra kalıcı bir yanıt alındığından emin olabilmek için, HDV RNA’nın 24 haftadan uzun bir süre tespit sınırının altında olduğu doğrulanmalıdır. Bir diğer kabul edilebilir sonlanım noktası, ALT düzeyinin normalleşmesiyle birlikte ≥2 log İÜ/ml HDV RNA düşüşünün sağlanmasıdır. IFN ve PEG-IFN-α tedavileriyle sağlanan virolojik yanıt oranları Tablo 3’te, yeni anti-HDV tedavilerinin klinik denemelerindeki birincil sonlanım noktaları Tablo 4’te sunulmuştur (98).
TEDAVİ TAKİBİNDE KULLANILAN GÖSTERGELER
Virolojik Göstergelerin Monitörizasyonu
HDV RNA
HDV infeksiyonunun tedavisinin birincil hedefi HDV replikasyonunu azaltmaktır. Bu nedenle, viral yük, iyi standardize edilmiş ve doğrulanmış gerçek zamanlı moleküler analizler kullanılarak, aynı laboratuvar ve aynı analizle tedavi sırasında 6 ayda bir test edilmelidir (50). Ayrıca, klinik olarak gerekli olduğunda (örneğin, daha önce yanıtı olan bir hastada ALT alevlenmeleri durumunda) test edilebilir. PEG-IFN-α tedavisinin bitiminden 6 ve 12 ay sonra ve sonrasında yıllık olarak HDV RNA takibi önerilmektedir. Çünkü PEG-IFN-α’dan sonra geç nüksler 5-8 yıl sonra bile bildirilmiştir (30,61).
BLV monoterapisi kesildikten sonra, viral yük daha erken ve daha sık test edilmelidir. Çünkü hepatitin alevlenmesiyle ilişkili olarak viral replikasyonun tekrarlama riski vardır ve yeniden BLV tedavisine başlamak gerekebilir (76).
HBsAg
PEG-IFN-α bazlı tedavinin bir diğer hedefi de HBsAg kaybıdır (104). Tedavinin kesilmesinden yıllar sonra bile HBsAg kaybı meydana gelebileceğinden, PEG-IFN-α tedavisi sırasında ve tedavi sonrasında HBsAg test edilmelidir (47). Buna karşılık, BLV tedavisi sırasında HBsAg serum düzeylerinde değişiklik gözlenmez (76). Ancak farklı çalışmalarda spontan HBsAg düşüşleri bildirildiği için BLV monoterapisi sırasında HBsAg için yıllık takip önerilebilir (53,94).
HBV DNA
PEG-IFN-α bazlı antiviral alan ve NA kullanmayan hastalarda HBV DNA düzeyi her 6 ayda bir test edilmelidir. Çünkü HBV-HDV baskınlık modelleri zamanla değişebilir (33). BLV’nin kesilmesi ise HBV replikasyonuna yol açabileceğinden, NA tedavisi almayan hastalarda BLV kesildikten sonra HBV DNA düzeyinin takibi önerilmektedir (1).
Yeni HBV göstergeleri
Antiviral tedavi sırasında serum HBcrAg ve HBV RNA düzeylerinin takibinin rolü değerlendirilmektedir; bu göstergelerin takibi güncel klinik uygulamada önerilmemektedir (55).
Biyokimyasal Göstergelerin Monitörizasyonu
Aminotransferazlar
Tedavi sırasında viral replikasyonun inhibisyonuna paralel şekilde aminotransferaz düzeylerinde düşüşün olup olmadığı değerlendirilmelidir. Ayrıca PEG-IFN-α bazlı tedavi sırasında veya sonrasında ortaya çıkabilecek ALT alevlenmelerini yakalamak için aminotransferaz takibi zorunludur (1). PEG-IFN-α tedavisi boyunca, aminotransferazlar, ilk 12 hafta boyunca her 4 haftada bir ve sonrasında her 6-8 haftada bir test edilmelidir. PEG-IFN-α tedavisi sonrası 24. ve 48. haftalarda aminotransferaz kontrolü önerilir; ek kontroller hastalığın evresine göre 4., 8. ve 12. haftalarda yapılabilir. BLV kesilmesi durumunda, HDV relaps riski nedeniyle olası bir ALT alevlenmesini tespit etmek için ilk 6 ayda izleme gerekebilir (76).
Tam kan sayımı
PEG-IFN-α ile tedavi edilen hastalarda standart programa göre tam kan sayımı yapılmalıdır (17). BLV monoterapisi alan hastalarda ise bu tetkik en az 3 ayda bir yapılmalıdır. Sirozu olan hastalarda kişiye özel izleme programları gerekebilir (1).
Karaciğer Görüntülemesi
Karaciğer sertliği
PEG-IFN-α bazlı tedavi sırasında ve sonrasında karaciğer sertliği ölçümlerinin tanısal ve öngörücü değeri hakkında veri yoktur. IFN-α tarafından indüklenen bağışıklık hücrelerinin artan aktivasyonu nedeniyle karaciğer sertliği değerleri tedavi sırasında bile artabilir. Çoğu hastada BLV tedavisinin 24. ve 48. haftalarından sonra, muhtemelen intrahepatik nekroinflamasyonun azalması nedeniyle karaciğer sertliği değerlerinin azaldığı gösterilmiştir (74,76). Ancak bu bulgunun klinik önemi belirsizdir. Tedaviden sonra karaciğer sertliği değerlerinin test edilmesi, hastalığın ilerlemesi hakkında yararlı klinik bilgi sağlayabilir ve yeniden tedavi kararlarını etkileyebilir (1).
Ultrasonografi
Karaciğerin ultrasonografi ile görüntülenmesi HSK taramasının bir parçası olmalı ve portal ven akımı, dalak büyüklüğü ve asit varlığı açısından karaciğer hastalığının ilerlemesini sistematik olarak izlemek için kullanılmalıdır (42).
Histoloji
Karaciğer biyopsisi
Karaciğer histolojisi, tedavi sırasında açıklanamayan ALT alevlenmelerinin nedenlerini araştırmak için yararlı olabilir. Çünkü IFN-α bazlı tedaviler, kortikosteroidlerle immünosüpresif tedavi gerektirebilecek otoimmün olaylara neden olabilir (68). Klinik yararları sınırlı olduğundan, klinik çalışmalar/protokoller dışında düzenli takip amaçlı karaciğer biyopsisi önerilmemektedir (1).
Klinik olaylar
Hastalar, siroz, hepatik dekompansasyon ve HSK gelişimi açısından izlenmelidir (1).
ÖNERİLER
- Kronik HDV infeksiyonunun tedavisi sırasında ve sonrasında virolojik yanıt belirlenmelidir.
- Tedavi sırasında 6 ayda bir ve herhangi bir klinik endikasyon halinde HDV RNA düzeyi test edilmelidir.
- PEG-IFN-α bazlı tedavi alanlarda, tedavi sonunda, tedavi sonrası 6. ve 12. aylarda ve sonrasında yıllık olarak HDV RNA düzeyi test edilmelidir.
- BLV kesilmesi durumunda, relaps açısından, tedavi kesildiğinde, tedavi sonrası 1., 3., 6. ve 12. aylarda ve sonrasında yıllık olarak HDV RNA düzeyi test edilmelidir.
- Tedavi sırasında ve sonrasında her yıl HBsAg testi yapılmalıdır.
- PEG-IFN-α bazlı tedavi alanlarda, tedavi sırasında 6 ayda bir, sonrasında her 12 ayda bir kantitatif HBsAg izlenebilir.
- NA tedavisi verilmeyen hastalarda her 6 ayda bir HBV DNA düzeyi test edilmelidir. BLV kesilmesi durumunda daha sık test edilmesi gerekebilir.
- Antiviral tedavi sırasında, klinik endikasyon halinde, karaciğer hastalığı aktivitesinin biyokimyasal belirteçleri ve tam kan sayımı istenmelidir.
- Karaciğer hastalığının evresine ve verilen antiviral tedaviye göre biyokimyasal test sıklığı en az 3-6 ayda bir olacak şekilde ayarlanmalıdır.
- PEG-IFN-α bazlı tedavi alanlarda, tedavi sonu, tedavi bitiminden sonra 6. ve 12. aylarda ve sonrasında yılda bir biyokimyasal testler yapılmalıdır.
- BLV kesilmesi durumunda, biyokimyasal testler tedavi kesildiğinde ve tedavi bitiminden sonra 1., 3., 6. ve 12. aylarda veya klinik ihtiyaca göre daha sık yapılmalıdır.
- Antiviral tedavi sırasında ve sonrasında yıllık olarak karaciğer sertliği tayini yapılabilir.
- Karaciğer biyopsisi, histolojik tanının klinik yönetime yardımcı olacağı durumlarda antiviral tedavi sırasında ve/veya sonrasında yapılmalıdır.
- Hastalar, tedavi sırasında ve sonrasında karaciğerle ilişkili klinik olayların gelişimi açısından izlenmelidir.
KARACİĞER NAKLİ SONRASI HEPATİT D NÜKSÜNÜ ÖNLEMEK İÇİN PROFİLAKTİK STRATEJİLER
Kronik HDV infeksiyonunda, kronik HBV infeksiyonundan farklı olarak, karaciğer nakli için en sık karşılaşılan neden HSK’den ziyade karaciğer yetmezliğidir. Avrupa’da son 15 yılda, kronik HDV infeksiyonuna bağlı karaciğer nakli oranı kronik HBV infeksiyonuna kıyasla daha yüksektir (sırasıyla HDV %3, HBV %1). Bu da kronik HDV infeksiyonunda etkili tedavilere olan ihtiyacın temelini oluşturmaktadır (104,105). 1980’lerin sonlarından bu yana, olguların %70’inden fazlasında HDV infeksiyonunun intrahepatik tekrarlamasına dair ortaya çıkan kanıtlara rağmen, sağkalım oranları yüksektir (5 yıllık sağkalım oranı %90 HDV, %70 HBV-HCV koinfeksiyonu) (104-108). Nakil sonrası HDV tekrarını önlemek için en iyi profilaktik strateji, hepatit B immünoglobulinin (HBIG’in) yüksek genetik bariyerli NA ile kombine edilmesiyle uzun süreli uygulanmasına dayanmaktadır. Nakil sonrası erken dönemdeki optimal HBIG dozu tanımlanmamıştır, merkezlere göre değişebilir. Avrupa Karaciğer ve Bağırsak Nakli Derneği’nin (European Liver and Intestine Transplant Association – ELITA) önerisine göre nakil sonrası erken dönemden sonra, anti-HBs serum düzeyleri için >100 İÜ/ml yeterli görünmektedir (108). NA’lar arasında entekavir ve tenofovir alafenamid tercih edilmelidir (1). Kalsinörin inhibitörleri ile TDF eş zamanlı kullanıldığında nefrotoksisite riski oluşabileceği için dikkatli olunmalıdır (17).
ÖNERİLER
- Kronik HDV infeksiyonu nedeniyle karaciğer nakli yapılan hastalar, nakilden sonra yüksek genetik bariyerli NA ile birlikte HBIG almalıdır.
- Nakil sonrası erken dönemi takiben (6 ay), anti-HBs serum düzeylerini >100 İÜ/ml’de tutacak dozda HBIG uygulanmalıdır.
HDV İNFEKSİYONUNUN ÖNLENMESİ
HDV infeksiyonunun önlenmesinin temel dayanağı HBV’ye karşı aşılamadır. Anti-HBs pozitif şempanzelerin deneysel HDV infeksiyonuna karşı korunduğu gösterilmiştir (44). Kronik HBV infeksiyonu olan hastalarda, HDV bulaşma riskini azaltmak için uyuşturucu kullanımını ve yüksek riskli cinsel davranışları azaltmak önemlidir (2). Kronik HBV infeksiyonunda HDV infeksiyonunu önlemek için aşı yoktur. Ancak yakın zamanda yapılan bir çalışmada, HBsAg’nin preS1 alanını ve L-HDAg antijenini içeren birincil güçlendirme aşı stratejisinin, HBV-naif farelerde HDV-HBV koinfeksiyonuna, HBV ile infekte farelerde ise HDV süperinfeksiyonuna karşı pasif profilaksi sağlamak için kullanılan antikorları ortaya çıkardığı gösterilmiştir (44, 109).
Danışman Değerlendirmesi
Bağımsız dış danışman
Yazar Katkıları
Fikir/Kavram – P.K., E.T., K.Ç., S.T.; Tasarım – P.K., E.T., K.Ç., S.T.; Analiz ve/veya Yorum – P.K., E.T., K.Ç., S.T.; Literatür Taraması – P.K., E.T., K.Ç., S.T.; Makale Yazımı – P.K., E.T., K.Ç., S.T.; Eleştirel İnceleme – P.K., E.T., K.Ç., S.T.
Çıkar Çatışması
Yazarlar herhangi bir çıkar çatışması bildirmemiştir.
Finansal Destek
Yazarlar finansal destek beyan etmemiştir.
Referanslar
- European Association for the Study of the Liver. EASL Clinical Practice Guidelines on hepatitis delta virus. J Hepatol. 2023;79(2):433-60. [CrossRef]
- Negro F. Lok SF. Epidemiology, clinical manifestations and diagnosis of hepatitis D virus infection [Internet]. In: UpToDate. [erişim 17 Ağustos 2024]. https://www.uptodate.com/contents/epidemiology-clinical-manifestations-and-diagnosis-of-hepatitis-d-virus-infection
- Giersch K, Dandri M. Hepatitis B and Delta virus: Advances on studies about ınteractions between the two viruses and the ınfected hepatocyte. J Clin Transl Hepatol. 2015;3(3):220-9. [CrossRef]
- Pearlman B. Hepatitis Delta infection: A clinical review. Semin Liver Dis. 2023;43(3):293-304. Erratum in: Semin Liver Dis. 2023;43(3):e1. [CrossRef]
- Lempp FA, Ni Y, Urban S. Hepatitis delta virus: insights into a peculiar pathogen and novel treatment options. Nat Rev Gastroenterol Hepatol. 2016;13(10):580-9. [CrossRef]
- Stockdale AJ, Kreuels B, Henrion MYR, Giorgi E, Kyomuhangi I, de Martel C, et al. The global prevalence of hepatitis D virus infection: Systematic review and meta-analysis. J Hepatol. 2020;73(3):523-32. [CrossRef]
- Hepatitis D: Key facts [Internet]. Geneva: World Health Organization (WHO); 20 July 2023. [erişim 17 Kasım 2024]. https://www.who.int/news-room/fact-sheets/detail/hepatitis-d
- Chen HY, Shen DT, Ji DZ, Han PC, Zhang WM, Ma JF, et al. Prevalence and burden of hepatitis D virus infection in the global population: a systematic review and meta-analysis. Gut. 2019;68(3):512-21. [CrossRef]
- Razavi-Shearer D, Dhindsa K, Razavi H. Population adjusted prevalence of hepatitis delta virus in 16 countries. Hepatology. 2022;76:S211.
- Uraz S, Deniz Z, Zerdali EY, Araslanova A, Tahan V, Tabak F, et al. The changing epidemiology of delta hepatitis in Türkiye over three decades: A systematic review. J Viral Hepat. 2023;30(7):588-96. [CrossRef]
- Örmeci N, Erdem H. Changing trends in the epidemiology of delta virus infection. Viral Hepatitis Journal. 2023;29(1):1-9. [CrossRef]
- Wedemeyer H, Manns MP. Epidemiology, pathogenesis and management of hepatitis D: update and challenges ahead. Nat Rev Gastroenterol Hepatol. 2010;7(1):31-40. [CrossRef]
- Manesis EK, Vourli G, Dalekos G, Vasiliadis T, Manolaki N, Hounta A, et al. Prevalence and clinical course of hepatitis delta infection in Greece: a 13-year prospective study. J Hepatol. 2013;59(5):949-56. [CrossRef]
- Soriano V, Grint D, d’Arminio Monforte A, Horban A, Leen C, Poveda E, et al. Hepatitis delta in HIV-infected individuals in Europe. AIDS. 2011;25(16):1987-92. [CrossRef]
- Lu MY, Chen CT, Shih YL, Tsai PC, Hsieh MH, Huang CF, et al. Changing epidemiology and viral interplay of hepatitis B, C and D among injecting drug user-dominant prisoners in Taiwan. Sci Rep. 2021;11(1):8554. [CrossRef]
- Sharafi H, SaeidRezaee-Zavareh M, Miri SM, Alavian SM. Global distribution of hepatitis D virus genotypes: A systematic review. Hepat Mon. 2020;20(2):e102268. [CrossRef]
- European Association for the Study of the Liver. EASL 2017 Clinical Practice Guidelines on the management of hepatitis B virus infection. J Hepatol. 2017;67(2):370-98. [CrossRef]
- Terrault NA, Lok ASF, McMahon BJ, Chang KM, Hwang JP, Jonas MM, et al. Update on prevention, diagnosis, and treatment of chronic hepatitis B: AASLD 2018 hepatitis B guidance. Hepatology. 2018;67(4):1560-99. [CrossRef]
- Lau G, Yu ML, Wong G, Thompson A, Ghazinian H, Hou JL, et al. APASL clinical practice guideline on hepatitis B reactivation related to the use of immunosuppressive therapy. Hepatol Int. 2021;15(5):1031-48. Erratum in: Hepatol Int. 2022;16(2):486-7. [CrossRef]
- Sarin SK, Kumar M, Lau GK, Abbas Z, Chan HL, Chen CJ, et al. Asian-Pacific clinical practice guidelines on the management of hepatitis B: a 2015 update. Hepatol Int. 2016;10(1):1-98. [CrossRef]
- Guidelines for the prevention, diagnosis, care and treatment for people with chronic hepatitis B infection [Internet]. Geneva: World Health Organization; March 2024. [erişim 10 Şubat 2025]. https://iris.who.int/bitstream/handle/10665/376353/9789240090903-eng.pdf?sequence=1
- Wu S, Zhang Y, Tang Y, Yao T, Lv M, Tang Z, et al. Molecular epidemiology and clinical characteristics of hepatitis delta virus (HDV) infected patients with elevated transaminases in Shanghai, China. BMC Infect Dis. 2020;20(1):565. [CrossRef]
- Rizzetto M, Hamid S, Negro F. The changing context of hepatitis D. J Hepatol. 2021;74(5):1200-11. [CrossRef]
- Lutterkort GL, Wranke A, Yurdaydin C, Budde E, Westphal M, Lichtinghagen R, et al. Non-invasive fibrosis score for hepatitis delta. Liver Int. 2017;37(2):196-204. [CrossRef]
- Kamal H, Westman G, Falconer K, Duberg AS, Weiland O, Haverinen S, et al. Long-term study of hepatitis delta virus infection at secondary care centers: The impact of viremia on liver-related outcomes. Hepatology. 2020;72(4):1177-90. [CrossRef]
- Spaan M, Carey I, Bruce M, Shang D, Horner M, Dusheiko G, et al. Hepatitis delta genotype 5 is associated with favourable disease outcome and better response to treatment compared to genotype 1. J Hepatol. 2020;72(6):1097-104. [CrossRef]
- Béguelin C, Moradpour D, Sahli R, Suter-Riniker F, Lüthi A, Cavassini M, et al; Swiss HIV Cohort Study. Hepatitis delta-associated mortality in HIV/HBV-coinfected patients. J Hepatol. 2017;66(2):297-303. [CrossRef]
- Ricco G, Coco B, Colombatto P, Oliveri F, Cavallone D, Bleve P, et al. Highly dynamic changes of regional HBV epidemiology over two decades. Dig Liver Dis. 2023;55(4):519-26. [CrossRef]
- Kamal H, Fornes R, Simin J, Stål P, Duberg AS, Brusselaers N, et al. Risk of hepatocellular carcinoma in hepatitis B and D virus co-infected patients: A systematic review and meta-analysis of longitudinal studies. J Viral Hepat. 2021;28(10):1431-42. [CrossRef]
- Wranke A, Hardtke S, Heidrich B, Dalekos G, Yalçin K, Tabak F, et al. Ten-year follow-up of a randomized controlled clinical trial in chronic hepatitis delta. J Viral Hepat. 2020;27(12):1359-68. [CrossRef]
- Berzigotti A, Garcia-Tsao G, Bosch J, Grace ND, Burroughs AK, Morillas R, et al; Portal Hypertension Collaborative Group. Obesity is an independent risk factor for clinical decompensation in patients with cirrhosis. Hepatology. 2011;54(2):555-61. [CrossRef]
- El-Serag HB, Hampel H, Javadi F. The association between diabetes and hepatocellular carcinoma: a systematic review of epidemiologic evidence. Clin Gastroenterol Hepatol. 2006;4(3):369-80. [CrossRef]
- Schaper M, Rodriguez-Frias F, Jardi R, Tabernero D, Homs M, Ruiz G, et al. Quantitative longitudinal evaluations of hepatitis delta virus RNA and hepatitis B virus DNA shows a dynamic, complex replicative profile in chronic hepatitis B and D. J Hepatol. 2010;52(5):658-64. [CrossRef]
- Pollicino T, Raffa G, Santantonio T, Gaeta GB, Iannello G, Alibrandi A, et al. Replicative and transcriptional activities of hepatitis B virus in patients coinfected with hepatitis B and hepatitis delta viruses. J Virol. 2011;85(1):432-9. [CrossRef]
- Ayaz C, Yardımcı C, Çandır N, et al. [Management Of Chronic Hepatitis D Virus Infection: A Consensus Report of the Study Group for Viral Hepatitis of the Turkish Society of Clinical Microbiology and Infectious Diseases]. Klimik Derg. 2014;27:40-7. Turkish. [CrossRef]
- Lampertico P, Degasperi E, Sandmann L, Wedemeyer H; Delta Cure 2022 Working Group. Hepatitis D virus infection: Pathophysiology, epidemiology and treatment. Report from the first international delta cure meeting 2022. JHEP Rep. 2023;5(9):100818. [CrossRef]
- Raimondo G, Brunetto MR, Pontisso P, Smedile A, Maina AM, Saitta C, et al; Associazione Italiana Studio Fegato Cooperative Group. Longitudinal evaluation reveals a complex spectrum of virological profiles in hepatitis B virus/hepatitis C virus-coinfected patients. Hepatology. 2006;43(1):100-7. [CrossRef]
- Mederacke I, Bremer B, Heidrich B, Kirschner J, Deterding K, Bock T, et al. Establishment of a novel quantitative hepatitis D virus (HDV) RNA assay using the Cobas TaqMan platform to study HDV RNA kinetics. J Clin Microbiol. 2010;48(6):2022-9. [CrossRef]
- Da BL, Surana P, Takyar V, Kleiner DE, Heller T, Koh C. Vibration-controlled transient elastography for the detection of cirrhosis in chronic hepatitis D infection. J Viral Hepat. 2020;27(4):428-36. [CrossRef]
- Takyar V, Surana P, Kleiner DE, Wilkins K, Hoofnagle JH, Liang TJ, et al. Noninvasive markers for staging fibrosis in chronic delta hepatitis. Aliment Pharmacol Ther. 2017;45(1):127-38. [CrossRef]
- de Franchis R, Bosch J, Garcia-Tsao G, Reiberger T, Ripoll C; Baveno VII Faculty. Baveno VII – Renewing consensus in portal hypertension. J Hepatol. 2022;76(4):959-74. Erratum in: J Hepatol. 2022;77(1):271. [CrossRef]
- European Association for the Study of the Liver. EASL Clinical Practice Guidelines: Management of hepatocellular carcinoma. J Hepatol. 2018;69(1):182-236. Erratum in: J Hepatol. 2019;70(4):817. [CrossRef]
- Marrero JA, Kulik LM, Sirlin CB, Zhu AX, Finn RS, Abecassis MM, et al. Diagnosis, Staging, and Management of Hepatocellular Carcinoma: 2018 Practice Guidance by the American Association for the Study of Liver Diseases. Hepatology. 2018;68(2):723-50. [CrossRef]
- Negro F. Lok SF. Treatment and prevention of hepatitis D virus infection [Internet]. In: UpToDate. [erişim 18 Ocak 2025]. https://www.uptodate.com/contents/treatment-and-prevention-of-hepatitis-d-virus-infection#H477191913
- Sandmann L, Wedemeyer H. New treatments for chronic hepatitis B virus/hepatitis d virus ınfection. Clin Liver Dis. 2021;25(4):831-9. [CrossRef]
- Farci P, Roskams T, Chessa L, Peddis G, Mazzoleni AP, Scioscia R, et al. Long-term benefit of interferon alpha therapy of chronic hepatitis D: regression of advanced hepatic fibrosis. Gastroenterology. 2004;126(7):1740-9. [CrossRef]
- Yurdaydin C, Keskin O, Kalkan Ç, Karakaya F, Çaliskan A, Kabaçam G, et al. Interferon treatment duration in patients with chronic delta hepatitis and its effect on the natural course of the disease. J Infect Dis. 2018;217(8):1184-92. [CrossRef]
- Ilan Y, Klein A, Taylor J, Tur-Kaspa R. Resistance of hepatitis delta virus replication to interferon-alpha treatment in transfected human cells. J Infect Dis. 1992;166(5):1164-6. [CrossRef]
- Palom A, Rodríguez-Tajes S, Navascués CA, García-Samaniego J, Riveiro-Barciela M, Lens S, et al. Long-term clinical outcomes in patients with chronic hepatitis delta: the role of persistent viraemia. Aliment Pharmacol Ther. 2020;51(1):158-66. Erratum in: Aliment Pharmacol Ther. 2021;54(11-12):1508. [CrossRef]
- Le Gal F, Brichler S, Sahli R, Chevret S, Gordien E. First international external quality assessment for hepatitis delta virus RNA quantification in plasma. Hepatology. 2016;64(5):1483-94. [CrossRef]
- Stelzl E, Ciesek S, Cornberg M, Maasoumy B, Heim A, Chudy M, et al. Reliable quantification of plasma HDV RNA is of paramount importance for treatment monitoring: A European multicenter study. J Clin Virol. 2021;142:104932. [CrossRef]
- Wu JC, Chen TZ, Huang YS, Yen FS, Ting LT, Sheng WY, et al. Natural history of hepatitis D viral superinfection: significance of viremia detected by polymerase chain reaction. Gastroenterology. 1995;108(3):796-802. [CrossRef]
- Caviglia GP, Martini S, Ciancio A, Niro GA, Olivero A, Fontana R, et al. The hepatitis D virus in Italy. A vanishing infection, not yet a vanished disease. J Adv Res. 2021;33:183-7. [CrossRef]
- Niro GA, Smedile A, Fontana R, Olivero A, Ciancio A, Valvano MR, et al. HBsAg kinetics in chronic hepatitis D during interferon therapy: on-treatment prediction of response. Aliment Pharmacol Ther. 2016;44(6):620-8. [CrossRef]
- Sandmann L, Yurdaydin C, Deterding K, Heidrich B, Hardtke S, Lehmann P, et al; HIDIT‐II Study Group. HBcrAg levels are associated with virological response to treatment with interferon in patients with hepatitis delta. Hepatol Commun. 2022;6(3):480-95. [CrossRef]
- Zhang Z, Filzmayer C, Ni Y, Sültmann H, Mutz P, Hiet MS, et al. Hepatitis D virus replication is sensed by MDA5 and induces IFN-β/λ responses in hepatocytes. J Hepatol. 2018;69(1):25-35. [CrossRef]
- Giersch K, Perez-Gonzalez P, Hendricks L, Goldmann N, Kolbe J, Hermanussen L, et al. Strain-specific responsiveness of hepatitis D virus to interferon-alpha treatment. JHEP Rep. 2023;5(4):100673. [CrossRef]
- Zhang Z, Ni Y, Lempp FA, Walter L, Mutz P, Bartenschlager R, et al. Hepatitis D virus-induced interferon response and administered interferons control cell division-mediated virus spread. J Hepatol. 2022;77(4):957-66. [CrossRef]
- Bremer B, Anastasiou OE, Hardtke S, Caruntu FA, Curescu MG, Yalcin K, et al. Residual low HDV viraemia is associated HDV RNA relapse after PEG-IFNa-based antiviral treatment of hepatitis delta: Results from the HIDIT-II study. Liver Int. 2021;41(2):295-9. [CrossRef]
- Abdrakhman A, Ashimkhanova A, Almawi WY. Effectiveness of pegylated interferon monotherapy in the treatment of chronic hepatitis D virus infection: A meta-analysis. Antiviral Res. 2021;185:104995. [CrossRef]
- Heidrich B, Yurdaydın C, Kabaçam G, Ratsch BA, Zachou K, Bremer B, et al; HIDIT-1 Study Group. Late HDV RNA relapse after peginterferon alpha-based therapy of chronic hepatitis delta. Hepatology. 2014;60(1):87-97. [CrossRef]
- Anastasiou OE, Caruntu FA, Curescu MG, Yalcin K, Akarca US, Gürel S, et al. Five-year follow-up of 96 weeks peginterferon plus tenofovir disoproxil fumarate in hepatitis D. Liver Int. 2024;44(1):139-47. [CrossRef]
- Gunsar F, Akarca US, Ersoz G, Kobak AC, Karasu Z, Yuce G, et al. Two-year interferon therapy with or without ribavirin in chronic delta hepatitis. Antivir Ther. 2005;10(6):721-6.
- Yurdaydin C, Bozkaya H, Karaaslan H, Onder FO, Erkan OE, Yalçin K, et al. A pilot study of 2 years of interferon treatment in patients with chronic delta hepatitis. J Viral Hepat. 2007;14(11):812-6. [CrossRef]
- Heller T, Rotman Y, Koh C, Clark S, Haynes-Williams V, Chang R, et al. Long-term therapy of chronic delta hepatitis with peginterferon alfa. Aliment Pharmacol Ther. 2014;40(1):93-104. [CrossRef]
- Guedj J, Rotman Y, Cotler SJ, Koh C, Schmid P, Albrecht J, et al. Understanding early serum hepatitis D virus and hepatitis B surface antigen kinetics during pegylated interferon-alpha therapy via mathematical modeling. Hepatology. 2014;60(6):1902-10. [CrossRef]
- Keskin O, Wedemeyer H, Tüzün A, Zachou K, Deda X, Dalekos GN, et al. Association between level of hepatitis D virus RNA at week 24 of pegylated interferon therapy and outcome. Clin Gastroenterol Hepatol. 2015;13(13):2342-9.e1-2. [CrossRef]
- Wedemeyer H, Yurdaydìn C, Dalekos GN, Erhardt A, Çakaloğlu Y, Değertekin H, et al; HIDIT Study Group. Peginterferon plus adefovir versus either drug alone for hepatitis delta. N Engl J Med. 2011;364(4):322-31. [CrossRef]
- Rigopoulou EI, Zachou K, Gatselis N, Koukoulis GK, Dalekos GN. Autoimmune hepatitis in patients with chronic HBV and HCV infections: patterns of clinical characteristics, disease progression and outcome. Ann Hepatol. 2013-2014;13(1):127-35.
- Enc F, Ulasoglu C. A case of autoimmune hepatitis following pegylated interferon treatment of chronic hepatitis delta. North Clin Istanb. 2020;7(4):407-10. [CrossRef]
- Strassburg CP, Obermayer-Straub P, Alex B, Durazzo M, Rizzetto M, Tukey RH, Manns MP. Autoantibodies against glucuronosyltransferases differ between viral hepatitis and autoimmune hepatitis. Gastroenterology. 1996;111(6):1576-86. [CrossRef]
- Crivelli O, Lavarini C, Chiaberge E, Amoroso A, Farci P, Negro F, et al. Microsomal autoantibodies in chronic infection with the HBsAg associated delta (delta) agent. Clin Exp Immunol. 1983;54(1):232-8.
- Lampertico P, Roulot D, Wedemeyer H. Bulevirtid with or without PEG-IFN-α for patients with compensated chronic hepatitis delta: From clinical trials to real-world studies. J Hepatol. 2022;77:1422-30.
- Wedemeyer H, Aleman S, Brunetto M, Blank A, Andreone P, Bogomolov P, et al. Bulevirtide monotherapy in patients with chronic HDV: Efficacy and safety results through week 96 from a phase III randomized trial. J Hepatol. 2024;81(4):621-9. [CrossRef]
- Bogomolov PO, Ivashkin VT, Bueverov AO, Maev IV, Sagalova OI, Sleptsova SS, et al. [Efficacy and safety of bulevirtide in patients with chronic hepatitis D and compensated cirrhosis]. Ter Arkh. 2021;93(11):1290-9. Russian. [CrossRef]
- Wedemeyer H, Schöneweis K, Bogomolov P, Blank A, Voronkova N, Stepanova T, et al. Safety and efficacy of bulevirtide in combination with tenofovir disoproxil fumarate in patients with hepatitis B virus and hepatitis D virus coinfection (MYR202): a multicentre, randomised, parallel-group, open-label, phase 2 trial. Lancet Infect Dis. 2023;23(1):117-29. Erratum in: Lancet Infect Dis. 2022;22(12):e348. [CrossRef]
- Wedemeyer H, Schöneweis K, Bogomolov P, et al. Final results of a multicenter, open-label phase 2 clinical trial (MYR203) to assess safety and efficacy of myrcludex B in with PEGinterferon alpha 2a in patients with chronic HBV/HDV co-infection [Internet]. In: Conference Reports for NATAP. [erişim 18 Ocak 2025]. https://www.natap.org/2018/AASLD/AASLD_223.htm
- Asselah T, Chulanov V, Lampertico P, Wedemeyer H, Streinu-Cercel A, Pântea V, et al. Bulevirtide combined with pegylated ınterferon for chronic hepatitis D. N Engl J Med. 2024;391(2):133-43. [CrossRef]
- Bogomolov P, Alexandrov A, Voronkova N, Macievich M, Kokina K, Petrachenkova M, et al. Treatment of chronic hepatitis D with the entry inhibitor myrcludex B: First results of a phase Ib/IIa study. J Hepatol. 2016;65(3):490-8. [CrossRef]
- Lampertico P, Bogomolov PO, Chulanov V, Stepanova T, Morozov V, Allweiss L, et al. Phase 2 randomised study of bulevirtide as monotherapy or combined with Peg-IFNα-2a as treatment for chronic hepatitis delta. Liver Int. 2025;45(2):e70008. [CrossRef]
- Hepcludex – opinion on variation to marketing authorisation [Internet]. Amsterdam: European Medicines Agency; 18 October 2024. [erişim 10 Şubat 2025]. https://www.ema.europa.eu/en/medicines/human/variation/hepcludex
- de Lédinghen V, Guyader D, Métivier S, Hilleret MN, Fontaine H, Roche B, et al. Safety and efficacy of 2 mg bulevirtid in patients with chronic HBV/ HDV co-infection: First real-world results French early access program [Abstract]. In: The Liver Meeting, AASLD, November 13-16, 2021;74:S16A.
- Degasperi E, Anolli MP, Uceda Renteria SC, Sambarino D, Borghi M, Perbellini R, et al. Bulevirtide monotherapy for 48 weeks in patients with HDV-related compensated cirrhosis and clinically significant portal hypertension. J Hepatol. 2022;77(6):1525-31. [CrossRef]
- Jachs M, Schwarz C, Panzer M, Binter T, Aberle SW, Hartl L, et al. Response-guided long-term treatment of chronic hepatitis D patients with bulevirtide-results of a “real world” study. Aliment Pharmacol Ther. 2022;56(1):144-54. [CrossRef]
- Dietz-Fricke C, Tacke F, Zöllner C, Demir M, Schmidt HH, Schramm C, et al. Treating hepatitis D with bulevirtide – Real-world experience from 114 patients. JHEP Rep. 2023;5(4):100686. [CrossRef]
- Degasperi E, Anolli MP, Jachs M, Reiberger T, De Ledinghen V, Metivier S, et al. Real-world effectiveness and safety of bulevirtide monotherapy for up to 96 weeks in patients with HDV-related cirrhosis. J Hepatol. 2025:S0168-8278(25)00001-7. [CrossRef]
- Dietz-Fricke C, Degasperi E, Jachs M, Maasoumy B, Reiter FP, Geier A, et al. Safety and efficacy of off-label bulevirtide monotherapy in patients with HDV with decompensated Child-B cirrhosis-A real-world case series. Hepatology. 2024;80(3):664-73. [CrossRef]
- Lampertico P, Anolli MP, Roulot D, Wedemeyer H. Antiviral therapy for chronic hepatitis delta: new insights from clinical trials and real-life studies. Gut. 2024:gutjnl-2024-332597. [CrossRef]
- Kabaçam G, Onder FO, Yakut M, Seven G, Karatayli SC, Karatayli E, et al. Entecavir treatment of chronic hepatitis D. Clin Infect Dis. 2012;55(5):645-50. [CrossRef]
- Yurdaydin C. New treatment options for delta virus: Is a cure in sight? J Viral Hepat. 2019;26(6):618-26. [CrossRef]
- Sheldon J, Ramos B, Toro C, Ríos P, Martínez-Alarcón J, Bottecchia M, et al. Does treatment of hepatitis B virus (HBV) infection reduce hepatitis delta virus (HDV) replication in HIV-HBV-HDV-coinfected patients? Antivir Ther. 2008;13(1):97-102.
- Soriano V, Vispo E, Sierra-Enguita R, Mendoza Cd, Fernández-Montero JV, Labarga P, et al. Efficacy of prolonged tenofovir therapy on hepatitis delta in HIV-infected patients. AIDS. 2014;28(16):2389-94. [CrossRef]
- Onali S, Figorilli F, Balestrieri C, Serra G, Conti M, Scioscia R, et al. Can antiretroviral therapy modify the clinical course of HDV infection in HIV-positive patients? Antivir Ther. 2015;20(7):671-9. [CrossRef]
- Palom A, Sopena S, Riveiro-Barciela M, Carvalho-Gomes A, Madejón A, Rodriguez-Tajes S, et al. One-quarter of chronic hepatitis D patients reach HDV-RNA decline or undetectability during the natural course of the disease. Aliment Pharmacol Ther. 2021;54(4):462-9. Erratum in: Aliment Pharmacol Ther. 2021;54(11-12):1508. Erratum in: Aliment Pharmacol Ther. 2022;55(11):1473. [CrossRef]
- Bazinet M, Pântea V, Cebotarescu V, Cojuhari L, Jimbei P, Albrecht J, et al. Safety and efficacy of REP 2139 and pegylated interferon alfa-2a for treatment-naive patients with chronic hepatitis B virus and hepatitis D virus co-infection (REP 301 and REP 301-LTF): a non-randomised, open-label, phase 2 trial. Lancet Gastroenterol Hepatol. 2017;2(12):877-89. Erratum in: Lancet Gastroenterol Hepatol. 2018;3(1):e1. [CrossRef]
- Bazinet M, Pântea V, Cebotarescu V, Cojuhari L, Jimbei P, Anderson M, et al. Persistent control of hepatitis B virus and hepatitis delta virus infection following REP 2139-Ca and pegylated ınterferon therapy in chronic hepatitis B virus/hepatitis delta virus coinfection. Hepatol Commun. 2020;5(2):189-202. [CrossRef]
- Etzion O, Hamid S, Lurie Y, Gane EJ, Yardeni D, Duehren S, et al. Treatment of chronic hepatitis D with peginterferon lambda-the phase 2 LIMT-1 clinical trial. Hepatology. 2023;77(6):2093-103. [CrossRef]
- Eiger discontinues phase III hepatitis study due to safety concerns [Internet]. In: BioSpace digital hub; September 13, 2023. [erişim 24 Şubat 2025]. https://www.biospace.com/eiger-discontinues-phase-iii-hepatitis-study-due-to-safety-concerns
- Yurdaydin C, Keskin O, Kalkan Ç, Karakaya F, Çalişkan A, Karatayli E, et al. Optimizing lonafarnib treatment for the management of chronic delta hepatitis: The LOWR HDV-1 study. Hepatology. 2018;67(4):1224-36. [CrossRef]
- Yurdaydin C, Keskin O, Yurdcu E, Çalişkan A, Önem S, Karakaya F, et al. A phase 2 dose-finding study of lonafarnib and ritonavir with or without interferon alpha for chronic delta hepatitis. Hepatology. 2022;75(6):1551-65. [CrossRef]
- Etzion O, Hamid SS, Asselah T, Gherlan GS, Turcanu A, Petrivna T, et al. Week 48 results of the phase 3 D-LIVR study, a randomized double-blind, placebo-controlled trial evaluating the safety and efficacy of Lonafarnib-boosted with Ritonavir with or without peginterferon alfa in patients with chronic hepatitis delta [Abstract]. In: The International Liver Congress, Austria, Vienna, June 21-24, 2023. European Association for the Liver, 2023.
- Koh C, Hervun J, Rahman F, et al. A phase 2 study of peginterferon lambda, lonafarnib, and ritonavir for 24 weeks: end-of-study results from the LIFT HDV study [Internet]. In: Conference Reports for NATAP. [erişim 18 Ocak 2025]. https://www.natap.org/2022/HBV/053122_04.htm
- Brillanti S. Management of delta hepatitis 45 years after the discovery of HDV. J Clin Med. 2022;11(6):1587. [CrossRef]
- Adam R, Karam V, Cailliez V, O Grady JG, Mirza D, Cherqui D, et al; all the other 126 contributing centers (www.eltr.org) and the European Liver and Intestine Transplant Association (ELITA). 2018 Annual Report of the European Liver Transplant Registry (ELTR) – 50-year evolution of liver transplantation. Transpl Int. 2018;31(12):1293-317. [CrossRef]
- Kushner T, Serper M, Kaplan DE. Delta hepatitis within the Veterans Affairs medical system in the United States: Prevalence, risk factors, and outcomes. J Hepatol. 2015;63(3):586-92. [CrossRef]
- Ottobrelli A, Marzano A, Smedile A, Recchia S, Salizzoni M, Cornu C, et al. Patterns of hepatitis delta virus reinfection and disease in liver transplantation. Gastroenterology. 1991;101(6):1649-55. [CrossRef]
- Zignego AL, Samuel D, Gentilini P, Bismuth H. Patterns and mechanisms of hepatitis B/hepatitis D reinfection after liver transplantation. Arch Virol Suppl. 1993;8:281-9. [CrossRef]
- Duvoux C, Belli LS, Fung J, Angelico M, Buti M, Coilly A, et al. 2020 position statement and recommendations of the European Liver and Intestine Transplantation Association (ELITA): management of hepatitis B virus-related infection before and after liver transplantation. Aliment Pharmacol Ther. 2021;54(5):583-605. [CrossRef]
- Burm R, Maravelia P, Ahlen G, Ciesek S, Caro Perez N, Pasetto A, et al. Novel prime-boost immune-based therapy inhibiting both hepatitis B and D virus infections. Gut. 2023;72(6):1186-95. [CrossRef]