En Çok Okunanlar
Özet
Amaç: Karbapeneme dirençli Klebsiella pneumoniae (KDKp), dünya çapında hastane kaynaklı infeksiyonların önde gelen etkenlerinden biridir. Yüksek mortaliteyle seyreden kan dolaşımı infeksiyonları (KDİ)’na neden olmaktadır. Artan çoklu ilaç direncine bağlı olarak, tedavi seçenekleri çok sınırlıdır ve prognoz kötüdür. Bu çalışmanın amacı KDKp’nin etken olduğu KDİ’lerde mortalite için risk faktörlerini değerlendirmektir.
Yöntemler: Eylül 2013 ile Ekim 2017 tarihleri arasında üçüncü basamak bir hastanede KDKp’ye bağlı kan dolaşımı infeksiyonu geçiren erişkin (>16 yaş) hastalar retrospektif olarak değerlendirildi. Hastaların demografik verileri, Charlson komorbidite indeksi (CKİ), yatış tarihinde ve infeksiyon gününde “acute physiology and chronic health evaluation” (APACHE II) skoru üreyen K. pneumoniae suşlarının minimum inhibitör konsantrasyonu (MİK) değerleri, antibiyotik tedavisi ve sonuçları (30 günlük mortalite) elektronik veri tabanlarından kaydedildi.
Bulgular: Çalışma süresi boyunca toplam 82 hasta takip edildi. Medyan yaş 54.5’ti ve 48 (%58.5)’i erkekti. İnfeksiyon günü medyan APACHE II skoru 14 (IQR 6-28) ve CKİ 4.0 (IQR 0-12) idi. Kırk altı (%56.1) hastada YBÜ kaynaklı KDİ, 36 (% 43.9)’sında santral kateterle ilişkili KDİ ve 25 (% 30.5)’inde primer KDİ vardı. Elli (%61.0) hastada kombinasyon tedavisi uygulanırken en sık kullanılan antibiyotik kombinasyonu kolistin/tigesiklin (% 28) idi. Hastane ve yoğun bakım mortalite oranları sırasıyla %56.1 (46/82) ve %65.2 (30/46) idi. Tek değişkenli analizde, KDKp-KDİ ilişkili mortalite için risk faktörleri; yüksek CKİ, tedavinin beşinci gününde klinik yanıtsızlık, hastaneye yatış ve infeksiyon tarihinde yüksek APACHE II skoru olarak bulundu (p<0.05). Çok değişkenli analizde; mortalite için en önemli risk faktörü infeksiyon gününde APACHE II skoru idi (OR: 1.190; %95 CI: 1.088-1.301). Kombinasyon tedavisi veya monoterapinin sağkalım üzerine anlamlı bir etkisi yoktu. Ayrıca, KDKp suşlarının MİK değerleri mortaliteyle ilişkili bulunmadı.
Sonuçlar: KDKp-KDİ’nın hastane mortalitesi %56.1 idi. İnfeksiyon gününde APACHE II skoru mortalite için en önemli prognostik faktördü. Mortalite oranı, kombinasyon (%54.3) ve monoterapi (%45.7) alan hastalar arasında benzerdi.
GİRİŞ
Karbapeneme dirençli enterik bakterilerin etken olduğu sağlık bakımıyla ilişkili infeksiyonlar, ülkemizde ve dünyada giderek artmaktadır (1,2). Özellikle Klebsiella pneumoniae, karbapenemaz salgılayan suşları nedeniyle mortalitesi yüksek kan dolaşımı infeksiyonları (KDİ)’na neden olmaktadır (3). Uzun süre hastanede yatış, yoğun bakımda takip, geniş spektrumlu antibiyotik almış olmak, santral venöz kateter varlığı, entübasyon, immünsüpresyon ve altta yatan ağır hastalık varlığı, mortaliteyi artıran faktörlerdendir (4).
Karbapenemaz salgılayan bu suşların tedavisinde “son basamak antibiyotikler” (kolistin, tigesiklin, aminoglikozidler vb.) kullanılmaktadır. Bu antibiyotiklerin yan etki profilleri daha kötüdür, monoterapi olarak kullanıldıklarında hızla direnç gelişmektedir ve KDİ’ni tedavi etmek için önemli farmakokinetik sınırlamalara sahiptirler (5,6). Karbapeneme dirençli suşlarda karbapenemaz varlığına rağmen, yüksek dozlarda (2 gr/8 saat) ve uzun süre infüzyonla (3 saat) verilmesi halinde meropenemin bakterisidal etkisini koruduğu belirtilmiştir. Tedavi kombinasyonlarında karbapenemlerin bulunmasının, mortaliteyi azalttığını belirten çalışmalar mevcuttur (7,8). Öte yandan izole edilen etkenin antibiyogram incelemesinde karbapenemlerin belli minimum inhibitör konsantrasyon (MİK) değerlerinin üstünde olması durumunda tedavide karbapenem kullanılmasının yeterli etkinliğinin olmadığı görülmüştür (9).
Bu çalışmanın amacı, Karbapeneme dirençli Klebsiella pneumoniae (KDKp)’nın etken olduğu KDİ olgularını değerlendirmek, mortalite oranlarını ve mortalite için risk faktörlerini belirlemek, tedavi seçeneklerinin etkinliğini karşılaştırmaktır.
YÖNTEMLER
Erciyes Üniversitesi Tıp Fakültesi Hastanesinde yoğun bakım üniteleri ve yataklı servislerde Eylül 2013 ile Ekim 2017 tarihleri arasında, KDKp’ye bağlı kan dolaşımı infeksiyonuyla takip edilmiş olan erişkin (>16 yaş) hastalar çalışmaya dahil edildi. Retrospektif olarak hastaların demografik verileri, Charlson komorbidite indeksi (CKİ), hastaneye yatış gününde ve infeksiyon gününde “acute physiology and chronic health evaluation” (APACHE II) skoru, hastaneye yatış ve infeksiyon tarihleri, verilen antibiyotik tedavileri ve sonuçları, üretilen etkenin duyarlılık profili kaydedildi. Veriler, Enfeksiyon Kontrol Komitesi sürveyans kayıtlarından alındı. Hastalar infeksiyon sonrası 30 günlük takibe göre ölen ve sağ kalanlar olarak iki gruba ayrıldı. Ölüm oranlarını etkileyen faktörler açısından analiz edildi.
Primer ve sekonder kan dolaşımı infeksiyonu tanımları Hastalık Kontrol ve Korunma Merkezleri (Centers for Disease Control and Prevention – CDC) kriterlerine göre belirlendi (10). Sepsis ve septik şok tanımları, sepsis sağkalım kampanyası (SSC) 2016 yılı kılavuzuna göre yapıldı (11). Antimikrobiyal tedavi etkinliğini değerlendirmek için tedavinin beşinci günü klinik yanıt baz alındı. Hastaların ateş ve hipotansiyon bulgularının düzelmesi, beyaz küre sayısı ve C-reaktif protein değerinde düşme olması, klinik durumlarında iyileşme varlığı tedaviye klinik yanıt var olarak kabul edildi.
Hastalardan alınan kan kültürleri için BD BacT/Alert® (Becton Dickinson Co., Sparks, Maryland, ABD) otomatize kan kültürü sistemi kullanıldı. Üreyen mikroorganizmalar “eosin methylen blue (EMB)” agar (Salubris, İstanbul, Türkiye) besiyerine ekilerek 35.5-37°C’de 24-48 saat inkübe edildi. Besiyerinde üreyen kolonilerin tanımlanmasında VITEK® 2 sistemi (bioMérieux, Marcy l’Etoile, Fransa) kullanıldı. Antibiyotik duyarlılık testi VITEK 2 sistemi ve Kirby-Bauer disk difüzyon yöntemi kullanılarak yapıldı, sonuçlar Klinik ve Laboratuvar Standartları Enstitüsü (Clinical and Laboratory Standards Institute – CLSI) önerileri doğrultusunda değerlendirildi (12). Antimikrobiyal duyarlılık testi aminoglikozidler, antipseudomonal penisilinler, karbapenemler, sefalosporinler, kinolonlar, β-laktam / β-laktamaz inhibitörleri, kolistin ve tigesiklini içermekteydi.
Toplanan verilerin analizi SPSS Statistics for Windows. Version 21.0 (Statistical Package for the Social Sciences, IBM Corp., Armonk, NY, ABD) programı kullanılarak yapıldı. Verilerin normallik varsayımını kontrol etmek için Shapiro-Wilk testi yapıldı. Tek değişkenli analizde kategorik değişkenler için χ2 testi, sürekli değişkenler için Mann-Whitney U testi kullanıldı. Anlamlı bulunan değişkenler için model oluşturularak lojistik regresyon analizi yapıldı.
BULGULAR
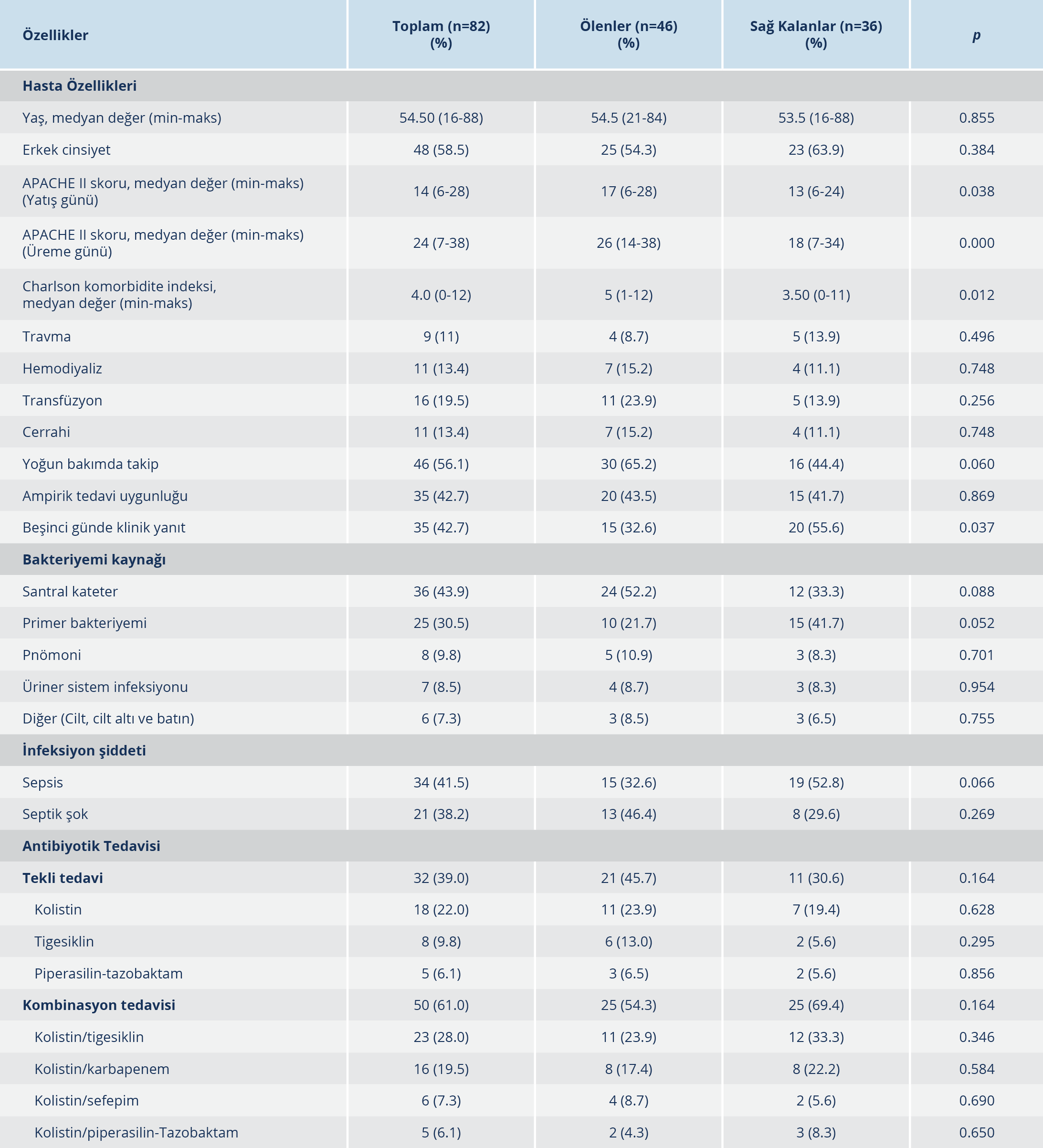
Tablo 1.Karbapeneme Dirençli K. pneumoniae ile İlişkili Kan Dolaşımı İnfeksiyonu Mortalite İçin Risk Faktörleri
Çalışma süresince KDKp’ye bağlı kan dolaşımı infeksiyonu gelişen 82 hasta çalışmaya dâhil edildi. Bu hastalardan 46 (%56.1)’sı çalışma sonunda kaybedildi. Ölen ve sağ kalan hastaların demografik verileri, risk faktörleri, infeksiyon odakları, ağırlık skorları Tablo 1’de gösterildi. Hastaların 48 (%58.5)’i erkek, medyan yaş 54.5 (16-88) idi. İnfeksiyon günü hesaplanan APACHE II skoru medyan değeri ölen hasta grubunda 17, sağ kalan hasta grubunda 13’tü (p=0.038). CKİ medyan değeri ise ölen hasta grubunda (5) sağ kalan hasta grubuna göre (3.5) daha yüksekti (p=0.012). Otuz hastada hipertansiyon, 24 hastada diyabet, 20 hastada kronik böbrek yetmezliği vardı. Beşinci gün klinik yanıtı, sağ kalan hasta grubunda ölen hastalara göre daha yüksek oranda izlendi (%56/%33). Kırk altı (%56.1) hasta yoğun bakımda takipliydi, 36 (%43.9) hastada santral kateterle ilişkili bakteriyemi mevcuttu. Risk faktörleri ve primer infeksiyon odağı ve infeksiyon şiddeti açısından ölen ve sağ kalan hastalar arasında fark izlenmedi. Yoğun bakım mortalitesi %65.2 (30/46) olarak bulundu. Çok yönlü analizde infeksiyon günü APACHE II skorunun yüksek olması mortalite için en önemli prediktif faktör idi (OR: 1.190; 95%CI: 1.088-1.301, p=0.001).
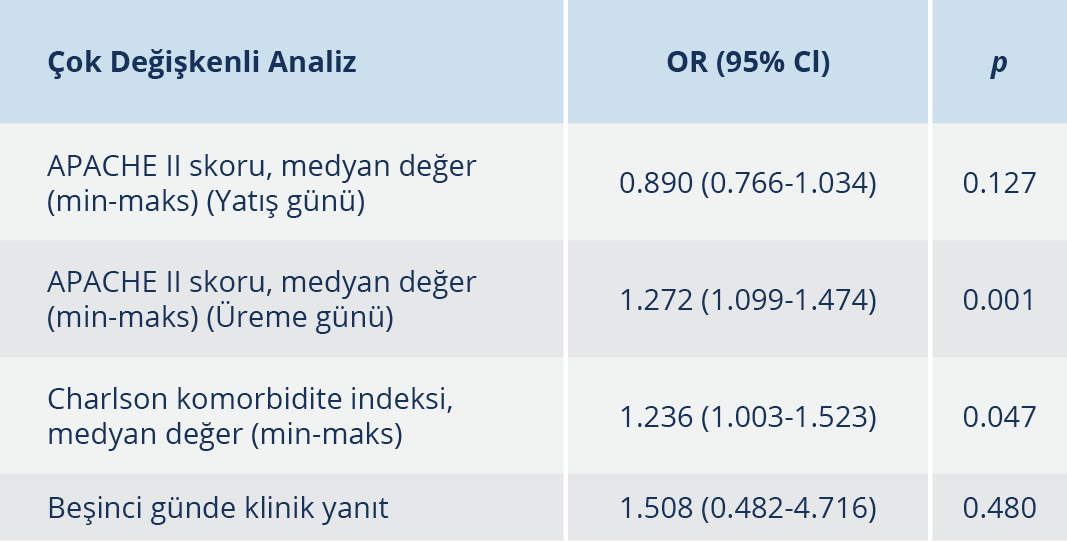
Tablo 2. Karbapeneme Dirençli K. pneumoniae ile İlişkili Kan Dolaşımı İnfeksiyonu Mortalite için Risk Faktörleri
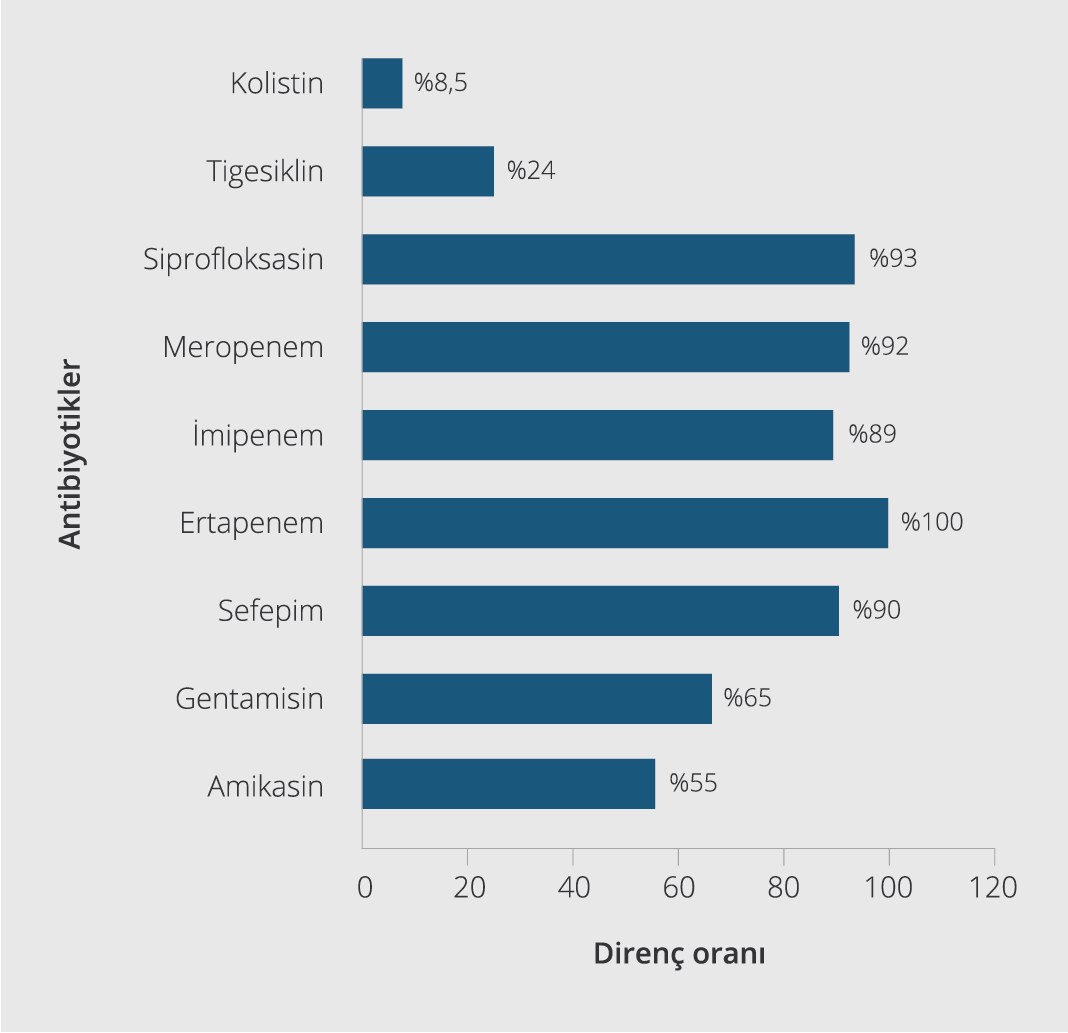
Ampirik tedavilerin uygunluğu, her iki grupta da benzer şekilde idi ve mortalite üzerinde anlamlı etkisi yoktu. Hastalara uygulanan antibiyotik tedavileri ve mortaliteyle ilişkisi Tablo 2’de gösterildi. Buna göre 32 (%39) hasta monoterapi alırken, 50 (%61.0) hasta kombinasyon tedavisi almıştı. Monoterapi olarak en sık kolistin kullanılmıştı. Kolistin/tigesiklin (%28) ve kolistin/karbapenem (%19.5) en sık tercih edilen kombinasyonlardı. Tedavide kombinasyon veya monoterapi kullanılmasının mortalite üzerine etkili olmadığı görüldü. KDKp suşlarının MİK değerleri de mortaliteyle ilişkili bulunmadı. Etken suşların antibiyotik direnç oranları Şekil 1’de sunuldu.
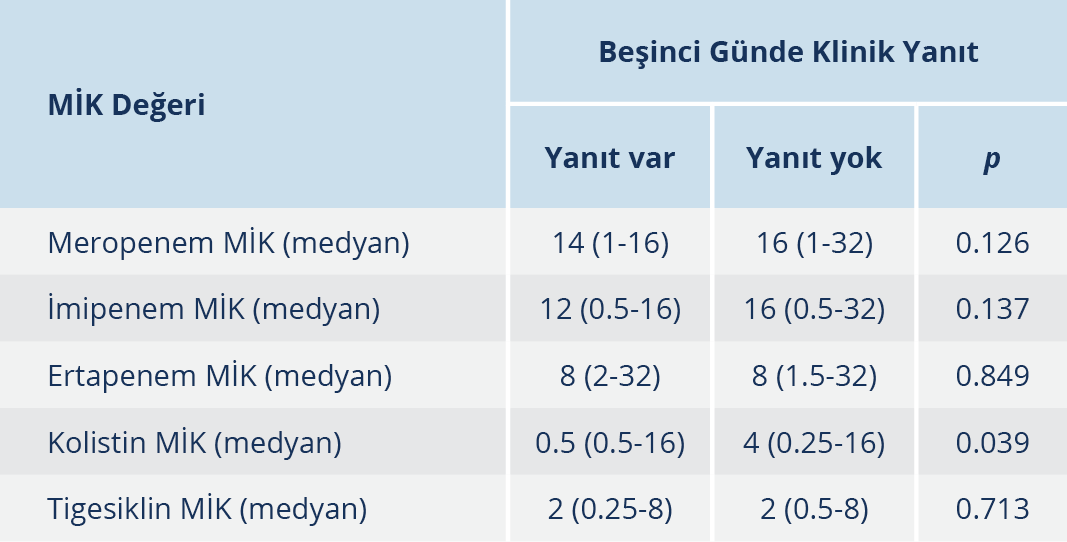
Beşinci günde klinik yanıt alınan hastalarda mortalite, istatistiksel olarak anlamlı ölçüde düşüktü. Ayrıca kolistin direnci, beşinci gün klinik yanıtsızlıkla ilişkiliydi (Tablo 3).
İRDELEME
KDKp’nın etken olduğu kan dolaşımı infeksiyonlarında mortalite %50’ye varan oranlarda bildirilmektedir (13-15). Çalışmamıza dahil edilen hastalarda 28 günlük mortalite yaklaşık %56 olarak bulundu. Mortaliteyi öngören en önemli faktör, infeksiyon gününde APACHE II skorunun yüksek olmasıydı (17 vs. 13). Tumbarello ve arkadaşları (16)’nın çalışmasında, infeksiyon gününde bakılan APACHE II skorunun >15 olması mortalite için en önemli risk faktörlerinden birisi olarak bulunmuştu. APACHE II yüksek olan hastalarda, dirençli patojenlerle olan infeksiyonlar da göz önünde bulundurularak kolistin içeren empirik tedavilerin başlanmasının sağkalım üzerinde olumlu etkisi olacaktır.
Benzer şekilde yüksek CKİ skoru da çalışmamızda mortalite için anlamlı bir risk faktörü olarak bulundu. CKİ, kronik hastalıkları içeren bir ağırlık skorudur. Literatürde altta yatan kronik hastalıkların varlığının, KDKp bakteriyemisinde mortaliteyi artırdığına dair çalışma sonuçları mevcuttur. Hussein ve arkadaşları (17), KDKp bakteriyemisinde, CKİ>5 olmasının mortaliteyi 6.7 kat arttırdığını belirtmişti. KDKp’nin etken olduğu 141 KDİ olgusunun değerlendirildiği bir çalışmada ise CKİ>4 olmasının kötü prognozla ilişkili olduğu raporlanmıştır (18). Bizim çalışmamızda da literatürle benzer şekilde fatal seyreden olgularda CKİ ortancası daha yüksek bulunmuştur. İnfeksiyon tedavisinin yanında altta yatan kronik hastalıkların kontrolü ve bu hastalara multidisipliner yaklaşım mortaliteyi önlemek açısından önemlidir.
Hastalarımız bakteriyemi kaynağı odaklar açısından değerlendirildiğinde ise santral kateterle ilişkili bakteriyemi oranı oldukça yüksekti. İstatistiksel olarak anlamlı olmasa da ölen grupta belirgin düzeyde fazla görülmüştü. Literatürde geniş hasta popülasyonlarında yapılan çalışmalarda da santral kateter varlığının KDKp infeksiyonu için ve KDKp bakteriyemisi geçiren hastalarda kötü prognoz için risk faktörü olduğu bilinmektedir (19,20). Santral kateter uygulanmış hastalarda, kateter bakımlarının düzenli yapılması, kateter kullanımında infeksiyon kontrol önlemlerine dikkat edilmesi, gerekliliğinin her gün sorgulanması ve ihtiyaç olmayan kateterlerin çıkarılması, mortalite riskini azaltacaktır.
KDKp infeksiyonlarının tedavileri oldukça tartışmalı bir konudur. Kombinasyon tedavilerinin monoterapiyle karşılaştırılmasında farklı sonuçlara ulaşılmıştır (21,22). Kombinasyon tedavilerinin önerildiği grupta, etken in vivo olarak dirençli olsa da karbapenemlerin uzun infüzyon ve yüksek doz şeklinde verilmesi halinde bakterisidal etkisinin devam edeceği ve tedaviden klinik yanıt alınacağı belirtilmiştir. Bu konuda geniş hasta popülasyonlarında yapılan çalışmalarda ise meropenemin MİK ≤8 mg/lt olması halinde tedavide kullanılabileceği gösterilmiştir (9,16,23-26).
Kolistin, konsantrasyona bağımlı etki gösteren bakterisidal bir antibiyotiktir. KDKp için tekli olarak kullanımında direnç geliştiği gösterilmiştir. Karbapenemler ve tigesiklinle kullanımı önerilmektedir (27,28). Öte yandan kolistinin nefrotoksik etkisi, kolistin içermeyen kombinasyonları gündeme getirmiştir. Tigesiklin ve karbapenem kombinasyonu için de farklı öneriler mevcuttur. Tigesiklinin bakteriyostatik etkili olması kullanımını kısıtlamaktadır. Yan etkileri (bulantı vs.) nedeniyle de yüksek doz kullanımı sınırlıdır (28-31). Bizim çalışmamızda da kombinasyon tedavileriyle monoterapiler arasında mortalite açısından fark yoktu. Tüm kombinasyon tedavileri kolistin içermekteydi ve hiçbirinin diğer kombinasyon tedavisine üstünlüğü yoktu.
Beşinci günde klinik yanıtsızlık, kötü prognozu öngören faktörlerden biri olarak öne çıkmıştı. Klinik yanıtsızlık ise kolistin MİK değeriyle ilişkili bulundu. Buna göre kolistin MİK değerinin >2 olması yüksek mortaliteyle ilişkili olabilir. Bu noktada çalışmamızın bazı limitasyonları mevcuttu. Kolistin direnci ve MİK değeri belirlenmesi için mikrodilüsyon yöntemiyle çalışılması önerilmektedir. Hastanemizde rutinde mikrodilüsyon yöntemi çalışılmamaktadır. Çalışmamız retrospektif olduğu için otomatize sistem sonuçları mevcuttur.
Sonuç olarak, KDKp ile ilişkili kan dolaşımı infeksiyonlarının tedavisi zor ve mortalitesi yüksektir. Daha fazla prospektif çalışmayla kolistin direnç oranıyla klinik yanıt ve mortalite ilişkisi değerlendirilmesi, tedavi yaklaşımları için yol gösterici olacaktır.
Çıkar Çatışması
Yazarlar herhangi bir çıkar çatışması bildirmemiştir.
Referanslar
- Xu L, Sun X, Ma X. Systematic review and meta-analysis of mortality of patients infected with carbapenem-resistant Klebsiella pneumoniae. Ann Clin Microbiol Antimicrob. 2017; 16(1): 18.
- Tümtürk A, Tezer Tekçe AY, Şanal L. Nozokomiyal infeksiyon etkeni Gram negatif bakterilerde karbapenem direnç oranları: Üçüncü basamak bir hastaneden retrospektif bir çalışma. Ortadoğu Tıp Derg. 2019; 11(4): 422-6.
- Delle Rose D, Sordillo P, Gini S, et al. Microbiologic characteristics and predictors of mortality in bloodstream infections in intensive care unit patients: A 1-year, large, prospective surveillance study in 5 Italian hospitals. Am J Infect Control. 2015; 43(11): 1178-83.
- Liu P, Li X, Luo M, et al. Risk factors for carbapenem-resistant Klebsiella pneumoniae infection: A meta-analysis. Microb Drug Resist. 2018; 24(2): 190-8.
- Daikos GL, Tsaousi S, Tzouvelekis LS, et al. Carbapenemase-producing Klebsiella pneumoniae bloodstream infections: Lowering mortality by antibiotic combination schemes and the role of carbapenems. Antimicrob Agents Chemother. 2014; 58(4): 2322-8.
- Trecarichi EM, Tumbarello M. Therapeutic options for carbapenem-resistant Enterobacteriaceae infections. Virulence. 2017; 8(4): 470-84.
- Roberts JA, Kirkpatrick CM, Lipman J. Monte Carlo simulations: Maximizing antibiotic pharmacokinetic data to optimize clinical practice for critically ill patients. J Antimicrob Chemother. 2011; 66(2): 227-31.
- Cristina ML, Alicino C, Sartini M, et al. Epidemiology, management, and outcome of carbapenem-resistant Klebsiella pneumoniae bloodstream infections in hospitals within the same endemic metropolitan area. J Infect Public Health. 2018; 11(2): 171-7.
- Daikos GL, Markogiannakis A. Carbapenemase-producing Klebsiella pneumoniae: (When) might we still consider treating with carbapenems? Clin Microbiol Infect. 2011; 17(8): 1135-41.
- Sievert DM, Ricks P, Edwards JR, et al. Antimicrobial-resistant pathogens associated with healthcare-associated infections: Summary of data reported to the National Healthcare Safety Network at the Centers for Disease Control and Prevention, 2009-2010. Infect Control Hosp Epidemiol. 2013; 34(1): 1-14.
- Singer M, Deutschman CS, Seymour CW, et al. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3). JAMA. 2016; 315(8): 801-10.
- Clinical and Laboratory Standards Institute. Performance Standards for Antimicrobial Susceptibility Testing. 23rd Informational Supplement (M100-S232). Wayne, PA: CLSI, 2013.
- Ben-David D, Kordevani R, Keller N, et al. Outcome of carbapenem resistant Klebsiella pneumoniae bloodstream infections. Clin Microbiol Infect. 2012; 18(1): 54-60.
- Borer A, Saidel-Odes L, Riesenberg K, et al. Attributable mortality rate for carbapenem-resistant Klebsiella pneumoniae bacteremia. Infect Control Hosp Epidemiol. 2009; 30(10): 972-6.
- Falcone M, Bassetti M, Tiseo G, et al. Time to appropriate antibiotic therapy is a predictor of outcome in patients with bloodstream infection caused by KPC-producing Klebsiella pneumoniae. Crit Care. 2020; 24(1): 29.
- Tumbarello M, Trecarichi EM, De Rosa FG, et al. Infections caused by KPC-producing Klebsiella pneumoniae: Differences in therapy and mortality in a multicentre study. J Antimicrob Chemother. 2015; 70(7): 2133-43.
- Hussein K, Raz-Pasteur A, Finkelstein R, et al. Impact of carbapenem resistance on the outcome of patients’ hospital-acquired bacteraemia caused by Klebsiella pneumoniae. J Hosp Infect. 2013; 83(4): 307-13.
- Gomez-Simmonds A, Nelson B, Eiras DP, et al. Combination regimens for treatment of carbapenem-resistant Klebsiella pneumoniae bloodstream infections. Antimicrob Agents Chemother. 2016; 60(6): 3601-7.
- Zheng SH, Cao SJ, Xu H, et al. Risk factors, outcomes and genotypes of carbapenem-nonsusceptible Klebsiella pneumoniae bloodstream infection: A three-year retrospective study in a large tertiary hospital in Northern China. Infect Dis (Lond). 2018; 50(6): 443-51.
- Çalık S, Arı A, Sönmez U, et al. Bir eğitim ve araştırma hastanesinde Klebsiella pneumoniae kan dolaşımı enfeksiyonlarının klinik özellikleri ve mortalitenin değerlendirilmesi. İzmir Eğitim ve Araştırma Hastanesi Tıp Dergisi. 2019; 23(2): 75-81.
- Demiraslan H, Dinc G, Ahmed SS, et al. Carbapenem-resistant Klebsiella pneumoniae sepsis in corticosteroid receipt mice: Tigecycline or colistin monotherapy versus tigecycline/colistin combination. J Chemother. 2014; 26(5): 276-81.
- Falagas ME, Lourida P, Poulikakos P, Rafailidis PI, Tansarli GS. Antibiotic treatment of infections due to carbapenem-resistant Enterobacteriaceae: Systematic evaluation of the available evidence. Antimicrob Agents Chemother. 2014; 58(2): 654-63.
- Kuti JL, Dandekar PK, Nightingale CH, Nicolau DP. Use of Monte Carlo simulation to design an optimized pharmacodynamic dosing strategy for meropenem. J Clin Pharmacol. 2003; 43(10): 1116-23.
- Pea F, Viale P, Cojutti P, Furlanut M. Dosing nomograms for attaining optimum concentrations of meropenem by continuous infusion in critically ill patients with severe gram-negative infections: A pharmacokinetics/pharmacodynamics-based approach. Antimicrob Agents Chemother. 2012; 56(12): 6343-8.
- Pascale R, Giannella M, Bartoletti M, Viale P, Pea F. Use of meropenem in treating carbapenem-resistant Enterobacteriaceae infections. Expert Rev Anti Infect Ther. 2019; 17(10): 819-27.
- Daikos GL, Tsaousi S, Tzouvelekis LS, et al. Carbapenemase-producing Klebsiella pneumoniae bloodstream infections: Lowering mortality by antibiotic combination schemes and the role of carbapenems. Antimicrob Agents Chemother. 2014; 58(4): 2322-8.
- Dundar D, Duymaz Z, Genc S, Er DK, İrvem A, Kandemir N. In-vitro activities of imipenem-colistin, imipenem-tigecycline, and tigecycline-colistin combinations against carbapenem-resistant Enterobacteriaceae. J Chemother. 2018; 30(6-8): 342-7.
- Liang Q, Huang M, Xu Z. Early use of polymyxin B reduces the mortality of carbapenem-resistant Klebsiella pneumoniae bloodstream infection. Braz J Infect Dis. 2019; 23(1): 60-5.
- Hirsch EB, Tam VH. Detection and treatment options for Klebsiella pneumoniae carbapenemases (KPCs): An emerging cause of multidrug-resistant infection. J Antimicrob Chemother. 2010; 65(6): 1119-25.
- Borer A, Saidel-Odes L, Riesenberg K, et al. Attributable mortality rate for carbapenem-resistant Klebsiella pneumoniae bacteremia. Infect Control Hosp Epidemiol. 2009; 30(10): 972-6.
- Humphries RM, Kelesidis T, Dien Bard J, Ward KW, Bhattacharya D, Lewinski MA. Successful treatment of pan-resistant Klebsiella pneumoniae pneumonia and bacteraemia with a combination of high-dose tigecycline and colistin. J Med Microbiol. 2010; 59(Pt 11): 1383-6.
- Shen F, Han Q, Xie D, Fang M, Zeng H, Deng Y. Efficacy and safety of tigecycline for the treatment of severe infectious diseases: An updated meta-analysis of RCTs. Int J Infect Dis. 2015; 39: 25-33.