En Çok Okunanlar
Özet
Amaç: 2019 ve 2020 yılları için SARS-CoV-2 sansasyonel bir virus olmuştur. Maalesef henüz SARS-CoV-2’ye spesifik bir tedavi ajanı geliştirilememiştir. Favipiravir de SARS-CoV-2 tedavisinde deneysel olarak kullanılan antiviral ajanlardan biridir. Bu çalışmada hastanemizde kesin ve muhtemel COVID-19 tanısıyla yatan ve tedavisinin herhangi bir aşamasında favipiravir alan hastalarda görülen yan etkilerin sıklığının belirlenmesi ve bu sayede bilimsel literatüre katkıda bulunmayı amaçladık.
Yöntemler: Çalışmamız retrospektif gözlemsel tipte bir çalışmadır. 23 Mart 2020 – 31 Mayıs 2020 tarihleri arasında hastanemizde yatarak tedavi gören kesin ve muhtemel COVID-19 olguları belirlendi ve başlangıç veya ikincil tedavi olarak favipiravir alanlar çalışmaya dahil edildi. Hastaların demografik verileri, laboratuvar tetkikleri ve gözlenen yan etkiler kaydedildi ve veriler istatistiksel olarak analiz edildi.
Bulgular: Araştırmaya %37.3’ü (n=50) başlangıçta, diğerleri ikincil olarak favipiravir kullanan toplam 134 hasta dahil edildi. Hastaların yaş ortalaması 66.8±15.7 yıldı. Grubun %38.1’i (n=51) kadındı. Tüm grupta toplam 17 (%13) hastada yan etki tespit edildi. Tüm hastalarda hepatotoksisite, serum ürik asid artışı, nefrotoksisite, gastrointestinal yan etkiler, kardiyak yan etkiler sırasıyla %4.5, %4.5, %1.5, %1.5, %0.7 tespit edildi. Başlangıçta favipiravir başlanan ve daha sonradan favipiravir alan hastalar arasında yan etkiler açısından istatistiksel olarak anlamlı bir fark saptanmadı.
Sonuçlar: Bazı sonuçlar favipiravirin kısa dönemde güvenilirliğini desteklemekle birlikte uzun dönem etkileri için daha fazla çalışmaya ihtiyaç vardır. Özellikle hiperürisemi, QTc uzaması, gebelikte, laktasyon döneminde ve çocuklarda kullanımıyla ilgili çalışmalar yetersizdir. Favipiravir COVID-19 tedavisinde iyi bir alternatif olarak görünmekle birlikte güvenilirliği ile ilgili halen yeterli veri olmaması nedeniyle dikkatli kullanılmasında yarar vardır.
GİRİŞ
Koronavirus hastalığı (COVID-19) ve etkeni SARS-CoV-2 (Severe Acute Respiratory Syndrome Coronavirus-2) insanlık tarihinde şimdiden önemli bir yere sahip olmuştur. Bir yıldan kısa bir zamanda SARS-CoV-2 dünyanın dört bir yanına hızla yayılan bir pandemiye neden olmuştur. Dünya Sağlık Örgütü (DSÖ) verilerine göre 8 Eylül 2020 tarihi itibariyle dünya çapında COVID-19 nedeniyle yaklaşık 27 237 000 doğrulanmış vaka ve 891 000 ölüm tespit edilmiştir (1). Hastalık hafif üst solunum yolu infeksiyonu şeklinde seyredebildiği gibi, ciddi pnömoni, akut solunum sıkıntısı sendromu (ARDS) ve ölüme neden olabilmektedir. Bu nedenle erken aşamada etkin bir ilaçla tedaviye başlama kritik önem taşımaktadır (2).
Henüz SARS-CoV-2’ye özel bir tedavi ajanı geliştirilememiş, geniş spektrumlu antiviraller ise sadece deneysel olarak kullanılmaktadır (3). Mevcut tedavi seçeneklerinin kar-zarar etkinliği ve sonuçları net olarak bilinmediği için klinik çalışmalara COVID-19 hastalarının dahil edilmesi çok önemli ve gereklidir (4).
Favipiravir yeni bir RNA’ya bağlı RNA polimeraz (RdRp) inhibitörü türüdür(5). 2014 yılında Fujifilm Toyama firması tarafından Japonya’da geliştirilmiş ve ilk kez nöraminidaz inhibitörlerine dirençli influenza virusuna karşı, akabinde de Ebola ve Norovirus infeksiyonlarının tedavisinde kullanılmıştır (6,7). SARS-CoV-2 genomu, SARS-CoV ve MERS-CoV’a büyük oranda benzediği için pandeminin ilk günlerinden itibaren favipiravirin COVID-19 tedavisinde de etkili olabileceği düşünülmüştür (8). Ülkemizde de hidroksiklorokinle birlikte veya tek başına, orta ve ağır COVID-19 olgularında önerilmiştir (9).
Favipiravir kullanımında en sık beklenen yan etkiler; diyare, serum ürik asid düzeyinde artış, serum transaminaz (ALT, AST) düzeylerinde artış, nefrotoksisite ve nötrofil ve beyaz küre düzeyinde azalmadır. Daha seyrek olarak bulantı, kusma, karın ağrısı, ciltte kızarıklık, kaşıntı, deliryum, halüsinasyon gibi psikiyatrik semptomlar, konvülziyon gibi nörolojik semptomlar da görülebilir (10,11). Genellikle düşük dozlarda hafif yan etkileri olup iyi tolere edilirken, yüksek dozlarda daha sık yan etki görülmektedir (12,13).
Hayvan deneylerine dayanarak favipiravirin teratojenik olabileceği düşünülmektedir. Gebe, emziren ve çocuklarda kullanımına dair Ebola ile ilgili çok az sayıda klinik çalışma vardır. Ancak bu özel durumlarda COVID-19’da kullanımıyla ilgili herhangi bir veri yoktur (14-16).
Amacımız hastanemizde yatarak tedavi alan ve tedavisinin herhangi bir aşamasında favipiravir kullanılan kesin ve olası COVİD-19 olgularında görülen yan etkilerin retrospektif olarak taranarak sıklığının belirlenmesi ve bu sayede bilimsel literatüre katkıda bulunmaktır.
YÖNTEMLER
Çanakkale Onsekiz Mart Üniversitesi Sağlık Uygulama ve Araştırma Hastanesi’nde 23 Mart 2020 ve 31 Mayıs 2020 tarihleri arasında yatarak tedavi gören, kesin ve muhtemel tüm COVID-19 olguları belirlendi ve 18 yaşından büyük, başlangıçta veya hidroksiklorokin tedavisinden sonra ikincil olarak favipiravir kullananlar çalışmaya dahil edildi. Bu rejimler dışında COVID-19’a yönelik lopinavir/ritonavir gibi başka tedaviler alanlar çalışma dışında bırakıldı. Hastaların anamnezleri, laboratuvar tetkikleri retrospektif olarak taranarak demografik verileri, komorbiditeleri ve hastalarda gözlenerek epikrize kaydedilen veya laboratuvar tetkiklerinden saptanabilen tüm yan etkiler kaydedildi. Karaciğer fonksiyon testleri (KCFT) normalken favipiravir başlanmasını takiben eşik değerin 2 kat ve üzerinde alanin aminotransferaz (ALT) ve/veya aspartat amino transferaz (AST) artışı (≥70 IU/ml) veya KCFT normalden yüksek bir hastada favipiravir kullanımıyla ALT, AST’nin daha da artması ilaca bağlı hepatotoksisite olarak kabul edildi. Favipiravir başlandıktan sonra 1 hafta içinde serum kreatinin değerinde 0.3 mg/dl ve üzerinde bir artış gözlenmesi ilaca bağlı nefrotoksisite olarak kabul edildi. Favipiravir tedavisi başlandıktan sonra serum ürik asid değerinde tedavi öncesine kıyasla artış saptanması ilaç yan etkisi olarak değerlendirildi. Serum ürik asid eşik değeri 5.7 mg/dl olarak kabul edildi. Hastalar tedavinin başlangıcında favipiravir alanlar ve hidroksiklorokin sonrası favipiravir alanlar olarak 2 gruba ayrıldı ve veriler bu iki grup kıyaslanarak analiz edildi.
İstatistiksel Analiz
Veriler SPSS Paket Program 20.0 sürümü ile değerlendirildi. Tanımlayıcı verilerin sunumunda sayı, yüzde, ortalama, standard sapma, ortanca, minimum, maksimum kullanıldı. Kategorik değişkenlerin karşılaştırılmasında χ² testi kullanıldı. Değişkenlerin normal dağılıma uygunluğu Kolmogorov-Smirnov testi ile değerlendirildi. Normal dağılıma uymayan değişkenlerin karşılaştırılmasında Mann-Whitney U testi kullanıldı. İstatistiksel anlamlılık için p<0.05 kabul edildi.
BULGULAR
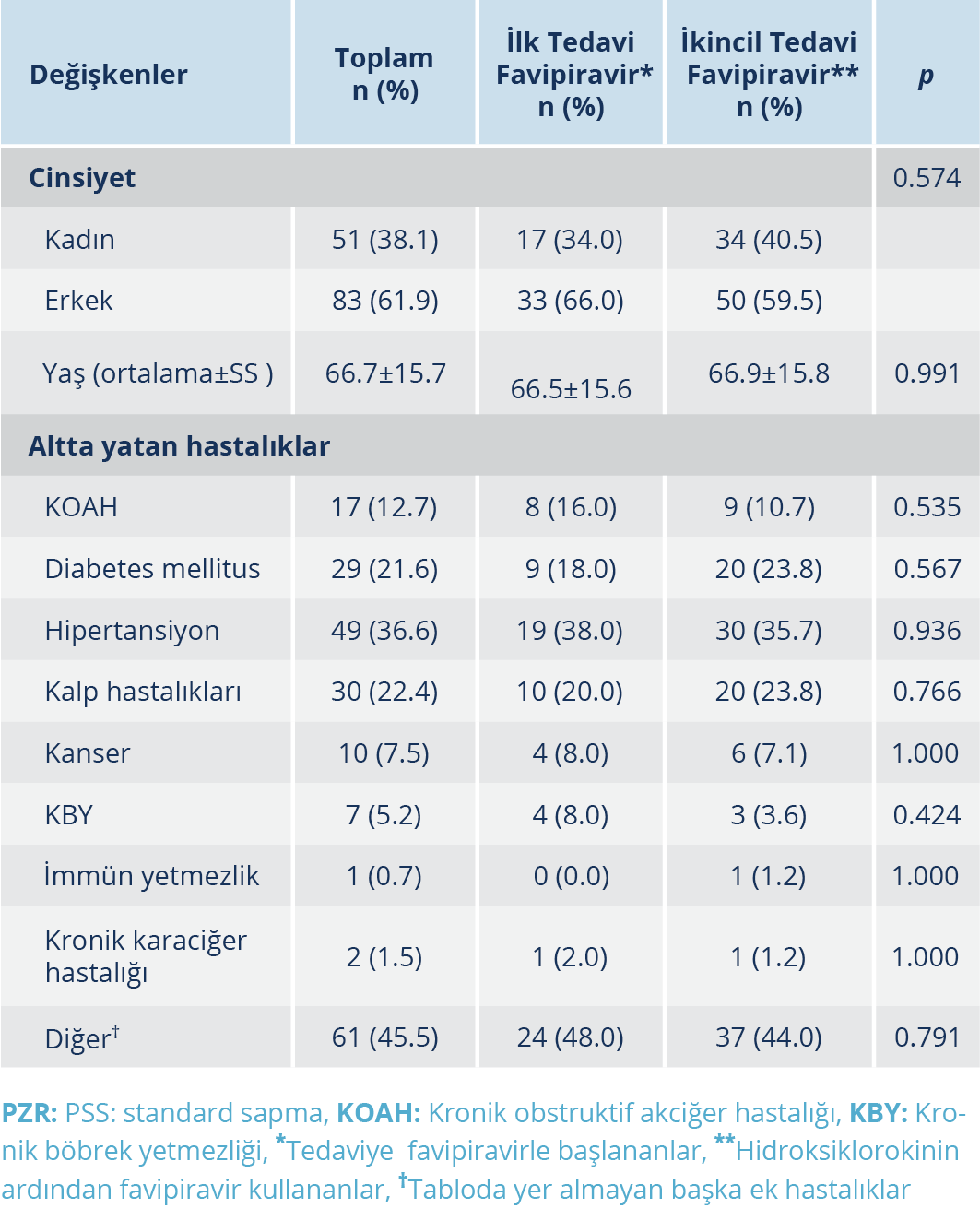
Primer tedavi olarak favipiravir alan tüm hastalar ilk gün 200 mg tb 2×8 po yükleme, takip eden 4 gün ise 2×3 tb/gün şeklinde toplam 5 gün kullanmıştı. Hidroksiklorokinden sonra favipiravir başlanan grup ise primer tedavi olarak hidroksiklorokin ilk gün 200 mg tb 2×2 po yükleme, ardından 4 gün 200 mg 2×1/gün idame olarak toplam 5 gün, ikincil olarak favipiravir 200 mg tb 2×8 po yükleme, takip eden 4 gün 2×3 tb/gün idame olarak toplam 5 gün kullanmıştı. Her iki tedavi seçeneğini de 5 günden uzun alan hasta yoktu. Hidroksiklorokin kullanan hastaların bir kısmı tek başına hidroksiklorokin bir kısmı ise hidroksiklorokinle eş zamanlı olarak 5 gün azitromisin kullanmıştı. Ancak COVID-19’a yönelik lopinavir/ritonavir, remdesivir, tocilizumab gibi başka bir ajan kullanan hasta yoktu. Favipiravir ve hidroksiklorokini eş zamanlı kullanan hasta yoktu. Araştırmaya %37.3’ü (n=50) başlangıçta favipiravir kullanan, %62.7’si (n=84) hidroksiklorokinin akabinde favipiravir başlanan toplam 134 hasta dahil edildi. Hastaların yaş ortalaması 66.8±15.7 yıldı. Başlangıçta ve sonradan favipiravir başlanan hastalar arasında yaş, cinsiyet ve ek hastalıklar açısından istatistiksel olarak anlamlı farklılık saptanmadı (p>0.05) (Tablo 1).
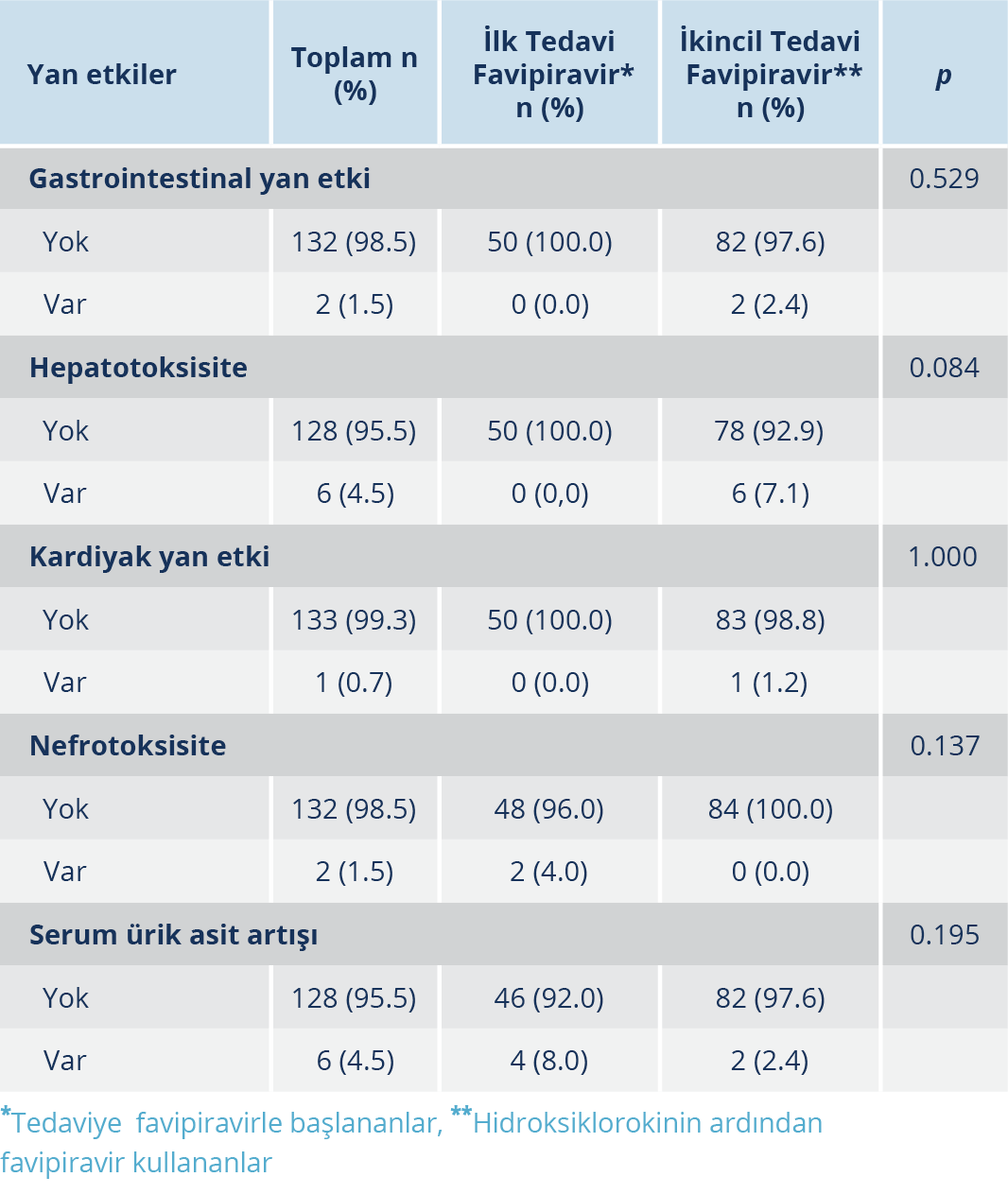
Tüm hasta grubu içinde toplam 17 hastada (%13) yan etki tespit edildi. Başlangıca göre serum ürik asid artışı 6 hastada (%4.5) gözlendi. Serum ürik asid için eşik değer 5.7 mg/dl olarak kabul edilmiş olup yan etki tespit edilen hastalarda ortalama değer 9.8±2.7(min:7-max:13) mg/dl’ydi. Hepatotoksisite oranı %4.5 (n=6) olarak tespit edilmiş olup söz konusu hastalarda ALT değeri 121±65.7(min:28-max:202) IU/ml, AST değeri 111±82.3(min:70-max:279) IU/ml’ydi. Kreatinin yüksekliği sadece favipiravirin ilk tedavi olarak başlandığı grupta bulunan 2 hastada saptanmış olup (1.3 ve 2.08 mg/dl) nefrotoksisite oranı %1.5 olarak saptandı. Gastrointestinal yan etki oranı %1.5 (n=2) olarak tespit edildi. Kardiyak yan etki ise tüm grupta %0.7 (n=1) oranında saptanmış olup, atrial fibrilasyon şeklindeydi. Başlangıçta favipiravir başlanan ve hidroksiklorokin sonrası favipiravir alan hastalar arasında yan etkiler açısından istatistiksel olarak anlamlı bir farklılık saptanmadı (p>0.05) (Tablo 2). Ancak hepatotoksisite, gastrointestinal sistem yan etkileri ve kardiyak yan etki gözlenen hastaların hepsi favipiravirin hidroksiklorokinden sonra ikincil tedavi olarak başlanan hasta grubundaydı. Nefrotoksisite sadece favipiravirin ilk olarak kullanıldığı grupta gözlenmiş olup, serum ürik asid artışı da yine bu ilk grupta daha yüksek oranda saptanmıştır (Tablo 2). Hastaların hiç birinde favipiravire bağlı bir hematolojik yan etki, cilt bulgusu, psikiyatrik veya nörolojik semptom tespit edilmemiştir.
İRDELEME
Favipiravirin COVID-19 tedavisindeki yeri halen tartışmalı olsa da etki mekanizması düşünüldüğünde önemli alternatifler arasındadır. Favipiravir kullanımı ülkemizde ve dünyada COVID-19 pandemisi nedeniyle artmıştır. Fakat favipiravirin güvenilirliği, bilinen yan etkilerinin sıklığı ve potansiyel yan etkileri hakkında literatür bilgisi kısıtlıdır. Bununla beraber devam eden ve sonuçları henüz bilinmeyen birçok klinik çalışma vardır.
Cai ve arkadaşlarının yaptığı favipiraviri lopinavir-ritonavirle kıyaslayan bir çalışmada 35 kişilik bir hasta grubunda %11.43 oranında yan etki tespit edilmiş ve favipiravir alan grupta lopinavir-ritonavir alan gruba göre daha az yan etki görülmüştür (p<0.001). Diyare %5.71, karaciğer ve böbrek hasarı %2.86 ve diğer yan etkiler %2.86 olarak bildirilmiştir (17).
Favipiravir ve arbidolle yapılan başka bir çalışmada ise favipiravir alan 116 hastanın %8.62’sinde yükselmiş karaciğer fonksiyon testleri, %4.31 psikiyatrik semptomlar, %13.79 gastrointestinal sistem semptomları, %13.79 oranında serum ürik asid artışı tespit edilmiştir (18). Bizim çalışmamızda da benzer şekilde hepatotoksisite %4.5 ile sık görülen yan etkilerden olmuş; gastrointestinal yan etkiler daha az oranda (%1.5) saptanmıştır. Ancak bizim çalışmamızda saptanan tüm hepatotoksik ve gastrointestinal yan etkiler favipiravirin bazen hidroksiklorokin, bazen hidroksiklorokin ve azitromisinden sonra ikincil olarak kullanıldığı hasta grubunda gözlenmiş olduğu için (Tablo 2), bu yan etkileri yalnızca favipiravirle ilişkilendirmek tam anlamıyla doğru olmayabilir. Ancak çalışmaya tedavi değişiminden önce gastrointestinal yan etki veya KCFT yüksekliği saptanmayan hastaların dahil edildiği düşünülecek olursa bu bulguları favipiravirden bağımsız değerlendirmek de oldukça güçtür. Başka bir açıdan bakacak olursak, COVID-19’un başvuru semptomları arasında bulantı, kusma, diyare gibi gastrointestinal semptomların başvuru anında da olması bu bulguların yatışın ilk günlerinde hastalığın seyriyle ilişkilendirilmiş olup var olandan daha az algılanmasına neden olmuş olabilir.
Pilkington ve ark. favipiravirin güvenilirliği hakkında sadece COVID-19’da değil İnfluenza ve Ebola infeksiyonlarının tedavilerindeki kullanımını kapsayan bir literatür taraması yapmışlardır. Çalışmanın sonunda gastrointestinal yan etkiler açısından favipiravirin (%8.7) kıyaslanan diğer tedavilerden (%11.5) belirgin olarak daha az yan etki gösterdiği saptanmıştır (p<0.0001). Aynı çalışmanın bir diğer önemli sonucu ise favipiravirin (%5.8) ürik asid seviyesini karşılaştırılan diğer seçeneklerden (%1.3) daha fazla arttırdığıdır (p<0.0001). Ürik asid artışının doz bağımlı olarak ortaya çıktığı, yaklaşık 21 günde normale döndüğü ve herhangi bir klinik belirtiye sebep olmadığı görülmüştür (12).
Favipiravirin, serum ürik asid düzeyindeki artışa idrarla ürik asid atılımını azaltarak sebep olduğu düşünülmektedir. İnfluenza için favipiravir ve oseltamivir etkinliğinin kıyaslandığı bir faz 3 çalışmasında favipiravir verilen grupta kan ürik asid seviyesinin oseltamivir alan gruptan yüksek olduğu bildirilmiştir (%5.6) (19). Bizim çalışmamızda ürik asid yüksekliği %4.5 oranıyla en sık görülen yan etkilerden biri olmuştur. Favipiravirin başlangıç tedavi olarak uygulandığı ilk grupta ikincil tedavi olarak başlanan gruba göre daha yüksek oranda (sırasıyla %8 ve %2.4) tespit edilmiştir. Ancak serum ürik asid değerinin rutin istenen tetkikler arasında olmayışı nedeniyle tüm hastalara bakılamamış olması bu veriler üzerinden bir sonuca varmak için yeterli olmayabilir.
Favipiravirin, nefrotoksisite yapabileceği ve kreatinin klirensi düşük (<30) hastalarda kullanılmaması gerektiği hakkında literatür bilgisi mevcuttur. Böbrek yetmezliği olan hastalarda da atılımın azalmasına bağlı serum ürik asid seviyesinde artış olabileceği için bu hastalarda favipiravir dikkatli kullanılmalıdır (13). Çalışmamızda da favipiravir alan hastalarda %1.5 (n=2) oranında nefrotoksisite tespit edilmiştir ve nefrotoksisite saptanan hastaların hepsi favipiraviri primer olarak kullanan ilk gruptadır. COVID-19 tedavisinde sınırlı sayıda tedavi seçeneği olduğu düşünülürse başlangıçta favipiravir tedavisi tercih edilen hastalar daha ziyade başvuru anında daha kritik ve ağır seyirli olgulardır. Bu yüzden bu grupta kreatinin artışını favipravirin nefrotoksik etkisine bağlı olabileceği gibi COVID-19 seyrinin ağırlığı ile de ilişkili olabilir.
Özellikle yüksek dozlarda favipiravirin kardiyak yan etki olarak QTc mesafesini uzattığını bildiren çalışmalar literatürde mevcuttur (12,20,21). Ancak yakın zamanda Japonya’da sağlıklı gönüllüler üzerinde yapılan ve pozitif kontrol olarak moksifloksasinin kullanıldığı bir çalışmada favipiravirin QT aralığı üzerine herhangi bir etkisi tespit edilmemiştir (12). Bizim çalışmamızda ise sadece bir kişide (%0.7) kardiyak yan etki saptanmıştır. Bu hastada ise QT uzaması şeklinde değil yeni başlayan atrial fibrilasyon (AF) olarak gözlenmiştir. Tek hastada saptanan bu kardiyak yan etki favipiravirin, hidroksiklorokin sonrası başlandığı hasta grubundadır. Bu durum hastanın daha önceden bilinmeyen bir AF öyküsünün olup olmadığı veya hidroksiklorokin kardiyak yan etkileriyle ön plana çıktığı için, hidroksiklorokine bağlı olarak gelişmiş olabileceği sorusunu akıllara getirmektedir. Ancak hidroksiklorokin kullanan hastalarda tedavi başlanmadan önce mutlaka EKG çekilmesi ve rutin EKG ile hastaların takip ediliyor olması nedeniyle bu yan etkinin favipiravire bağlı gelişmiş olması daha olası gözükmektedir. Literatürde favipiravirin atrial fibrilasyona neden olabildiğine dair veri olmamakla birlikte, bu konuda yorum yapabilmek için elbette daha çok kişiyi kapsayan uzun soluklu çalışmalara ihtiyaç vardır. Bu dönemde favipiravirin oldukça yaygın kullanımı nedeniyle bu hastada olduğu gibi bilinmeyen başka potansiyel yan etkilerinin de ortaya çıkması mümkündür.
Hastalarda hematolojik bir yan etki saptanmamıştır. Ayrıca herhangi bir psikiyatrik, nörolojik semptom veya cilt bulgusu da gözlenmemiştir. Bulaş riski veya tedirginliği nedeniyle sınırlı sayıda hasta viziti ve fizik muayenenin her gün ayrıntılı yapılamaması nedeniyle minör bulgular gözden kaçmış olabilir. Ayrıca çalışmanın retrospektif olması ve olgu sayısının az olması gibi kısıtlılıklar nedeniyle de bu gibi daha seyrek görülen yan etkilere rastlanmamış olması muhtemeldir. Çalışmada analiz edilen iki grup arasında yan etkiler arasından oransal farklar bulunmasına rağmen istatistiksel olarak anlamlı fark bulunmaması da yine çalışmanın bu kısıtlılıkları ile ilgili olabilir.
Sonuç olarak favipiravirin kısa dönemde güvenilirliğini ve tolerabilitesini destekleyen sonuçlar vardır ve bizim çalışmamızda bunu destekler niteliktedir. Ancak uzun dönem etkileri, potansiyel ve daha seyrek görülen yan etkilerin sıklığını belirlemek için daha geniş çaplı, randomize, kontrollü çalışmalara ihtiyaç vardır. Favipiravir COVID-19 tedavisinde iyi bir alternatif gibi görünmekle birlikte güvenilirliği ile ilgili halen yeterli veri olmaması nedeniyle dikkatli kullanılmasında yarar vardır.
Hasta Onamı
Retrospektif gözlemsel tipte bir çalışma olduğu için alınmamıştır.
Etik Kurul Kararı
Çalışma için T.C. Sağlık Bakanlığı, Sağlık Hizmetleri Genel Müdürlüğü COVID-19 Bilimsel Araştırma Değerlendirme Komisyonu’ndan 04.05.2020 tarihinde ve Çanakkale Onsekiz Mart Üniversitesi Klinik Araştırmalar Etik Kurulu’ndan 03.06.2020 tarih ve 2020-08 karar numarasıyla onay alınmıştır.
Danışman Değerlendirmesi
Bağımsız dış danışman.
Yazar Katkıları
Fikir/Kavram – A.Ş.; Tasarım – A.Ş., S.A.Ç., E.D.; Denetleme – A.Ş., S.A.Ç., U.G., T.Ş.; Malzemeler/Hastalar – A.Ş., U.G., T.Ş.; Veri Toplama ve/veya İşleme – E.D., A.A., M.H.U.; Analiz ve/veya Yorum – E.D., B.Y.; Literatür Taraması – E.D., A.A.; Makale Yazımı – E.D., A.A.; Eleştirel İnceleme- A.Ş., S.A.Ç., U.G.
Çıkar Çatışması
Yazarlar herhangi bir çıkar çatışması bildirmemiştir.
Finansal Destek
Yazarlar finansal destek beyan etmemişlerdir.
Referanslar
- WHO Coronavirus Disease (COVID-19) Dashboard [İnternet] [erişim 08 Eylül 2020]. https://covid19.who.int/
- Hoffmann C., Kamps BS [İnternet] Covid Reference, Edition 2020-2. Stein Hauser Verlag; Amedeo, Germany; 2020. [erişim 12 April 2020]. https://covidreference.com
- Kalil AC. Treating COVID-19—Off-Label drug use, compassionate use, and randomized clinical trials during pandemics. JAMA 2020; 323(19):1897–1898. [CrossRef]
- McCreary EK, Pogue JM. Coronavirus Disease 2019 Treatment: A review of early and emerging options, Open Forum Infectious Diseases, Volume 7, Issue 4, April 2020, ofaa105. [CrossRef]
- Lam S, Lombardi A, Ouanounou A. COVID-19: A review of the proposed pharmacological treatments. Eur J Pharmacol. 2020 Nov 5;886:173451. [CrossRef]
- Furuta Y, Komeno T, Nakamura T. Favipiravir (T-705), a broad spectrum inhibitor of viral RNA polymerase. Proc Jpn Acad Ser B Phys Biol Sci. 2017;93(7):449–463 [CrossRef]
- De Clercq E. New nucleoside analogues for the treatment of hemorrhagic fever virus infections. Chem Asian J. 2019;14(22):3962–3968. [CrossRef]
- Gautret P, LagierJG, Parola P, Hoang VT, Meddeb L, et al. Hydroxychloroquine and azithromycin as a treatment of COVID-19: Results of an open-label non-randomized clinical trial. Int J Antimicrob Agents. 2020 Jul;56(1):105949. [CrossRef]
- T.C. Sağlık Bakanlığı COVID-19 Tedavi Rehberi [İnternet] [erişim 05 Nisan 2020]. https://covid19bilgi.saglik.gov.tr/depo/rehberler/COVID-19_Rehberi.pdf
- Chen C, Huang J, Cheng Z, Wu J, Chen S, Zhang Y, et al. (2020). Favipiravir versus arbidol for COVID-19: A randomized clinical trial.
- medRxiv 2020.03.17.20037432 [CrossRef]
- Avigan Tablets 200 mg [İnternet] [erişim 10 Eylül 2020 ] https://www.cdc.gov.tw/File/Get/ht8jUiB_MI-aKnlwstwzvw
- Pilkington V, Pepperrell T, Hill A. A review of the safety of favipiravir – a potential treatment in the COVID-19 pandemic? J Virus Erad. 2020 Apr 30;6(2):45-51. [CrossRef]
- Sanders JM, Monogue ML, Jodlowski TZ, Cutrell JB. Pharmacologic treatments for coronavirus disease 2019 (COVID-19): A review. JAMA. 2020;323(18):1824–1836. [CrossRef]
- Report on the deliberation results – Avigan, Evaluation and Licensing Division, Pharmaceutical and Food Safety Bureau Ministry of Health, Labour and Welfare , March 30, 2011. [İnternet] [erişim 10 Nisan 2020] www.pmda.go.jp/files/000210319.pdf
- Bouazza N, Treluyer JM, Foissac F, et al. Favipiravir for children with Ebola. Lancet. 2015 Feb 14;385(9968):603-604. [CrossRef]
- WHO Guidelines for the management of pregnant and breastfeeding women in the context of Ebola virus disease, Feb 9, 2020.
- Cai Q, Yang M, Liu D, Chen J, Shu D et al. Experimental treatment with favipiravir for COVID-19: An open-label control study. Engineering 2020 Oct;6(10):1192-1198. [CrossRef]
- Chen C, Huang J, Cheng Z, et al. (2020). Favipiravir versus arbidol for COVID-19: A randomized clinical trial. medRxiv: 2020.03.17.20037432 [CrossRef]
- Mishima E, Anzai N, Miyazaki M, Abe T. Uric acid elevation by favipiravir, an antiviral drug. Tohoku J Exp Med. 2020 Jun;251(2):87-90. [CrossRef]
- Chinello P, Petrosillo N, Pittalis S, et al. QTc interval prolongation during favipiravir therapy in an Ebolavirus-infected patient. PLoS Negl Trop Dis. 2017 Dec 28;11(12):e0006034. [CrossRef]
- Naksuk N, Lazar S, Peeraphatdit TB. Cardiac safety of off-label COVID-19 drug therapy: a review and proposed monitoring protocol. Eur Heart J Acute Cardiovasc Care. 2020 Apr;9(3):215-221. [CrossRef]