En Çok Okunanlar
Özet
Amaç: Sitokin fırtınası ile karşımıza çıkabilen şiddetli COVID-19 olgularının tedavi protokollerinde immünosüpresif ilaçlar yer alabilmektedir. Bu çalışmada COVID-19 olgularında immünosüpresif tedavi uygulanan hastaların özelliklerinin incelenmesi amaçlanmıştır.
Yöntemler: 01 Mart – 31 Mayıs 2020 tarihleri arasında hastanemiz karantina servisinde takip edilen COVID-19 tanılı 18 yaş ve üzeri 263 hasta çalışmaya dahil edildi. Hasta bilgileri retrospektif olarak hasta dosyalarından ve epikrizlerden elde edildi.
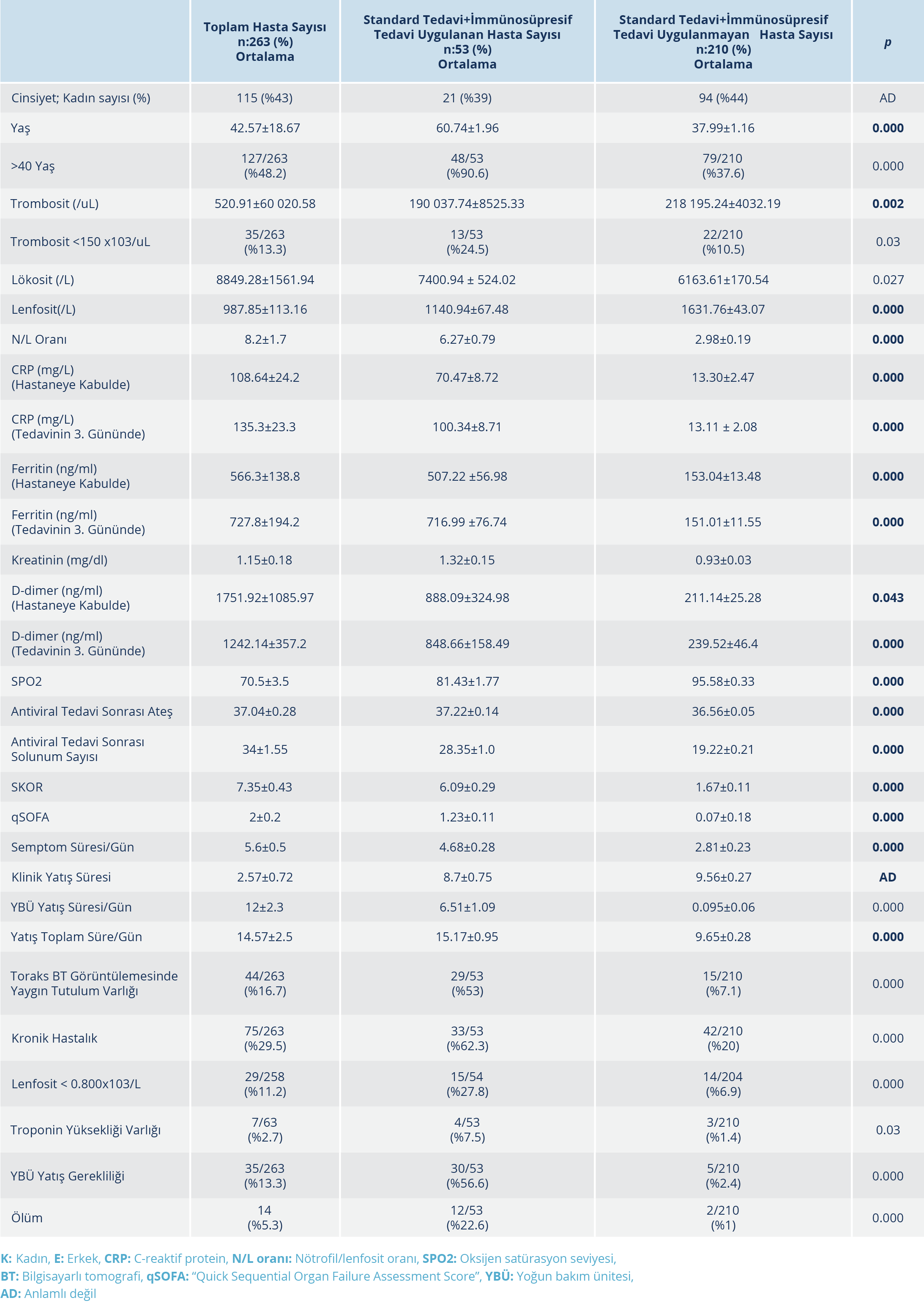
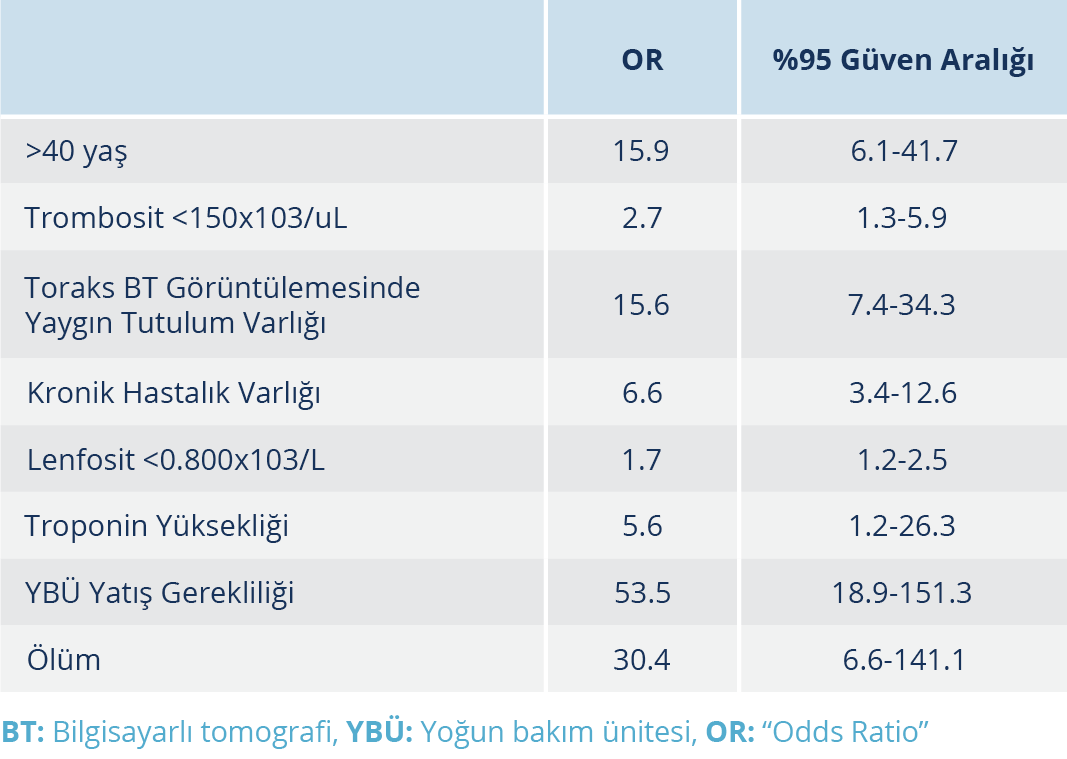
Bulgular: İmmünosüpresif tedavi uygulanan hastaların yaş ortalaması 60.74±1.96 olup bunların %39.6’sı kadındı. Çalışmada incelenen hastaların hastaneye başvuru anındaki semptom süresinin ortalama 4.59±0.29 gün olduğu görüldü. İmmünosüpresif tedavi uygulanma durumuna göre oluşturulan iki grup arasında; yaş, lenfosit sayısı, nötrofil/lenfosit oranı, C-reaktif protein, ferritin, D-dimer, kan oksijen satürasyonu, antiviral tedavi sonrası ateş değeri, “quick Sequential Organ Failure Assessment” (qSOFA) skoru ve toplam yatış süreleri arasında anlamlı fark bulunduğu tespit edildi (p<0.05). İmmünosüpresif tedavi ihtiyacının >40 yaş üzerinde 15.9 kat, toraks BT’de yaygın tutulum varlığında 15.6 kat, kronik hastalık eşlik ettiğinde 6.6 kat, trombositopeni varlığında 2.7 kat ve lenfopeni varlığında 1.7 kat arttığı saptandı (p<0.05).
Sonuçlar: Tedavi protokollerine immünosüpresif tedavi eklenen hastaların; başvuru esnasında semptom süresi daha uzun olan diğer bir değişle hastaneye daha geç başvuran, radyolojide patolojik tutulumu daha fazla ve yaygın olan, akut faz reaktanları yüksek, SPO2 seviyesi düşük ve birden fazla kronik hastalığa sahip bireyler olduğu görüldü.
GİRİŞ
Şiddetli akut solunum sendromu virusu (SARS-CoV-2) ile ilişkili infeksiyon ilk kez Aralık 2019’da Çin’in Hubei eyaletinde bulunan Vuhan şehrinde saptanmış olup altı aydan daha kısa bir sürede dünya geneline yayılarak küresel bir salgına sebep olmuştur (1). Virusun infektivitesinin yüksek olması, tedavide etkili bir antiviral ajanın bulunmaması ve infeksiyonun yüksek oranda asemptomatik seyretmesi nedenlerinden dolayı koronavirus hastalığı 2019 (COVID-19)’un tedavi yönetimi ve pandeminin kontrol altına alınması oldukça güç olmaktadır (2). Çeşitli klinik tablolarla karşımıza çıkan COVID-19’un özellikle risk faktörü yüksek hastalarda; şiddetli sitokin fırtınası sendromuna, akut solunum yetmezliği sendromuna (“acute respiratory distress syndrome”, ARDS), doku perfüzyon bozukluklarına, septik şoka ve çoklu organ yetmezliğine ve hatta ölüme neden olduğu görülmektedir (3, 4). Sekonder hemofagositik lenfohistiyositoz (sHLH) sendromu, çoklu organ yetmezliğine yol açan fülminan ve fatal hipersitokinemiyle karakterize hiperinflamasyon sendromu olup COVID-19 infeksiyonu gibi viral infeksiyonlarla tetiklenebilmektedir (5). Şiddetli COVID-19 gelişen hastalar için bildirilen olgu serileri ve gözlemler sonucunda potansiyel patogenezin sitokin salınım sendromu olduğu düşünülmekte olup şiddetli tablonun sHLH ile karakterize olduğu öne sürülmektedir (6). Sitokin salınım sendromu; abartılmış ve kontrolsüz inflamatuar sitokin üretimi [başlıca interlökin-6 (IL-6), interlökin-10 (IL-10) ve tümör nekroz faktör-α (TNF- α)] olarak tanımlanmaktadır (2, 7). Bu durum, her ne kadar güvenlik ve etkinliği kesin olarak belirlenmiş olmasa da COVID-19 hasta grubunda anti-sitokin ve kortikosteroid tedavilerinin tercih edilmesine yol açmıştır (3). İnterlökin-6 reseptör antagonistleri, Amerikan Gıda ve İlaç Dairesi (“U.S. Food and Drug Administration”, FDA) tarafından sitokin fırtınası sendromu tedavisinde onaylanmıştır (8). COVID-19 infeksiyonunun indüklediği sitokin fırtınasında, interlökin-6’nın anahtar rolü olduğu düşünüldüğünden, tedavide tosilizumab kullanılması gündeme gelmiştir (9). Birçok ülkenin COVID-19 tedavi rehberinde, sitokin fırtınası ve/veya ARDS gelişen kritik hastaların tedavisinde kortikosteroid ve IL-6 antagonistleri yer almaktadır (10-12). Buna karşın, COVID-19 tedavisinde immünosüpresif tedavilerin başlanma zamanı hakkında farklı görüşler bulunmakta ve HLH skorlamalarının COVID-19 olguları için her zaman yeterli olamayacağı düşünülmektedir (12). Çalışmamızda kliniğimizde yatırmak suretiyle takip ettiğimiz COVID-19 olgularında immünosüpresif tedavi alan ve almayan hasta gruplarının karşılaştırmalı olarak değerlendirilmesi amaçlanmıştır. Bunun yanında, hastalığın şiddetini saptamada T.C. Sağlık Bakanlığı COVID-19 Erişkin Hasta Tedavisi Rehberi’nde belirtilen kötü prognostik faktörler ve HLH skorlamasında kullanılan parametrelerden seçilen 13 kötü prognostik parametreden oluşan bir skorlama algoritmasının, immünosüpresif tedavi alan ve almayan hastalar ile mortalite gelişen ve gelişmeyen hastalarda karşılaştırılması ve mortaliteyi tahmin ettirmedeki duyarlılık ve özgüllüğü araştırılmıştır (12).
YÖNTEMLER
Çalışma 01 Mart -31 Mayıs 2020 tarihleri arasında, üçüncü basamak bir eğitim araştırma hastanesinde yürütüldü. Hastane, 1500 yatak kapasiteli olup 62 erişkin yoğun bakım yatak kapasitesine sahiptir. Çalışmaya T.C. Sağlık Bakanlığı COVID-19 Erişkin Hasta Tedavisi Rehberi’ne göre COVID-19 tanısı koyularak yoğun bakım ünitesi (YBÜ) ve servislerde takip edilen 18 yaş üzeri 263 hasta dahil edildi. COVID-19 tanısının laboratuvar doğrulaması, hastaların nazofaringeal sürüntü örneklerinde SARS-CoV-2 “real-time” polimeraz zincir reaksiyon testi (RT-PCR) pozitifliğinin gösterilmesiyle yapıldı. Hastaların tamamı yatırılarak tedavi edilmiş olup tedavi süresince Sağlık Bakanlığı’nın yayınladığı rehberde önerilen standard tedavi algoritmaları uygulandı (12).
Standard tedavi verilen hasta gruplarında antiviral tedavi olarak; hidroksiklorokin ve/veya favipravir kullanıldı. Pnömoni saptanan olgularda bakteriyel infeksiyonun eşlik ettiği düşünüldüğünde, infeksiyonun şiddetine göre ampirik olarak levofloksasin, azitromisin ve sefalosporin türevleriyle monoterapi veya kombinasyon tedavisi (sefalosporin + levofloksason / sefalosporin + azitromisin) antiviral tedaviye eklendi. Antimikrobiyal ve antiviral tedaviye ek olarak antikoagülan, mukolitik ve antiasit tedavileri T.C. Sağlık Bakanlığı COVID-19 Erişkin Hasta Tedavisi Rehberi’nde belirtilen doz ve endikasyonlarda uygulandı.
Karantina servisi veya YBÜ’nde takip edilen hastalarda, dirençli ateş (>37.8 0C), CRP yüksekliği, normalin üst sınırlarının üzerinde ve artış eğiliminde olan ferritin değerleri (>500μg/L), D-dimer yüksekliği, lenfopeni (<0.800×103/uL), trombositopeni (<150 x103/uL), karaciğer fonksiyon testlerinde (ALT, AST, LDH) patoloji olması durumunda, klinisyen tercihine göre tek başına steroid, steroid ve tosilizumab ardışık olarak yada sadece tosilizumab olacak şekilde standard tedavilere, immünosüpresif tedaviler eklendi. Hastalarda ko-infeksiyon ve sekonder infeksiyonun dışlanmasında; kan kültürü negatifliğinin olması, spontan balgam çıkaran hastalarda balgam kültüründe üreme olmaması ve normal prokalsitonin değerleri esas alındı. Sitokin fırtınası ya da hemofogositoz düşünülen hastaların standard tedavilerine klinisyenin tercihine göre ek olarak kortikosteorid (metilprednizolon 1 mg/kg dozunda 5-7 gün) ve/veya IL-6 blokörü (tosilizumab 8 mg/kg, maks. 800 mg) ardışık iki doz şeklinde intravenöz olarak uygulandı.
Tocilizumab tedavisi, şüpheli ya da doğrulanmış bakteriyel infeksiyon varlığı, aktif divertikülit varlığı ya da gastrointestinal perforasyon varlığı, nötropeni (0.500×103 hücre/uL) ve trombositopeni (50×103 hücre/uL) varlığı durumlarında uygulanmadı. ARDS tanısı konulan hastaların tedavilerine, kortikosteorid tedavisi eklendi. Kan şekeri regülasyonu sağlanamayan diabetes mellitus (DM) varlığı, kontrolsüz hipertansiyon, kalp yetmezliği ve periferal ödem, katarakt, glokom, peptik ülser hastalığı, bakteriyel infeksiyon varlığı, düşük kemik dansitesi ve/veya osteoporozu bulunan hastalara kortikosteroid tedavisi uygulanmadı (13).
ARDS, aşağıda belirtilen üç patolojik kriterin bir arada olması olarak tanımlandı (12):
- Son bir haftada ortaya çıkan veya kötüleşen solunum sıkıntısı,
- Radyolojik olarak plevral efüzyon, kollaps ile açıklanamayan bilateral multilober buzlu cam dansiteleri,
- Kalp yetmezliği veya volüm fazlalığı ile açıklanamayan solunum yetmezliği (transtorasik ekokardiyografi ile sol ventrikül disfonksiyonunun olmadığının gösterilmesi).
ARDS şiddeti; hafif [200<PaO2/FiO2 ≤ 300 (PEEP ≥ 5 cmH20)], orta [100<PaO2/FiO2 ≤ 200 (PEEP ≥ 5 cmH20)] ve ağır [PaO2/FiO2 ≤ 100 (PEEP ≥ 5 cmH20)] olarak sınıflandırıldı.
“Quick” SOFA (qSOFA) Skoru
“Quick” SOFA (qSOFA) skoru, YBÜ dışındaki hastaları değerlendirmek ve sepsis açısından ölüm riski olan hastaları erken belirlemek amacıyla; solunum sayısı, sistolik kan basıncı ve mental durum değişikliği şeklinde üç parametreden oluşan bir skorlama sistemidir. “Sequential Organ Failure Assessment Score” (SOFA)’un modifiye şekli olup hastalarda daha hızlı septik tablo varlığını belirlemek amacıyla “Quick” SOFA (qSOFA) olarak adlandırılan skorlama sistemi kullanılmıştır (14). Hastalar yatak başında kolaylıkla belirlenebilen, solunum sayısı ≥22/dk., mental durumda bozulma-Glaskow Koma Skalası ≤13 ve sistolik kan basıncı ≤100 mmHg özelliklerinin her biri için birer puan alır.
Hastalara, klinisyenlerin tercihlerine göre farklı etki mekanizmaları olan immünosüpresif tedaviler uygulandı. Hastalar etki mekanizmalarından bağımsız olarak, immünosüpresif tedavi verilen ve verilmeyen olarak iki gruba ayrıldı ve analizler bu gruplamaya göre yapıldı. T.C. Sağlık Bakanlığı COVID-19 Erişkin Hasta Tedavisi Rehberi’nde belirtilen kötü prognostik faktörlerin yanı sıra HLH skorlamasında kullanılan parametrelerle 13 kötü prognostik parametrelik bir skorlama algoritması oluşturuldu. Prognostik faktörlerin ortalama değerleri, immünosüpresif tedavi alan ve almayan hastalar ile mortalite gelişen ve gelişmeyen hastalarda karşılaştırılarak hastalığın şiddeti ve mortaliteyi tahmin ettirmedeki duyarlılık ve özgüllüğü araştırıldı.
Mortalitenin öngörülebilmesinde kullanılabilecek skorlama sisteminde aşağıdaki parametreler kullanıldı ve her bir parametreye birer puan verilerek toplam skor hesaplandı:
- Antiviral tedaviye rağmen tedavinin 48. ve 72. saatleri arasında 37.8 0C ve üzeri ateşin devam etmesi,
- Bilgisayarlı tomografi (BT)’de bilateral yaygın buzlu cam görünümü varlığı,
- C-reaktif protein (CRP) değerinin 48-72 saatlik dönemde progresyonu,
- Ferritin değerinin 500 ng/ml ve üzerinde olması,
- D-dimer değerinde yatışa göre 2 kat artış olması,
- Takiplerde derinleşen lenfopeni (<0.800×103/uL),
- Trombositopeni (<150 x103/uL) eşlik etmesi,
- Troponin yüksekliği saptanması,
- Tedaviye rağmen solunum sayısının 30/dk. üzerinde olması,
- Oksijen satürasyonunun %75-85 arasında seyretmesi,
- En az iki komorbid faktörün eşlik ediyor olması,
- 40 yaş ve üzeri olmak,
- Erkek cinsiyet.
İstatistiksel Analizler
İstatistiksel analiz, “IBM SPSS Statistics for Windows. Version 22.0 (Statistical Package for the Social Sciences” (IBM Corp., Armonk, NY, ABD)” programı kullanılarak gerçekleştirildi. Verilerin normal dağılıma uygunluğu Kolmogorov-Smirnov testi ile değerlendirildi. Gruplar arasındaki farklılıkların karşılaştırılması kapsamında; kategorik değişkinlerden bağımsız grup oranlarının karşılaştırılması için χ2 ve Fisher kesin olasılık testleri, bağımlı grup oranlarının karşılaştırılması için McNemar testi kullanıldı. Sayısal değişkenlerden bağımsız iki grup ortalamasının karşılaştırılması kapsamında; normal dağılım gösteren gruplar için Student t testi ve normal dağılım göstermeyen gruplar için Mann-Whitney U testi kullanıldı. Skorlama sisteminin mortaliteyi tahmin ettirmedeki duyarlılık ve özgüllüğü ROC (“Receiver Operating Characteristics”) analizi ile değerlendirildi.
P değerinin 0.05’ten küçük olması istatistiksel olarak anlamlı kabul edilmiş olup p=0.000 olan değerler p<0.001 olarak raporlandı.
Çalışmamız için Sağlık Bakanlığı’ndan 30 Nisan 2020 tarihinde izin ve Sağlık Bilimleri Üniversitesi Van Eğitim Araştırma Hastanesi Etik Kurulu’ndan 18 Haziran 2020 tarih ve 2020/11 karar numarasıyla onay alındı.
BULGULAR
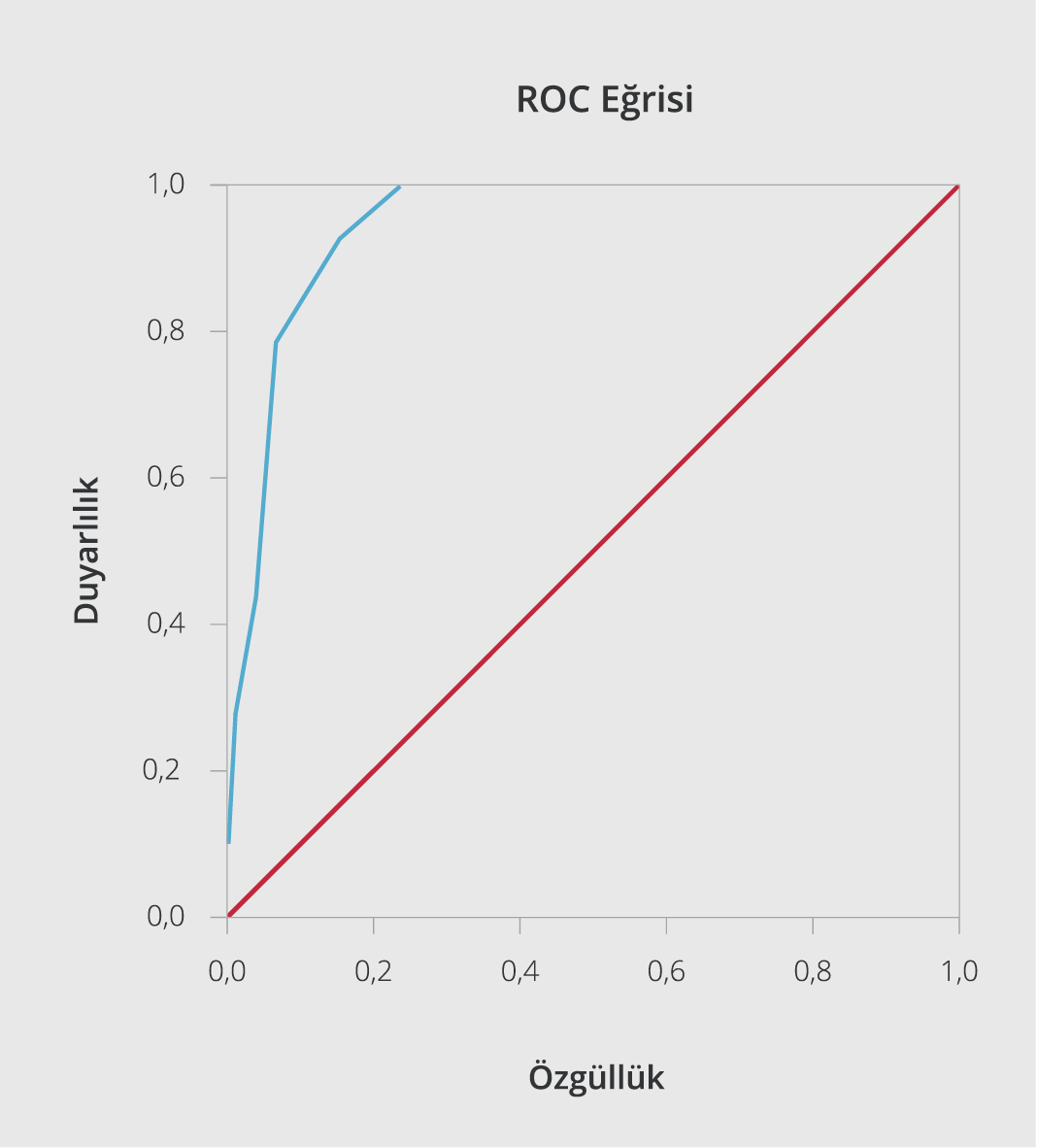
Şekil 1a. Risk skorlamasının mortaliteyi tahmin ettirmedeki etkinliği. Skor>4 mortaliteyi tahmin etmede Duyarlılık %93, Özgüllük %84.
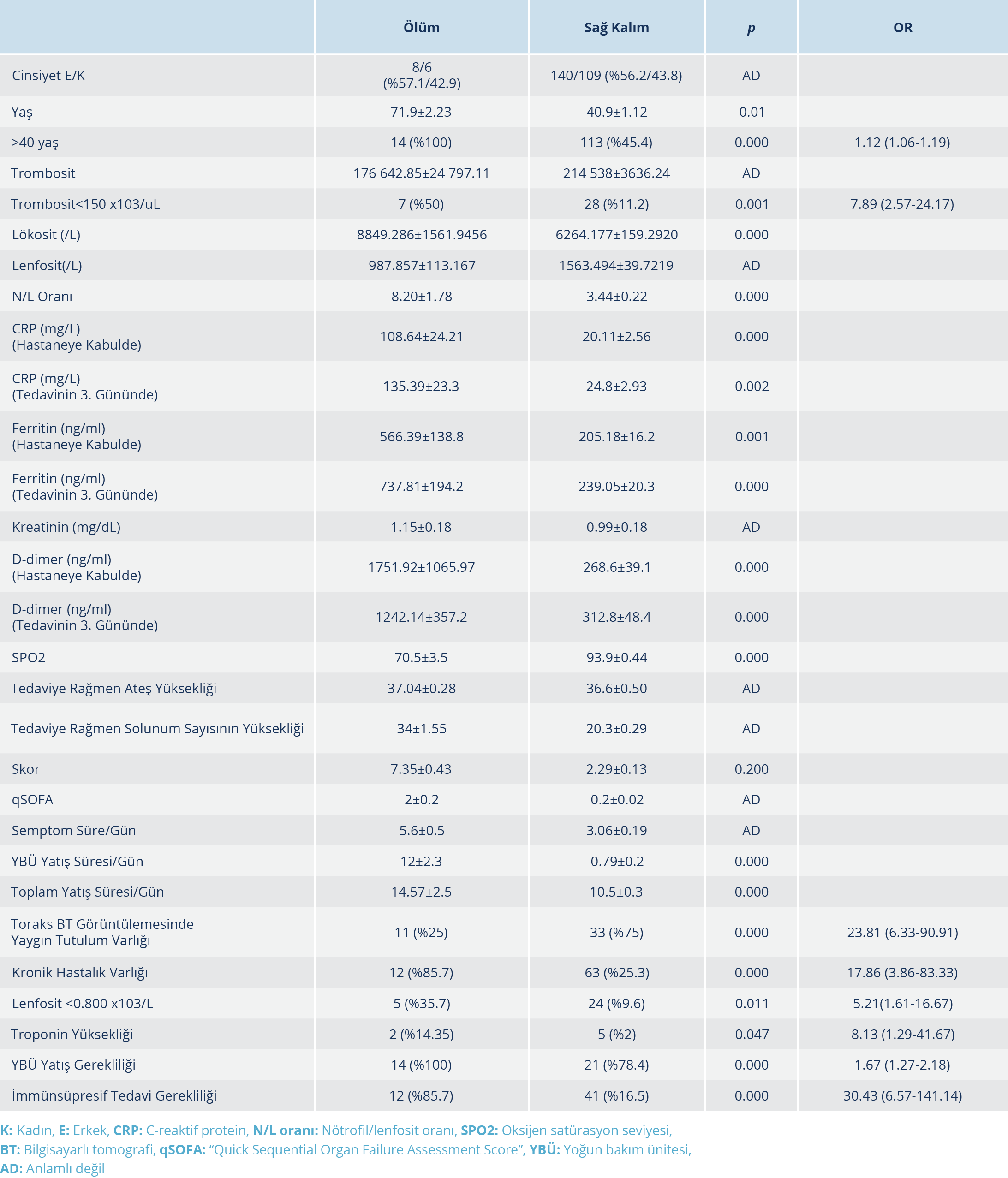
İmmünosüpresif tedavi uygulanan hastaların yaş ortalaması 60.74±1.96 olup %90.6’sının 40 yaş üzerinde olduğu görüldü. İmmünosüpresif tedavi grubunda 40 yaş üzerinde hastaların istatistiksel olarak anlamlı oranda yüksek olduğu görüldü (p<0.05). İmmünosüpresif tedavi uygulanan hastaların % 39.6’sı kadındı. İmmünsüpresif tedavi uygulanması ve cinsiyet arasında anlamlı bir ilişki bulunamadı (p>0.05). İmmünsüpresif tedavi alan hastaların hastaneye başvuru anındaki semptom süreleri ortalama 4.68±0.28 gün olup başvuru anında ortalama lökosit sayısı 7400.94 ± 524.02, trombosit sayısı 190 037.74±8525.33, lenfosit sayısı 1140.94±67.48 ve nötrofil/lenfosit oranı (NLO) 6.27±0.79 olarak saptandı (Tablo 1). İmmünosüpresif tedavi alan ve alamayan gruplar arasında; başvuru anındaki trombosit sayısı, lenfosit sayısı, NLO, C-reaktif protein (CRP) değeri, ferritin değeri, kan oksijen satürasyonu, solunum sayısı, antiviral tedaviye rağmen yükselen ateş (>37.8 0C), qSOFA skoru ve toplam yatış süreleri arasında anlamlı fark bulunduğu tespit edildi (Tablo 1). İmmünsüpresif tedavi uygulanan hastaların toraks BT görüntülemelerinde daha yaygın tutulum olduğu görüldü (p<0.05). YBÜ takip gerekliliği, 40 yaş üzerinde olma, toraks BT görüntülemesinde yaygın tutulum varlığı, kronik hastalık varlığı, troponin yüksekliği varlığı, trombositopeni ve lenfopeni bulunması gibi parametrelerin immünosüpresif tedavi ihtiyacını artırdığı saptandı (Tablo 2). Tüm çalışma grubunda mortalite oranı %5.3 iken bu oranın immunosüpresif tedavi uygulanan hasta grubunda %22.6 (12/53) olduğu ve anlamlı bir şekilde mortalitenin daha yüksek olduğu görüldü (p<0.05) (Tablo 1). Çalışma grubunda ölümün ön görülebilmesinde oluşturduğumuz skorlama sisteminde immünosüpresif tedavi uygulanan hastalardan elde edilen ortalama skorun 6.09±0.29 olduğu belirlendi ve immünosüpresif tedavi almayan gruba göre elde ettiğimiz değer istatistiki olarak anlamlı şekilde immünosüpresif tedavi uygulanan hasta grubunda daha yüksek bulundu (p<0.05). Ayrıca yapılan ROC analizlerinde Skor >4 olmasının mortaliteyi tahmin etmede %93 duyarlılık ve %84 özgüllükte olduğu saptandı (Şekil 1).
İRDELEME
COVID-19 hastalarında immünosüpresif tedavinin etkinliği ve önemi halen araştırılmaya devam eden konulardan biridir. Hekimler arasında COVID-19 infeksiyonu tedavisinde immün sistem üzerine etkili tedavilerin yeri tartışmalı konular arasında yer almaktadır. Sağlıklı bir bireyde oluşan immün yanıt, çeşitli proinflamatuar sitokinler üreterek T hücrelerinin (CD4 ve CD8 T hücreler) aktivasyonunun sağlanmasını, mikroorganizma ile infekte hücrelerin temizlenmesini, inflamasyonu, virusun yayılımının kısıtlanmasını ve viral replikasyonun kontrolünü sağlamaktadır (4). SARS-CoV-2 infeksiyonunda oluşan disregüle sitokin/kemokin yanıtı ve yüksek virus titresi, immüno patolojik akciğer hasarına yol açarak inflamatuar sitokin fırtınasına neden olmaktadır (15). Uzun inkübasyon periyoduna sahip olan koronaviruslerin, bu süre zarfında, özellikle dalak lenf nodlarını, küçük kan damarlarını, kalp, karaciğer ve böbrek gibi organları etkileyerek çoklu organ hasarına sebep olduğu bilinmektedir (16). SARS-CoV-2 infeksiyonunda oluşan bu proinflamatuar yanıt, influenza dahil birçok viral infeksiyon tarafından taklit edilen ve hayatı tehdit eden otoimmün hastalıklarda görülen klinik durum olan makrofaj aktivasyonu sendromuna (MAS) benzetilmektedir (17–19). COVID-19 hastalarında da ana ölüm nedeninin MAS ve ARDS olduğu bilinmektedir (20).
Huang ve arkadaşları (7), SARS ve MERS’de raporlanan sitokin fırtınasına benzeyen bir yüksek sitokin profilinin, kritik COVID-19 hastalarında da görüldüğünü bildirmiştir. Zhou ve arkadaşları (21), 191 COVID-19 olgusundan oluşan çalışmalarında ölen hastaların %93 (50/54)’ünde ARDS geliştiğini ve ARDS gelişiminin semptom başlangıcından 8-12 gün sonra olduğunu bildirmiştir (21). Xu ve arkadaşlarının (22), 239 kritik COVID-19 hastasından oluşan çalışmasında, semptomlar başladıktan 13.5 gün sonra tüm olguların %68.6’sında ARDS geliştiği tespit edilmiştir (22). Guan ve arkadaşlarının (23) yaptığı çalışmada; tüm olgularda %3.4 oranında ARDS geliştiği, bu oranın ciddi olgularda %15.6’yı bulduğu görülmüştür. Ayrıca ciddi COVID-19 olgularında yüksek qSOFA değeri saptandığı ve bu hastaların ileri yaşta olduğu görülmüştür (21, 22). COVID-19 olgularında akciğerde oluşan patolojinin yanı sıra; COVID-19 olgu serilerinde ciddi hasta grubunda lökositoz ve lökopeni, nötropeni ve lenfopeni, CRP artışı, ferritin yüksekliği, D-dimer artışı, kardiyak troponin yüksekliği saptanmıştır (24–26). Çalışmamızda diğer çalışmalarla benzer şekilde immünosüpresif tedavi uygulamalarına ihtiyaç duyduğumuz kritik hasta grubunda; lenfopeni, yüksek NLO, ferritin ve CRP değerlerinde saptanan yükseklik, tedavinin üçüncü gününde saptanan D-dimer değerinin yüksekliğinin istatistiki olarak anlamlı şekilde immünosüpresif tedavi uygulanmayan hasta grubundan farklı olduğu ortaya kondu (p<0.05) (Tablo 1). Standard tedavi alan grubun hastaneye daha erken başvurduğu, hastanede yatış süresinin daha kısa olduğu, qSOFA değerlerinin daha düşük olduğu ve kan oksijenasyonunun immünosüpresif tedavi grubundan daha iyi olduğu saptandı (p<0.05). Ayrıca immünsüpresif tedavi ihtiyacının >40 yaş üzerinde 15.9 kat, toraks BT’de yaygın tutulum varlığında 15.6 kat, kronik hastalık eşlik ettiğinde 6.6 kat, lenfopeni varlığında 1.7 kat ve trombositopeni varlığında 2.7 kat arttığı belirlendi (Tablo 2).
SARS-CoV-2 infeksiyonunda sitokin fırtınasını destekleyen çalışmalar ışığında; immünosüpresif tedaviler klinisyenler tarafından COVID-19 standard tedavilerine eklenmektedir. Sistemik kortikosteroidler, IL-1 blokörü, IL-6 blokörleri, intravenöz immünglobulinler, Janus kinaz inhibitörleri gibi daha birçok immün sistem üzerinden etki gösteren ilaç COVID-19 hastalığında görülen sitokin fırtınasının tedavisinde denenmiş olup halen kullanılmaya devam etmektedir (10, 27). COVID-19 dışı kritik ARDS hastaları ile gerçekleştirilen çeşitli çalışmalarda steroidler denenmiş olup plasebo kontrollü çalışmalar da dahil olmak üzere steroid uygulanan gruplarda, tüm nedenlere bağlı mortalite oranlarının ve mekanik ventilasyon süresinin azalmakta olduğu bildirilmiştir (28–30). COVID -19 hastalarında da sitokin fırtınası eşliğinde oluşan akciğer hasarında, glukokortikoidlerin kullanımı önerilmektedir (10–12). Kortikosteroidler, kanser immünoterapisi gibi durumlarda da sitokin fırtınasının kontrolünde kullanılabilmekte olup deksametazon sitokin fırtınasının yönetiminde etkili bir ajandır (31). COVID-19 olgularında bir glukokortikoid olan deksametazonun etkinliğini araştıran çalışmada, oksijen desteği alan hastalarda deksametazon uygulamalarının, invazif mekanik ventilasyon ihtiyacını ve mortalite oranlarını standard tedavi grubuna göre anlamlı şekilde azalttığı gösterilmiştir (32). COVID-19 infeksiyonunda hiperinflamasyon ile ilişkili sitokinlerin blokajı ise kortikosteroid kullanımına karşı daha hedefe yönelik bir yaklaşım olarak görülmekte ve bunun umut verici bir tedavi yolu olduğu düşünülmektedir (20). Xu ve arkadaşlarının (33), ciddi COVID-19 hastaları ile yaptıkları retrospektif çalışmada, tosilizumab uygulandıktan sonra hastaların CRP değerinin gerilediği, lenfopeninin düzeldiği, ateşin düştüğü ve oksijen ihtiyacının azalıp kan oksijen satürasyonunun oksijen desteği olmadan arttığı ortaya konmuştur. Toniati ve arkadaşlarının (34), tosilizumab uygulanan 100 COVID-19 pnömonili hastayı inceledikleri çalışmada, ilaç uygulandıktan 24-72 saat sonra hastaların %58’inin klinik ve respiratuar durumlarında iyileşme olduğu; uygulamanın 10. gününde hastaların %77’sinde respiratuar durumda stabilizasyon ya da iyileşmenin yanı sıra lenfosit sayısı, CRP, fibrinojen, ferritin ve IL-6 dahil olmak üzere infeksiyon parametrelerinin normale döndüğü bildirilmiştir. Çalışmamıza katılan hastaların %20.1’ine immünosüpresif tedavi uygulandı ve bu hastaların klinik, radyolojik ve laboratuvar olarak diğer gruptan daha kötü hastalar olduğu görüldü (Tablo 1). İmmünosüpresif tedavi uygulanan hasta grubu daha uzun süren semptomları olan, hastanede daha uzun takip edilmiş ve ileri yaşa sahip hastalardan oluşmaktadır (p<0.05) (Tablo 1). Bu hasta grubunun; hastaneye daha geç başvuran, radyolojide patolojik tutulumu daha fazla ve yaygın olan, akut faz reaktanları yüksek, SPO2 değeri düşük ve birden fazla kronik hastalığı olan hastalardan oluştuğu gözlendi. Hastaların ölüm oranı incelendiğinde >40 yaş üzeri olmanın, trombositopeni ve lenfopeni varlığının, toraks BT’de yaygın tutulum varlığının, kronik hastalığın eşlik etmesinin, YBÜ’nde takip edilmesinin ve immünsüpresif tedavi gerekliliğinin mortalite ile ilişkili olduğu görüldü (Tablo 3). COVID-19 olgularında mortaliteyi öngörmede kullanılmak amacıyla risk faktörlerini göz önüne alarak düzenlediğimiz skorlamada, skorun >4 olmasının mortaliteyi öngörmede yüksek özgüllük ve duyarlılıkta olduğu belirlendi (Resim 1). Verilerimiz ışığında COVID-19 hastalığının ciddiyeti arttıkça sitokin fırtınası riskinin de artmakta olduğu ve bu durumun mortaliteyi artırdığı düşünülmektedir. Sitokin fırtınası durumunun daha ciddi tablolara sebep olmasının önüne geçilmesi için standard tedavilerin immünosüpresif tedavilerle yeniden düzenlenmesine ihtiyaç duyulabileceği sonucuna ulaşıldı.
Sonuç olarak; kritik COVID-19 hastaları laboratuvar ve klinik parametrelerle sitokin fırtınası açısından mutlaka değerlendirilmelidir. Standard tedavilere ek olarak immünosüpresif tedavilerin uygun hastaya, uygun zamanda ve uygun dozda eklenmesinin, mortalite ve morbidite üzerine olumlu yönde etkisinin olacağı çok açıktır. Bunun yanında mortaliteyi tahmin etmede 13 parametreden oluşan skorlama sistemimin kullanılması faydalı olabilir. Bu tür skorlama sistemlerinin valide edilebilmesi için hasta sayısının daha yüksek olduğu geniş çaplı çalışmalara ihtiyaç vardır.
Hasta Onamı
Retrospektif dosya taraması şeklinde bir çalışma olduğu için hasta onamı alınmamıştır.
Etik Kurul Kararı
Çalışma için Sağlık Bilimleri Üniversitesi Van Eğitim ve Araştırma Hastanesi Etik Kurulu’ndan 18 Haziran 2020 tarih ve 2020/11 karar numarasıyla onay alınmıştır.
Danışman Değerlendirmesi
Bağımsız dış danışman.
Yazar Katkıları
Fikir/Kavram – M.S.S., D.B.; Tasarım – M.S.S., A.A.; Denetleme – A.A., S.Ç.; Kaynak ve Fon Sağlama – S.Ç., E.O.; Malzemeler/Hastalar – D.B., E.O.; Veri Toplama ve/veya İşleme – M.S.S., D.B.; Analiz ve/veya Yorum – A.A.; Literatür Taraması – M.S.S., D.B., E.O.; Makale Yazımı – M.S.S.; Eleştirel İnceleme – S.Ç.
Çıkar Çatışması
Yazarlar herhangi bir çıkar çatışması bildirmemiştir.
Finansal Destek
Yazarlar finansal destek beyan etmemiştir.
Referanslar
- Jean SS, Lee PI, Hsueh PR. Treatment options for COVID-19: The reality and challenges. J Microbiol Immunol Infect. 2020;53(3):436-43. [CrossRef]
- Cao W, Li T. COVID-19: towards understanding of pathogenesis. Cell Res. 2020;30(5):367-9. [CrossRef]
- Liu F, Li L, Xu M Da, et al. Prognostic value of interleukin-6, C-reactive protein, and procalcitonin in patients with COVID-19. J Clin Virol. 2020;127(4):104370. [CrossRef]
- Zhang S, Li L, Shen A, Chen Y, Qi Z. Rational use of tocilizumab in the treatment of novel coronavirus pneumonia. Clin Drug Investig. 2020;40(6):511-8. [CrossRef]
- Mehta P, McAuley DF, Brown M, Sanchez E, Tattersall RS, Manson JJ. COVID-19: consider cytokine storm syndromes and immunosuppression. Lancet. 2020;395(10229):1033-4. [CrossRef]
- Radbel J, Narayanan N, Bhatt PJ. Use of tocilizumab for COVID-19-induced cytokine release syndrome: A cautionary case report. Chest. 2020;158(1):e15-9. [CrossRef]
- Huang C, Wang Y, Li X, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet. 2020;395(10223):497-506. [CrossRef]
- Actemra (tocilizumab) injection [İnternet]. Falls Church, VA. WCG CenterWatch. [erişim 05 Aralık 2021]. Available from: https://www.centerwatch.com/directories/1067-fda-approved-drugs/listing/4692-actemra-tocilizumab
- Saghazadeh A, Rezaei N. Towards treatment planning of COVID-19: Rationale and hypothesis for the use of multiple immunosuppressive agents: Anti-antibodies, immunoglobulins, and corticosteroids. Int Immunopharmacol. 2020;84(5):106560. [CrossRef]
- Coronavirus Disease 2019 (COVID-19) Treatment Guidelines [İnternet]. Bethesda, MD: National Institutes of Health (NIH). [erişim 05 Aralık 2021]. https://www.covid19treatmentguidelines.nih.gov
- Bhimraj A, Morgan RL, Shumaker AH, et al. Infectious Diseases Society of America. Guidelines on the Treatment and Management of Patients with COVID-19. 2020;ciaa478. [CrossRef]
- T.C. Sağlık Bakanlığı COVID-19 Erişkin Hasta Tedavisi Rehberi [İnternet]. Ankara: T.C. Sağlık Bakanlığı Halk Sağlığı Genel Müdürlüğü. [erişim 05 Aralık 2021]. https://covid19.saglik.gov.tr/Eklenti/42169/0/covid-19rehberieriskinhastayonetimivetedavi20122021v6pdf.pdf
- Hoes JN, Jacobs JWG, Boers M, et al. EULAR evidence-based recommendations on the management of systemic glucocorticoid therapy in rheumatic diseases. Ann Rheum Dis. 2007;66(12):1560-7. [CrossRef]
- Singer M, Deutschman CS, Seymour C, et al. The third international consensus definitions for sepsis and septic shock (Sepsis-3). JAMA. 2016;315(8):801-10. [CrossRef]
- Zhou Y, Fu B, Zheng X, et al. Pathogenic T-cells and inflammatory monocytes incite inflammatory storms in severe COVID-19 patients. Natl Sci Rev. 2020;7(6):998-1002. [CrossRef]
- Quirch M, Lee J, Rehman S. Hazards of the cytokine storm and cytokine-targeted therapy in patients with COVID-19: Review. J Med Internet Res. 2020;22(8):e20193. [CrossRef]
- Torres Acosta MA, Singer BD. Pathogenesis of COVID-19-induced ARDS: implications for an aging population. Eur Respir J. 2020;56(3):2002049. [CrossRef]
- McGonagle D, Sharif K, O’Regan A, Bridgewood C. The role of cytokines including Interleukin-6 in COVID-19 induced pneumonia and macrophage activation syndrome-like disease. Autoimmun Rev. 2020;19(6):102537. [CrossRef]
- Janka GE, Lehmberg K. Hemophagocytic syndromes – an update. Blood Rev. 2014;28(4):135-42. [CrossRef]
- Felsenstein S, Herbert JA, McNamara PS, Hedrich CM. COVID-19: Immunology and treatment options. Clin Immunol. 2020;215:108448. [CrossRef]
- Zhou F, Yu T, Du R, et al. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. Lancet. 2020;395(10229):1054-62. [CrossRef]
- Xu J, Yang X, Yang L, et al. Clinical course and predictors of 60-day mortality in 239 critically ill patients with COVID-19: A multicenter retrospective study from Wuhan, China. Crit Care. 2020;24(1):394. [CrossRef]
- Guan W, Ni Z, Hu Y, et al. Clinical characteristics of coronavirus disease 2019 in China. N Engl J Med. 2020;382(18):1708-20. [CrossRef]
- Feng Y, Ling Y, Bai T, et al. COVID-19 with different severities: A multicenter study of clinical features. Am J Respir Crit Care Med. 2020;201(11):1380-8. [CrossRef]
- Ge H, Wang X, Yuan X, et al. The epidemiology and clinical information about COVID-19. Eur J Clin Microbiol Infect Dis. 2020;39(6):1011-9. [CrossRef]
- Karakoç ZÇ, Pınarbaşı-Şimşek B, Asil R, et al. First wave in COVID-19 pandemic: A single center experience. Klimik Derg. 2020;33(3):223-9. [CrossRef]
- Tufan A, Avanoğlu Güler A, Matucci-Cerinic M. Covid-19, immune system response, hyperinflammation and repurposinantirheumatic drugs. Turkish J Med Sci. 2020;50(SI-1):620-32. [CrossRef]
- Umberto Meduri G, Golden E, Freire AX, et al. Methylprednisolone infusion in early severe ARDS: results of a randomized controlled trial. Chest. 2007;131(4):954-63. [CrossRef]
- Mammen MJ, Aryal K, Alhazzani W, Alexander PE. Corticosteroids for patients with acute respiratory distress syndrome: a systematic review and meta-analysis of randomized trials. Pol Arch Intern Med. 2020;130(4):276-86. [CrossRef]
- Alhazzani W, Møller MH, Arabi YM, et al. Surviving sepsis campaign: guidelines on the management of critically ill adults with coronavirus disease 2019 (COVID-19). Intensive Care Med. 2020;46(5):854-87. [CrossRef]
- Lotfi M, Hamblin MR, Rezaei N. COVID-19: Transmission, prevention, and potential therapeutic opportunities. Clin Chim Acta. 2020;508:254-66. [CrossRef]
- Horby P, Lim WS, Emberson JR, et al. (RECOVERY Collaborative Group). Dexamethasone in hospitalized patients with Covid-19 — Preliminary report. N Engl J Med. 2020;384(8):693-704. [CrossRef]
- Xu X, Han M, Li T, et al. Effective treatment of severe COVID-19 patients with tocilizumab. Proc Natl Acad Sci U S A. 2020;117(20):10970-5. [CrossRef]
- Toniati P, Piva S, Cattalini M, et al. Tocilizumab for the treatment of severe COVID-19 pneumonia with hyperinflammatory syndrome and acute respiratory failure: A single center study of 100 patients in Brescia, Italy. Autoimmun Rev. 2020;19(7):102568. [CrossRef]