En Çok Okunanlar
Özet
Amaç: Kolistin duyarlılığını, standart referans yönteme göre belirlemek klinik mikrobiyoloji laboratuvarları için sorun olmaktadır. Sınırlı imkanlara sahip laboratuvarlar için hızlı, kolay uygulanabilir, doğruluğu yüksek basit bir yönteme ihtiyaç duyulmaktadır. Çalışmamızda, kolistin sıvı disk elüsyon (KSDE) testinin uygulanabilirliğinin değerlendirilmesi amaçlandı.
Yöntemler: Laboratuvarımızda çeşitli klinik örneklerden izole ettiğimiz 193 Gram-negatif bakteri çalışmaya dahil edildi ve sıvı mikrodilüsyon yöntemi referans yöntem olarak kullanıldı. Her bir bakteri izolatı için katyon ayarlı Mueller-Hinton buyyon (MHB) içeren beş tüp hazırlandı ve bu tüplerin içine 0, ½, 1, 2, 4 adet kolistin disk (10 µg; Becton Dickinson, ABD) eklendi. Son konsantrasyonlar sırasıyla; 0 (üreme kontrolü), 0.5, 1, 2 ve 4 µg/ml olacak şekilde hazırlandı. Tüplerin içine bakteri inoküle edildikten 16-20 saat sonra gözle değerlendirme yapılarak minimum inhibitör konsantrasyonu (MİK) değerleri belirlendi.
Bulgular: Enterobacterales grubunda “kategorik uyum” %94, “büyük hata” %5, “çok büyük hata” oranı 0 bulundu. Nonfermentatif bakteri grubunda ise sırasıyla “kategorik uyum” %94, “büyük hata” %1, “çok büyük hata” %33 tespit edildi.
Sonuç: Rutin mikrobiyoloji laboratuvarlarında, KSDE testi kolay uygulanabilir ve ucuz olması nedeniyle Enterobacterales grubu için iyi bir seçenektir.
GİRİŞ
Çok ilaca dirençli Gram-negatif bakterilerle gelişen infeksiyonlar günümüzde giderek artış göstermektedir (1, 2). Bu nedenle dirençli bakterilerle gelişen infeksiyonların tedavisi için eski antibiyotiklerin yeniden kullanımına başlanmıştır. Kolistin bu antibiyotiklerden biri olup çoklu antibiyotik direnci olan Pseudomonas aeruginosa, Acinetobacter baumannii, Klebsiella pneumoniae ve Escherichia coli bakterilerinin neden olduğu infeksiyonların tedavisinde son seçenek olarak kullanılmaktadır (3, 4).
Son yıllarda hastane kökenli infeksiyonlarda sık kullanılması nedeniyle tedaviler başarılı olsa bile direnç gelişme riski göz önünde tutularak kolistin duyarlılığı takip edilmelidir. Klinik mikrobiyoloji laboratuvarlarının, karbapenem dirençli Gram-negatif bakterilerde kolistin direncini tanımlayabilmesi önemlidir. Ancak bu şekilde, kolistin direnci belirlenen bakteri ile infekte olan hastalarda ciddi yan etkisi olan bu antibiyotiğin gereksiz yere kullanımının önüne geçilmiş olur. Son yıllarda, tüm dünyada olduğu gibi ülkemizde de kolistin dirençli bakteriler raporlanmıştır (5). Bu nedenle, kolistin duyarlılık testinin “Clinical and Laboratory Standards Institute (CLSI)” ve “European Committee on Antimicrobial Susceptibility Testing (EUCAST)” tarafından önerilen sıvı mikrodilüsyon yöntemi ile çalışılarak doğru sonucun raporlanması önemlidir (6). Ancak sıvı mikrodilüsyon yönteminin pratik olmamasından dolayı rutin bakteriyoloji laboratuvarlarında kolistin direncini belirlemek her zaman problem olmuştur. Bu nedenle pratik, basit, hızlı ve etkin bir yönteme ihtiyaç vardır.
Bu çalışmada, Gram-negatif bakterilerde kolistin duyarlılığının belirlenmesinde daha önceden tanımlanan basit ve pratik bir yöntem olan kolistin sıvı disk elüsyon (KSDE) testinin değerlendirilmesi amaçlandı.
YÖNTEMLER
Bakteri İzolatları
Çalışmamıza 2018-2020 yılları arasında çeşitli klinik örneklerden izole ettiğimiz toplam 193 Gram-negatif bakteri dahil edildi. Bu izolatlar K. pneumoniae (59), E. coli (20), E. cloacae (18), A. baumannii (51) ve P. aeruginosa (45)’dan oluşmaktadır.
Sıvı Mikrodilüsyon Referans Yöntemi
Kolistin sülfat (Sigma-Aldrich, Almanya) ve 32 ile 0.064 mg/lt konsantrasyonlar arasında, katyon ayarlı Mueller-Hinton buyyon (MHB) kullanılarak çift kat dilüsyonlar şeklinde hazırlanan 96 kuyucuklu mikroplaklarda CLSI/EUCAST önerilerine göre çalışıldı (7, 8). Kalite kontrolü; negatif kontrol olarak E. coli 25922 ve pozitif kontrol olarak mcr-1 üreten E. coli suşu (NCTC 13846) kullanılarak yapıldı.
Kolistin Sıvı Disk Elüsyon (KSDE) Testi
KSDE testi, Simner ve arkadaşlarının (9) tanımladığı metoda uygun olarak çalışıldı. Her bir bakteri izolatı için 10 ml katyon ayarlı MHB içeren 5 tüp hazırlandı. Bu tüplere; 0, ½, 1, 2, 4 adet kolistin diski (10 µg; Becton Dickinson, ABD) eklendi. Son konsantrasyonlar sırasıyla; 0 (üreme kontrolü), 0.5, 1, 2 ve 4 µg/ml dir. Daha sonra tüpler oda sıcaklığında kolistinin sıvıya geçebilmesi için inokülasyondan önce 30 dakika bekletildi. Kanlı agarda üretilen taze kültür kolonilerinden 0.5 McFarland bakteri süspansiyonları hazırlandı ve her tüpe 50 µl bu süspansiyonlardan eklenerek vortekslendi. 35 °C’de 18-20 saat inkübasyondan sonra kolistin minimum inhibitör konsantrasyonu (MİK) değerleri okundu ve EUCAST verilerine göre değerlendirildi.
Veri Analizi
“Çok büyük hata” (ÇBH), KSDE yöntemi ile duyarlı iken referans yöntem ile dirençli; “büyük hata” (BH), KSDE yöntemi ile dirençli iken referans yöntem ile duyarlı bulunması olarak tanımlandı. Referans yöntem olan sıvı mikrodilüsyon ile KSDE yöntemi arasındaki “temel uyum” (TU) ve “kategorik uyum” (KU) değerleri hesaplandı. KSDE testi için TU değeri olarak bakterilerin yüzdesi referans metoda göre MİK değerinin ±1 dilüsyon dahilinde kabul edilerek; KU değeri ise bakterilerin duyarlı ya da dirençli olmalarına göre aynı kategoride bulunma yüzdesine göre hesaplandı.
Çalışma için Ahi Evran Üniversitesi Girişimsel Olmayan Klinik Araştırmalar Etik Kurulu’ndan 29 Mayıs 2020 tarih ve 2020-07/48 karar numarasıyla onay alınmıştır.
BULGULAR
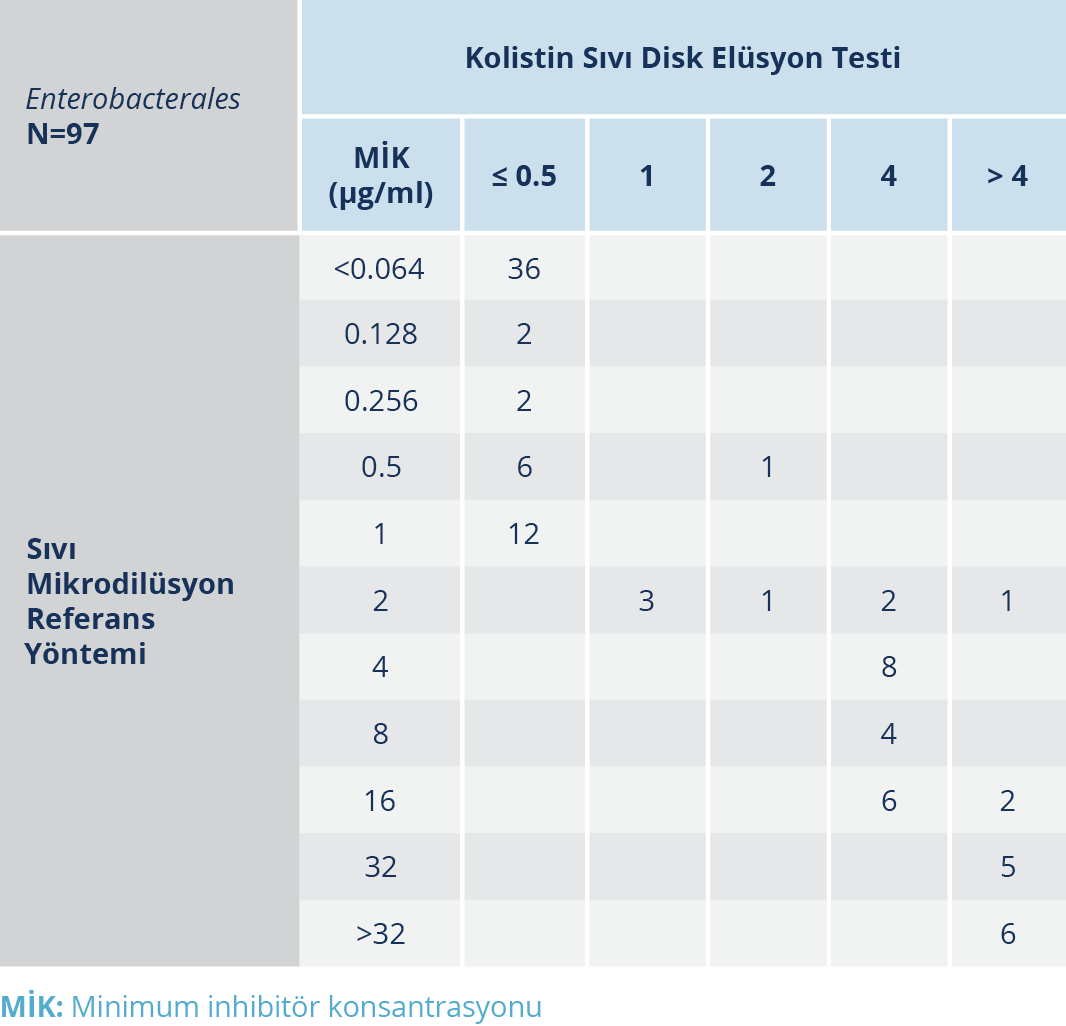
Tablo 1. Enterobacterales Grubu İçin Sıvı Mikrodilüsyon Referans Yöntemi ve KSDE Testinin Kolistin MİK Değerleri
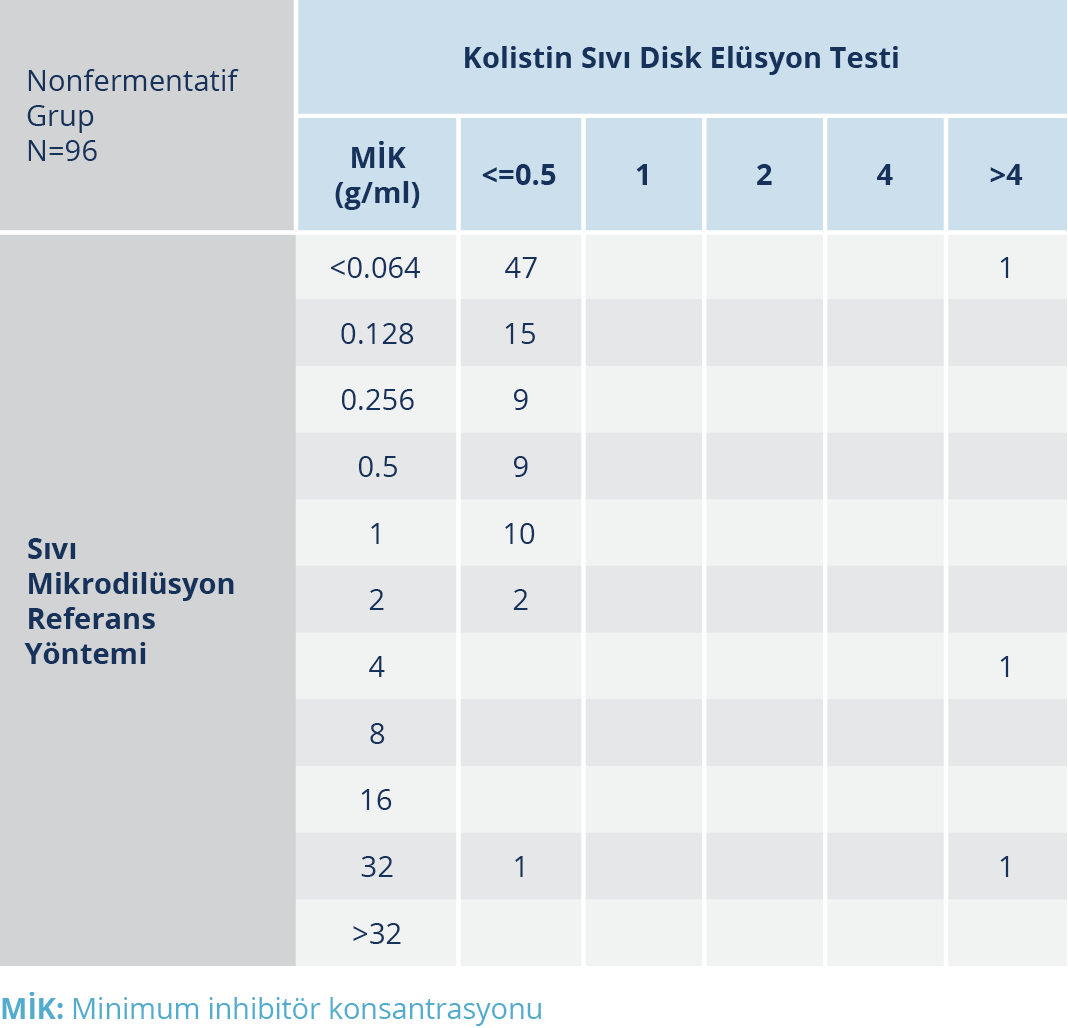
Tablo 2. Nonfermentatif (A. baumannii ve P. aeruginosa) Grup için Sıvı Mikrodilüsyon Referans Yöntemi ve KSDE Testinin Kolistin MİK Değerleri
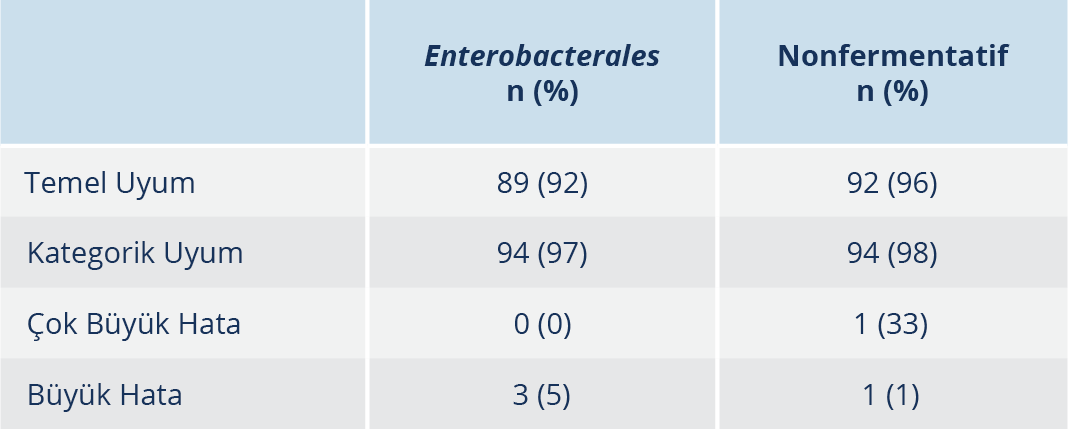
Tablo 3.Enterobacterales ve Nonfermentatiflerde “Temel Uyum”, “Kategorik Uyum”, “Çok Büyük Hata” ve “Büyük Hata” Oranları
Kolistin için klinik sınır değerler, EUCAST standartlarına göre (≤ 2 mg/L duyarlı ve > 2 mg/L dirençli) değerlendirildi.
Test edilen 97 Enterobacterales grubunda referans yönteme göre 31 izolat kolistin dirençli, 66 izolat kolistin duyarlı bulundu. Referans sıvı mikrodilüsyon yöntemine göre MİK aralıkları <0.064 ile ≥ 32 µg/ml arasındaydı (Tablo 1). KSDE testinin performans değerlendirilmesinde, KU %94 ve TU %89 olarak tespit edildi; ÇBH oranı ise sıfırdı. KSDE testi ile üç K. pneumoniae izolatı dirençliyken referans yöntem ile duyarlıydılar. BH oranı %5 olarak saptandı.
Test edilen 96 non-fermantatif bakteri grubunda, referans yönteme göre 93 izolat kolistin duyarlı üçü ise kolistin dirençliydi. Dirençli izolatlardan biri A. baumannii diğer ikisi ise P. aeruginosa olarak tespit edildi. Referans sıvı mikrodilüsyon yöntemine göre MİK aralıkları <0.064 ile 32 µg/ml arasındaydı (Tablo 2). KSDE testinin performans değerlendirmesinde KU %94 ve TU %92 olarak tespit edildi. P. aeruginosa izolatında referans yönteme göre MİK değeri 32 olup KSDE testi 0.5’ti; ÇBH oranı ise %33’tü. Referans yönteme göre MİK değeri 0.064 olan A. baumannii izolatında ise KSDE ile MİK değeri >4 bulundu; BH oranı ise %1’di (Tablo 3). Çalışılan izolatların referans yönteme göre kolistin MİK dağılımı Tablo 4’te gösterilmiştir.
İRDELEME
Kolistin, karbapenemaz üreten Gram-negatif basillerin etken olduğu infeksiyonların tedavisinde halen son seçenek olduğu için laboratuvarlarımızda kolistin duyarlılığını doğru saptamanın önemi büyüktür. Çoğu mikrobiyoloji laboratuvarında antibiyotik duyarlılık testleri disk difüzyon, gradyan difüzyon gibi yöntemler ve otomatize sistemler (Vitek, Phonex) kullanılarak gerçekleştirilmektedir. Ancak hem CLSI hem de EUCAST kolistin için söz konusu yöntemleri önermemektedir. Kolistinin büyük katyonik bir molekül olması, plastik yüzeylere tutunması, otomatize sistem sonuçlarındaki ÇBH oranlarında %35-53 gibi yüksek değerlerle karşılaşılması nedeniyle referans yöntem olarak sıvı mikrodilüsyon yöntemi tek seçenektir (10). Bununla birlikte, kaynakları yetersiz olan ülkelerdeki laboratuvarlar için kolistin tozunu sağlamak zordur. Aynı zamanda tüm dünyada, kolistinin çok kullanımına bağlı olarak direnç de artmaya devam etmektedir (11). Bu nedenle rutin laboratuvarlarda kullanabilecek basit, pratik ve ucuz bir kolistin test metodunun acilen geliştirilmesi gerekmektedir.
İlk olarak 2018 yılında Simner ve arkadaşları (9) CLSI’nın bir alt komitesinde KSDE testini tanımlamıştır. 2021 CLSI-M100-S31’de Enterobacterales ve Pseudomanas suşlarında kolistin için; sıvı mikrodilüsyon, KSDE ve KA (kolistin agar) test metotlarının kullanımı önerilmiştir. Acinetobacter spp. için ise sadece kabul edilen MİK yöntemi sıvı mikrodilüsyon olarak belirtilmiştir (7).
2018 yılından günümüze bu konuda yapılan çalışma sayısı oldukça azdır. Özyurt ve arkadaşlarının (12) yaptıkları çalışmada, Gram-negatif bakterilerde KSDE yöntemi, otomatize sistem sonuçları ve sıvı mikrodilüsyon yöntemi birlikte değerlendirilmiştir. Söz konusu çalışmada, KSDE ile sıvı mikrodilüsyon yöntemi arasındaki KU oranı %99.3, ÇBH oranı %0.2 ve BH oranı %0.5 olarak saptanmıştır. Otomatize sistem ile referans yöntemin KU oranı ise %95, ÇBH oranı ise %5 olarak tespit edilmiştir. KSDE yönteminin, referans yöntem ile karşılaştırıldığında performansının iyi, uyumunun ise yüksek olduğu belirtilmiştir.
Simner ve arkadaşları (9) yaptıkları çalışmada, 171 Gram-negatif bakteride KSDE testinin doğruluğunu değerlendirmiştir. KSDE yöntemi ile referans sıvı mikrodilüsyon yöntemi arasındaki KU oranı %98, TU oranı %99 ve ÇBH oranı ise %8 olarak tespit edilmiştir. Bu çalışmada mcr-1 pozitif E.coli izolatları da test edilmiş olup mcr-1 E. coli izolatlarında KU ve ÇBH oranı %50 olarak saptanmıştır. mcr-1 E. coli dışındaki izolatlarda ise iki test arasındaki KU ve TU oranları %100 olarak saptanmıştır.
Cielo ve arkadaşlarının (13) çalışmasında ise Polimiksin B için sıvı disk elüsyon testi değerlendirilmiştir. Referans yöntem olarak sıvı mikrodilüsyon yöntemi ile karşılaştırıldığında disk elüsyon yönteminin; KU, BH ve ÇBH oranları sırasıyla %99.5, %0 ve %1.11 (bir yanlış negatif K. pneumoniae MİK 4 μg/ml) olarak saptanmıştır.
Dalmolin ve arkadaşlarının (11) Gram-negatif basillerde elüsyon metodunu değerlendirdikleri çalışmasında, kolistin sıvı mikroelüsyon testi; Enterobacterales izolatlarında KU ve “esas uyum” (EU) oranlarının yanı sıra duyarlılık ve özgüllük değerleri kabul edilebilir tespit edilmekle birlikte BH ve ÇBH daha az tatmin edici bulunmuştur. Aynı çalışmada, nonfermentatif izolatlar için de sonuçlar tatmin edici bulunmamıştır. Bununla birlikte önerilen yöntemin, referans yönteme göre kolay ve ucuz bir seçenek olması nedeniyle Enterobacterales’ler arasında kolistin direncini saptamak için tarama testi olarak kullanılabileceği belirtilmiştir.
Ülkemizde yapılan diğer bir çalışmada, kolistin duyarlılığının saptanmasında sıvı mikrodilüsyon referans yöntemini temel alan iki ticari test ve kolistin agar tarama plağı yöntemi değerlendirilmiş; Klebsiella spp. izolatlarında, ek ekipman ve tecrübe gerektirmeyen sıvı mikrodilüsyon temelli ticari sistemlerin ve kolistin agar tarama plağının rutinde kullanılabileceği ancak nonfermantatif bakterilerde referans yöntem olan sıvı mikrodilüsyon ile doğrulanması gerektiği vurgulanmıştır (6).
Çalışmamızın sonuçlarına göre, Enterobacterales grubunda ÇBH’nın olmaması, BH’nın ise %5 olması olumlu bulunmuştur. Ancak nonfermentatif grupta, ÇBH oranı %33, BH oranı ise %1 tespit edilmiştir. Literatürle uyumlu olarak nonfermentatif grupta bu testin kullanımının uygun olmadığı görülmektedir.
KSDE’nin en büyük avantajlarından biri kolistin tozuna ihtiyaç duyulmamasıdır. Basit ekipmanlarla çalışılabiliyor olmasının yanı sıra değerlendirilmesinin kolay olması da bu yöntemin diğer önemli avantajlarıdır. Ancak sınırda MİK değerlerine sahip mcr-1 pozitif izolatlar için mutlaka sıvı mikrodilüsyon yöntem ile tekrar çalışılması gerektiği vurgulanmıştır (9). Plasmid kaynaklı kolistin direncinin gösterilebilmesi için EDTA’lı KSDE testi geliştirilerek çalışması yapılmıştır (14). Şu an için yaygın olan kromozomal kaynaklı kolistin direncidir; plazmid kaynaklı direnç tüm dünyada kolistin dirençli izolatların %3’ünü oluşturur (10). Ülkemizde mcr-1 pozitif izolatlara nadir olarak rastlanmaktadır (5); söz konusu izolatlarda kolistin MİK değerleri 2-4 arasında çıkabilmektedir. CLSI, MİK değeri 2 olan izolatların kolistin sonuçlarının sıvı mikrodilüsyonla doğrulanmasını önermektedir.
Çalışmamızda kısıtlılıklar mevcuttur. Sıvıya geçen kolistin konsantrasyonu başka bir analitik metot ile doğrulanmalıdır. Farklı ticari markaların kolistin diskleri kullanılmamış; çalışılan izolatların mcr-1 genlerine bakılmamıştır. Çalışmaya dahil edilen nonfermentatiflerin sayısı ise azdır.
Sonuç olarak; rutin mikrobiyoloji laboratuvarlarında basit ama güvenilir yöntemlere ihtiyacımız vardır. Kolistin duyarlılık testi için yöntem geliştirilmesi, validasyon ve verifikasyon çalışmalarının yapılması kaynakları sınırlı ülkeler için değerlidir. Bu çalışma ile KSDE testinin Enterobacterales grubu için güvenle kullanılabileceği söylenebilir.
Hasta Onamı
Hastalardan izole edilen bakteri izolatları kullanıldığı için hasta onamı alınmamıştır.
Etik Kurul Kararı
Çalışma için Ahi Evran Üniversitesi Girişimsel Olmayan Klinik Araştırmalar Etik Kurulu’ndan 29 Mayıs 2020 tarih ve 2020-07/48 karar numarasıyla onay alınmıştır.
Danışman Değerlendirmesi
Bağımsız dış danışman.
Yazar Katkıları
Fikir/Kavram – A.Ö., F.M.S.; Tasarım – A.Ö., F.M.S.; Denetleme – A.Ö., F.M.S.; Kaynak ve Fon Sağlama – A.Ö., F.M.S.; Malzemeler/Hastalar – A.Ö., F.M.S.; Veri Toplama ve/veya İşleme – A.Ö., F.M.S.; Analiz ve/veya Yorum – A.Ö., F.M.S.; Literatür Taraması – A.Ö.; Makale Yazımı – A.Ö., F.M.S.; Eleştirel İnceleme – F.M.S.
Çıkar Çatışması
Yazarlar herhangi bir çıkar çatışması bildirmemiştir.
Finansal Destek
Yazarlar finansal destek beyan etmemiştir.
Referanslar
- Shorr AF. Review of studies of the impact on Gram-negative bacterial resistance on outcomes in the intensive care unit. Crit Care Med. 2009;37(4):1463-9. [CrossRef]
- Boucher HW, Talbot GH, Bradley JS, et al. Bad bugs, no drugs: no ESKAPE! An update from the Infectious Diseases Society of America. Clin Infect Dis. 2009;48(1):1-12. [CrossRef]
- Li J, Nation RL, Turnidge JD, et al. Colistin: the re-emerging antibiotic for multidrug-resistant Gram-negative bacterial infections. Lancet Infect Dis. 2006;6(9):589-601. [CrossRef]
- Falagas ME, Rafailidis PI, Ioannidou E, et al. Colistin therapy for microbiologically documented multidrug-resistant Gram-negative bacterial infections: a retrospective cohort study of 258 patients. Int J Antimicrob Agents. 2010;35(2):194-9. [CrossRef]
- Hazırolan G, Karagöz A. Emergence of carbapenemase-producing and colistin-resistant Klebsiella pneumonia ST101 high-risk clone in Turkey. Acta Microbiol Immunol Hung. 2020 Nov 9;67(4):216-21. [CrossRef]
- Demir-Çuha M, Hazırolan G. [Comparison of MIC COL, Sensititre™ and colistin agar screening plate methods with broth microdilution reference method for detection of colistin susceptibility in carbapenem-resistant Gram-negative bacteria]. Klimik Derg. 2021;34(3):186-91. Turkish. . [CrossRef]
- Clinical and Laboratory Standards Institute (CLSI). Performance Standards for Antimicrobial Susceptibility Testing. 31st ed. CLSI supplement M100 (ISBN 978-1-68440-104-8 [Print]; ISBN 978-1-68440-105-5 [Electronic]). Clinical and Laboratory Standards Institute, USA, 2021.
- Breakpoint tables for interpretation of MICs and zone diameters. Version 11.0. [İnternet]. EUCAST. [erişim 10 Mart 2022]. https://www.eucast.org/fileadmin/src/media/PDFs/EUCAST_files/Breakpoint_tables/v_11.0_Breakpoint_Tables.pdf
- Simner PJ, Bergman Y, Trejo M, et al. Two-site evaluation of the colistin broth disk elution test To determine colistin in vitro activity against Gram-negative bacilli. J Clin Microbiol. 2019;57(2):e01163-18. [CrossRef]
- Satlin MJ. The search for a practical method for colistin susceptibility testing: Have we found it by going back to the future? J Clin Microbiol. 2019;57(2):e01608-18. [CrossRef]
- Dalmolin TV, Mazzetti A, Ávila H, et al. Elution methods to evaluate colistin susceptibility of Gram-negative rods. Diagn Microbiol Infect Dis. 2020;96(1):114910. [CrossRef]
- Koyuncu Özyurt Ö, Özhak B, Öğünç D, et al. [Evaluation of the BD Phoenix100 system and colistin broth disk elution method for antimicrobial susceptibility testing of colistin against Gram-negative bacteria]. Mikrobiyol Bul. 2019;53(3):254-61. Turkish. [CrossRef]
- Cielo NC, Belmonte T, Raro OHF, et al. Polymyxin B broth disk elution: a feasible and accurate methodology to determine polymyxin B susceptibility in Enterobacterales. Diagn Microbiol Infect Dis. 2020;98(2):115099. [CrossRef]
- Fenwick AJ, Bergman Y, Lewis S, et al. Evaluation of the NG-test MCR-1 lateral flow assay and EDTA-colistin broth disk elution methods to detect plasmid-mediated colistin resistance among Gram-negative bacterial isolates. J Clin Microbiol. 2020;58(4):e01823-19. [CrossRef]