En Çok Okunanlar
Özet
Amaç: Klasik aşı geliştirme süreçleri düşünüldüğünde, çok kısa bir zaman diliminde geliştirilen COVID-19 aşıları, bilim dünyası için üstün bir başarı olarak kabul edilebilir. Aşıların hızlı bir şekilde geliştirilmesi için güvenlikten ödün verilemez. Çalışmamızda COVID-19 geçiren ve geçirmeyenlerde, aşı dozları ve türleri arasında akut istenmeyen etki insidansının belirlenmesi ve karşılaştırılması amaçlandı.
Yöntemler: Çalışma, 01 Temmuz -31 Ekim 2021 tarihleri arasında prospektif olarak yürütüldü. Hastanemiz aşı polikliniğine başvurarak, Pfizer-BioNTech BNT162b2 mRNA aşısı (Comirnaty) veya Sinovac inaktif SARS-CoV-2 aşısı (CoronaVac) ile aşılanan kişiler kohortu oluşturdu. Kohort; kendi içinde iki aşı grubuna ve her bir aşı grubu da COVID-19 geçirmiş ve geçirmemiş olanlar olmak üzere iki alt gruba ayrıldı. Kohorttaki tüm hastalara aşılanma tarihinden sekiz gün sonra telefon açılarak İstenmeyen Etki Değerlendirme Anketi uygulandı ve grupların akut istenmeyen etki insidansı belirlenerek sonuçlar karşılaştırmalı olarak değerlendirildi.
Bulgular: Çalışmada toplam 1607 aşı uygulaması izlenmiş olup bunların 301 (%18.7)’i inaktif SARS-CoV-2 aşısı, 1306 (%81.3)’sı BNT162b2 aşısıydı. Aşı uygulaması öncesi COVID-19 geçirme öyküsü olan birey sayısı 743 (%46.2)’tü. Aşı uygulaması sonrasında yedi gün içinde herhangi bir istenmeyen etki görülme oranı BNT162b2 aşısı için %64.1 [%95 güven aralığı (GA): %61.2-%66.4], inaktif SARS-CoV-2 aşısı için %24.6 (%95 GA: %20.1-%29.8) olarak tespit edildi [“odds ratio” (OR): 1.975; %95 GA: 1.60-2.44]. BNT162b2 aşısı ile istenmeyen etki gelişme riski; yaş, cinsiyet, aşı dozu, COVID-19 geçirme öyküsü ve ek hastalık varlığına göre düzeltildiğinde inaktif SARS-CoV-2 aşısına göre 5.8 kat daha yüksek bulundu (OR: 5.83; %95GA: 4.34-7.84). COVID-19 geçirenlerde COVID-19 geçirmeyenlere göre istenmeyen etki gelişme riski; aşı dozu, aşı türü, yaş, cinsiyet ve ek hastalık varlığına göre düzeltildiğinde 1.6 kat fazla bulundu (OR: 1.61; %95 GA: 1.29-2.00).
Sonuç: Aşı sonrası akut istenmeyen etki görülme sıklığı BNT162b2 aşısında inaktif SARS-CoV-2 aşısına kıyasla ve COVID-19 geçirenlerde geçirmeyenlere kıyasla daha fazla olmasına rağmen, söz konusu istenmeyen etkilerin çoğu hafif, geçici ve yönetilebilirdir.
GİRİŞ
Aşılar modern tıbbın en önemli silahlarından biridir. Tarih boyunca görülen diğer büyük salgınlarda olduğu gibi COVID-19 pandemisinde de aşı, en etkili çıkış yolu olarak görülmüş ve hızla aşı çalışmaları başlatılmıştır (1). Aşı geliştirme çalışmalarında COVID-19 aşılarının bir kısmının etkili ve kabul edilebilir bir güvenlik profiline sahip olduğu gösterilmiştir (2, 3). Bu aşılardan ikisi, Pfizer-BioNTech ortaklığı ile geliştirilen COVID-19 mRNA aşısı (BNT162b2) ve Sinovac tarafından geliştirilen inaktif SARS-CoV-2 aşısı (CoronaVac) olup ülkemizde acil kullanım onayı alarak yaygın aşılamada kullanılmaktadır (4). Her ne kadar klinik çalışmalarda bu aşıların etkinliği ve güvenliği kanıtlanmış olsa da özel gruplarla ilgili veriler eksik kalmaktadır. Daha önceden COVID-19 geçirmiş bireyler, aşıların ruhsatlandırma öncesi değerlendirildiği klinik çalışmalara dahil edilmemiştir (2, 3). Ayrıca henüz az sayıda çalışmada bu iki aşı türünün etkinliği ve güvenliği karşılaştırmalı olarak incelenmiştir (5). Toplumda aşılama oranlarının hedeflenen düzeye ulaşmasını sağlamak ve COVID-19’a karşı geliştirilen yeni aşılar hakkında daha fazla bilimsel veriye ulaşmak için, yeni aşıların gerçek yaşamdaki istenmeyen etkilerinin insidansı ve ciddiyeti hakkında araştırmalara ihtiyaç vardır.
Çalışmamızda, COVID-19 geçiren ve geçirmeyen bireylerde aşı dozları ve türleri arasında akut istenmeyen etki insidansının belirlenmesi ve karşılaştırılması amaçlandı.
YÖNTEMLER
Çalışma, 01 Temmuz – 31 Ekim 2021 tarihleri arasında prospektif olarak yürütüldü. Hastanemizin aşı polikliniğinde BNT162b2 veya inaktif SARS-CoV-2 aşısı uygulanan bireyler kohortu oluşturdu. Gebeler, emzirenler, 18 yaş altı bireyler, şahsen olur veremeyecek kişiler ve aşı uygulaması sonrası sekiz gün içinde COVID-19 geçirmiş olanlar çalışma dışı tutuldu. Kohort; kendi içinde iki aşı grubuna ve her bir aşı grubu da COVID-19 geçirmiş ve geçirmemiş olanlar olmak üzere iki alt gruba ayrıldı. Alt gruplarda da aynı gün BNT162b2 aşısı veya inaktif SARS-CoV-2 aşısı uygulananlar eşleştirildi. Çalışmaya dahil edilen tüm katılımcılardan aşının uygulandığı gün bilgilendirilmiş gönüllü onamı yazılı olarak alındı; yaşı, cinsiyeti, daha önce COVID-19 geçirip geçirmediği bilgisi, hangi aşıların uygulandığı, kaçıncı doz aşısı uygulandığı ve kronik hastalık bilgileri kayıt altına alındı. Kohorttaki tüm bireyler aşılanma tarihinden sekiz gün sonra telefonla aranarak İstenmeyen Etki Değerlendirme Anketi yoluyla aşı sonrası ilk yedi gün içinde ortaya çıkan akut istenmeyen etkiler belirlendi.
Çalışma için Ankara Şehir Hastanesi 1 No’lu Klinik Araştırmalar Etik Kurulu’ndan 07 Temmuz 2021 tarih ve E1-21-1933 karar numarasıyla onay alındı.
İstenmeyen Etki Değerlendirme Anketi
Anket araştırmacılarımız tarafından hazırlanmış olup akut istenmeyen etki sorgulaması, genel semptomlar, lokal semptomlar, kardiyovasküler sistem semptomları, solunum sistemi semptomları, gastrointestinal sistem semptomları, nörolojik ve psikiyatrik semptomlar, solunum sistemi semptomları, kulak/burun/ boğaz/göz semptomları ve alerjik semptomlar olmak üzere dokuz ana başlık altında 46 maddeden oluşan sistem sorgusundan oluşmaktaydı. Katılımcılardan her bir maddeyi “evet / hayır” şeklinde cevaplamaları istendi. Bildirilen istenmeyen etkilerin günlük aktivitelere etkisi; “geçici olarak günlük düzenli aktivitelerimi gerçekleştiremedim”, “geçici olarak işe gidemedim”, “evde ayaktan tedavi aldım”, “acil servise başvurup, tedavi oldum” ve “hastanede yatarak tedavi oldum” şeklinde beş madde ile sorgulandı. İstenmeyen etkinin şiddet derecesi belirlenmeye çalışıldı. Herhangi bir nedenle anketi tamamlayamayan ya da kendi isteği ile çalışmadan ayrılanlar çalışma dışı bırakıldı.
Örneklem
Minimum örnek büyüklüğü, Epi Info versiyon 3.01 (CDC, Atlanta, ABD) bilgisayar programında; %95 güven düzeyinde ve 0.90 güç, COVID-19 geçirmeyenlerde istenmeyen etki insidansı %50, COVID-19 geçiren ve geçirmeyenlerin birbirine oranı 1 ve rölatif risk (“risk ratio” – RR) oranı 1.8 kabul edilerek her bir alt kolda 317 kişi olmak üzere toplam 1268 olarak hesaplandı. Çalışma için örnek seçimi yapılmadı ve aşılanan tüm bireyler çalışmaya alındı.
İstatistiksel Analiz
Kategorik değişkenler; sayı, yüzde ve %95 güven aralığı ile özetlenip, karşılaştırmalarda χ2 testi kullanıldı. Yaş, aktiviteye etki ve istenmeyen etki süresi değişkeni ortalama, standart sapma, minimum ve maksimum değer ile özetlenip, normallik varsayımı karşılanan durumlarda karşılaştırmalarda bağımsız gruplarda Student t testi kullanıldı. Normallik varsayımı karşılanmıyorsa Mann-Whitney U testi kullanıldı. İstenmeyen etki süresi <1 gün olanlar analize 0.5 gün olarak alındı. Aşı dozları, aşı türleri arasında ve COVID-19 geçirme durumuna göre insidans (istenmeyen etki gelişen kişi sayısı/toplam kişi sayısı x100) ve %95 güven aralıkları hesaplandı. Gruplar arasında istenmeyen etki gelişimi için risk ölçütü olarak RR ve %95 güven aralığı (GA) hesaplandı. İstenmeyen etki gelişiminde etkili faktörler çok değişkenli lojistik regresyon analizi ile incelendi. Veriler “IBM SPSS Statistics for Windows, Version 20.0” (Armonk, NY, ABD) programı kullanılarak analiz edildi ve tüm istatistiksel testler için önemlilik sınırı 0.05 olarak alındı.
BULGULAR
Tablo 2. Aşı Dozu ve Aşı Türüne Göre Cinsiyet, COVID-19 Geçirme Öyküsü ve Ek Hastalık Varlığının
Dağılımı
Tablo 3. COVID-19 Geçirme Durumuna Göre Aşı Dozları Sonrası İstenmeyen Etki Gelişme İnsidansının
Karşılaştırılması
Tablo 4. Aşı Türüne Göre Aşı Dozları Sonrası İstenmeyen Etki Gelişme İnsidansının COVID-19 Geçiren
ve Geçirmeyenler Arasında Karşılaştırılması
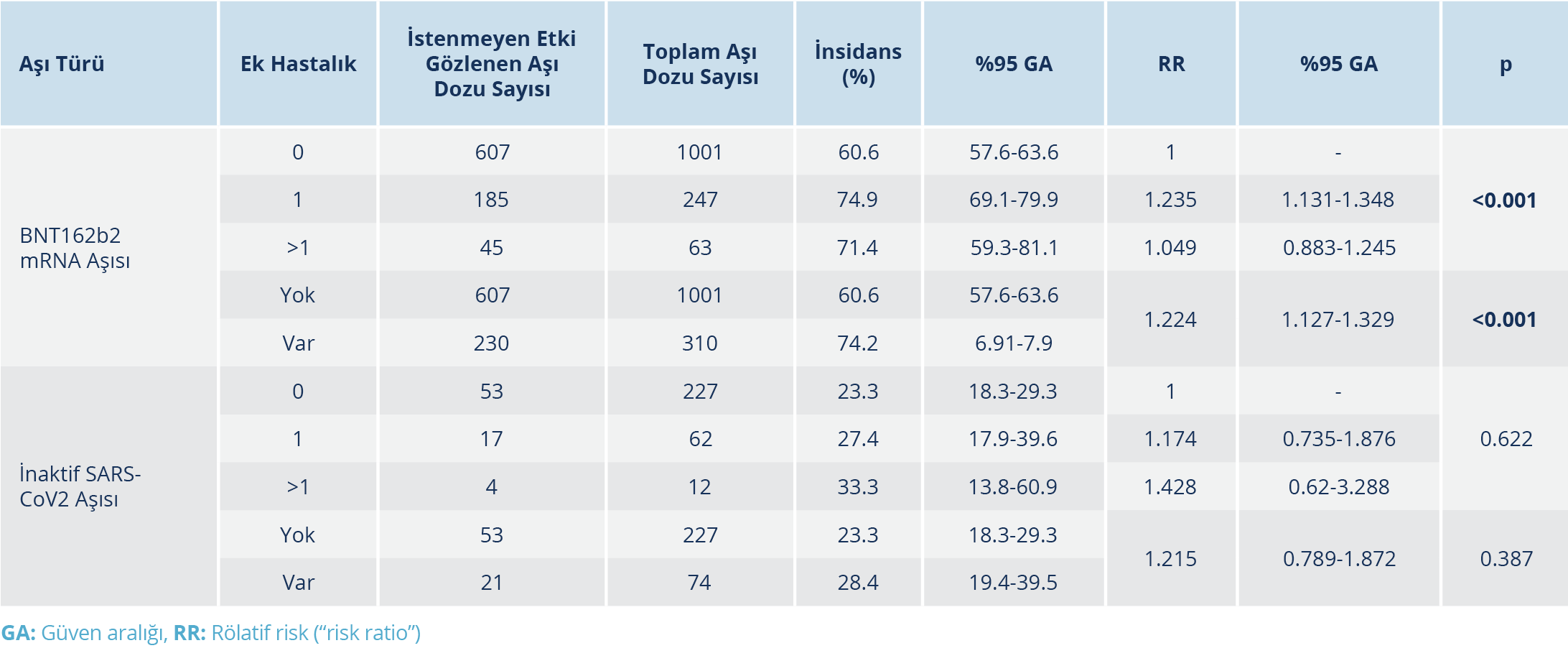
Tablo 5. Aşı Dozları Sonrası İstenmeyen Etki Gelişme İnsidansının Ek Hastalık Varlığı, Sayısı ve Aşı
Türüne Göre Karşılaştırılması
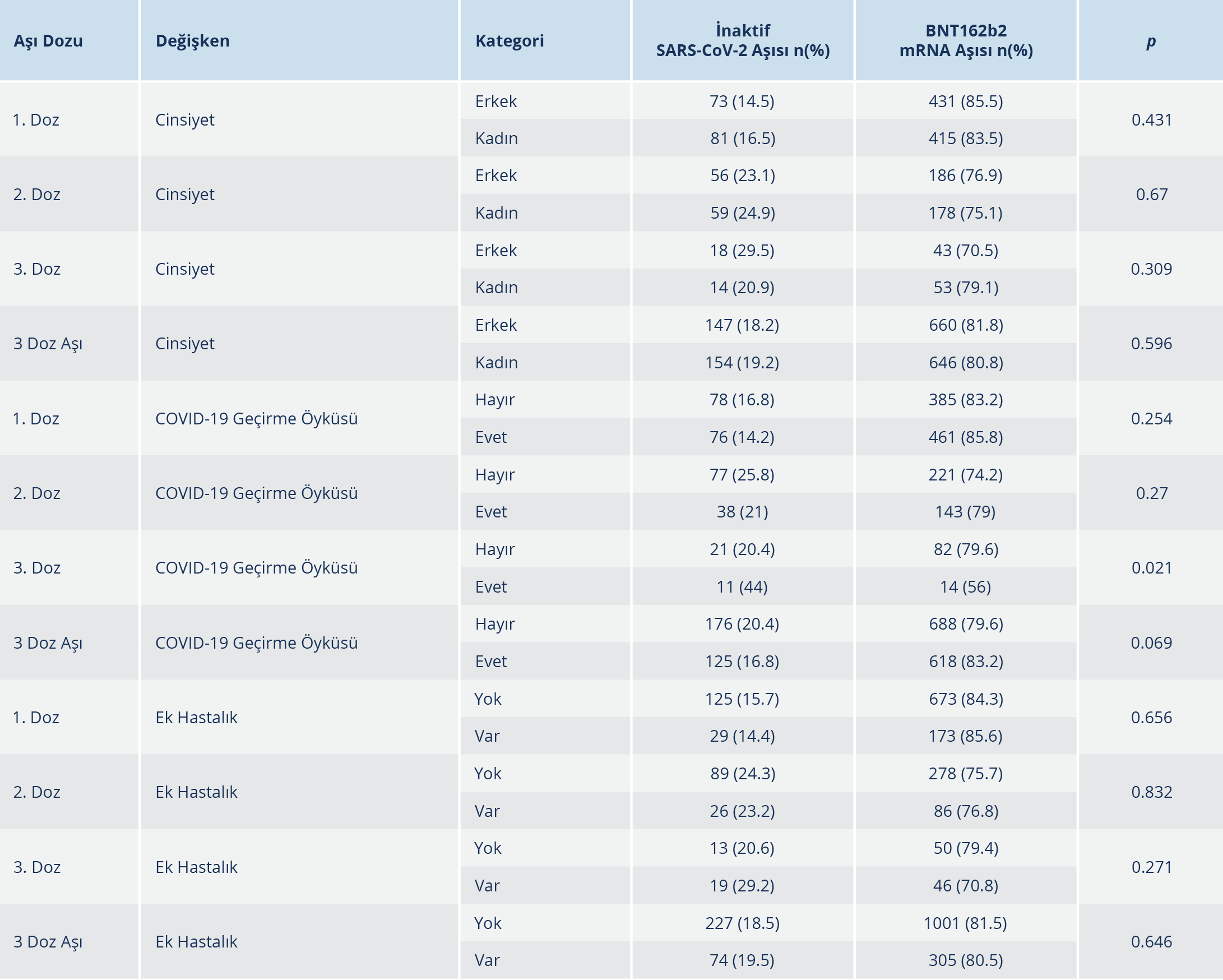
Çalışmada toplam 1607 aşı uygulaması izlenmiş olup bunların 807 (%50.2)’si erkek ve 800 (%49.8)’ü kadındı. Aşı dozlarının 301 (%18.7)’i inaktif SARS-CoV-2 aşısı, 1306 (%81.3)’sı BNT162b2 aşısı olup %62.2’si 1. doz, %29.8’i 2. doz ve %8’i 3. doz aşıydı. Çalışmaya dahil edilen bireylerin aşı şemasında aynı aşı türü ile aşılamaya (homolog aşı şeması) devam edildiği gözlendi; farklı aşı türleri ile aşılanma (heterolog aşılama) gözlenmedi. Aşı uygulanan kişilerin yaş ortalaması, kaçıncı doz olduğuna bakılmaksızın 43.9±14.5 (minimum=18 – maksimum=91) olarak tespit edildi (Tablo 1). Aşı dozu öncesi COVID-19 geçirme öyküsü olan birey sayısı 743 (%46.2)’tü. Aşı uygulanan kişilerin 379 (%23.6)’unda en az bir ek hastalık öyküsü olup 75 (%4.7)’inde birden fazla ek hastalık öyküsü bulunmaktaydı. Aşı dozu ve türüne göre; cinsiyet, COVID-19 geçirme öyküsü ve ek hastalık varlığının dağılımı Tablo 2’de verildi.
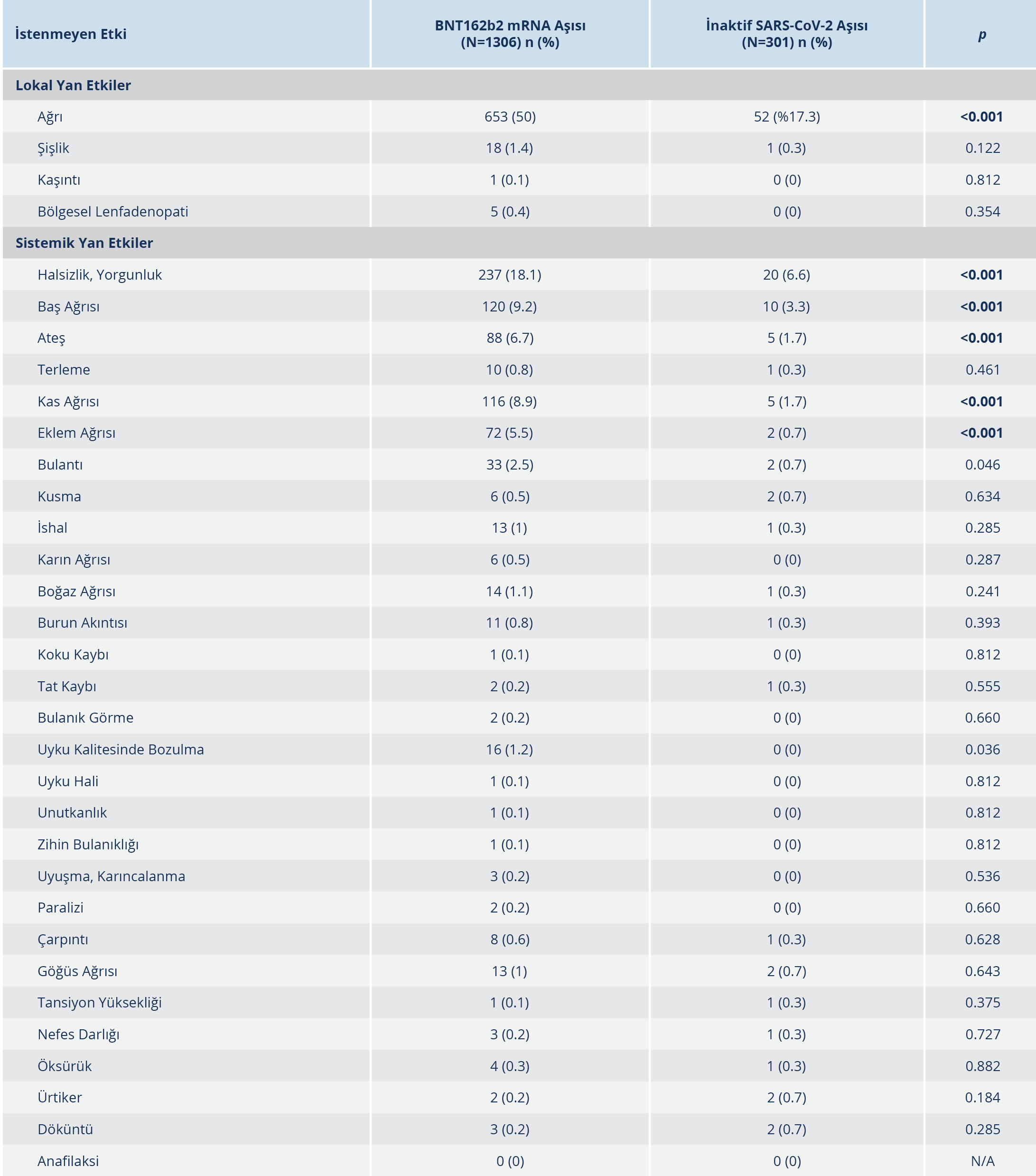
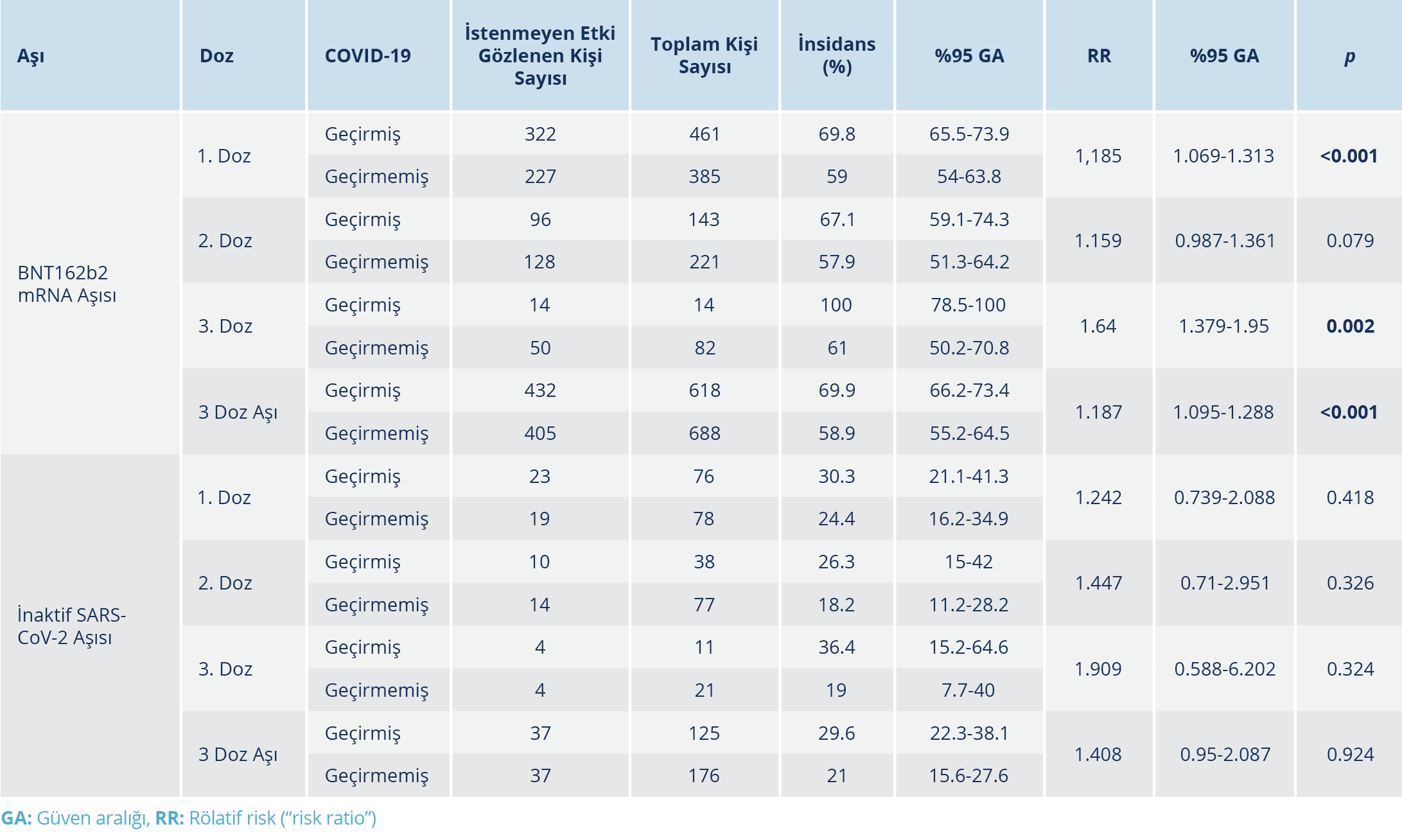
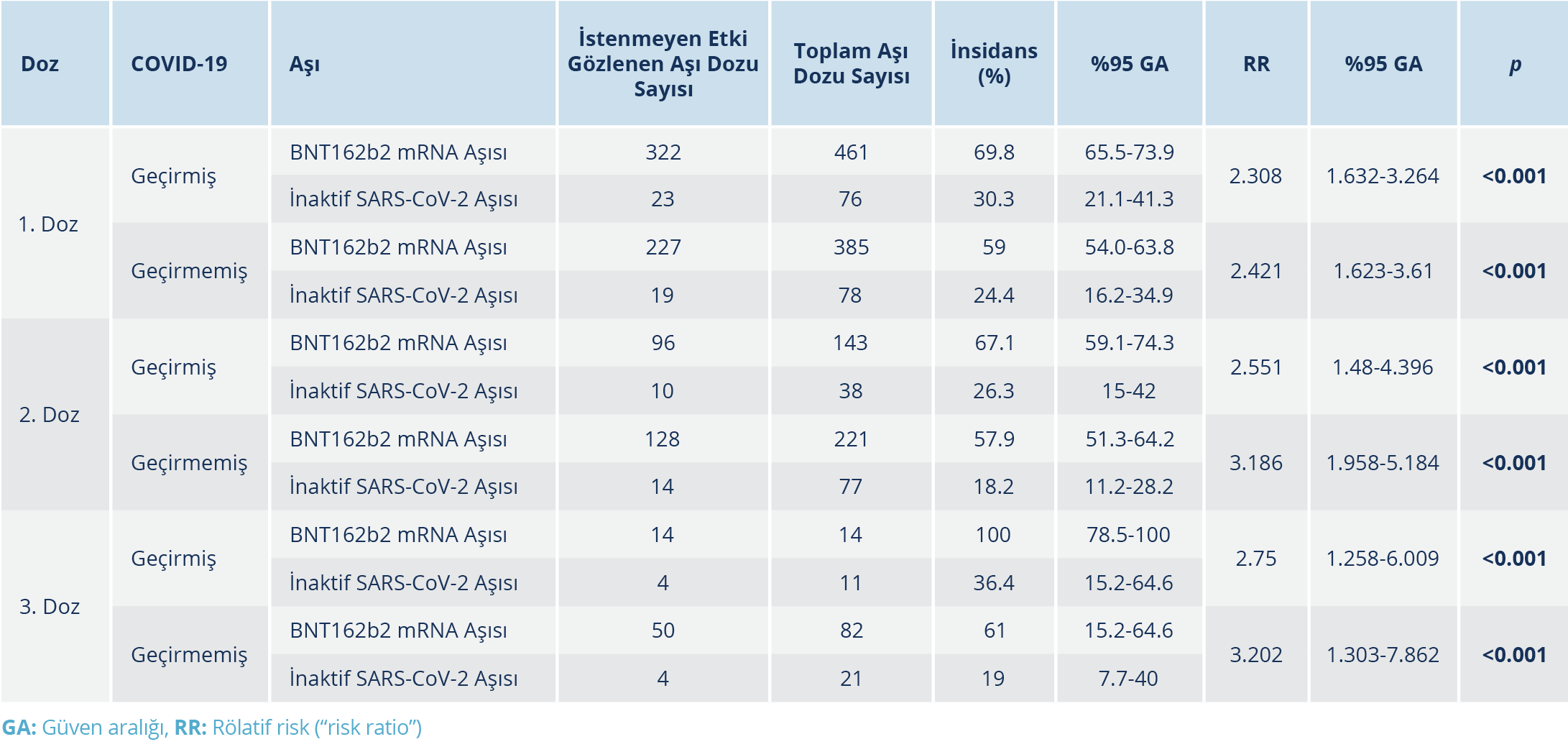
Aşı uygulaması sonrasında yedi gün içinde herhangi bir istenmeyen etki görülme oranı BNT162b2 aşısı için %64.1 [%95 GA: %61.2-%66.4], inaktif SARS-CoV-2 aşısı için %24.6 (%95 GA: %20.1-%29.8) olarak tespit edildi [“odds ratio” (OR): 1.975; %95 GA: 1.60-2.44]. Aşı dozu, aşı türü, COVID-19 geçirme öyküsü, ek hastalık varlığı ve sayısına göre istenmeyen etki dağılımı Tablo 3, 4, ve 5’te verildi. BNT162b2 aşısı sonrası istenmeyen etki gelişme riski, ek hastalığı olanlarda olmayanlara göre anlamlı düzeyde daha yüksek bulundu (p<0.001). Birden fazla ek hastalık olması riski artırmadı. Aşı dozları sonrası istenmeyen etki gelişme insidansı COVID-19 geçiren ve geçirmeyenlerde aşı türüne göre karşılaştırıldığında, COVID-19 geçirenlerde BNT162b2 aşısı sonrası istenmeyen etki gelişme riski 3. doz için 1. ve 2. doza göre anlamlı ölçüde yüksek bulundu (p=0. 039; OR: 1.43; %95 GA: 1.35-1.52). Her iki aşı türünde aşı dozundan bağımsız olarak, aşı sonrası en sık gözlenen istenmeyen etkiler sırasıyla; kolda ağrı [BNT162b2 grubunda 653 (%50) kişi ve inaktif SARS-CoV-2 aşı grubunda 52 (%17.3) kişi; p<0.001], halsizlik/yorgunluk [BNT162b2 grubunda 237 (%18.1) kişi ve inaktif SARS-CoV-2 aşı grubunda 20 (%6.6) kişi; p<0.001] ve baş ağrısı [BNT162b2 grubunda 120 (%9.2) kişi ve inaktif SARS-CoV-2 aşı grubunda 10 (%3.3); p<0.001] idi (Tablo 6). Çalışmaya dahil edilen hiçbir bireyde ölüm ve hayatı tehdit eden ciddi istenmeyen etki (anafilaksi vb.) gözlenmedi. İstenmeyen etki gelişen aşı dozlarında inaktif SARS-CoV-2 aşısı ile %28.4 ve BNT162b2 aşısı ile %36.2 oranında istenmeyen etkinin günlük aktiviteye etkisi bulunurken (p=0.359); aşı türleri arasında ortalama günlük aktiviteye etki (p=0.359) ve ortalama istenmeyen etki süresi (p=0.520) de benzer bulundu. Çok değişkenli lojistik regresyon analizinde, BNT162b2 aşısı ile istenmeyen etki gelişme riski; yaş, cinsiyet, aşı dozu, COVID-19 geçirme öyküsü ve ek hastalık varlığına göre düzeltildiğinde inaktif SARS-CoV-2 aşısına göre 5.8 kat daha yüksek bulundu (OR: 5.83; %95 GA: 4.34-7.84). COVID-19 geçirenlerde COVID-19 geçirmeyenlere göre istenmeyen etki gelişme riski; aşı dozu, aşı türü, yaş, cinsiyet ve ek hastalık varlığına göre düzeltildiğinde 1.6 kat fazla bulundu (OR: 1.60; %95 GA: 1.29-2.00).
İRDELEME
Aşıların yaygın kullanıma sunulmasından sonra genel popülasyonun aşı güvenliği açısından izlenmesi gerekir. Tüm dünyada COVID-19 aşılarının çeşitli gruplarda, gerçek yaşamdaki etkinliğini ve güvenliğini değerlendirmek için çalışmalar yürütülmektedir (6). Ülkemizde de aşı sonrası istenmeyen etkiler, yapılan bildirimlere dayalı olarak, T.C. Sağlık Bakanlığı tarafından izlenmektedir (7). Ancak söz konusu bildirimlerde eksiklikler ve bilgi kısıtlılığı olabilir. COVID-19 aşıları, nispeten sınırlı klinik veriyle hızlandırılmış bir onay süreci sonunda kullanıma sunulduğu için gerçek yaşam verileri, bu aşıların etkinliğinin ve güvenliğinin izlenmesinde ve toplumun güveninin korunmasında kritik öneme sahiptir. Çalışmamızda, ülkemizde kullanımda olan BNT162b2 ve inaktif SARS-CoV-2 aşılarının gerçek yaşam verileri, aşı güvenliği açısından incelendi.
İnaktif SARS-CoV-2 aşısı, gerçekleştirilen klinik çalışmalarda tolere edilebilir advers etki profiline sahip olarak bildirilmiştir. CoronaVac aşısının faz 1 ve 2 çalışmalarında, farklı dozlama ve aşılama şemaları uygulansa da en sık gözlenen advers etkilerin lokal reaksiyonlar olduğu ve aşı uygulanan grupta advers etki sıklığı sırasıyla %29 ve %33 olarak bildirilmiştir (8). Ülkemizden bildirilen faz 3 çalışma sonuçlarında, lokal reaksiyonlar daha sık gözlenmiş ve advers etki görülme oranı aşılanan grupta %18.9 olarak raporlanmıştır. Ciddi advers etki görülme oranı %0.1 olarak bulunmuş ve sadece bir katılımcıda ciddi sistemik alerjik reaksiyon geliştiği bildirilmiştir (3). Aşının uygulandığı bir diğer ülke olan Şili’de yapılan çalışmada ise hiçbir ciddi advers etki gözlenmediği bildirilmiştir (9). Diğer taraftan gerçek yaşam verileri ile sağlık çalışanları arasında inaktif SARS-CoV-2 aşısının güvenliğini değerlendiren bir çalışmada; 1. ve 2. doz sonrası advers etki görülme insidansı sırasıyla %15.6 ve %14.6 olarak bulunmuştur (10). Bir diğer çalışmada da daha önceden COVID-19 geçirmiş ve geçirmemiş sağlık çalışanları arasında inaktif SARS-CoV-2 aşısı sonrası advers etki insidansının benzer olduğu bildirilmiştir (11). Ülkemizde inaktif SARS-CoV-2 aşısı olan 4040 sağlık çalışanının incelendiği bir çalışmada 1. ve 2. dozlar sonrası en sık görülen yan etkiler enjeksiyon bölgesinde ağrı, baş ağrısı ve halsizliktir (12). Sağlık çalışanları toplumda kronik hastalık insidansının düşük olduğu nispeten genç popülasyonu temsil edebileceğinden, sonuçlar bu durum göz önünde bulundurularak yorumlanmalıdır. İnaktif SARS-CoV-2 aşısının otoimmün romatolojik hastalığı olan grupta güvenlik ve etkinliğinin değerlendirildiği bir çalışmada, aşı sonrası istenmeyen etki insidansı önceki klinik çalışma sonuçlarıyla benzer bulunmuştur (13). Ülkemizde kanser hastalarında inaktif SARS-CoV-2 aşısının etkinlik ve güvenliğini değerlendiren çok merkezli bir kohort çalışmada, kanser hastalarına göre kontrol grubunda ilk aşı dozu sonrası yan etki oranı yüksek bulunmuştur. Bunun nedeni, araştırmacılar tarafından, kanser hastalarının hastalık seyrinde ve daha önceki tedavilerinde benzer yan etkiler ile karşılaştıklarından yan etki bildiriminin düşük bulunduğu şeklinde yorumlanmıştır. İkinci aşı dozu sonrası yan etki oranı ise her iki grupta benzer bulunmuştur (14).
Genetik temelli bir aşı olan BNT162b2 aşısı için 6 ülkeden 43 548 katılımcı ile gerçekleştirilen faz 3 çalışma sonuçlarında, 16-55 yaşları arası yetişkinlerin yaklaşık %80’inde (1. doz: %83; 2. doz: %78) aşılama sonrası lokal reaksiyon bildirilmiştir. En sık bildirilen sistemik reaksiyonlar ise %59 oranında yorgunluk ve %52 oranında baş ağrısı olarak raporlanmıştır. Advers etkiler genç yaş grubunda (16-55 yaş) ve 2. dozdan sonra daha sık görülmüştür (2). 600 000’den fazla aşılanmış kişinin anket verilerine dayalı bir çalışmanın sonucunda, BNT162b2 aşısı sonrası akut istenmeyen etkiler faz 3 çalışmasında bildirilen oranlardan daha düşük bulunmuştur (15). Her ne kadar BNT162b2 aşısının gerçek yaşam verileri ile etkinliği ve güvenliği doğrulanmış olsa da faz 3 çalışmalarında bildirilmemiş fakat yaygın aşılama sırasında nadir görülen advers etkiler aşı ile ilişkili bulunmuştur (16). Çalışmamızda, aşı sonrası istenmeyen etki görülme oranı BNT162b2 aşısında %64.1 (%95 GA: %61.2-%66.4), inaktif SARS-CoV-2 aşısında %24.6 (%95 GA: %20.1-%29.8) olarak tespit edildi (OR: 1.97; %95 GA: 1.60-2.44). Bu oranlar, aşıların klinik öncesi çalışmalarında bulunan oranlardan daha düşük olup diğer gerçek yaşam verileri ile benzerdir.
Mart 2022 itibariyle dünya genelinde, BNT162b2 aşısı 141 ülkede, inaktif SARS-CoV-2 aşısı 54 ülkede acil kullanım onayı almış olup birçok ülkede yaygın olarak aşılamada kullanılmaktadır (17). Bu aşıların her biri ile ilgili olarak çeşitli araştırmaların klinik öncesi çalışmaları ve gerçek yaşam verileri sunulmuş olmakla birlikte yalnızca bir prospektif kohort çalışmada BNT162b2 ve inaktif SARS-CoV-2 aşısı güvenlik açısından karşılaştırılmıştır (5). Çalışmamızda, her iki aşıda da aşı dozundan bağımsız olarak gözlenen istenmeyen etkilerin genellikle lokal ve ciddi olmayan sistemik advers etkiler olduğunu saptadık. BNT162b2 aşısı ile istenmeyen etki gelişme riski inaktif SARS-CoV-2 aşısına göre 5.8 kat daha yüksekti. Bununla birlikte istenmeyen etki süresi ve istenmeyen etkinin günlük yaşama etkisi iki aşı arasında benzer bulundu. Lai ve arkadaşlarının (5) çalışmasından farklı olarak çalışmamızda, aşı sonrası istenmeyen etkiler COVID-19 geçirip geçirmeme durumuna göre de incelendi. COVID-19 geçiren kişilerde zamanla nötralize edici antikorların azaldığı ve tekrarlayan infeksiyonların giderek artan oranda görüldüğü bildirilmektedir (18). SARS-CoV-2 varyantları, özellikle delta ve omicron, daha bulaşıcıdır ve önceki infeksiyondan kaynaklanan nötralize edici antikorların önemli bir kısmından kaçabilme yeteneğine sahiptir. Bu nedenle önceden COVID-19 geçiren kişilerin de tekrar aşılanması makul görünmektedir (19). Çalışmamızda COVID-19 geçirenlerde aşı sonrası istenmeyen etki görülme riski COVID-19 geçirmeyenlere göre 1.6 kat fazla bulundu (OR: 1.61; %95 GA: 1.29-2.00). Aşı türlerine göre incelediğimizde BNT162b2 aşısı sonrası advers etki gelişme riski hastalığı geçirenlerde anlamlı derecede yüksek bulundu. İnaktif SARS-CoV-2 aşısı sonrası hastalığı geçirenlerde istenmeyen etki insidansının sayısal olarak daha yüksek olduğu gözlenmekle birlikte kontrol grubuyla karşılaştırıldığında istatistiksel olarak anlamlı düzeyde bir fark saptanmadı. COVID-19 infeksiyonu öyküsü olanlarda BNT162b2 aşısının advers etkiler açısından değerlendirildiği bir çalışmada, aşının genellikle iyi tolere edildiği fakat hastalığı geçirenlerde advers etki riskinin daha yüksek olduğu bildirilmiştir. Söz konusu çalışmada, yalnızca 1. doz sonrası gözlenen istenmeyen etkiler incelenmiş, 2. doz ve hatırlatma dozuna ait veriler değerlendirilmemiştir (20). Birleşik Krallık’ta çok sayıda katılımcının mobil uygulama üzerinden verilerini oluşturduğu aşı sonrası akut istenmeyen etkilerin değerlendirildiği bir çalışmada, COVID-19 geçirenlerde mRNA aşıları sonrası hem 1. doz hem de 2. doz sonrası sistemik ve lokal reaksiyonların kontrol grubuna göre daha sık gözlendiği raporlanmıştır (15). Bizim çalışmamızda COVID-19 geçirenlerde BNT162b2 aşısı sonrası advers etki sıklığının 3. dozda, 1. ve 2. doza kıyasla daha fazla olduğu görüldü. COVID-19 geçirenlerde her bir aşı dozu, daha yüksek bir hümoral ve hücresel yanıta sahip ikinci bir doza karşılık gelerek aşı sonrası reaktojeniteye yol açıyor olabilir. Bununla birlikte, aşı sonrası reaktojenitenin hümoral veya hücresel yanıtın yoğunluğu ile ilişkili olup olmadığını anlamak için daha fazla çalışmaya ihtiyaç vardır.
Çalışmamızda yalnızca aşı sonrası akut istenmeyen etkiler değerlendirilmiş olup ciddi advers reaksiyonlar gözlenmedi. Rapor edilen istenmeyen etkiler telefon görüşmesi ile değerlendirildiği ve ayrıntılı bir vizit ve fizik muayene yapılmadığından minör reaksiyonlar gözden kaçmış veya gerçekte olandan daha şiddetli saptanmış olabilir. Diğer taraftan genel olarak anket bazlı çalışmalarda verilerin sübjektif olarak yansıdığı, yaşlılar gibi anketi yanıtlayamayacak engeli bulunan grupların çalışmaya dahil edilememesinin “bias” olasılığını artıracağı akılda tutulmalıdır. COVID-19 geçiren bireylerde akut infeksiyondan sonra devam eden ve bazen aylarca sürebilen uzamış COVID-19 ile ilişkili semptomlar aşı sonrası görülen yan etkiler ile benzer olabilir (21). Çalışmamızda, COVID-19 geçiren bazı bireylerde aşı sonrası gözlenen yan etkilerin gözden kaçan bir uzamış COVID-19 kliniğine ait olabileceğini de düşünmekteyiz. COVID-19 aşıları sonrası uzun dönem istenmeyen etkilerin ve daha nadir görülen advers etkilerin sıklığını belirlemek için daha geniş çaplı, randomize, kontrollü çalışmalara ihtiyaç vardır.
Sonuç olarak; BNT162b2 aşı uygulamasında inaktif SARS-CoV-2 aşısına kıyasla ve COVID-19 geçirenlerde geçirmeyenlere kıyasla aşı sonrası akut istenmeyen etki daha sık görülmesine rağmen, söz konusu etkilerin çoğu hafif, geçici ve yönetilebilirdir. Yeni ortaya çıkan varyantlarla birlikte tekrarlayan doz gereksinimlerinin istenmeyen etki insidansında artışa yol açıp açmayacağı henüz bilinmese de toplumun aşı güvenli açısından sürekli izlemi çok önemlidir.
Hasta Onamı
Çalışmaya dahil edilen tüm katılımcılardan aşının uygulandığı gün bilgilendirilmiş gönüllü onamı yazılı olarak alınmıştır.
Etik Kurul Kararı
Çalışma için Ankara Şehir Hastanesi 1 Numaralı Klinik Araştırmalar Etik Kurulu’ndan 07 Temmuz 2021 tarih ve E1-21-1933 karar numarasıyla onay alınmıştır.
Danışman Değerlendirmesi
Bağımsız dış danışman.
Yazar Katkıları
Fikir/Kavram – Ü.S.S., C.H.H.; Tasarım – Ü.S.S., C.H.H.; Denetleme – Ü.S.S., C.H.H., D.D., A.Y.; Kaynak ve Fon Sağlama – D.D., A.Y., C.H.H.; Malzemeler/Hastalar – Ü.S.S., D.D., A.Y.; Veri Toplama ve/veya İşleme – Ü.S.S., A.Y.; Analiz ve/veya Yorum – Ü.S.S., C.H.H., D.D.; Literatür Taraması – Ü.S.S., A.Y.; Makale Yazımı – Ü.S.S., C.H.H., A.Y.; Eleştirel İnceleme – Ü.S.S., C.H.H., D.D.
Çıkar Çatışması
Yazarlar herhangi bir çıkar çatışması bildirmemiştir.
Finansal Destek
Yazarlar finansal destek beyan etmemiştir.
Referanslar
- McGovern ME, Canning D. Vaccination and all-cause child mortality from 1985 to 2011: global evidence from the Demographic and Health Surveys. Am J Epidemiol. 2015;182(9):791-8. [CrossRef]
- Polack FP, Thomas SJ, Kitchin N, et al; C4591001 Clinical Trial Group. Safety and efficacy of the BNT162b2 mRNA Covid-19 vaccine. N Engl J Med. 2020;383(27):2603-15. [CrossRef]
- Tanriover MD, Doğanay HL, Akova M, et al; CoronaVac Study Group. Efficacy and safety of an inactivated whole-virion SARS-CoV-2 vaccine (CoronaVac): interim results of a double-blind, randomised, placebo-controlled, phase 3 trial in Turkey. Lancet. 2021;398(10296):213-22. Erratum in: Lancet. 2022;399(10323):436. [CrossRef]
- Four vaccines approved for use in Turkey [İnternet]. VIPER Group COVID19 Vaccine Tracker Team. [güncelleme 2 Kasım 2022; erişim 30 Mart 2022]. https://covid19.trackvaccines.org/country/turkey
- Lai FTT, Leung MTY, Chan EWW, et al. Self-reported reactogenicity of CoronaVac (Sinovac) compared with Comirnaty (Pfizer-BioNTech): A prospective cohort study with intensive monitoring. Vaccine. 2022;40(10):1390-6. [CrossRef]
- COVID-19 vaccine studies database [İnternet]. Bethesda: National Institute of Health (NIH) [erişim 30 Mart 2022]. https://www.clinicaltrials.gov/ct2/results?cond=COVID-19+vaccine
- Aşı sonrası istenmeyen etkiler genelgesi (2009) [İnternet]. Ankara: T.C. Sağlık Bakanlığı. [erişim 30 Mart 2022]. https://www.saglik.gov.tr/TR,11136/asi-sonrasi-istenmeyen-etkiler-genelgesi-2009.html
- Zhang Y, Zeng G, Pan H, et al. Safety, tolerability, and immunogenicity of an inactivated SARS-CoV-2 vaccine in healthy adults aged 18-59 years: a randomised, double-blind, placebo-controlled, phase 1/2 clinical trial. Lancet Infect Dis. 2021;21(2):181-92. [CrossRef]
- Bueno SM, Abarca K, González PA, et al. Safety and immunogenicity of an inactivated severe acute respiratory syndrome coronavirus 2 vaccine in a subgroup of healthy adults in Chile. Clin Infect Dis. 2022;75(1):e792-e804. [CrossRef]
- Zhang MX, Zhang TT, Shi GF, et al. Safety of an inactivated SARS-CoV-2 vaccine among healthcare workers in China. Expert Rev Vaccines. 2021;20(7):891-8. [CrossRef]
- Soysal A, Gönüllü E, Karabayır N, et al. Comparison of immunogenicity and reactogenicity of inactivated SARS-CoV-2 vaccine (CoronaVac) in previously SARS-CoV-2 infected and uninfected health care workers. Hum Vaccin Immunother. 2021;17(11):3876-80. [CrossRef]
- Tosun S, Ozkan Ozdemir H, Erdogan E, et al. Adverse events report of inactivated COVID-19 vaccine from 4040 healthcare workers. Postgrad Med. 2022;134(1):104-10. [CrossRef]
- Medeiros-Ribeiro AC, Aikawa NE, Saad CGS, et al. Immunogenicity and safety of the CoronaVac inactivated vaccine in patients with autoimmune rheumatic diseases: a phase 4 trial. Nat Med. 2021;27(10):1744-51. [CrossRef]
- Yasin AI, Aydin SG, Sümbül B, et al. Efficacy and safety profile of COVID-19 vaccine in cancer patients: a prospective, multicenter cohort study. Future Oncol. 2022;18(10):1235-44. [CrossRef]
- Menni C, Klaser K, May A, et al. Vaccine side-effects and SARS-CoV-2 infection after vaccination in users of the COVID Symptom Study app in the UK: a prospective observational study. Lancet Infect Dis. 2021;21(7):939-49. [CrossRef]
- Barda N, Dagan N, Ben-Shlomo Y, et al. Safety of the BNT162b2 mRNA Covid-19 Vaccine in a Nationwide Setting. N Engl J Med. 2021;385(12):1078-90. [CrossRef]
- Approved vaccines [İnternet]. VIPER Group COVID19 Vaccine Tracker Team. [güncelleme 2 Kasım 2022; erişim 30 Mart 2022]. https://covid19.trackvaccines.org/vaccines/approved/ – vaccine-list
- Cromer D, Juno JA, Khoury D, et al. Prospects for durable immune control of SARS-CoV-2 and prevention of reinfection. Nat Rev Immunol. 2021;21(6):395-404. [CrossRef]
- Zou J, Xia H, Xie X, et al. Neutralization against Omicron SARS-CoV-2 from previous non-Omicron infection. Nat Commun. 2022;13(1):852. [CrossRef]
- Baldolli A, Michon J, Appia F, Galimard C, Verdon R, Parienti JJ. Tolerance of BNT162b2 mRNA COVI-19 vaccine in patients with a medical history of COVID-19 disease: A case control study. Vaccine. 2021;39(32):4410-3. [CrossRef]
- Yong SJ. Long COVID or post-COVID-19 syndrome: putative pathophysiology, risk factors, and treatments. Infect Dis (Lond). 2021;53(10):737-54. [CrossRef]