En Çok Okunanlar
Özet
Amaç: Tüm dünyada, COVID-19 pandemisinin kontrol altına alınmasında en etkili yol aşı uygulamalarıdır. Amacımız, iki doz inaktif SARS-CoV-2 aşısı olan CoronaVac (Sinovac Life Sciences, Pekin, Çin) uygulanmış sağlık çalışanlarında, hatırlatma dozu olarak uygulanan Pfizer-BioNTech ortaklığı ile geliştirilen COVID-19 mRNA aşısı (BNT162b2) sonrası antikor titreleri ile aşı yan etkileri arasındaki ilişkiyi değerlendirmektir.
Yöntemler: Çalışmaya 428 sağlık çalışanı katıldı. Hatırlatma dozu olarak mRNA aşısı uygulanan katılımcılar antikor değerleri ve aşı yan etkileri açısından anket ile değerlendirildi. Sağlık çalışanlarına ilk BNT162b2 aşı uygulamasından üç hafta sonra yüz yüze olarak, ikinci kez hatırlatma dozu yaptıranlara ise telefon aracılığı aynı anket uygulandı.
Bulgular: İnaktif aşı sonrası hatırlatma dozu olarak, 428 sağlık çalışanının 373 (%87.1)’ü bir, 55 (%12.9)’i ise iki doz BNT162b2 aşısı tercih etmişti. Kadınlarda tek doz için ve 18-40 yaşları arasında BNT162b2 aşısı sonrası yan etkilerin daha sık olduğu görüldü (p<0.001). En sık görülen yan etki, %59.6 oranıyla enjeksiyon yerinde kızarıklık, şişlik ve ağrıydı. Yorgunluk-halsizlik ise %58.6 oranıyla sistemik reaksiyonlardan en sık görülen oldu. Katılımcıların üç (%1.1)’ünde aksiller lenfadenopati görüldü. Yan etki görülen sağlık çalışanlarının hatırlatma dozu sonrası üçüncü haftadaki IgG titrelerine ait medyan değeri yan etki görülmeyenlere göre daha yüksek olarak saptandı (p<0.001). Aşılı kişilerin kümülatif insidans oranları 389 kişi üzerinden değerlendirildiğinde; BNT162b2’nin birinci hatırlatma dozu sonrasında 14. ve 30. günlerde hiç olgu görülmeyip ilk olarak 60. gün içinde ve ikinci doz sonrasında ise 14., 30. ve 60. günlerde olgu gözlendi.
Sonuç: BNT162b2 hatırlatma dozu uygulamasından sonra tespit edilen yan etkilerin hafif-orta derecede olması ve lokal semptomlarla seyretmesi nedeniyle, yüksek koruyuculuğa sahip mRNA aşılarının COVID-19’dan korunmada güvenle tercih edilebileceği görüldü.
GİRİŞ
SARS-CoV-2’nin neden olduğu COVID-19 hastalığı, başta akciğerler olmak üzere birçok sistemi tutan, mortalitesi ve morbiditesi nedeniyle toplumların gündelik yaşamını etkileyen bulaşıcı bir hastalıktır. Mart 2020’de başlayan pandemi nedeniyle tüm dünyada hızlı bir şekilde aşı geliştirme çalışmaları başlatılmıştır. Tarih boyunca tüm pandemilerin kontrolünde en etkili yol aşı uygulamaları olmuştur. COVID-19 pandemisinde inaktif, canlı atenüe, protein alt ünitesi, virus benzeri parçacıklar, viral vektör ve mRNA olmak üzere 130’dan fazla aşı geliştirilmiş olup pre-klinik çalışmaları da devam eden yüzlerce aşı bulunmaktadır (1). Aralık 2020’de, Pfizer-BioNTech ortaklığı ile geliştirilen COVID-19 mRNA aşısı (BNT162b2), Amerikan Gıda ve İlaç Dairesi (“U.S. Food and Drug Administration – FDA”) tarafından acil kullanım onayı verilen ilk COVID-19 aşısı olmuştur (2). Faz 3 çalışmasında etkinliği %95 olarak saptanan BNT162b2 aşısının, yüksek SARS-CoV-2 nötralize edici antikor titreleri ve güçlü antijene özgü CD8+ yanıtı ortaya çıkardığı gösterilmiştir (3, 4). Yapılan çeşitli klinik çalışmalarda, faz 3 çalışmalarına kıyasla daha düşük şiddet ve oranda yan etkiler görülmüştür (5, 6). Ülkemizde T.C. Sağlık Bakanlığı’nın aşılama programı kapsamında sağlık çalışanlarına, Ocak 2021’den itibaren inaktif SARS-CoV-2 aşısı olan CoronaVac (Sinovac Life Sciences, Pekin, Çin) uygulanmaya başlanmış olup daha sonra ortaya çıkan endişe verici varyantlara karşı söz konusu aşının etkinliğinin düşmesi nedeniyle, üçüncü doz olarak BNT162b2 aşısı tercihe sunulmuştur. Farklı aşı kombinasyonları ile uygulanan heterolog aşılamanın immünojenisitesi ve bağışıklığa nasıl katkı sağladığına dair elde edilecek bilgiler, aşılama politikalarına rehberlik etmek için büyük önem taşımaktadır.
Kohort olarak planlanan bu çalışmanın amacı, hastanemizde iki doz CoronaVac ile aşılanmış sağlık çalışanlarında hatırlatma dozu olarak uygulanan BNT162b2 aşısı sonrası antikor titrelerinde meydana gelen değişim ile aşı yan etkileri arasındaki ilişkiyi incelemektir.
YÖNTEMLER
Çalışma Grubu
Çalışmamıza, Sanko Üniversitesi Tıp Fakültesi Sani Konukoğlu Uygulama ve Araştırma Hastanesi’nde görev yapan ve COVID-19 geçiren/geçirmeyen 428 sağlık çalışanı gönüllü olarak katıldı. Katılımcıların tamamı 2021 yılı Ocak ve Şubat aylarında iki doz CoronaVac ile aşılandıktan altı ay sonra, üçüncü doz olarak BNT162b2 aşısını tercih etmişti. Üçüncü dozunda BNT162b2 aşısını tercih eden 55 kişi ise bir ay sonra dördüncü doz olarak yine BNT162b2 aşısı yaptırmışlardı. Tüm katılımcılar bilgilendirilmiş onam formu doldurduktan sonra çalışmaya katılmıştır.
Çalışmaya, T.C. Sağlık Bakanlığı Sağlık Hizmetleri Genel Müdürlüğü Bilimsel Çalışma Platformu’na yapılan 2022-01-04T11_20_02 başvuru numarasıyla 07 Ocak 2022 tarihinde ve Sanko Üniversitesi Tıp Fakültesi Klinik Araştırmalar Etik Kurulu tarafından Şubat 2021’de 2021/02/01 karar numarasıyla onay verilmiştir.
Laboratuvar Analizleri
SARS-CoV-2’ye karşı aşıya bağlı bağışıklığı anlamak amacıyla, iki doz CoronaVac aşısı uygulanmış sağlık çalışanlarından ikinci doz uygulamasından sonra 4. ayda ve üçüncü doz olarak BNT162b2 aşısı yaptıranlardan ise üç hafta sonra serum örneği alınarak antikor düzeylerine bakıldı. Tüm örneklerin antikor değerleri Sanko Üniversitesi Tıp Fakültesi Sani Konukoğlu Uygulama ve Araştırma Hastanesi Merkez Laboratuvarı Mikrobiyoloji Bölümü’nde kemilüminesans mikropartikül immünoassay (CMIA) yöntemle çalışan Architect i2000SR (Abbott Diagnostics, ABD) analizörü ve SARS-CoV-2 IgG II Quant (CoV-2 IgG II; Abbott Laboratories, İrlanda) kiti kullanılarak belirlendi. Üretici firmanın önerileri doğrultusunda sonuçlar ≥50.0 AU/ml ise pozitif olarak değerlendirildi; >40.000 AU/ml’nin üzerinde çıkan örnekler 1:2 oranında dilüe edildikten sonra tekrar çalışıldı. Semptomu olan sağlık çalışanlarında SARS-CoV-2 infeksiyonu tanısı, nazofarengeal sürüntü örneklerinden CoronaGen RT-qPCR SARS-CoV2 variants detection kit V1.0 (Gensutek Sağlık Teknolojileri A.Ş., Türkiye) ile çalışılarak doğrulandı.
Aşı Protokolü
BNT162b2 aşısı, in vitro olarak SARS-CoV-2’nin “spike” (S) proteinini kodlayan ilgili RNA dizisinin çoğaltılmasıyla elde edilen yüksek derecede saflaştırılmış tek zincirli (5’ ucundan başlayan) “messenger” RNA (mRNA) aşısıdır; 0.3 ml’lik bir doz 30 μg SARS-CoV-2 mRNA içermektedir. Aşı kullanılmadan önce %0.9 NaCl çözeltisinden 1.8 ml alınır ve sulandırılarak seyreltilir; 0.3 ml olarak 90° açı ile deltoid kasa intramüsküler olarak uygulanır.
Anket Çalışması
Katılımcılardan, BNT162b2 aşısının ilk hatırlatma dozu yapıldıktan üç hafta sonra antikor düzeyi bakmak için serum örneği alınırken, aşının yan etkilerini belirlemek amacıyla anket uygulandı. Anket sorularıyla; cinsiyet, yaş gibi demografik verilerin dışında, COVID-19 geçirme öyküsü, aşı sonrası yan etki yaşanıp yaşanmadığı ve yaşandı ise ne kadar sürdüğü hakkında bilgiler sorgulandı. Aşı sonrası yan etki sıklığı, cinsiyet ve yaş gruplarına göre incelenerek karşılaştırıldı. BNT162b2 aşısının ikinci dozunu yaptıranlardan bir hafta sonra tekrar bir anket formu doldurmaları istendi ve ikinci doz sonrası yan etkiler sorgulandı. BNT162b2 aşısının ilk dozu ile ikinci dozu arasındaki yan etki oranları karşılaştırıldı.
İstatistiksel Analiz
Verilerin analizinde SPSS (“Statistical Package for the Social Sciences”) versiyon 23.0 programı (IBM Corp., Armonk, NY, ABD) kullanıldı. Ölçümle belirtilen sürekli değişkenler medyan ve minimum-maksimum değerleri ile, nitel değişkenler frekans ve yüzde değerleri ile sunuldu. Yan etki olan ve olmayan grupların karşılaştırmalarında; ölçümle belirtilen sürekli değişkenler için Mann-Whitney U testi, nitel değişkenler için χ2 testi kullanıldı. Birinci ve ikinci doz aşı sonrası 14., 30. ve 60. gün kümülatif insidans oranları ve %95 güven aralığı değerleri Microsoft Excel programında hesaplandı. İki grubun antikor düzeylerinin grafiksel gösterimi için kutu grafiği (“box plot”) kullanıldı. Tüm değerlendirmelerde p<0.05 istatistiksel olarak anlamlı düzey olarak kabul edildi.
BULGULAR
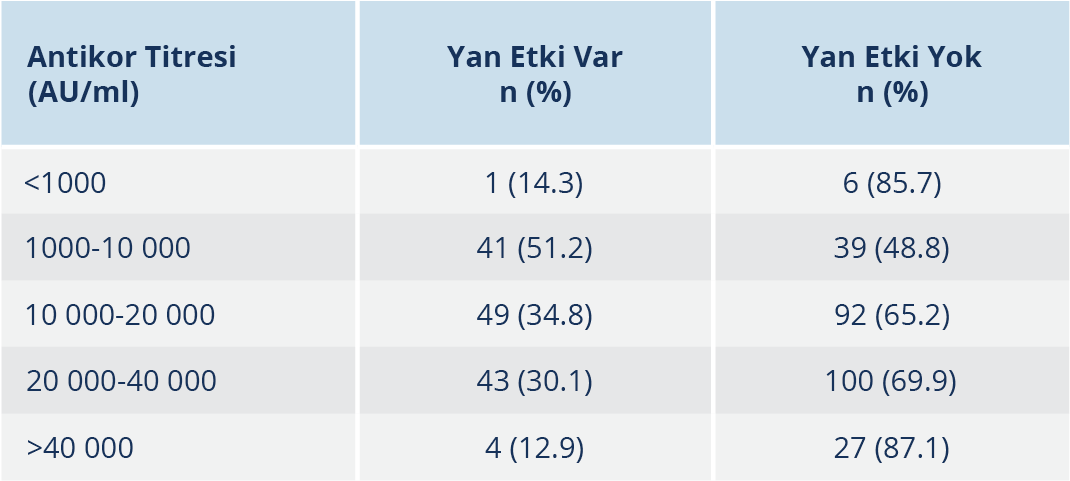
Tablo 1. İlk Hatırlatma Dozu Sonrası Üçüncü Hafta SARS-CoV-2
IgG Antikor Düzeyleri ve Yan Etki Oranları
Çalışmaya katılan 428 sağlık çalışanının 373 (%87.1)’ü iki doz CoronaVac sonrası hatırlatma dozu olarak BNT162b2, 55 (%12.9)’i ise iki doz CoronaVac sonrasında iki doz BNT162b2 aşısını tercih etmiştir.
Sağlık çalışanlarının iki doz CoronaVac aşısı sonrası 4. aydaki SARS-CoV-2 IgG titreleri değerlendirildiğinde, seropozitiflik oranı %95 iken (minimum:10, maksimum: 14 739.5; medyan: 292.10), bir doz BNT162b2 hatırlatma dozu sonrası seropozitiflik oranı %100 (minimum:151.10, maksimum: 117 170.40; medyan: 17 625.3) olarak bulundu.
BNT162b2 aşısı sonrası ilk 48 saatte görülen yan etkiler değerlendirildiğinde; tek dozda 148 (%34.6) sağlık çalışanında, iki dozda ise 21 (%38.2) sağlık çalışanında herhangi bir yan etki saptanmadı.
BNT162b2 aşısı sonrası ilk 48 saatte görülen yan etkiler değerlendirildiğinde; 104 (%39.7)’ü erkek, 176 (%60.3)’sı kadın olmak üzere toplam 280 (%65.4) katılımcıda yan etki tespit edildi (p<0.001).
Tek doz BNT162b2 aşısı sonrası yan etki görülme sıklığı ile kohort yaş dağılımı arasındaki ilişki incelendiğinde, 18-40 yaş arası yan etki oranının istatiksel açıdan daha yüksek olduğu görüldü (p<0.001).
Tek doz BNT162b2 aşısı sonrası oluşan yan etkiler cinsiyete göre karşılaştırıldığında; kadınlarda erkeklere göre daha sık olarak yan etki görüldüğü ve yorgunluk-halsizlik, ateş, üşüme-titreme gibi sistemik semptomların kadınlarda daha fazla olduğu tespit edildi (p<0.001).
Aşı sonrası en sık karşılaşılan yan etkiler, %59.6 oranıyla enjeksiyon yerinde kızarıklık, şişlik ve ağrıdır. Sistemik reaksiyonlardan ise en sık görülenlerin sırasıyla; yorgunluk-halsizlik (%58.6), kas-eklem ağrısı (%51.1), baş ağrısı (%40.7), ateş-üşüme-titreme (%27.5), mide bulantısı (%12.9) ve kusma-ishal (%3.2) olduğu belirlendi. Bunların dışında, üç (%1.1) sağlık çalışanında istenmeyen yan etki olarak aksiller lenfadenopati görüldü. Tek doz BNT162b2 aşısı sonrası yan etki görülme sıklığı ile geçirilmiş COVID-19 öyküsü arasında anlamlı düzeyde bir ilişki bulunmadı (p=0.250).
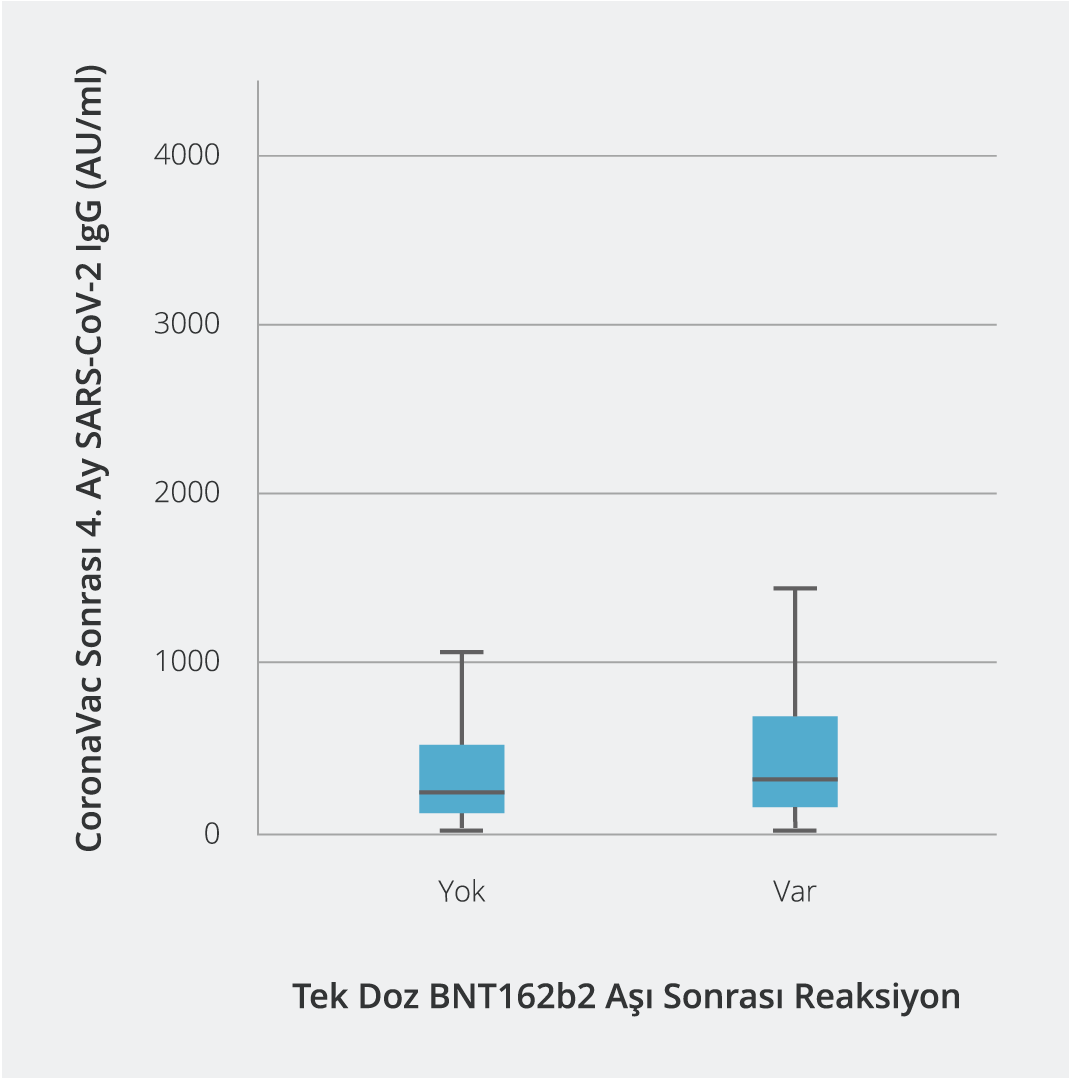
Tek doz BNT162b2 aşısı sonrası yan etki görülme sıklığı ile CoronaVac aşısı sonrası 4. aydaki SARS-CoV-2 IgG titreleri karşılaştırıldığında, yan etki görülenlerin medyan değerinin daha yüksek olduğu tespit edildi (minimum:10, maksimum: 8830.2; medyan: 255.1) (p<0.001) (Şekil 1). Tek doz BNT162b2 aşısı sonrası yan etki görülme sıklığı ile BNT162b2 aşısı sonrası 3. haftadaki SARS-CoV-2 IgG titreleri karşılaştırıldığında, yan etki görülenlerin medyan değerinin bu grupta da yan etki görülmeyenlere oranla daha yüksek olduğu saptandı (minimum: 151.1, maksimum: 117 170.4; medyan: 19 466.3) (p<0.001). BNT162b2 aşısı sonrası 3. haftadaki SARS-CoV-2 IgG titreleri dört gruba ayrılarak incelendiğinde, yan etki görülen sağlık çalışanlarının büyük çoğunluğunun 40 000 AU/ml ve üzeri değerlere sahip oldukları görüldü (p<0.001) (Tablo 1).
İki doz BNT162b2 aşısı olan 55 katılımcının 21 (%38.2)’inde ilk 48 saat içerisinde yan etki görülmedi. Yan etki görülen 34 (%61.8) katılımcının 22 (%64.7)’sinin kadın, 11 (%35.3)’inin ise erkek olduğu belirlendi.
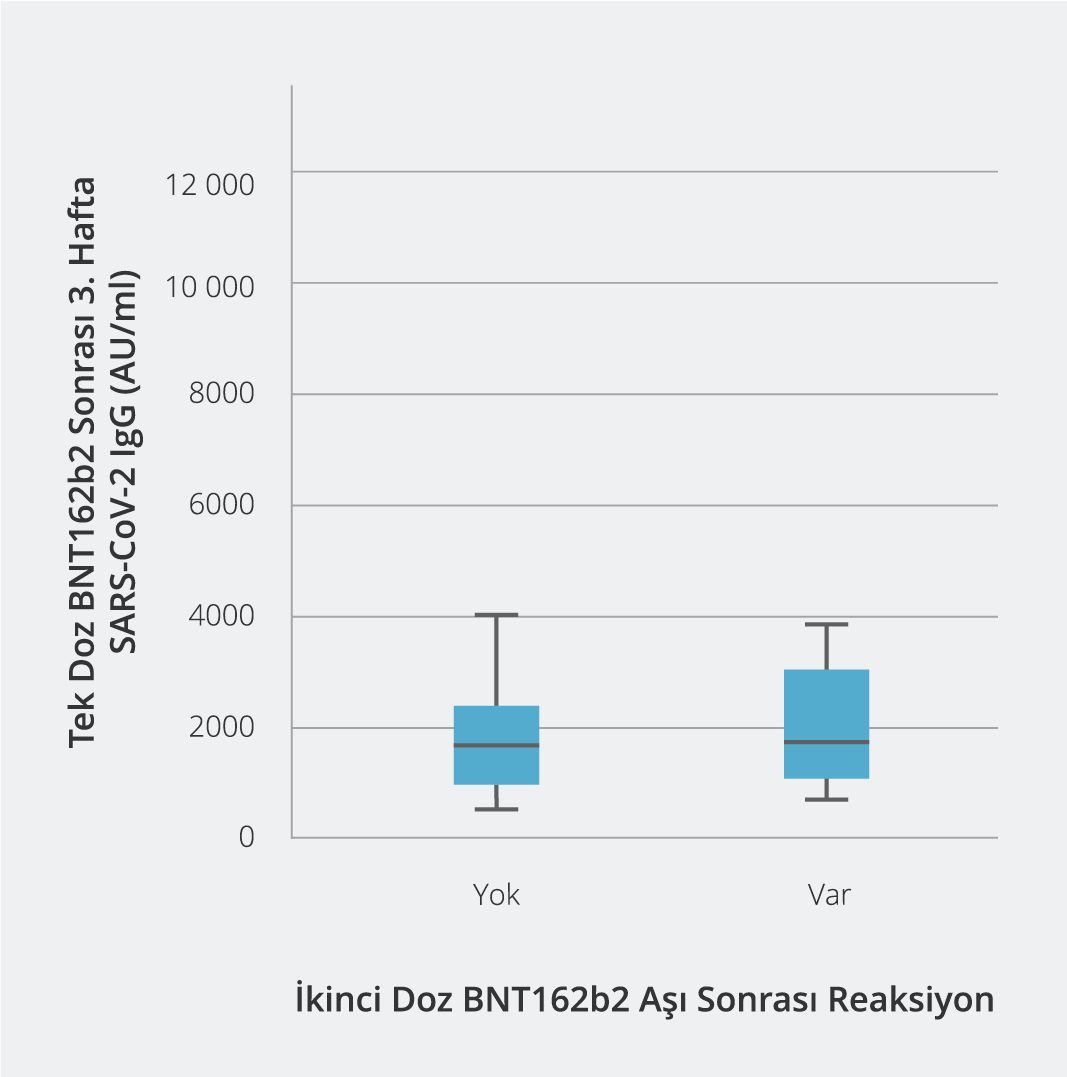
İki doz BNT162b2 aşısı sonrası yan etki görülme sıklığı, kohortun yaş dağılımına (p=0.929) ve antikor titrelerinin medyan değerlerine (p=0.585) (Şekil 2) göre karşılaştırıldığında istatistiksel olarak anlamlı düzeyde fark bulunmadı. İki doz BNT162b2 aşısı sonrası yan etki ile cinsiyet arasındaki ilişki incelendiğinde ise kadınlar ve erkeklerde yan etki görülme oranı eşit olup en sık izlenen yan etki aşı uygulanan yerde ağrıdır.
Kümülatif insidans oranı hesaplaması, 389 sağlık çalışanının verileri üzerinden gerçekleştirildi. BNT162b2 aşısı birinci hatırlatma dozu sonrasında 14. ve 30. günlerde hiç olgu görülmezken, 60 gün içinde 48. gün tek bir olgu görüldü. Semptomatik SARS-CoV-2 infeksiyonunun kümülatif insidans oranı, 100 000 kişi-günde 4.3 [%95 güven aralığı (GA); 4.26-4.31] olarak tespit edildi. BNT162b2 aşısının ikinci hatırlatma dozu sonrasında ilk 14 günde üç olgu görülmüş olup semptomatik SARS-CoV-2 infeksiyonunun insidans oranı 10 000 kişi-günde 5.5 (%95 GA; 5.43-5.65); 30 gün içinde 6 olgu görülmüş olup insidans oranı 10 000 kişi-günde 5.2 (%95 GA, 5.08-5.28) ve 60 gün içinde 9 olgu görülmüş olup insidans oranı 10 000 kişi-günde 3.9 (%95 GA, 5.43-5.65) olarak tespit edildi.
İRDELEME
Halen pek çok ülkede etkili tedavi ve profilaksi sağlayan ilaçların bulunmaması nedeniyle COVID-19 pandemisi kapsamında geliştirilen aşılar kritik öneme sahiptir. Özellikle aşıların oluşturduğu bağışık yanıtın antikor titreleri ile korelasyonunun anlaşılması, COVID-19 pandemisini daha iyi kontrol altına almada ve aşı etkisinin değerlendirilmesinde yol gösterici olmaktadır (7). Ancak, aşı sonrası SARS-CoV-2’ye özgül antikor aracılı humoral yanıtın koruyuculuğunun ne kadar süreceği ve varyantlara karşı değişkenliği gibi sorulara halen yanıt bulunamamıştır. Heterolog aşılama, ilk olarak vektör bazlı ChAdOx1 (Oxford-AstraZeneca) aşısına karşı gelişen trombositopenili tromboz sendromu sonrası gündeme gelmiş olup adenoviral vektör aşılama ile aşı reaksiyonunun daha da tetiklenebileceği, bu nedenle de hatırlatma dozu olarak farklı tür aşılama ile yan etki riskinin azaltılabileceği düşünülmüştür (8). Çeşitli aşı eşleştirmeleri sonrasında oluşan bağışıklık yanıtının artmasıyla daha yüksek antikor titrelerinin ve güçlü T-hücre cevabının oluştuğu gösterilmiştir (9, 10).
Ülkemizde sağlık çalışanlarında başlatılan aşılama programı inaktif bir aşı olan CoronaVac ile devam ederken, yeni varyantlara karşı etkinlik ve korumada görülen eksiklik nedeniyle T.C. Sağlık Bakanlığı tarafından BNT162b2 aşısı hatırlatma dozu seçeneği olarak sunulmuştur. Daha önce yaptığımız bir çalışmada, 18-59 yaş arasındaki sağlık çalışanlarında iki doz CoronaVac sonrası üçüncü hafta seropozitiflik oranı %99.6 (minimum10.1, maksimum: 66 923.7; medyan: 1022.4 AU/ml) olarak bulunmuştur (11). Bu çalışmada ise sağlık çalışanlarının iki doz CoronaVac aşısı sonrası 4. aydaki seropozitiflik oranı %95 (minimum: 10, maksimum: 14 739.5; medyan: 292.10 AU/ml) olarak saptandı. Aşı sonrası 3. hafta ile 4. ayda saptanan SARS-CoV-2 IgG titrelerinin medyan değerleri karşılaştırıldığında antikor titrelerinde oldukça ciddi bir düşüş olduğu gözlendi. Sağlık çalışanlarında iki doz CoronaVac sonrası antikor titrelerinin değerlendirildiği başka bir çalışmada ise birinci ayda seropozitiflik oranı %98.9 (medyan: 473.6 AU/ml) iken dördüncü ayda seropozitiflik oranı %89.1 (medyan: 166.5 AU/ml) olarak bulunmuştur (12).
Ülkemizde ve CoronaVac ile aşılama yapılan diğer ülkelerde gerçekleştirilen çalışmalarda, iki doz CoronaVac aşısı sonrasındaki takiplerde aynı dönemlerde antikor titrelerinde görülen azalma ve olgu sayılarındaki hızlı artış hatırlatma dozu gerekliliği üzerine dikkatleri çekmiştir (13-15). SARS-CoV-2 varyantlarına karşı tam olarak koruyucu antikor titresinin ne kadar olduğu bilinmese de nötralize antikor titresindeki azalmanın aşı bağışıklık yanıtında da azalmaya neden olduğu gösterilmiştir (16, 17). Dünya Sağlık Örgütü (DSÖ) tarafından endişe edici varyantlar (“variants of concern – VOCs”) olarak tanımlanan beş varyant içinde yer alan delta (B.1.617.2) ve omicron (B.1.526) suşlarına karşı özellikle inaktif aşıların kişilerde oluşturduğu seropozitifliğe rağmen nötralize etme kapasitesinde azalma olduğu çalışmalarla saptanmıştır (18, 19). Çalışmamızda, iki doz inaktif aşı ile aşılanmış sağlık çalışanlarında BNT162b2 aşısı hatırlatma dozu sonrasında önemli ölçüde yüksek IgG titrelerinin elde edildiği belirlendi. İki doz inaktif aşı sonrası hatırlatma dozu olarak BNT162b2 aşısının daha yüksek oranda antikor titrelerinde artışa neden olduğu farklı çalışmalarda da gösterilmiştir (10, 17). Can ve arkadaşlarının (20) çalışmalarında, hatırlatma dozu olarak BNT162b2 aşısı sonrası antikor titrelerinde 3.38 kat artış olduğu, IFN-gamma, IL-2 seviyelerinde ve CD8+ T hücre yanıtında da artış görüldüğünü bildirilmiştir. İnaktif aşılar daha düşük titrede antikor yanıtına neden olmakla birlikte yüksek bir IgG2a/IgG1 oranını indüklediği, mRNA temelli aşıların ise Th1 tipi T hücre yanıtını yüksek oranda artırdığı gösterilmiştir (21). İnaktif aşı sonrası hatırlatma dozu olarak BNT162b2 aşısı uygulanmasının, homolog aşılamaya kıyasla “spike-specific” CD4+ ve CD8+ T hücre yanıtlarını artırdığı, yüksek titrede nötralizan antikor oluşturduğu ve IFN-gamma salgılayan T hücre yanıtını da artırdığı tespit edilmiştir (22, 23).
Tüm aşı gruplarının faz 3 çalışmalarını içeren bir meta analiz çalışmasına göre; aşılanmış ve aşılanmamış bireyler arasında yan etki görülme riski 1.7 kat; CoronaVac aşısı için 0.89 kat; mRNA aşılarından Moderna COVID-19 aşısı (mRNA1273) için 1.83 kat ve BNT162b2 aşısı içinse çok daha yüksek olarak 4.1 kat fazla olduğu bildirilmiştir (24). Çalışmamızla benzer şekilde FDA raporunda BNT162b2 aşısının yan etki sıklığının hem lokal (%88.7) hem de sistemik yan etkiler (%82.8) bakımından 18-55 yaş aralığında daha sık olduğu bildirilmiştir (25). Çalışmamızda, katılımcıların 280 (%65.4)’inde tek doz BNT162b2 uygulanmasından sonra en az bir yan etki görüldü; yan etki görülen 176 (%60.3) kadın sağlık çalışanında %64.2 oranında yorgunluk-halsizlik ve %31.8 oranında ateş-üşüme-titreme gibi sistemik yan etkilerin erkeklere göre daha yaygın şekilde görüldüğü belirlendi (p<0.001).
Menni ve arkadaşları (5) çalışmalarında, sağlık çalışanları arasında BNT162b2 aşısının ilk dozunu takiben en az bir yan etki görülme sıklığını %71.9 oranıyla daha yüksek bulmuştur. Aynı çalışmada, çalışmamıza benzer şekilde kadınlarda daha yaygın olarak yan etki görüldüğü bildirilmiştir. Çalışmamızda, BNT162b2 aşısının faz 3 çalışmalarında raporlanan yan etkilere kıyasla yan etki sıklığı daha az bulundu ve lokal yan etkilerin sistemik yan etkilere göre daha fazla oranda olduğu görüldü (4). Kohort olarak gerçekleştirilen çalışmamızda, sağlık çalışanlarında tek doz BNT162b2 aşısı uygulanmasından sonra %59.6 oranıyla enjeksiyon yerinde kızarıklık, şişlik ve ağrı en sık görülen yan etkiydi. Yapılan çeşitli çalışmalarda ve BNT162b2 aşısının faz 3 çalışmasında, enjeksiyon yerinde ağrı çalışmamızla benzer şekilde en sık yan etki olarak saptanmıştır (4, 26, 27).
Çalışmamızda, %58.6 oranıyla yorgunluk-halsizlik en sık görülen sistemik reaksiyon oldu. Sık görülen yan etkiler açısından bunu %51.1 oranıyla kas-eklem ağrısı, %40.7 oranıyla baş ağrısı ve %27.5 oranıyla ateş-üşüme-titreme izledi. Katılımcıların18-55 yaş aralığında olduğu bir başka çalışmada, sistemik reaksiyonlardan yorgunluk-halsizlik benzer şekilde en sık görülen yan etki olup baş ağrısı, ikinci günden itibaren >38°C ateş, titreme, kas ağrısı ve eklem ağrısı da sık yan etkiler olarak rapor edilmiştir (27). Çeşitli kohort araştırmalarında, tek doz BNT162b2 aşısı sonrasında sistemik yan etkilerin sıklığı diğer mRNA aşılarına kıyasla ve faz 3 çalışmasına göre daha az oranda görülmüştür (4, 5, 28). Çalışmamızda iki doz BNT162b2 aşısı uygulanmış 55 sağlık çalışanı değerlendirildiğinde, aşı uygulanan yerde ağrı en sık izlenen yan etki oldu.
Çalışmamızda lokal ve sistemik yan etkilerin dışında üç (%1.1) sağlık çalışanında aksiller lenfadenopati saptandı. Faz 3 çalışmasında BNT162b2 aşısı sonrasında %0.3 popülasyonda bölgesel lenfadenopati geliştiği bildirilmiştir (4). Özellikle aşı sonrası 2-4 gün içerisinde görülen aksiller ve servikal lenfadenopatiler, çeşitli çalışmalarda BNT162b2 aşısı sonrası bildirilen %16 oranında ortak ve %44.1 oranında yaygın istenmeyen etki olarak tanımlanmıştır (28, 29).
Çalışmamızda sağlık çalışanlarında tek doz BNT162b2 aşısı sonrası yan etki görülme sıklığı ve geçirilmiş COVID-19 öyküsü arasında anlamlı düzeyde bir ilişki bulunmadı (p=0.250). Benzer şekilde bir üniversite hastanesinde görev yapan 3659 sağlık çalışanının dahil edildiği bir çalışmada geçirilmiş COVID-19 öyküsünün yan etki riskini artırmadığı gösterilmiştir (30). Randomize yapılan klinik çalışmalarda geçirilmiş COVID-19 öyküsü ile aşı sonrası görülen yan etki arasında kesin bir ilişki gösterilmemiş olmak birlikte çeşitli kohort çalışmalarında COVID-19 öyküsü ile aşı sonrası görülen yan etki arasında anlamlı düzeyde ilişki bulunmuştur (31-33).
Çalışmamızın katılımcılarında, tek doz BNT162b2 aşısı sonrası yan etki görülme sıklığı ile CoronaVac aşısı sonrası 4. aydaki SARS-CoV-2 IgG titreleri ve BNT162b2 aşısı sonrası 3. haftadaki SARS-CoV-2 IgG titreleri karşılaştırıldığında yan etki görülenlerin medyan değerinin yan etki görülmeyenlere göre daha yüksek ve ≥ 40.000 AU/ml olduğu görüldü (p<0.001). Coggins ve arkadaşlarının (34) çalışmalarında, BNT162b2 aşısının yan etkileri ile antikor titreleri arasında anlamlı düzeyde bir ilişki olmadığı bildirilmiştir.
Çalışmamızda, iki doz CoronaVac aşısı sonrası hatırlatma dozu olarak uygulanan BNT162b2 aşılamasında, gerek birinci gerekse ikinci dozda görülen yan etkiler hafif-orta derecede olup tolere edilebilir düzeyde olarak değerlendirildi. Birinci hatırlatma dozunda %65.4 oranıyla yan etkilerin görülme sıklığı %61.8 oranında olan ikinci hatırlatma dozuna göre daha sıktı. BNT162b2 heterolog aşılama sonrasında yan etkilerin özellikle 18-40 yaş aralığında, kadınlarda ve öncesinde daha yüksek titrede antikora sahip kişilerde anlamlı olarak daha sık görüldüğü saptandı.
Sonuç olarak, özellikle yüksek riskli ortamda bulunan sağlık çalışanları ve yaşlı popülasyonda hatırlatma dozu olarak mRNA aşıları yüksek koruyucu etkisi nedeniyle tercih edilebilir.
Hasta Onamı
Tüm katılımcılar bilgilendirilmiş onam formu doldurduktan sonra çalışmaya katılmıştır.
Etik Kurul Kararı
Çalışmaya, T.C. Sağlık Bakanlığı Sağlık Hizmetleri Genel Müdürlüğü Bilimsel Çalışma Platformu’na yapılan 2022-01-04T11_20_02 başvuru numarasıyla 07 Ocak 2022 tarihinde ve Sanko Üniversitesi Tıp Fakültesi Klinik Araştırmalar Etik Kurulu tarafından Şubat 2021’de 2021/02/01 karar numarasıyla onay verilmiştir.
Danışman Değerlendirmesi
Bağımsız dış danışman.
Yazar Katkıları
Fikir/Kavram – İ.K., A.B.; Tasarım – H.D., A.B., İ.B.; Denetleme – H.D., İ.K.; Kaynak ve Fon Sağlama – H.D., A.B.; Malzemeler/Hastalar – A.B., H.D.; Veri Toplama ve/veya İşleme – İ.K., İB; Analiz ve/veya Yorum – H.D., İ.K., A.B.; Literatür Taraması – İ.K., H.D.; Makale Yazımı –H.D., İ.K., A.B., İ.B.; Eleştirel İnceleme – H.D.
Çıkar Çatışması
Yazarlar herhangi bir çıkar çatışması bildirmemiştir.
Finansal Destek
Yazarlar finansal destek beyan etmemiştir.
Referanslar
- COVID-19 vaccine tracker and landscape [İnternet]. Geneva: World Health Organization (WHO). [güncelleme 11 Kasım 2022; erişim 4 Nisan 2022]. https://www.who.int/publications/m/item/draft-landscape-of-covid-19-candidate-vaccines
- FDA takes key action in fight against COVID-19 by issuing emergency use authorization for first COVID-19 vaccine [İnternet]. New Hamphire: U.S, Food and Drug Administration (FDA). [erişim 28 Mart 2022]. https://www.fda.gov/news-events/press-announcements/fda-takes-key-action-fight-against-covid-19-issuing-emergency-use-authorization-first-covid-19
- Pfızer-BioNtech COVID-19 Vaccine (BNT162, PF-07302048) Vaccines and Related Biological Products Advisory Committee Briefing Document [İnternet]. New Hamphire: U.S, Food and Drug Administration (FDA). [erişim 28 Mart 2022]. https://www.fda.gov/media/144246/download
- Polack FP, Thomas SJ, Kitchin N,et al; C4591001 Clinical Trial Group. Safety and efficacy of the BNT162b2 mRNA COVID-19 vaccine. N Engl J Med. 2020;383(27):2603-15. [CrossRef]
- Menni C, Klaser K, May A, et al. Vaccine side-effects and SARS-CoV-2 infection after vaccination in users of the COVID Symptom Study app in the UK: a prospective observational study. Lancet Infect Dis. 2021;21(7):939-49. [CrossRef]
- Barda N, Dagan N, Ben-Shlomo Y, et al. Safety of the BNT162b2 mRNA COVID-19 vaccine in a nationwide setting. N Engl J Med. 2021;385(12):1078-90. [CrossRef]
- Earle KA, Ambrosino DM, Fiore-Gartland A, et al. Evidence for antibody as a protective correlate for COVID-19 vaccines. Vaccine. 2021;39(32):4423-8. [CrossRef]
- Overview of EU/EEA country recommendations on COVID-19 vaccination with Vaxzevria, and a scoping review of evidence to guide decision-making [İnternet]. Stockholm: European Centre for Disease Prevention and Control (ECDC). [erişim 4 Nisan 2022]. https://www.ecdc.europa.eu/en/publications-data/overview-eueea-country-recommendations-covid-19-vaccination-vaxzevria-and-scoping
- Shaw RH, Stuart A, Greenland M, Liu X, Nguyen Van-Tam JS, Snape MD; Com-COV Study Group. Heterologous prime-boost COVID-19 vaccination: initial reactogenicity data. Lancet. 2021;397(10289):2043-6. [CrossRef]
- Costa Clemens SA, Weckx L, Clemens R, Almeida Mendes AV, Ramos Souza A, Silveira MBV, et al; RHH-001 study team. Heterologous versus homologous COVID-19 booster vaccination in previous recipients of two doses of CoronaVac COVID-19 vaccine in Brazil (RHH-001): a phase 4, non-inferiority, single blind, randomised study. Lancet. 2022;399(10324):521-9. [CrossRef]
- Bayram A, Demirbakan H, Günel Karadeniz P, Erdoğan M, Koçer I. Quantitation of antibodies against SARS-CoV-2 spike protein after two doses of CoronaVac in healthcare workers. J Med Virol. 2021;93(9):5560-7. [CrossRef]
- Çağlayan D, Süner AF, Şiyve N, et al. An analysis of antibody response following the second dose of CoronaVac and humoral response after booster dose with BNT162b2 or CoronaVac among healthcare workers in Turkey. J Med Virol. 2022;94(5):2212-21. [CrossRef]
- Yigit M, Ozkaya-Parlakay A, Cosgun Y, Ince YE, Bulut YE, Senel E. Should a third booster dose be scheduled after two doses of CoronaVac? A single-center experience. J Med Virol. 2022;94(1):287-90. [CrossRef]
- Bayhan GI, Guner R. Effectiveness of CoronaVac in preventing COVID-19 in healthcare workers. Hum Vaccin Immunother. 2022;18(1):2020017. [CrossRef]
- Fonseca MHG, de Souza TFG, de Carvalho Araújo FM, de Andrade LOM. Dynamics of antibody response to CoronaVac vaccine. J Med Virol. 2022;94(5):2139-48. [CrossRef]
- Duarte LF, Gálvez NMS, Iturriaga C, et al. Immune profile and clinical outcome of breakthrough cases after vaccination with an inactivated SARS-CoV-2 vaccine. Front Immunol. 2021;12:742914. [CrossRef]
- Barin B, Kasap U, Selçuk F, Volkan E, Uluçkan Ö. Comparison of SARS-CoV-2 anti-spike receptor binding domain IgG antibody responses after CoronaVac, BNT162b2, ChAdOx1 COVID-19 vaccines, and a single booster dose: a prospective, longitudinal population-based study. Lancet Microbe. 2022;3(4):e274-83. [CrossRef]
- Vacharathit V, Aiewsakun P, Manopwisedjaroen S, et al. CoronaVac induces lower neutralising activity against variants of concern than natural infection. Lancet Infect Dis. 2021;21(10):1352-4. [CrossRef]
- Cao Y, Yisimayi A, Bai Y, et al. Humoral immune response to circulating SARS-CoV-2 variants elicited by inactivated and RBD-subunit vaccines. Cell Res. 2021;31(7):732-41. [CrossRef]
- Kuloğlu ZE, El R, Guney-Esken G, et al. Effect of BTN162b2 and CoronaVac boosters on humoral and cellular immunity of individuals previously fully vaccinated with CoronaVac against SARS-CoV-2: A longitudinal study. Allergy. 2022;77(8):2459-67. [CrossRef]
- Zhang J, He Q, An C, et al. Boosting with heterologous vaccines effectively improves protective immune responses of the inactivated SARS-CoV-2 vaccine. Emerg Microbes Infect. 2021;10(1):1598-08. [CrossRef]
- Barros-Martins J, Hammerschmidt SI, Cossmann A, et al. Immune responses against SARS-CoV-2 variants after heterologous and homologous ChAdOx1 nCoV-19/BNT162b2 vaccination. Nat Med. 2021;27(9):1525-9. [CrossRef]
- Kanokudom S, Assawakosri S, Suntronwong N, et al. Safety and immunogenicity of the third booster dose with inactivated, viral vector, and mRNA COVID-19 vaccines in fully immunized healthy adults with inactivated vaccine. Vaccines (Basel). 2022;10(1):86. [CrossRef]
- McDonald I, Murray SM, Reynolds CJ, Altmann DM, Boyton RJ. Comparative systematic review and meta-analysis of reactogenicity, immunogenicity and efficacy of vaccines against SARS-CoV-2. NPJ Vaccines. 2021;6(1):74. [CrossRef]
- Pfizer-BioNTech COVID-19 vaccine reactions & adverse events [İnternet]. Atlanta: Centers for Disease Control and Prevention (CDC). [erişim 28 Mart 2022]. https://www.cdc.gov/vaccines/covid-19/info-by-product/pfizer/reactogenicity.html
- Kadali RAK, Janagama R, Peruru S, Malayala SV. Side effects of BNT162b2 mRNA COVID-19 vaccine: A randomized, cross-sectional study with detailed self-reported symptoms from healthcare workers. Int J Infect Dis. 2021;106:376-81. [CrossRef]
- Walsh EE, Frenck RW Jr, Falsey AR, et al. Safety and immunogenicity of two RNA-based COVID-19 vaccine candidates. N Engl J Med. 2020;383(25):2439-50. [CrossRef]
- Riad A, Pokorná A, Attia S, Klugarová J, Koščík M, Klugar M. Prevalence of COVID-19 vaccine side effects among healthcare workers in the Czech Republic. J Clin Med. 2021;10(7):1428. [CrossRef]
- Keshavarz P, Yazdanpanah F, Rafiee F, Mizandari M. Lymphadenopathy following COVID-19 vaccination: imaging findings review. Acad Radiol. 2021;28(8):1058-71. [CrossRef]
- Borroni E, Consonni D, Cugno M, et al. Side effects among healthcare workers from a large Milan university hospital after second dose of BNT162b2 mRNA COVID-19 vaccine. Med Lav. 2021;112(6):477-85. [CrossRef]
- Tissot N, Brunel AS, Bozon F, Rosolen B, Chirouze C, Bouiller K. Patients with history of covid-19 had more side effects after the first dose of covid-19 vaccine. Vaccine. 2021;39(36):5087-90. [CrossRef]
- Beatty AL, Peyser ND, et al. Analysis of COVID-19 vaccine type and adverse effects following vaccination. JAMA Netw Open. 2021;4(12):e2140364. [CrossRef]
- Parés-Badell O, Martínez-Gómez X, Pinós L, et al. Local and systemic adverse reactions to mRNA COVID-19 vaccines comparing two vaccine types and occurrence of previous COVID-19 infection. Vaccines (Basel). 2021;9(12):1463. [CrossRef]
- Coggins SA, Laing ED, Olsen CH, et al. Adverse effects and antibody titers in response to the BNT162b2 mRNA COVID-19 vaccine in a prospective study of healthcare workers. Open Forum Infect Dis. 2021;9(1):ofab575. [CrossRef]