En Çok Okunanlar
Özet
Amaç: Çalışmamızda, SARS-CoV-2 virusu ile daha önce infekte olan ve olmayan sağlık çalışanlarında CoronaVac (Sinovac Life Sciences, Pekin, Çin) aşısı sonrası gelişen istenmeyen etkilerin bir anket çalışmasıyla değerlendirilmesi amaçlandı.
Yöntemler: Çalışmaya, 14-24 Ocak 2021 tarihleri arasında ilk doz inaktif CoronaVac aşısı uygulanan 18-65 yaş arası gönüllü sağlık çalışanları dâhil edildi. Katılımcılara ait demografik bilgiler; uygulanan anket ve gelişen yan etkiler nedeniyle aşı polikliniğine yapılan başvuru verilerinden elde edildi.
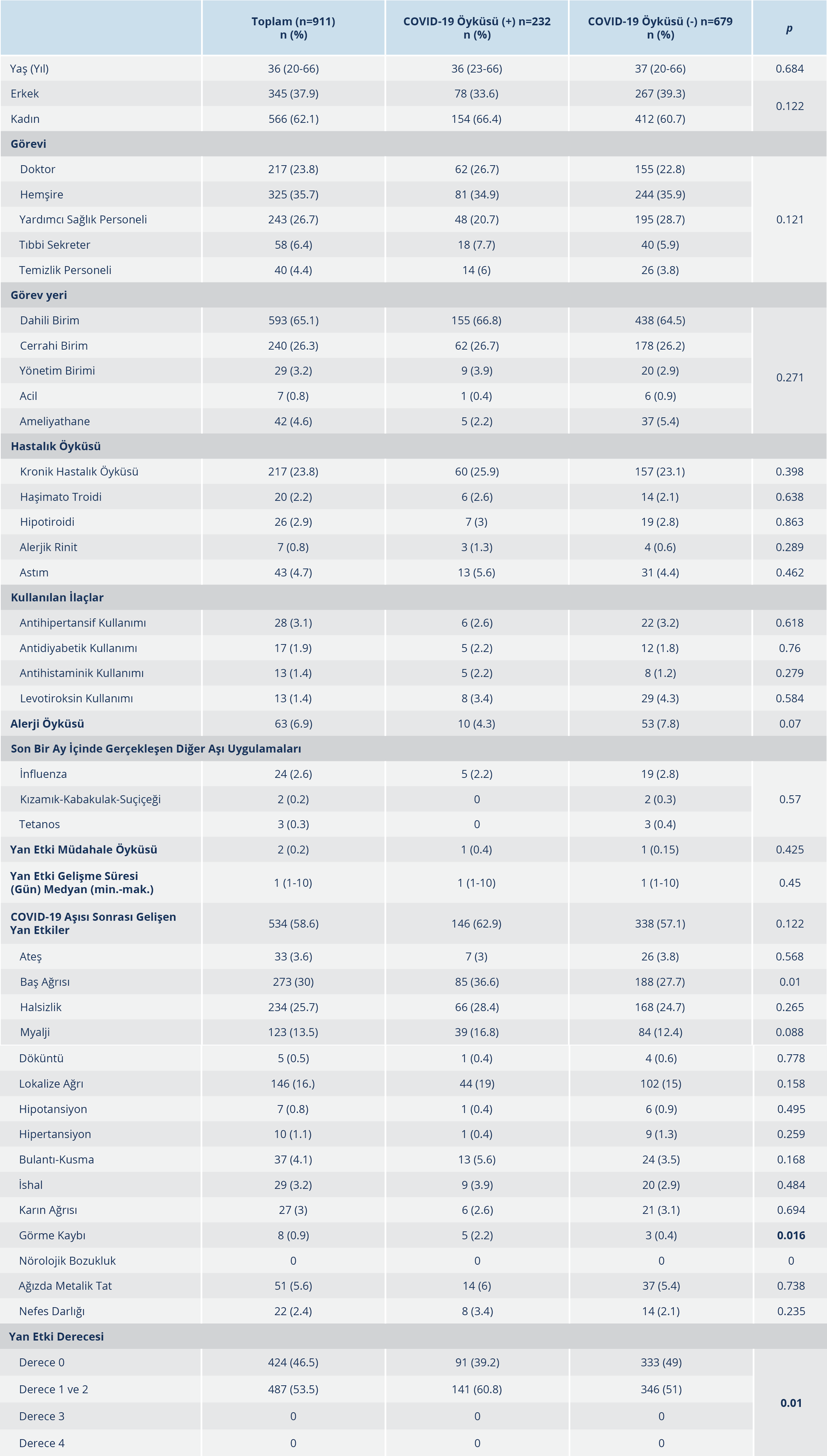
Bulgular: Çalışmaya dahil edilen 911 sağlık çalışanının 232’sinde COVID-19 geçirme öyküsü mevcuttu. COVID-19 öyküsü olanların yaş ortalaması 36 (20-66) olup %33.6’sı erkekti. Katılımcıların %26.7’si doktor, %34.9’u hemşire ve %20.7’si yardımcı personeldi; 155 (%66.8)’i dâhili, 62 (%26.7)’si cerrahi birimlerde çalışmaktaydı. Gruplar arasında; yaş, cinsiyet, görev durumları ve çalıştıkları birimler arasında anlamlı bir fark bulunmadı. COVID-19 öyküsü olan grubun %25.9’unda kronik bir hastalık mevcut olup en sık görülen %5.6 oranıyla astımdı. Alerji öyküsü; COVID-19 geçiren grupta %4.3, geçirmeyen grupta ise %7.8 oranındaydı (p=0.070). COVID-19 öyküsü olanlarda aşı sonrası istenmeyen etki görülme durumu %62.9 oranıyla daha yüksekti; öyküsü olmayanlarda ise bu oran %57.1 olarak tespit edildi. En sık gelişen istenmeyen etki baş ağrısı olup COVID-19 geçiren grupta geçirmeyenlere göre anlamlı düzeyde yüksek olarak bulundu (%36.6 ve %27.7; p=0.01).
Sonuç: Çalışmamızda, COVID-19 geçirme öyküsü olan bireylerde aşı sonrası istenmeyen etki oranlarının yüksek olduğu görüldü. Bu durumun daha çok gelişen antikor yanıt oranları ile ilişkili olabileceği düşünülmekle birlikte; olgu sayısının yetersiz olması, infeksiyon ve aşı sonrası oluşan antikor yanıtının da bilinmemesi çalışmanın kısıtlılıkları olarak bu sonucu çıkarmayı mümkün kılmamaktadır.
GİRİŞ
SARS-CoV-2 virusuna maruziyet, asemptomatik infeksiyondan şiddetli akut solunum sıkıntısı ve ölüme kadar değişen bir dizi klinik bulgu ile sonuçlanabilir (1,2). Bu infeksiyonu önlemeye yönelik gerçekleştirilen aşılama uygulamaları, pandemiyi kontrol altına almak için en umut verici yaklaşım olarak kabul edilmektedir. SARS-CoV-2’nin neden olduğu COVID-19 hastalığına karşı pek çok aşı geliştirme çalışması yürütülmüş olup aşı adaylarının çoğunda SARS-CoV-2’nin “spike” (S) proteini kullanılmıştır (3). Dünyanın farklı bölgelerinde 2020 yılı sonunda birkaç aşı kullanıma hazır hale gelmiştir; 40’ın üzerinde aday aşının ise preklinik denemeleri halen devam etmektedir. Söz konusu aşıların etkinliğini, güvenliğini test etmek ve geliştirmek için acil eylem planları hazırlanmış; klinik geliştirme süreçleri tamamlanmadan acil kullanım onayları verilmiştir. SARS-CoV-2 ile mücadele edecek bir aşının; bir veya iki aşı uygulaması sonrası etkili olması, bağışıklığı zayıflamış bireyler dahil olmak üzere yaşlı bireyler ve komorbiditesi olanlar gibi hedef popülasyonları koruması ve en az 6 ay koruma sağlayarak virusun kişilere bulaşmasını azaltması beklenmektedir (4,5).
Yapılan epidemiyolojik çalışmalarda, nötralize edici antikorların infeksiyondan korunma ile ilişkili olduğu öne sürülmüştür. Bu nedenle, yeterli nötralize edici yanıt ortaya çıkaran aşılar, COVID-19’a karşı koruma sunabilmektedir. COVID-19 aşıları farklı yaklaşımlarla geliştirilmektedir. Bunların bazıları inaktif veya canlı-atenüe aşılar olup diğerleri rekombinant proteinler ve vektörler gibi daha yeni platformlarla geliştirilen aşılardır. İnaktif aşılar; hücre kültüründe SARS-CoV-2 üretilmesinin ardından virusun kimyasal olarak inaktive edilmesiyle geliştirilir. Etkisi zayıflatılmış olan virus, bağışıklık yanıtı oluşturmak için genellikle aşı içinde başka bir yardımcı madde ile birleştirilir. İnaktive aşılar tipik olarak kas içine uygulanır. SARS-CoV-2 ile etkisiz hale getirilmiş bir aşıya bağışıklık yanıtı sadece S proteinini değil aynı zamanda virusun diğer bileşenlerini de hedefleyebilir (5-7). Aşı uygulama bölgesi, immün yanıtı etkileyebilir. Aşıların çoğu kas içinden (veya deri içinden) uygulanır ve esas olarak sistemik bir bağışıklık yanıtı ortaya çıkarır (3). Doğal solunum yolu infeksiyonları ise hem mukozal hem de sistemik bağışıklık yanıtı ortaya çıkarır. Bu nedenle aşının oluşturduğu yanıt daha az olmaktadır. Aşı uygulamaları sonrası enjeksiyon yerinde ağrı, ateş, yorgunluk ve baş ağrısı gibi lokal ve sistemik reaksiyonlar gelişebilmektedir. Aşıya veya bileşenlerine karşı şiddetli alerjik reaksiyon veya anafilaksi öyküsü, aşılama için bir kontrendikasyondur (7,8).
Çalışmamızda, en önemli risk gruplarından biri olan sağlık çalışanlarında, daha önce SARS-CoV-2 ile infekte olan veya olmayan gruplarda uygulanan birinci doz CoronaVac (Sinovac Life Sciences, Pekin, Çin) aşısı sonrası gelişen istenmeyen etkilerin değerlendirilmesi amaçlandı.
YÖNTEMLER
Retrospektif olarak yürütülen çalışmaya, 14-24 Ocak 2021 tarihleri arasında birinci doz olarak inaktif CoronaVac aşısı (Sinovac Life Sciences, Pekin, Çin) uygulanan 18-65 yaş arası gönüllü 911 sağlık çalışanı dâhil edildi. Katılımcılara ait demografik bilgiler; düzenlenen anket aracılığıyla ve gelişen yan etkiler nedeniyle aşı polikliniğine yapılan başvuruların kayıtlarından elde edildi. Söz konusu demografik veriler; yaş, cinsiyet, görev ve çalıştığı birim, kronik hastalık varlığı, bilinen alerji öyküsü, kullanılan ilaçlar, son bir ay içerisinde yapılan COVID-19 dışı aşı öyküsü, COVID-19 geçirme öyküsü, ayaktan veya yatarak tedavi alma durumu, yoğun bakım yatış öyküsü, aşı sonrası gelişen istenmeyen etkiler, istenmeyen etki süresi, müdahale gerekip gerekmediği gibi bilgilerden oluşmaktaydı (9,10). Hastalarda gelişen istenmeyen etkiler, Amerikan Gıda ve İlaç Dairesi (U.S. Food and Drug Administration – FDA) tarafından yayınlanmış olan Toksisite Derecelendirme Ölçeği Kılavuzuna uygun olarak değerlendirildi. Bu derecelendirme ölçeğine dayalı olarak; herhangi bir istenmeyen etki yok “derece 0”, hafif istenmeyen etki “derece 1”, orta dereceli istenmeyen etki, “derece 2”, şiddetli istenmeyen etki “derece 3”, şiddetli istenmeyen etki ve potansiyel olarak hayatı tehdit eden olaylar “derece 4” olarak tanımlandı (11). Ciddi istenmeyen etki; vücut sıcaklığı ≥ 39.5 °C olması, herhangi bir anafilaksi veya aşırı duyarlılık reaksiyonu (30 dakika içinde gelişen kızarıklık veya ürtiker) ve sağlık durumunda bozulma olarak tanımlandı. Diğer etkiler ise; aşılama sonrası lokal ağrı, kızarıklık veya şişlik, ateş, miyalji, halsizlik, gastrointestinal semptomlar (ishal, karın ağrısı, bulantı, kusma) ve kardiyovasküler semptomlar (çarpıntı, hipotansiyon veya hipertansiyon), nörolojik bulgular (vücutta uyuşma, baş ağrısı, baş dönmesi) ve ağızda metalik tat olarak tanımlandı.
Aşı sonrası istenmeyen etkiler; COVID-19 geçiren ve geçirmeyen grupların yanı sıra COVID-19 hastalığı için yatış gereken ve gerekmeyen gruplar arasında değerlendirildi.
Çalışma için, Erciyes Üniversitesi Girişimsel Olmayan Klinik Araştırmalar Etik Kurulu’ndan 24 Mart 2021 tarih ve 2021/225 karar numarasıyla onay alındı.
İstatistiksel Analiz
Verilerin analizi, SPSS (Statistical Package for the Social Sciences) versiyon 22.0 programı (IBM Corp., Armonk, NY, ABD) ile yapıldı. Değerlendirmede; yüzde, ortalama, minimum, maksimum değer gibi tanımlayıcı istatistiksel metotlar kullanıldı. Kategorik değişkenler için χ2 veya Fischer kesin testi, iki grup arasındaki farklılıkları karşılaştırmak için de Mann-Whitney U testi kullanıldı. Anlamlılık düzeyi tüm testler için p<0.05 olarak belirlendi.
BULGULAR
Çalışmaya, CoronaVac aşısı (Sinovac Life Sciences, Pekin, Çin) uygulanan 911 gönüllü sağlık çalışanı dâhil edildi. COVID-19 geçirme öyküsü olan katılımcı sayısı 232 (%25.5) olup 679 (%74.5) kişinin COVID-19 öyküsü yoktu. Söz konusu 232 kişinin 22’sinin COVID-19 nedeniyle yatarak tedavi aldığı öğrenildi. COVID-19 geçiren ve geçirmeyen katılımcı gruplarının epidemiyolojik özellikleri ve gelişen istenmeyen etkiler Tablo 1’de verildi.
SARS-CoV-2 ile infekte sağlık çalışanlarının yaş ortalaması 36 (20-66) iken %33.6’sını erkek cinsiyet oluşturuyordu. Görev dağılımlarına bakıldığında; %34.9’u hemşire, %26.7’si doktor ve %20.7’si yardımcı sağlık personeliydi. COVID-19 geçiren çalışanların, 155 (%66.8)’inin dahili birimlerde, 62 (%26.7)’sinin cerrahi birimlerde geri kalanın ise acil, ameliyathane ve yönetim birimlerinde görev aldığı belirlendi. COVID-19 geçirme öyküsü bulunmayan çalışanların ise 438 (%64.5)’inin dahili, 178 (%26.2)’inin ise cerrahi birimlerde çalıştığı tespit edildi. Her iki grupta da yaş, cinsiyet, görev yetkisi ve çalışma birimleri arasında anlamlı düzeyde bir fark bulunmadı. Katılımcıların yaklaşık 217 (%23.8)’sinde en az bir kronik hastalık mevcuttu; COVID-19 öyküsü olan grupta bu oran %25.9 diğer grupta ise %23.1 idi. Her iki grupta da en sık görülen kronik alt hastalık %5.6 oranıyla astımdı. Alerji öyküsü olanların oranı COVID-19 geçirenlerde %4.3, geçirmeyenlerde %7.8 idi. Gruplar arası anlamlı düzeyde bir istatistiksel fark bulunmadı. Son bir ay içinde yapılan inaktif veya canlı-atenüe aşı uygulamaları açısından bakıldığında; COVID-19 geçiren grupta yalnızca %2.2 oranında influenza aşı öyküsü mevcut iken COVID-19 geçirmeyen grupta %2.8 oranında influenza aşısı, %0.3 oranında kızamık-kabakulak-suçiçeği aşısı ve %0.4 oranında tetanos aşı öyküsü mevcuttu. Katılımcıların yaklaşık 487 (%53.5)’sinde “derece 1” ve “derece 2” düzeyinde istenmeyen etki görülürken; bu oran COVID-19 öyküsü olan kişilerde %60.8, geçirmeyenler de ise %51’di. İstenmeyen etki gelişme süresi her iki grupta da ortalama 1 (1-10) gündü. Her iki grupta en sık görülen etki baş ağrısıydı. COVID-19 geçiren grupta %36.6 ile daha yüksek olan baş ağrısı oranı istatistiksel olarak da anlamlı düzeydeydi (p=0.01); geçirmeyen grupta bu oran %27.7 olarak tespit edildi. Diğer sık gelişen istenmeyen etkilere bakıldığında COVID-19 öyküsü olan grupta; halsizlik (%28.4), aşı uygulama bölgesinde lokalize ağrı (%19), miyalji (%16.8) ve ağızda metalik tat hissi (%6) görüldü. COVID-19 öyküsü olmayan grupta ise halsizlik %24.7, lokalize ağrı
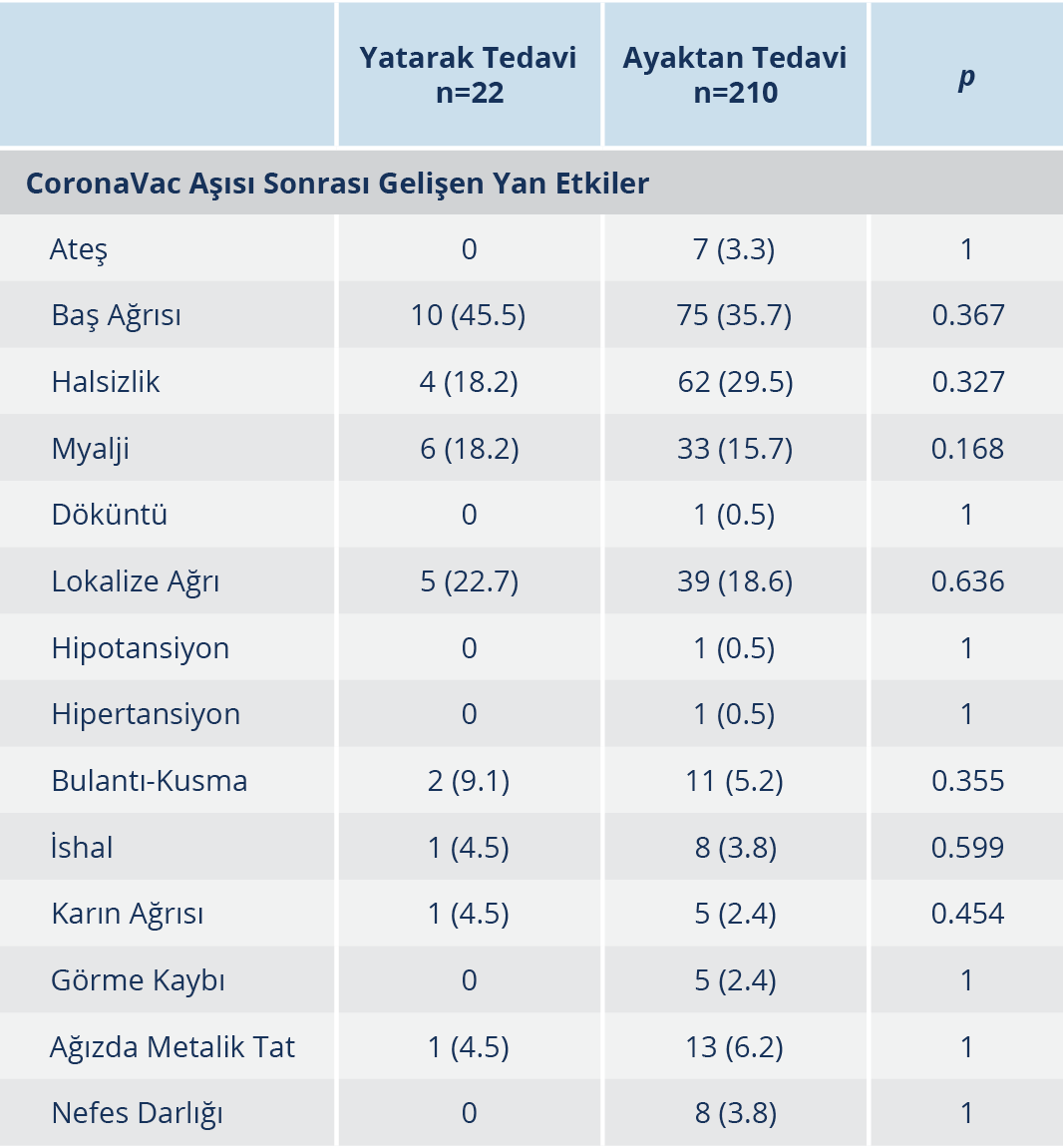
Tablo 2. COVID-19 Nedeni ile Yatarak ve Ayaktan Tedavi Alan Hastalarda Aşı Sonrası Gelişen Yan Etkiler
%15, miyalji %12.4 ve ağızda metalik tat hissi %5.4 oranlarında görüldü. COVID-19 nedeniyle yatış öyküsü olan kişilerde olmayanlara göre istenmeyen etki gelişme oranlarının daha yüksek olduğu görüldü. En sık gelişen etkiler baş ağrısı (%45.5), enjeksiyon yerinde ağrı (%22.7) ve myalji (%18.2) idi. Aradaki fark istatistiksel olarak anlamlı düzeyde bulunmadı (Tablo 2). Ayrıca katılımcılardan COVID-19 öyküsü olanların 5 (%2.2)’inde, olmayanların ise 3 (%0.4)’ünde aşı sonrası geçici görme kaybı olduğu bildirildi. COVID-19 öyküsü olanlarda daha yüksek oranda olmakla birlikte, fark istatistiksel olarak da anlamlı düzeyde bulundu. Bu kişilerin nörolojik ve göz muayene bulguları normal iken yapılan radyolojik görüntüleme yöntemlerinde de herhangi bir patolojik bulguya rastlanmadı. Aşı uygulanan katılımcıların hiçbirinde ciddi yan etki bildirilmedi. Yalnızca vücudunda döküntüler gelişen 2 kişide müdahale gerekliliği oluştu ve intravenöz antihistaminik ve steroid tedavisi sonrası klinik düzelme görüldü.
İRDELEME
Bugüne kadar, COVID-19’a karşı geliştirilen inaktif aşıların ve m-RNA aşılarının faz çalışmalarında sıklıkla hafif ve orta derecede istenmeyen etkiler bildirilirken nadir olarak da ciddi etkiler gözlenmiştir (12). Geliştirilen aşılardan biri olan CoronaVac aşısı, inaktive edilmiş COVID-19 aşısı olup alüminyum hidroksit yardımcı maddesi içermekte ve iki doz olarak kas içine uygulanmaktadır. Yapılan randomize, plasebo kontrollü faz I-II çalışmalarda 18-59 yaşları arası, 60 yaş ve üstü sağlıklı bireylerde güvenli ve immünojenik bulunmuştur. CoronaVac aşısı için klinik öncesi çalışmalar kapsamında yayınlanan veriler, yeterli IgG yanıtı ve nötralizan antikor seviyelerinin elde edildiğini göstermiştir (8). Randomize ve çift kör olarak gerçekleştirilen bir faz II aşı çalışmasında 18-59 yaş arası yaklaşık 600 katılımcı 14 ve 28 gün olmak üzere iki doz programına ayrılmış, her program dahilinde katılımcılara iki ayrı doz aşı veya plasebo uygulanmıştır. Enjeksiyon bölgesinde ağrı ve şişlik gibi lokal istenmeyen etkiler hafif-orta şiddette izlenmiştir. Randomize kontrollü bu çalışmada 14 günlük programda katılımcıların yaklaşık %20.3’ünde, 28 günlük programda ise %10.3’ünde aşı sonrası enjeksiyon bölgesinde ağrı şikâyeti olmuştur. Yan etkiler 3 gün içinde gerilerken ciddi istenmeyen etki bildirilmemiştir (1). Başka bir inaktif COVID-19 aşısı için de bu bulgulara benzer şekilde en yaygın olarak enjeksiyon bölgesinde ağrı görülmüştür. Viral vektör aşılarda, DNA veya RNA aşıları gibi diğer COVID-19 aşı adaylarıyla karşılaştırıldığında aşılamadan sonra ateş oluşumu nispeten daha düşük bulunmuştur. En yaygın istenmeyen etkiler, enjeksiyon bölgesinde ağrı ve ateş olarak bildirilmiştir. Tüm bu etkiler hafif (derece 1 veya derece 2), geçici ve kendi kendini sınırlayan nitelikte olup herhangi bir tedavi gerektirmemiştir (13,14). Çalışmamızda ise standart dozlarda 28 gün arayla uygulanması planlanan CoronaVac aşısı sonrası en sık bildirilen istenmeyen etkiler baş ağrısı (%30), halsizlik (%25.7), lokalize ağrı (%16), myalji (%13.5) ve ağızda metalik tat hissi (%5.6) oldu. Bu etkilerin görülme oranları COVID-19 geçirme öyküsü olan grupta (%62.9) COVID-19 geçirmeyen gruba oranla (%57.1) daha yüksek bulundu. En sık görülen istenmeyen etkilerden biri olan baş ağrısı, özellikle COVID-19 öyküsü olan grupta daha sık görüldü. Ayrıca her iki grup arasındaki fark da istatistiksel olarak anlamlı düzeyde bulundu (p=0.01). Ülkemizden yapılan bir çalışmada, CoronaVac aşısı sonrası görülen en yaygın sistemik istenmeyen etki yorgunluktur; aşı grubunda 546 (%8.2), plasebo grubundan ise 248 (%7) bireyde bu etki görülmüştür (p=0.0228). Ciddi bir istenmeyen etki tanımlanmamıştır. En sık görülen lokal istenmeyen etki enjeksiyon yerinde ağrı olup aşı grubunda 157 (%2.4), plasebo grubunda ise 40 (%1.1) bireyde görülmüştür (p<0.0001) (12).
Adenovirus tip-5 vektör COVID-19 aşıları ile ilgili yapılan çalışmalarda ise bildirilen en yaygın istenmeyen etkiler; hafif veya orta şiddette ateş, yorgunluk, baş ağrısı ve kas ağrısıdır. Farklı dozlar arasında istenmeyen etki insidansı açısından anlamlı bir fark bulunmamıştır. İnfeksiyonunun neden olduğu viremi ile ilişkili olabileceği düşünülen semptomların şiddetini, uygulanan yüksek dozlarda oluşan viral partikül yükü ile ilişkili gelişen şiddetli reaksiyonun belirlediği gösterilmiştir. Yaklaşık 108 gönüllünün dahil edildiği vektör aşı uygulamasında 87 (%81) kişide aşılamadan sonraki ilk 7 gün içinde en az bir istenmeyen etki bildirilmiştir. Yüksek ve düşük doz tedavi grupları arasında genel istenmeyen etki oranları açısından önemli bir fark gözlenmemiştir. En yaygın olarak %54 oranıyla enjeksiyon bölgesinde ağrı bildirilmiştir. Genel olarak en sık rapor edilen etkiler ise ateş (%46), yorgunluk (%44), baş ağrısı (%39) ve kas ağrısı (%17) olmuştur (13). Çalışmamızda ise bu etkilerin çoğu %53.5 oranıyla hafif veya orta şiddette izlenmekle birlikte çoğunlukla aşılamadan sonraki ilk 24 saat içinde meydana geldiği görüldü. Ayrıca bu etkiler COVID-19 öyküsü olan grupta daha yüksek oranda olup aradaki fark istatistiksel olarak da anlamlı düzeyde bulundu.
Sonuç olarak; COVID-19 geçirme öyküsü olan bireylerde aşı sonrası istenmeyen etki oranlarının yüksek olduğu görüldü. Bu durumun COVID-19 sonrası gelişen antikor yanıt oranları ile ilişkili olabileceği düşünülse de olgu sayılarının yetersiz olması, infeksiyon ve aşı sonrası oluşan antikor yanıtının belirlenmemiş olması çalışmanın sınırlılıklarıdır. Aşı sonrası gelişen istenmeyen etkilerde potansiyel risk faktörlerinin daha iyi anlaşılmasını sağlamak için aşı güvenliği konusunda daha fazla bağımsız veriye ihtiyaç vardır. Ayrıca, günümüzde geliştirilen aşı faz çalışmaları sonucu güvenli ve etkili aşı uygulamaları ile birlikte kitlesel aşılama deneyimlerinin COVID-19 pandemisini kontrol altına almada ne kadar etkili olduğu gösterilmiştir.
Etik Kurul Kararı
Çalışma için, Erciyes Üniversitesi Girişimsel Olmayan Klinik Araştırmalar Etik Kurulu’ndan 24 Mart 2021 tarih ve 2021/225 karar numarasıyla onay alındı.
Danışman Değerlendirmesi
Bağımsız dış danışman.
Yazar Katkıları
Fikir/Kavram – G.K.Ü., Z.T.Y., N.K., B.A., O.Y.; Tasarım – G.K.Ü., Z.T.Y., B.A., O.Y.; Denetleme – G.K.Ü., Z.T.Y., N.K., B.A., O.Y.; Kaynak ve Fon Sağlama – G.K.Ü., Z.T.Y., N.K., B.A., O.Y.; Malzemeler/Hastalar – G.K.Ü., Z.Y.T, N.K., B.A., O.Y.; Veri Toplama ve/veya İşleme – G.K.Ü., N.K., Z.T.Y., B.A., O.Y.; Analiz ve/veya Yorum – G.K.Ü., Z.T.Y., N.K., B.A., O.Y.; Literatür Taraması – G.K.Ü.; Makale Yazımı – G.K.Ü.; Eleştirel İnceleme – G.K.Ü., Z.T.Y., N.K., B.A., O.Y.
Çıkar Çatışması
Yazarlar herhangi bir çıkar çatışması bildirmemiştir.
Finansal Destek
Yazarlar finansal destek beyan etmemiştir.
Sunulduğu Bilimsel Etkinlik
26-30 Mayıs 2021 tarihleri arasında gerçekleştirilen XI. Türk Klinik Mikrobiyoloji ve İnfeksiyon Hastalıkları Kongresi’nde poster olarak sunulmuştur.
Referanslar
- Zhang Y, Zeng G, Pan H, et al. Safety, tolerability, and immunogenicity of an inactivated SARS-CoV-2 vaccine in healthy adults aged 18-59 years: a randomised, double-blind, placebo-controlled, phase 1/2 clinical trial. Lancet Infect Dis. 2021;21(2):181-92. [CrossRef]
- Coronavirus disease (COVID-19) pandemic [Internet]. Geneva: World Health organization (WHO). [erişim 5 Şubat 2022]. https://www.who.int/emergencies/diseases/novel-coronavirus-2019
- Dhama K, Patel SK, Natesan S, et al. COVID-19 in the elderly people and advances in vaccination approaches. Hum Vaccin Immunother. 2020;16(12):2938-43. [CrossRef]
- Sharma O, Sultan AA, Ding H, Tringle, CR. A review of the progress and challenges of developing a vaccine for COVID-19. Front Immunol. 2020;11:585354. [CrossRef]
- Haynes BF, Corey L, Fernandes P, et al. Prospects for a safe COVID-19 vaccine. Sci Transl Med. 2020;12(568):eabe0948. [CrossRef]
- Gao Q, Bao L, Mao H, et al. Development of an inactivated vaccine candidate for SARS-CoV-2. Science. 2020;369(6499):77-81. [CrossRef]
- Palacios R, Patiño EG, de Oliveira Piorelli R, et al. Double-blind, randomized, placebo-controlled phase III clinical trial to evaluate the efficacy and safety of treating healthcare professionals with the adsorbed COVID-19 (inactivated) vaccine manufactured by Sinovac – PROFISCOV: A structured summary of a study protocol for a randomised controlled trial. Trials. 2020;21(1):853. [CrossRef]
- Xia S, Duan K, Zhang Y, et al. Effect of an inactivated vaccine against SARS-CoV-2 on safety and immunogenicity outcomes: interim analysis of 2 randomized clinical trials. JAMA. 2020;324(10):951-60. [CrossRef]
- McNeil MM, DeStefano F. Vaccine-associated hypersensitivity. J Allergy Clin Immunol. 2018;141(2):463-72. [CrossRef]
- Jackson LA, Anderson EJ, Rouphael NG, et al. An m-RNA vaccine against SARS-CoV-2 -preliminary report. N Engl J Med. 2020;383(20):1920-31. [CrossRef]
- Common terminology criteria for adverse events (CTCAE) v5.0 [Internet]. Washington, DC: U.S. Department of Health and Human Services. [erişim 5 Şubat 2022]. https://ctep.cancer.gov/protocoldevelopment/electronic_applications/docs/ctcae_v5_quick_reference_5x7.pdf
- Tanriover MD, Doğanay HL, Akova M, et al.; CoronaVac Study Group. Efficacy and safety of an inactivated whole-virion SARS-CoV-2 vaccine (CoronaVac): interim results of a double-blind, randomised, placebo-controlled, phase 3 trial in Turkey. Lancet. 2021;398(10296):213-22. [CrossRef]
- Zhu F-C, Li Y-H, Guan X-H, et al. Safety, tolerability, and immunogenicity of a recombinant adenovirus type-5 vectored COVID-19 vaccine: a dose-escalation, open-label, non-randomised, first-in-human trial. Lancet 2020; 395:1845-54. [CrossRef]
- Folegatti PM, Ewer KJ, Aley PK, et al. Safety and immunogenicity of the ChAdOx1 nCoV-19 vaccine against SARS-CoV-2: a preliminary report of a phase 1/2, single-blind, randomised controlled trial. Lancet. 2020;396(10249):467-78. Erratum in: Lancet. 2020;396(10249):466. [CrossRef]