En Çok Okunanlar
Özet
Amaç: Çalışmanın amacı, Mycobacterium abscessus kompleks (MABK) izolatlarının bir nükleik asit çoğaltma yöntemi olan GenoType NTM-DR testi ile alt tür ayrımlarının yapılması, makrolid ve aminoglikozidlere dirençten sorumlu mutasyonların belirlenmesi ve fenotipik olarak CLSI standardı tarafından önerilen antimikrobiyal ajanların in vitro duyarlılıklarının araştırılmasıdır.
Yöntemler: Araştırma kapsamında klinik örneklerden izole edilmiş ve stoklanmış toplam 27 MABK izolat incelendi. İzolatların alt tür ayrımı ile aminoglikozid ve makrolid direncinden sorumlu mutasyonlar GenoType NTM-DR testi ile belirlendi ve çeşitli antimikrobiyal ajanlara direnç fenotipleri Sensititre™ RAPMYCOI AST mikrodilüsyon testi ile araştırıldı.
Bulgular: Test edilen 27 izolatın 21’i M. abscessus subsp. abscessus, üçü M. abscessus subsp. bolletii ve üçü M. abscessus subsp. massiliense olarak tanımlandı. İzolatların hiçbirinde moleküler olarak aminoglikozid (rrs mutasyonu) veya kazanılmış makrolid (rrl mutasyonu) direnci gözlenmedi. Test edilen bir izolat dışında M. abscessus subsp. abscessus izolatlarının tümünde indüklenebilir makrolid direncini tanımlayan erm(41) T28 genotipi izlendi. GenoType NTM-DR ve fenotipik duyarlılık sonuçları arasındaki uyum indüklenebilir makrolid direnci için %81 (k=0.5, p=0.02), kazanılmış makrolid direnci için %89 olarak hesaplandı. M. abscessus kompleks izolatlarına en etkin antimikrobiyal ajanlar sırası ile amikasin (%100), sefoksitin (%100), imipenem (%85), linezolid (%70) ve tigesiklin (MİK50=0.24 µg/ml) olarak tespit edildi.
Sonuç: GenoType NTM-DR testi, MABK alt türlerinin tespitinde ve moleküler direncin saptanmasında güvenilir olmakla birlikte genotipik ve fenotipik açıdan uyumsuz sonuçlar alınabilir. Bu nedenle moleküler direnç sonuçlarının kültürde üreme olduktan sonra fenotipik yöntemler ile doğrulanması önerilir. M. abscessus kompleks birçok antimikrobiyal ajana dirençli olmakla birlikte amikasin, sefoksitin, imipenem, linezolid ve tigesikline büyük oranda duyarlı bulundu. M. abscessus subsp. abscessus ve M. abscessus subsp. bolletii izolatlarında indüklenebilir makrolid direncinin yüksek oranda bulunması tedavi öncesinde ve kültür negatifliğinin sağlanmadığı hastalarda tedavi sırasında alt tür ayrımının ve duyarlılık testlerinin yapılmasının önemini göstermektedir.
GİRİŞ
Hızlı üreyen mikobakteriler içinde yer alan Mycobacterium abscessus kompleks (MABK), antibiyotiklere en dirençli bakterilerden biri olup neden olduğu infeksiyonların tedavisinde etkili olan antimikrobiyal ajanlar makrolidler ve aminoglikozidlerdir (1,2). Makrolidlere direnç, kazanılmış veya indüklenebilir (intrensek) mekanizmalar ile ortaya çıkabilir (3). Kompleks içinde yer alan M. abscessus subsp. abscessus (M. abscessus) ve M. abscessus subsp. bolletii (M. bolletii) alt türleri erm(41) geni tarafından kodlanan işlevsel bir eritromisin ribozom metiltransferaz enzimi yolu ile indüklenebilir makrolid direncine sahiptir. Bununla birlikte, M. abscessus subsp. massiliense (M. massiliense), erm(41) genindeki kısmi delesyon nedeni ile çalışan erm(41) olmadığı için makrolidlere duyarlıdır (3,4). Makrolid duyarlılığı aynı zamanda erm(41)’in 28. pozisyondaki timin nükleotidi yerine sitozin değişimi (T28C) sonucu M. abscessus ve M. bolletii alt türlerinde de görülebilir. Kazanılmış direnç ise makrolidlerin hedefi olan 23S rRNA’nın peptidil transferaz alanını kodlayan rrl genindeki nokta mutasyonlar ile ortaya çıkar. M. abscessus kompleks’de 16S rRNA’daki mutasyonların ise aminoglikozidlere yüksek düzeyde dirençten sorumlu olduğu bilinmektedir (4). Klinik ve Laboratuvar Standartları Enstitüsü (Clinical and Laboratory Standards Institute – CLSI) etken olarak kabul edilen MABK üyelerinin moleküler olarak alt tür ayrımının yapılmasını ve klaritromisin ve amikasin başta olmak üzere sefoksitin, siprofloksasin, moksifloksasin, imipenem, doksisiklin (veya minosiklin), linezolid ve trimetoprim-sulfametoksazol (SXT)’a in vitro duyarlılıklarının belirlenmesini önermiştir (5,6). Bu çalışmanın amacı, M. abscessus kompleks izolatlarının bir nükleik asit çoğaltma yöntemi olan GenoType NTM-DR testi ile alt tür ayrımlarının yapılması, makrolid ve aminoglikozidlere dirençten sorumlu mutasyonların belirlenmesi ve fenotipik olarak CLSI standardı tarafından önerilen antimikrobiyal ajanların in vitro duyarlılıklarının araştırılmasıdır.
YÖNTEMLER
Araştırma kapsamında Manisa Celal Bayar Üniversitesi ve Ege Üniversitesi Tıp Fakültesi Tüberküloz Laboratuvarları’nda klinik örneklerden izole edilmiş ve stoklanmış toplam 27 MABK izolatı kullanıldı. İzolatların her biri farklı bir hastaya aitti ve 23’ü solunum yolu örneğinden, üçü plevra sıvısından ve biri lenf bezi biyopsi örneğinden izole edilmişti. Kriyobankalarda yağsız süt içinde -20 ºC’de saklanmakta olan stok izolatlardan 100 µl alınarak BACTEC “Mycobacteria Growth Indicator Tube” (MGIT) 960 (Becton Dickinson, ABD) kültür şişelerine aktarıldı ve izolatlar BACTEC MGIT 960 (Becton Dickinson, ABD) kültür sistemi kullanılarak canlandırıldı. Üreme sinyali alınan şişelerden çikolata agar besiyerine (Becton Dickinson, ABD) ekim yapılarak olası kontaminasyon durumu araştırıldı. Kültürler 35ºC’de inkübe edildi ve 24 saatin sonunda incelendi. Kontamine olduğu tespit edilen izolatlar değerlendirme dışında tutuldu.
Çalışma, Manisa Celal Bayar Üniversitesi Sağlık Bilimleri Etik Kurulu tarafından 07 Temmuz 2021 tarih ve 20.478.486 karar numarasıyla onaylamıştır.
Genotype NTM-DR Testi
M. abscessus kompleks izolatlarının moleküler olarak alt tür ayrımı ile makrolid (intrensek/kazanılmış) ve aminoglikozid dirençlerinin saptanması için “line probe assay” teknolojisine dayalı bir nükleik asit çoğaltma yöntemi olan Genotype NTM-DR (Hain Lifescience, Almanya) testi kullanıldı. DNA ekstraksiyonu için MGIT kültür şişesinden 1 ml alınarak 10 000xg hızda 15 dakika santrifüj edildi. Üstteki sıvı atıldıktan sonra çökeltiye 100-300 µl steril distile su eklenerek vortekslendi. Daha sonra tüpler 950C’de 20 dakika inkübe edildi. Ardından ultrasonik banyoda 15 dakika kaldıktan sonra, tüpler tam hızda (10 000xg) 5 dakika döndürüldü. Daha sonra üstteki sıvıdan 5 µl alınarak PCR için kullanıldı. GenoType NTM-DR sürüm 1 testi üretici firmanın önerilerine uygun olarak çalışıldı ve DNA bantları üretici tarafından sağlanan şablon yardımıyla yorumlandı.
Sensititre™ RAPMYCOI AST Mikrodilüsyon Testi
Sensititre™ RAPMYCOI AST (ThermoFisher, İngiltere) mikrodilüsyon testi CLSI standardına (5) uygun olarak ve üretici firmanın çalışma talimatları doğrultusunda çalışıldı. Kit içinde 30 mikroplak bulunmakta idi. Proje kapsamında 27 M. abscessus kompleks izolatı ve pozitif kontrol olarak Staphylococcus aureus ATCC 29213 suşu kullanıldı. Test edilen antimikrobiyal ajanlar; klaritromisin, amikasin, sefoksitin, siprofloksasin, moksifloksasin, imipenem, doksisiklin, minosiklin, linezolid, SXT ve tigesiklin idi.
Steril pamuklu silgeç ile Mueller-Hinton agardaki saf bakteri kolonilerinden birkaç tane alınarak demineralize su içinde fotometrik ölçümle 0.5 McFarland standart bulanıklığında (5×105 CFU/ml) bir süspansiyon hazırlandı. Tüpler 30 saniye vortekslendi ve varsa büyük partiküllerin çökmesi beklendi. Buradan 50 µl süspansiyon 10 ml katyon ayarlı Mueller-Hinton buyyon içine aktarıldı ve tüpün iyice karışması için 8-10 kez çevrildi. Bu süspansiyondan, 96 kuyucuklu mikroplakların her bir kuyucuğuna 100 µl aktarıldı. Mikroplaklar yapışkan kâğıt ile kapatıldı ve 30 0C’de üç gün inkübe edildi. Üreme, bulanıklık veya kuyucuğun dibinde hücre birikintileri şeklinde gözlendi. Pozitif kuyucukta üreme olup olmadığı her gün kontrol edildi ve üreme yeterli ise minimum inhibitör konsantrasyon (MİK) değerleri belirlendi. Üreme zayıf ise dördüncü ve beşinci gün tekrar kontrol edildi. Beşinci günde üreme olmayan kuyucuklar klaritromisin dışındaki ilaçlar için değerlendirmeye alınmadı. İndüklenebilir klaritromisin direncini belirlemek için ilk beş gün içinde klaritromisine duyarlı olan izolatlar (≤2 µg/ml) 14. gün tekrar okundu. İkinci değerlendirmede dirençli (≥8 µg/ml) bulunanlar indüklenebilir dirençli olarak kaydedildi. Trimetoprim-sulfametoksazol için MİK değeri pozitif kontrol kuyucuğuna göre üremeyi %80 inhibe eden konsantrasyon olarak kabul edildi. Her bir izolat için inokulumun uygun bir dilüsyonu çikolata agar ve Mueller-Hinton agara ekilerek saflık kontrolü ve doğru inokulum yoğunluğu kontrol edildi. Kontaminasyon saptanan
mikroplaklar değerlendirme dışında tutuldu.
İstatistiksel Analiz
Verilerin istatistiksel analizinde “Statistical Package for the Social Sciences” (SPSS) versiyon 21.0 programı (IBM Corp., Armonk, NY, ABD) kullanıldı. Grup değişkenleri yüzde ile sunuldu. Gruplar arasındaki sayısal değişkenlerdeki farklılıklar Pearson χ2 testi ile belirlendi. GenoType NTM-DR testi ile antibiyotik duyarlılık testi sonuçları arasındaki uyum kappa değerleri belirlenerek incelendi. Kappa değeri >0.75 ise mükemmel uyum, 0.40-0.75 ise orta-iyi uyum ve <0.40 ise düşük uyum olarak değerlendirildi. İstatistiksel değerlendirme sonucunda p<0.05 değerleri anlamlı düzey olarak kabul edildi.
BULGULAR
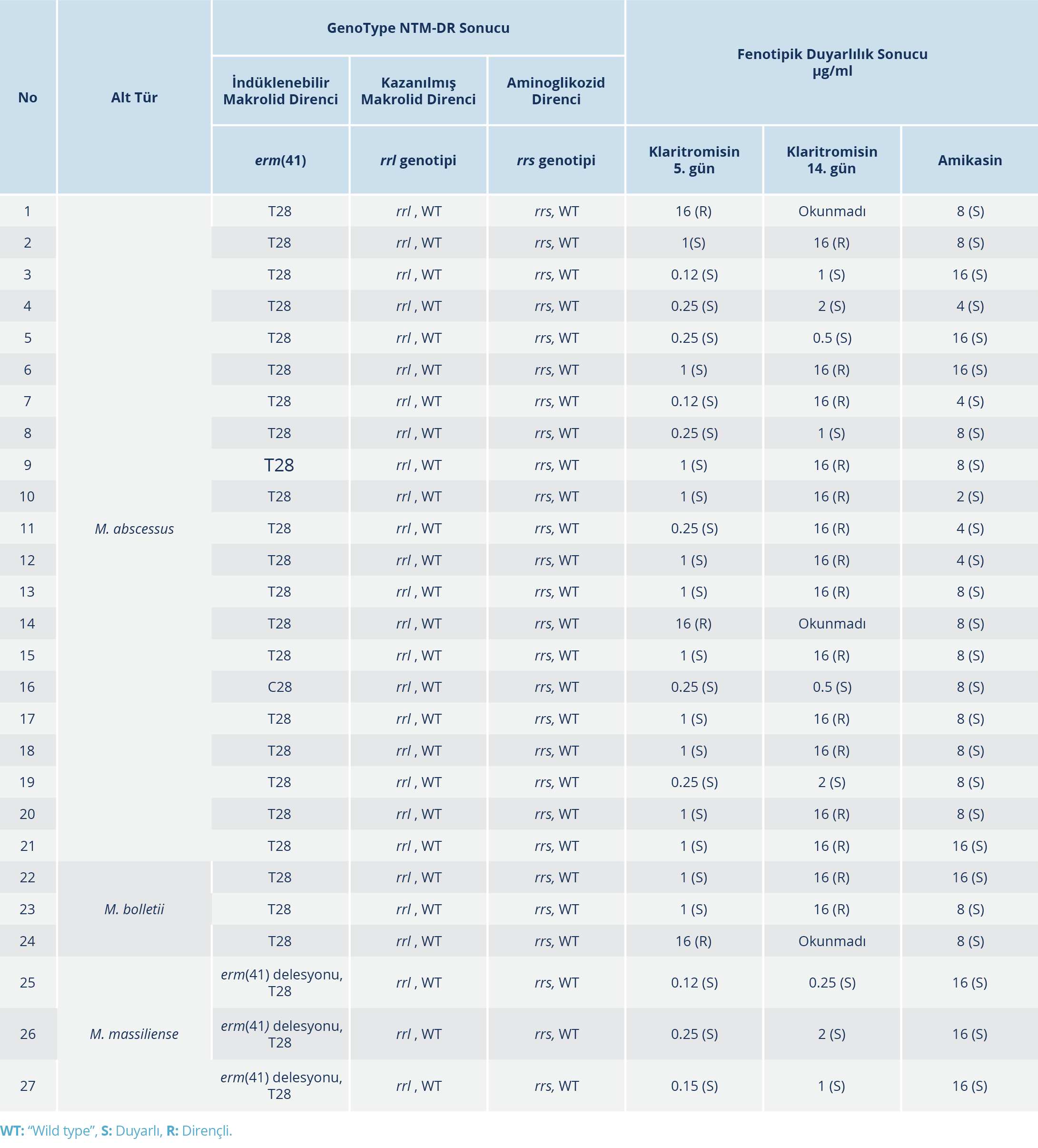
Tablo 1. M. abscessus Kompleks İzolatlarının Klaritromisin ve Amikasin İçin Moleküler ve Fenotipik
Duyarlılık Sonuçları
GenoType NTM-DR testi ile alt tür ayrımı yapılan 27 izolatın alt tür sonuçları ile klaritromisin ve amikasin için moleküler ve fenotipik duyarlılık sonuçları Tablo 1’de verildi. GenoType NTM-DR testi sonuçlarına göre incelenen 27 MABK izolatın 21(%78)’i M. abscessus, 3 (%11)’ü M. bolletii ve 3 (%11)’ü M. massiliense idi. İzolatların hiçbirinde moleküler olarak aminoglikozid direnci (rrs mutasyonu) veya kazanılmış makrolid direnci (rrl mutasyonu) gözlenmedi. Test edilen bir izolat (16 numaralı) dışında M. abscessus izolatlarının tümünde indüklenebilir makrolid direncini tanımlayan erm(41) T28 genotipi izlendi. Moleküler olarak indüklenebilir makrolid direnci olan 20 M. abscessus izolatının beşi (3, 4, 5, 8 ve 19 numaralı) ise fenotipik olarak klaritromisine duyarlı idi. Moleküler olarak izolatların hiçbirinde rrl mutasyonu saptanmamakla birlikte iki M. abscessus (1ve 14 numaralı) ve bir M. bolletii (24 numaralı) izolatı olmak üzere toplam üç izolat inkübasyonun beşinci gününde fenotipik olarak klaritromisine dirençli bulundu (kazanılmış direnç). Test edilen üç M. massiliense izolatında erm(41) delesyonu ve T28 genotipi saptandı ve her üçü de fenotipik olarak klaritromisine duyarlı idi.
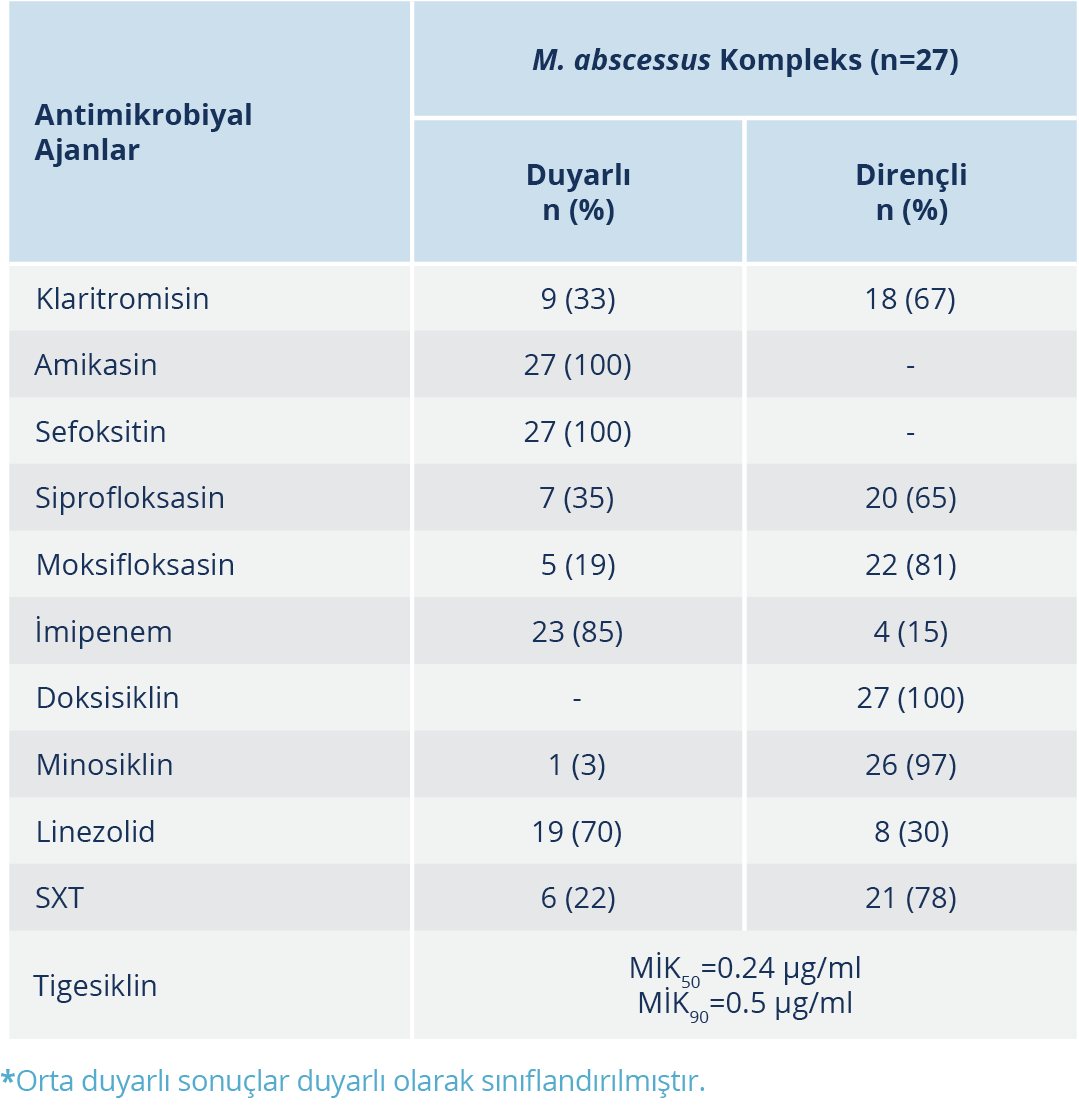
GenoType NTM-DR ve fenotipik duyarlılık sonuçları arasındaki uyum indüklenebilir makrolid direnci için %81 (22/27; k=0.5, p=0.02), kazanılmış makrolid direnci için %89 (24/27) olarak hesaplandı. İzolatların tümü (%100) hem moleküler test ile hem de fenotipik olarak amikasine duyarlı bulundu. İzolatlarda rrl ve rrs mutasyonları saptanmadığından kazanılmış makrolid direnci ve amikasin direnci için uyum analizi yapılamadı. Klinik ve Laboratuvar Standartları Enstitüsü standardı (5) tarafından test edilmesi önerilen diğer antimikrobiyal ajanların fenotipik duyarlılık sonuçları Tablo 2’de verildi.
M. abscessus kompleks izolatlarına karşı en etkin olan antimikrobiyal ajanlar sırası ile amikasin (%100), sefoksitin (%100), imipenem (%85), linezolid (%70), siprofloksasin (%35), klaritromisin (%33), SXT (%22) ve moksifloksasin (%19) olarak tespit edildi. İzolatların tamamı doksisikline dirençli iken sadece bir M. abscessus izolatı (%3) minosikline duyarlı bulundu. İzolatların ikisi sekiz ilaca, 11’i yedi ilaca ve yedisi altı ilaca dirençli olmak üzere 20 (%74)’si CLSI standardı tarafından test edilmesi önerilen antimikrobiyallerin yarısından fazlasına dirençli bulundu. Tigesiklin için MİK eşik değeri olmadığından MİK50 ve MİK90 değerleri verildi (Tablo 2). İzolatların tigesiklin MİK değerleri 0.12 µg/ml (n=3), 0.24 µg/ml (n=15), 0.5 µg/ml (n=8) ve 1 µg/ml (n=1) olarak tespit edildi.
İRDELEME
M. abscessus kompleks, tüberküloz basili gibi patojenlere kıyasla virulansı düşük olmakla birlikte birçok antimikrobiyal ajana dirençlidir ve tedavi edilmesi en zor tüberküloz dışı mikobakteri türüdür. M. abscessus kompleks infeksiyonlarının tedavisinde makrolidler ve amikasin en önemli ajanlardır (7,8). Ancak önceden makrolid ile karşılaşan suşlarda direnç gelişebildiği bildirilmiştir (8-10). Bu nedenle tedaviye karar vermeden önce makrolid direncinin araştırılması önerilmektedir (5,6,11,12). Direncin belirlenmesinde kültüre dayalı testler altın standart olmakla birlikte iş yükleri ve zaman alıcı olmaları nedeni ile uygulanmaları zordur. İndüklenebilir makrolid direnci sonucunu bildirmek için 14 gün beklemek gerekir. Bu nedenle moleküler tanı testleri önem kazanmıştır. Araştırmamızda MABK izolatlarının %85 (23/27)’inde indüklenebilir makrolid direncini tanımlayan işlevsel erm(41) geni saptandı. Bu sonuç hastaların %85’inde tedavi sırasında makrolidlere direnç gelişebileceğini göstermektedir. Bu nedenle hastalarda klinik izlemin yanı sıra aylık kültür takiplerinin yapılması son derece önemlidir. Araştırmamızda incelenen M. massilense izolatlarında erm(41) gen delesyonu nedeni ile indüklenebilir makrolid direnci saptanamadı. M. abscessus kompleks izolatlarında alt tür ayrımının yapılması direnç genotipi hakkında bilgi vermektedir. M. massiliense alt türü makrolidlere duyarlı kabul edilmektedir (11). M. massiliense’nin etken olduğu akciğer infeksiyonlarında klaritromisine klinik yanıtın daha iyi olduğu gösterilmiştir (13).
Araştırmamızda GenoType NTM-DR testi ile kazanılmış makrolid direncini ve aminoglikozid direncini tanımlayan mutasyonlara rastlanmadı. Yapılan çalışmalarda kazanılmış makrolid direncinden sorumlu rrl mutasyonları farklı sıklıkta bildirilmiştir. Sharma ve arkadaşlarının (13) yaptığı bir araştırmada gerçek zamanlı PCR yöntemi ile 126 M. abscessus izolatının %21.4’ünde erm(41) T28C mutasyonu, %1.6’sında ise rrl geninde A2058C mutasyonu belirlenmiştir. Yoshida ve arkadaşlarının (14) yaptığı bir araştırmada ise 145 M. abscessus izolatının %14.3’ünde rrl mutasyonu bildirilmiştir. GenoType NTM-DR testi ile MABK izolatlarında aminoglikozid direncine eşlik eden rrs mutasyonları ise %5 sıklıkta bildirilmiştir (4,15). Araştırmamızda, rrl ve rrs mutasyonlarının saptanmaması değerlendirilen izolat sayısının az olması ile ilişkili olabilir.
GenoType NTM-DR testinin MABK infeksiyonlarının tanısında ve klaritromisin ve amikasin direncinin belirlenmesinde güvenilir ve hızlı sonuç verdiği, sonuçların DNA dizi analizi ve fenotipik test sonuçları ile uyumlu olduğu bildirilmiştir (16-18). Araştırmamızda genotipik ve fenotipik duyarlılık yöntemi arasındaki uyum indüklenebilir klaritromisin direnci için orta-iyi düzeyde bulundu (%81). Kazanılmış klaritromisin direnci için bu oran %89, amikasin direnci için %100 idi. Genotipik ve fenotipik direnç sonuçları arasında uyumsuzluk bildiren çalışmalar vardır (14,19,20). DNA dizi analizi ile incelenen 144 klinik izolatın %9.5’inde işlevsel bir erm(41) geni saptandığı halde, fenotipik olarak klaritromisine duyarlı oldukları, ayrıca kazanılmış klaritromisin direnci saptanan izolatların sadece %14’ünde rrl mutasyonunun saptandığı bildirilmiştir (14). M. abscessus’ta klaritromisin direncinin belirlenmesinde tam gen dizi analizinin performansının değerlendirildiği bir araştırmada ise indüklenebilir direnç için büyük hata oranı (fenotipik duyarlı, dizi analizi ile dirençli) %34 olarak bildirilmiştir (21). Araştırmamızda bu oran %18.5 (5/27) olarak bulundu. Bu izolatlarda işlevsel bir erm(41) genotipi olmakla birlikte 14. günde MİK düzeyleri 8 µg/ml’nin altında idi.
Hastaların tedavi öykülerinin ve klaritromisin tedavisine yanıtlarının bilinmemesi araştırmamızın kısıtlı yönlerinden biridir. Ayrıca fenotipik duyarlılık testi ile incelenen izolat sayısının az olması da her iki yöntem arasındaki uyumsuzluğun yorumlanmasını güçleştirmektedir. Ancak elde edilen sonuçlar makrolid direncinin saptanmasında tarama testi olarak GenoType NTM-DR testinin güvenilir olmakla birlikte, fenotipik duyarlılık testleri ile birlikte uygulanmasının gerekli olduğunu göstermektedir.
Fenotipik duyarlılık testi ile incelenen izolatların tümü amikasin ve sefoksitine duyarlı bulundu. Linezolid ise izolatların %70’inde etkili idi. Linezolid, in vitro duyarlılık testlerinde iyi sonuç vermesi ve oral kullanılabilen bir ajan olması nedeni ile tedavi kombinasyonlarında önerilmektedir (11,20,21). Araştırmamızda tigesiklin MİK değeri de 0.5 µg/ml’nin altında bulundu. CLSI standardı tigesiklin için MİK eşik değeri bildirmemekle birlikte MABK için test edilmesini önermektedir (5). M. abscessus kompleks’e bağlı akciğer infeksiyonu olan 34 hastanın değerlendirildiği çok merkezli retrospektif bir araştırmada suşların %97’sinin MİK değeri 1 µg/ml’nin altında bildirilmiştir (22). Tigesiklinin, klaritromisin, amikasin veya rifabutin ile kombinasyonu ile klinik yanıtın veya in vitro ortamda sinerjik etkinin daha iyi olduğunu bildiren çalışmalar mevcuttur (3,22,23).
Araştırmamızda klaritromisine, kinolonlara, SXT’ye ve tetrasiklinlere duyarlılık %35’in altında idi. Direnç oranları coğrafik bölgelere göre farklılık göstermekle birlikte Çin, Japonya, Tayland, Fransa ve ABD gibi birçok ülkede çalışmamızla benzer direnç oranları bildirilmiştir (19,24,25). Antibiyotik kâbusu olarak da adlandırılan MABK infeksiyonlarının tedavisi kombine antibiyotik tedavisini gerektirmektedir (26). Antibiyotik seçiminde duyarlılık sonuçları önemlidir. Araştırmamızda izolatların %74’ü test edilen ilaçların yarısından fazlasına dirençli idi. Ancak in vitro olarak dirençli bulunan antibiyotiklerin, duyarlı antibiyotikler ile birlikte kullanıldıklarında sinerjik etkileri olabilir ve klinik yanıt alınabilir. Amikasin ve klaritromisinin in vitro duyarlılık test sonuçları klinik yanıt ile uyumludur (11). Ancak diğer antibiyotikler için kültür konversiyonu sağlanamasa da klinik ve radyolojik iyileşme sağlanıyorsa tedavisi sürdürülmelidir.
Sonuç olarak; MABK klinik izolatlarının moleküler tanısının yanı sıra makrolid ve aminoglikozid dirençlerinin saptanmasında GenoType NTM-DR testi hızlı ve güvenilir bir yöntemdir. Ancak kültürde üreme olduktan sonra fenotipik duyarlılık testi ile sonuçların doğrulanması önerilir. M. abscessus subsp. abscessus ve M. abscessus subsp. bolletii izolatlarında indüklenebilir makrolid direncinin yüksek oranda bulunması tedavi öncesi ve kültür konversiyonunun sağlanmadığı hastalarda tedavi sırasında alt tür ayrımının ve duyarlılık testlerinin yapılmasının önemini göstermektedir. Çalışmamızda, M. abscessus kompleks izolatları birçok antimikrobiyal ajana dirençli olmakla birlikte amikasin, sefoksitin, imipenem, linezolid ve tigesikline büyük oranda duyarlı bulundu.
Hasta Onamı
Veriler retrospektif olarak incelendiği için hasta onamı alınmamıştır.
Etik Kurul Kararı
Çalışma için, Manisa Celal Bayar Üniversitesi Sağlık Bilimleri Etik Kurulu tarafından 07 Temmuz 2021 tarih ve 20.478.486 karar numarasıyla onay alınmıştır.
Danışman Değerlendirmesi
Bağımsız dış danışman
Yazar Katkıları
Fikir/Kavram – S.S., N.Ö.; Tasarım – S.S., N.Ö.; Denetleme – S.S.; Kaynak ve Fon Sağlama – S.S., H.G., C.Ç.; Malzemeler/Hastalar – S.S., H.G., C.Ç.; Veri Toplama ve/veya İşleme – S.S., N.Ö.; Analiz ve/veya Yorum – S.S., N.Ö., H.G., C.Ç.; Literatür Taraması – S.S., H.G.; Makale Yazımı – S.S.; Eleştirel İnceleme – S.S., N.Ö., C.Ç.
Çıkar Çatışması
Yazarlar herhangi bir çıkar çatışması bildirmemiştir.
Finansal Destek
Araştırma Manisa Celal Bayar Üniversitesi Bilimsel Araştırma Projeleri Koordinasyon Birimi tarafından 2021-084 proje numarasıyla desteklenmiştir.
Referanslar
- Nessar R, Cambau E, Reyrat JM, Murray A, Gicquel B. Mycobacterium abscessus: a new antibiotic nightmare. J Antimicrob Chemother. 2012;67(4):810-8. [CrossRef]
- Wetzstein N, Kohl TA, Schultze TG, et al. Antimicrobial susceptibility and phylogenetic relations in a German cohort infected with Mycobacterium abscessus. J Clin Microbiol. 2020;58(12):e01813-20. [CrossRef]
- Cheng A, Tsai YT, Chang SY, et al. In vitro synergism of rifabutin with clarithromycin, ımipenem, and tigecycline against the Mycobacterium abscessus complex. Antimicrob Agents Chemother. 2019;63(4):e02234-18. [CrossRef]
- Bouzinbi N, Marcy O, Bertolotti T, et al. Evaluation of the GenoType NTM-DR assay performance for the identification and molecular detection of antibiotic resistance in Mycobacterium abscessus complex. PLoS One. 2020;15(9):e0239146. [CrossRef]
- Susceptibility testing of mycobacteria, Nocardia spp., and other aerobic actinomycetes. 3rd ed, CLSI Standard Document, M24. Wayne PA: Clinical and laboratory Standards Institute; 2018.
- Brown-Elliott BA, Woods GL. Antimycobacterial susceptibility testing of nontuberculous mycobacteria. J Clin Microbiol. 2019;57(10):e00834-19. [CrossRef]
- Ryan K, Byrd TF. Mycobacterium abscessus: Shapeshifter of the mycobacterial world. Front Microbiol. 2018;9:2642. [CrossRef]
- Wu M, Li B, Guo Q, et al. Detection and molecular characterisation of amikacin-resistant Mycobacterium abscessus isolated from patients with pulmonary disease. J Glob Antimicrob Resist. 2019;19:188-91. [CrossRef]
- Martiniano SL, Esther CR, Haworth CS, Kasperbauer SH, Zemanick ET, Caverly LJ. Challenging scenarios in nontuberculous mycobacterial infection in cystic fibrosis. Pediatr Pulmonol. 2020;55(2):521-5. [CrossRef]
- Schildkraut JA, Pennings LJ, Ruth MM, et al. The differential effect of clarithromycin and azithromycin on induction of macrolide resistance in Mycobacterium abscessus. Future Microbiol. 2019;14:749-55. [CrossRef]
- Daley CL, Iaccarino JM, Lange C, et al. Treatment of nontuberculous mycobacterial pulmonary disease: an official ATS/ERS/ESCMID/IDSA clinical practice guideline. Eur Respir J. 2020;56(1):2000535. [CrossRef]
- Richards CJ, Olivier KN. Nontuberculous mycobacteria in cystic fibrosis. Semin Respir Crit Care Med. 2019;40(6):737-50. [CrossRef]
- Sharma MK, La Y, Janella D, Soualhine H. A real-time PCR assay for rapid identification of inducible and acquired clarithromycin resistance in Mycobacterium abscessus. BMC Infect Dis. 2020;20(1):944. [CrossRef]
- Yoshida S, Tsuyuguchi K, Kobayashi T, et al. Discrepancies between the genotypes and phenotypes of clarithromycin-resistant Mycobacterium abscessus complex. Int J Tuberc Lung Dis. 2018;22(4):413-8. [CrossRef]
- Huh HJ, Kim SY, Shim HJ, et al. GenoType NTM-DR performance evaluation for identification of Mycobacterium avium complex and Mycobacterium abscessus and determination of clarithromycin and amikacin resistance. J Clin Microbiol. 2019;57(8):e00516-19. [CrossRef]
- Mougari F, Loiseau J, Veziris N, et al; French National Reference Center for Mycobacteria. Evaluation of the new GenoType NTM-DR kit for the molecular detection of antimicrobial resistance in non-tuberculous mycobacteria. J Antimicrob Chemother. 2017;72(6):1669-77. [CrossRef]
- Huh HJ, Kim SY, Jhun BW, Shin SJ, Koh WJ. Recent advances in molecular diagnostics and understanding mechanisms of drug resistance in nontuberculous mycobacterial diseases. Infect Genet Evol. 2019;72:169-82. [CrossRef]
- Kehrmann J, Kurt N, Rueger K, Bange FC, Buer J. GenoType NTM-DR for identifying Mycobacterium abscessus subspecies and determining molecular resistance. J Clin Microbiol. 2016;54(6):1653-5. [CrossRef]
- Yamaba Y, Takakuwa O, Saito M, et al. Pulmonary Mycobacterium abscessus subspecies abscessus disease that showed a discrepancy between the genotype and phenotype of clarithromycin resistance. Intern Med. 2019;58(18):2675-8. [CrossRef]
- Ananta P, Kham-Ngam I, Chetchotisakd P, et al. Analysis of drug-susceptibility patterns and gene sequences associated with clarithromycin and amikacin resistance in serial Mycobacterium abscessus isolates from clinical specimens from Northeast Thailand. PLoS One. 2018;13(11):e0208053. [CrossRef]
- Lipworth S, Hough N, Leach L, et al. Whole-genome sequencing for predicting clarithromycin resistance in Mycobacterium abscessus. Antimicrob Agents Chemother. 2018;63(1):e01204-18. [CrossRef]
- Yang JH, Wang PH, Pan SW, et al. Treatment outcome in patients with Mycobacterium abscessus complex lung disease: The impact of tigecycline and amikacin. Antibiotics (Basel). 2022;11(5):571. [CrossRef]
- Portell-Buj E, Bonet-Rossinyol Q, López-Gavín A, et al. Comparison of two-drug combinations, amikacin/tigecycline/imipenem and amikacin/tigecycline/clarithromycin against Mycobacteroides abscessus subsp. abscessus using the in vitro time-kill assay. J Antibiot (Tokyo). 2021;74(4):285-90. [CrossRef]
- Guo Y, Cao X, Yu J, et al. Antimicrobial susceptibility of Mycobacterium abscessus complex clinical isolates from a Chinese tertiary hospital. Infect Drug Resist. 2020;13:2001-10. [CrossRef]
- Mougari F, Bouziane F, Crockett F, et al. Selection of resistance to clarithromycin in Mycobacterium abscessus subspecies. Antimicrob Agents Chemother. 2016;61(1):e00943-16. [CrossRef]
- Pasipanodya JG, Ogbonna D, Ferro BE, et al. Systematic review and meta-analyses of the effect of chemotherapy on pulmonary Mycobacterium abscessus outcomes and disease recurrence. Antimicrob Agents Chemother. 2017;61(11):e01206-17. [CrossRef]