En Çok Okunanlar
Özet
Amaç: COVID-19 geçiren hastalarda bir yıl boyunca antikor titrelerini kantitatif olarak takip ederek SARS-CoV-2’ye karşı gelişen antikor titre düzeyine ve antikor pozitifliği süresine etki eden faktörleri değerlendirmeyi amaçladık.
Yöntemler: Hastanemize Mart-Ağustos 2020 tarihleri arasında başvuran ve COVID-19 tanısı alan erişkin kişiler çalışmaya alındı. Hastaların yaş, cinsiyet, vücut kitle indeksi (VKİ), Charlson komorbidite indeksi (CCI) ve klinik ağırlık skorları kaydedildi. Hastalar toplam dört kez değerlendirildi ve antikor titreleri ölçüldü.
Bulgular: Çalışmaya alınan 177 hastanın 94 (%53.1)’ü erkekti ve yaş medyan (IQR) değeri 47 (33.5-55) yıl idi. Yetmiş hastanın (%39.5) en az bir ek hastalığı vardı. Klinik ağırlık derecesine göre hastaların %33.3’ü hafif, %46.9’u orta, %19.8’i ağır olarak sınıflandırıldı. Vizitlerinin yapıldığı medyan gün aralıkları sırasıyla; 56, 92, 193, 371 idi. Antikor pozitiflik oranları sırasıyla %88.7, %80.8, %45.9 ve %21.4 saptandı. Medyan antikor titrelerinin özellikle üçüncü vizitte önemli derecede düştüğü görüldü (p<0.0001). Anti-N IgG titreleri ile hastalığın ağırlık skoru arasında istatistiksel olarak anlamlı düzeyde bir ilişki mevcuttu. Çok değişkenli lojistik regresyon analizinde, hastalığın ağırlık skoru arttıkça birinci ve üçüncü vizitlerde antikor pozitifliği olasılığı yaklaşık üç ila altı kat artmaktaydı. Antikor pozitifliği üzerine etki eden diğer bağımsız değişkenler yaş ve CCI skoruydu.
Sonuç: Çalışmamızda anti-N IgG antikor titresinde, özellikle altıncı aydan sonra anlamlı bir düşüş ve bir yıl içerisinde önemli miktarda negatiflik gözlendi; antikor pozitifliği üzerine etkili en önemli bağımsız faktörler hastalığın ağırlık skoru, yaş ve CCI skoru olarak belirlendi. Ancak, SARS-CoV-2’ye karşı gelişen antikorların kalıcılık süresinin yanı sıra seropozitiflik ile re-infeksiyona karşı koruyucu bağışıklık arasındaki ilişkiyi aydınlatmak ve koruyucu antikor titre düzeylerini belirleyebilmek için daha fazla çalışmaya ihtiyaç vardır.
![]() Bu makaleye ilişkin bir düzeltme 29 Aralık 2024’de yayınlandı.
Bu makaleye ilişkin bir düzeltme 29 Aralık 2024’de yayınlandı.
GİRİŞ
Koronavirus hastalığı 2019 (COVID-19) geçiren kişilerde immünglobulin M (IgM) ve IgG antikor yanıtı oluştuğu bilinmektedir. Yapılan çalışmalarda akut infeksiyondan sonra IgM antikorlarının ortalama 6-12 günde saptanabildiği ve 12 haftaya kadar kalıcı olabildiği gösterilmiştir. IgG antikorları ise infeksiyondan sonra en erken 10. günde saptanabilir düzeye erişirler; bir yıla kadar da pozitif kaldıkları düşünülmektedir. Serokonversiyon oranları ise %91-99 arasındadır (1-4).
Asemptomatik veya hafif COVID-19 hastalarında IgG titresinde iki ila dört ay içerisinde hızlı bir düşüş görülmekle birlikte hastaların çoğunda infeksiyondan 13 ay sonrasına kadar SARS-CoV-2 antikor yanıtı mevcuttur (5-8). Özellikle şiddetli COVID-19 geçiren hastalarda ölçülen antikor titreleri hafif geçiren hastalara kıyasla daha yüksek bulunmuştur (9-12).
Serokonversiyonu değerlendirmek için incelenen primer viral antijenler, spike (S) ve nükleokapsid (N) proteinleridir. N proteini, nükleokapsidi oluşturan ve RNA’ya bağlanma işlevi gören bir proteindir. Virusu hücre içi savunma sistemlerine karşı korur ve viral RNA’nın replikasyonunda görev alır. S proteini tip 1 membran glikoproteinidir; reseptör bağlanma alanını (receptor-binding domain – RBD) içerir ve virus ile hedef hücre membranının füzyonuna aracılık eder (13).
IgG antikor titrelerinin düşüş hızı antijene göre farklılık arz etmektedir. Anti-S seviyeleri, geçirilmiş infeksiyon sonrası en az üç ay stabil kalıp 5-8 ay sonra düşüş gösterirken, anti- RBD ve anti-N antikorları daha hızlı azalır (5,14-16).
Anti-S veya anti-N antikorlarının en az altı ay kalıcı olduğu ve re-infeksiyon riskinin azalmasıyla ilişkili olduğu bildirilmiştir (17). Bu antikorların nötralizan antikor karakterinde olduğunu bildiren yayınlar da mevcuttur (18). Ancak SARS-CoV-2’ye karşı gelişen bu antikor yanıtının kalıcı olup olmayacağı bilinmemektedir. Re-infeksiyona karşı koruma için nötralize edici antikorların sınır seviyeleri henüz açıklığa kavuşturulmamıştır (19).
Çalışmamızda COVID-19 geçiren olgularda IgG antikor yanıtının gelişip gelişmediği incelendi ve antikor yanıtı gelişen hastalarda toplam bir yıl süre ile antikor düzeyleri kantitatif olarak takip edildi. Böylece SARS-CoV-2’ye karşı gelişen antikor yanıtının kalıcı olup olmayacağı, antikor titre düzeyi ve antikor pozitifliği süresinin hangi değişkenlerden etkilendiği sorularına yanıt bulunması amaçlandı.
YÖNTEMLER
11 Mart-11 Ağustos 2020 tarihleri arasında hastanemize başvurmuş ve COVID-19 tanısı almış olgular çalışmaya davet edildi. Dâhil olma kriterleri; 18 yaşından büyük olmak ve T.C. Sağlık Bakanlığı COVID-19 Rehberi’ne göre olası veya kesin COVID-19 tanısı almış olmak idi (20). Dışlama kriterleri ise takip sırasında semptomatik COVID-19 geçirme ve aşılanmaktı. Aşı olan olgular, aşı yanıtını gözlemlemek için ayrıca değerlendirildi.
Çalışmaya katılmayı kabul eden hastaların; SARS-CoV-2 gerçek zamanlı polimeraz zincir reaksiyonu (real-time polymerase chain reaction- RT-PCR) test sonuçları, toraks bilgisayarlı tomografi (BT) bulguları, gebelik ve eşlik eden hipertansiyon (HT), diabetes mellitus (DM), koroner arter hastalığı (KAH), kronik obstrüktif akciğer hastalığı (KOAH) ve kronik böbrek yetmezliği (KBY) gibi kronik hastalıkları kaydedilerek Charlson komorbidite indeksi (CCI) skorları hesaplandı. COVID-19 açısından klinik bulguları ve tedavide kullandıkları ilaçlar (hidroksiklorokin, favipiravir, steroid, tocilizumab) kaydedildi. Hastaların ilk vizitte alınan boy, kilo bilgileri ile vücut kitle indeksi (VKİ) hesaplandı.
Amerikan Ulusal Sağlık Enstitüleri (The National Institutes of Health – NIH)’nin COVID-19 Tedavi Rehberi’ne göre hastaların klinik ağırlık skorları belirlendi (21). Çalışmamızda asemptomatik infeksiyonu olan olgu yoktu; kritik hastalığa sahip olan ise sadece yedi olgu vardı. Kritik hasta grubunun sayıca az olması nedeniyle bu hastalar istatistiksel hesaplamalarda ağır hasta grubu içinde değerlendirildi. Hastalar ağırlık skoruna göre “hafif”, “orta” ve “ağır” şeklinde üç grup olarak sınıflandırıldı. Antikor titre takibi için bir yıllık takip sürecinde dört vizit yapılması planlandı. Vizitler arasında re-infeksiyon açısından hastaların semptomları sorgulandı. Her vizitte, hastalardan SARS-CoV-2 anti-N IgG titresinin ölçülmesi amacıyla kan numunesi alındı. Toplam 584 serum örneği, Amerika Birleşik Devletleri (ABD) Gıda ve İlaç Dairesi (U.S. Food and Drug Administration – FDA) onaylı, kemilüminesans mikropartikül immünoanaliz (chemiluminescent microparticle immunoassay – CMIA) yöntemini kullanan SARS-CoV-2 IgG Quant testi (Abbott Laboratories, ABD) ile üreticinin talimatlarına uygun olarak Abbott Architect i1000sr (Abbott, ABD) cihazında SARS-CoV-2 nükleokapsid proteinine karşı IgG antikorlarını ölçmek için kullanıldı. Testin pozitif eşik değeri, üretici firma tarafından sinyal/eşik değer indeksi (signal/cut-off index – S/C) ≥1.4 olarak belirlenmişti.
Dünya Tabipler Birliği Helsinki Bildirgesi’ne uygun olarak yürütülen çalışma için hastaların onamı ve Bezmialem Vakıf Üniversitesi Tıp Fakültesi İlaç Dışı Klinik Araştırmalar Etik Kurulu’ndan 22 Haziran 2020 tarihinde 7208 karar numarasıyla onay alındı.
İstatistiksel Analizler
Çalışma sonunda vizitlerdeki SARS-CoV-2 anti-N IgG pozitiflik oranları, titreleri ve bunları etkileyen faktörler (demografik özellikler, VKİ, CCI, COVID-19 ağırlık skorları, kullanılan tedaviler, immünsüpresif ilaçlar, vb.) istatistiksel analizlerle incelendi. Verilerin analizi, SPSS (Statistical Package for the Social Sciences) versiyon 26.0 programı (IBM Corp., Armonk, NY, ABD) ile yapıldı. Tanımlayıcı analizlerde kategorik değişkenler için frekans (n) ve yüzde (%), sürekli değişkenler için ortalama ve standart sapma, medyan ve çeyrekler açıklığı (interquartile ranges – IQR) kullanıldı. Gruplar arası karşılaştırmalar, sürekli değişkenler için t-test, Mann-Whitney U, Kruskal-Wallis, Friedman, Wilcoxon testleri ve varyans analizi; kategorik değişkenler için Pearson χ2 ve Fisher kesin testleri kullanılarak yapıldı. “Post hoc” analizlerde Dunn ve Bonferroni kullanıldı. Değişkenler arasındaki korelasyonu değerlendirmek için Spearman korelasyon analizi kullanıldı. Çok değişkenli lojistik regresyon analizleri için “forward LR” metodu kullanıldı. Tüm testler iki yönlüydü ve p<0.05 değerleri istatistiksel olarak anlamlı düzey kabul edildi.
BULGULAR
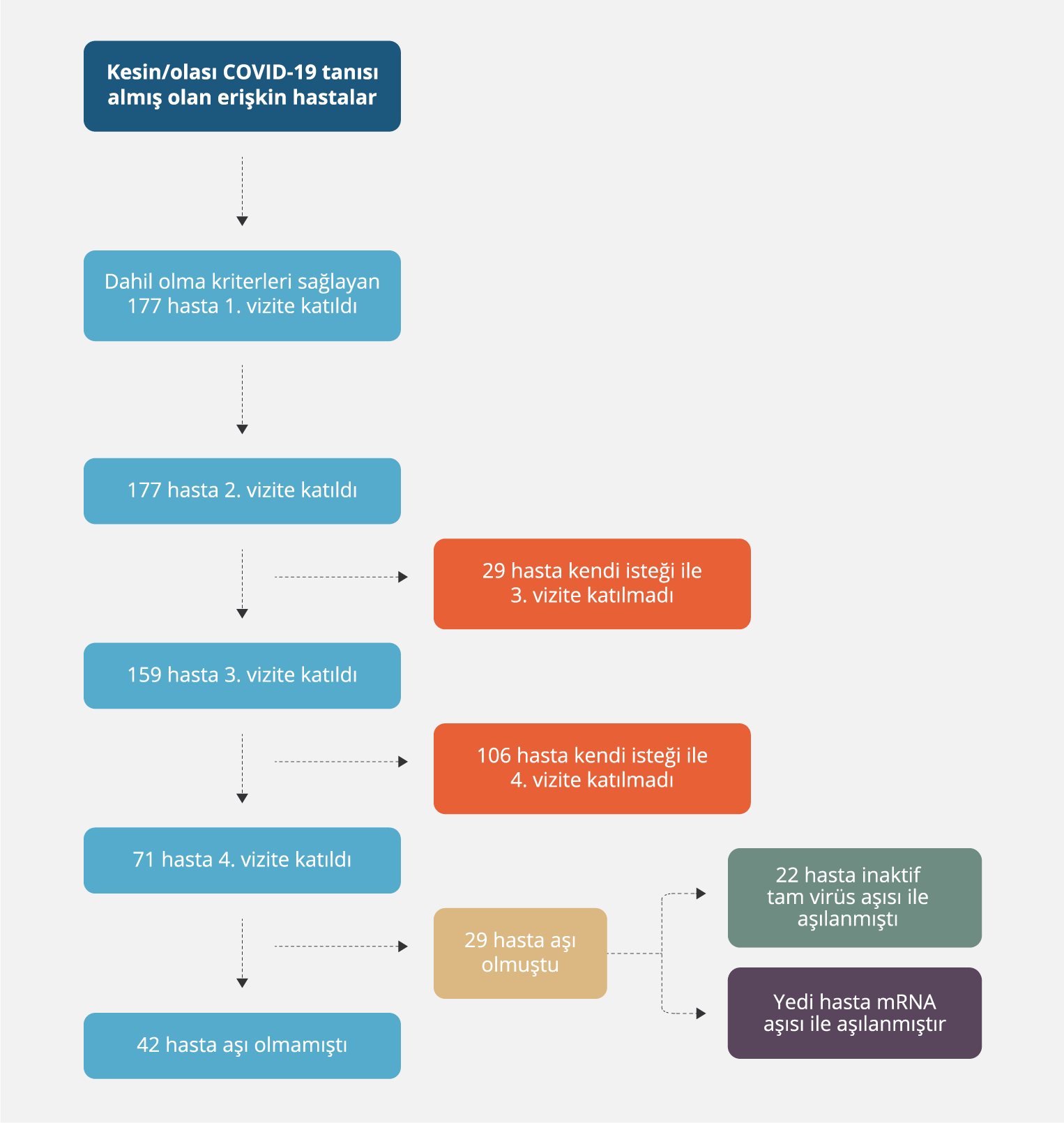
Çalışmaya davet edilen ve onam alınan toplam 177 hasta olup üçüncü vizite katılmayan 29, dördüncü vizite katılmayan 106 hasta vardı. Son vizitte serum örneği alınmış olan 71 hastanın 29 (%40.8)’u SARS-CoV-2’ye karşı aşılanmışlardı; aşı olan hastalar analize alınmadı (Şekil 1). Vizitler arasında semptomatik re-infeksiyona rastlanmadı.
Hastaların 164 (%92.7)’ü PCR pozitifti; bu hastalar kesin COVID-19 hastası olarak değerlendirildi. Kalan 13 olgu olası COVID-19 tanısı almış hastalar olup ilk vizitteki ölçümlerinde antikor yanıtı geliştiği için bu hastalar da kesin COVID-19 olgusu olarak kabul edildiler.
Vizitlerin yapılma zamanı, tanı tarihinden sonra medyan (IQR) gün olarak sırasıyla; birinci vizit 56 (42-64), ikinci vizit 92 (90-96), üçüncü vizit 193 (183-199), dördüncü vizit 371 (366-405) idi. Klinik ağırlık skoruna göre hastaların %33.3’ü hafif, %46.9’u orta, %15.8’i ağır, %4’ü kritik gruptaydı. Kritik hasta grubundaki yedi hasta, sayının az olması nedeniyle istatistiksel hesaplamalarda ağır hasta grubuna dâhil edildi.
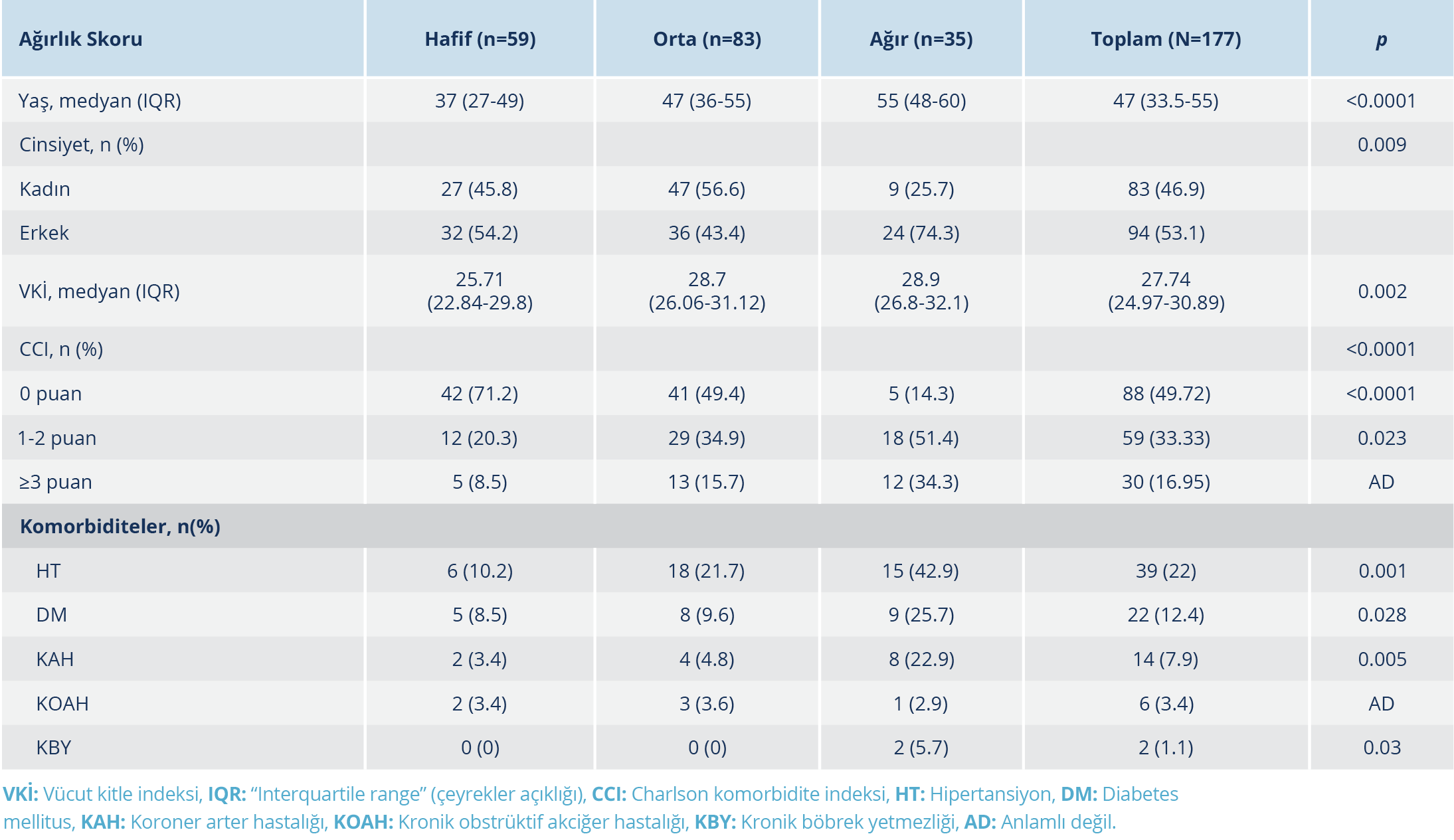
Hastaların demografik özelliklerinin, VKİ ve CCI skorlarının ağırlık skoruna göre dağılımı Tablo 1’de verildi. İkili analizlerde, erkek hastaların kliniği, anlamlı düzeyde daha ağır seyretti (p=0.009). Ağır hastalarda; HT, DM, KAH, KBY daha yüksek oranda saptandı (sırasıyla p=0.001, p=0.028, p=0.005, p=0.03). Klinik ağırlık skoru yüksek olan hastalarda yaş, VKİ ve CCI değeri anlamlı düzeyde daha fazlaydı (sırasıyla p<0.0001, p=0.002, p<0.0001).
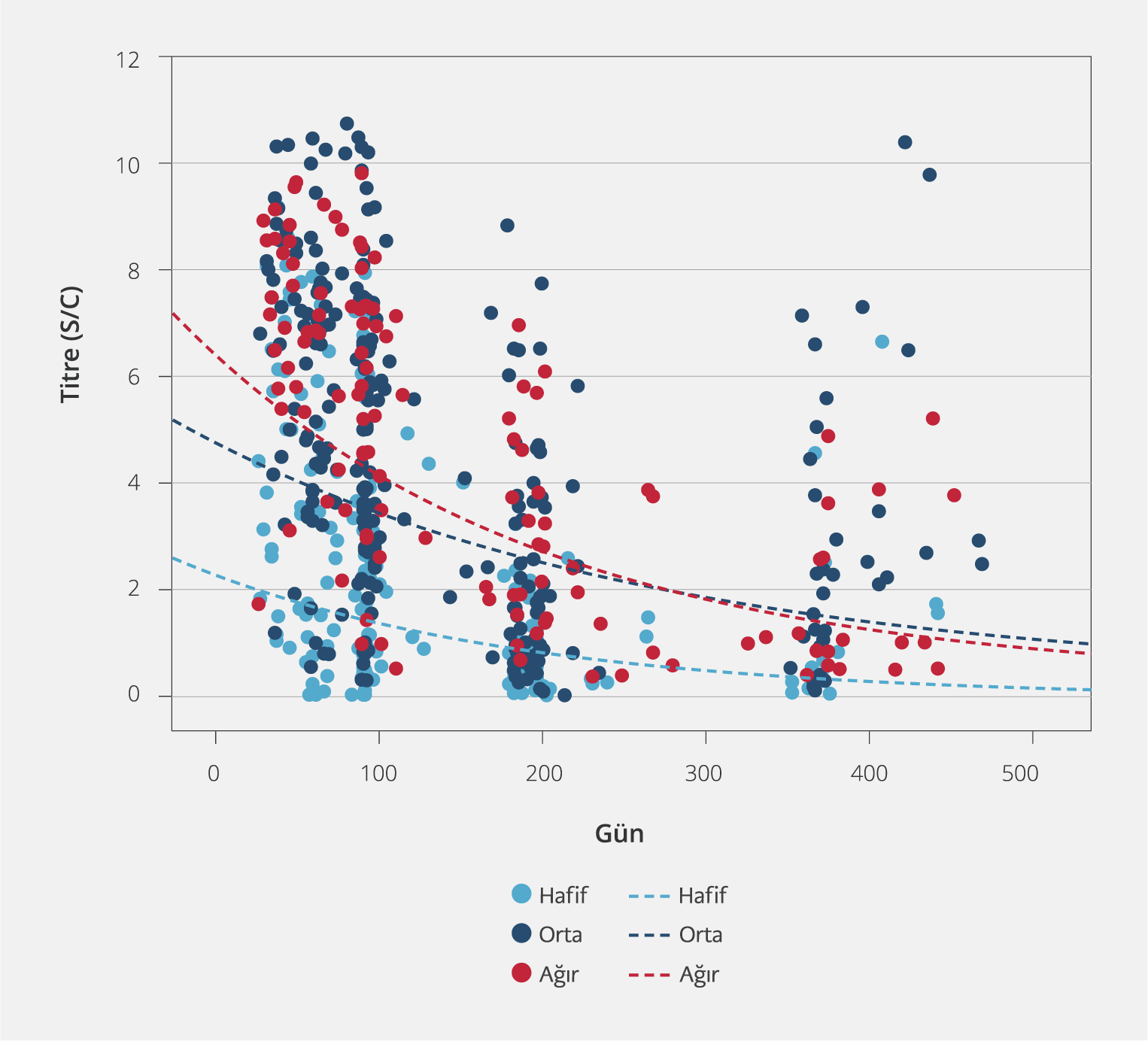
On iki aylık takip süresince, dört vizitte alınan serum örneklerinde ölçülen antikor titrelerinin zaman içerisindeki değişimi değerlendirildi. SARS-CoV-2 anti-N IgG titrelerinin medyan (IQR) gün değerleri birinci vizitte 5.9 (3.45-7.66), ikinci vizitte 3.88 (2.08-6.44), üçüncü vizitte 1.36 (0.58-2.83) ve dördüncü vizitte 0.84 (0.38-1.22) olarak ölçüldü. Antikor titrelerinin hafif, orta ve ağır hasta gruplarında zaman içerisindeki değişimi Şekil 2’de verildi.
Zaman içerisinde medyan antikor seviyesindeki düşüş istatistiksel olarak anlamlı düzeyde bulundu (p<0.0001). “Post hoc” analizde birinci ve ikinci vizit arasında anlamlı düzeyde fark yoktu (p=0.068); bunun dışındaki tüm vizitler arasındaki ikili analizler istatistiksel olarak anlamlıydı (sırasıyla p<0.0001, p<0.0001, p<0.0001, p<0.0001, p=0.003).
Vizitlerde ölçülen medyan SARS-CoV-2 anti-N IgG titreleri, klinik ağırlık skoruna göre karşılaştırıldığında istatistiksel olarak anlamlıydı (sırasıyla p<0.0001, p<0.0001, p<0.0001, p=0.004). “Post hoc” analizde, hafif hasta grubunda antikor titreleri orta ve ağır hasta grubuna göre anlamlı düzeyde daha düşüktü (p<0.0001) (Şekil 2).
Eşik değerin üstünde antikor yanıtı olan hastaların oranı birinci vizitte %88.7 (157/177), ikinci vizitte %80.8 (143/177), üçüncü vizitte %45.9 (73/159) ve dördüncü vizitte %21.4 (9/42) saptandı. Pozitif antikor testi sonucunun; klinik ağırlık skoru, yaş, cinsiyet, VKİ, CCI, hastane yatışı, DM/HT varlığı, steroid/tocilizumab kullanımı ile ilişkisi değerlendirildi.
Spearman korelasyon analizinde; yaş (r=0.346, p<0.0001), CCI skoru (r=0.262, p=0.001) ve HT öyküsü (r=0.306, p<0.0001) birinci vizitte antikor titre değeri ile orta derecede pozitif korelasyon gösterdi. Benzer şekilde hastalığın ağırlık skoru arttıkça birinci vizitteki antikor titresi de artmaktaydı (r =0.400, p<0.0001). Vücut kitle indeksi ile birinci vizitteki antikor titresi arasında zayıf pozitif korelasyon görüldü (r=0.181, p=0.022).
Üçüncü vizitte yaş (r=0.351, p<0.0001), HT öyküsü (r=0.295, p=0.004) ve hastalığın ağırlık skoru (r=0.447, p<0.0001) antikor titresi ile orta derecede pozitif yönde korelasyon gösterdi. Charlson komorbidite indeksi (r=0.192, p=0.02) ve VKİ (r=0.177, p=0.036) değerleri ile üçüncü vizitteki antikor titresi arasında ise zayıf pozitif korelasyon saptandı.
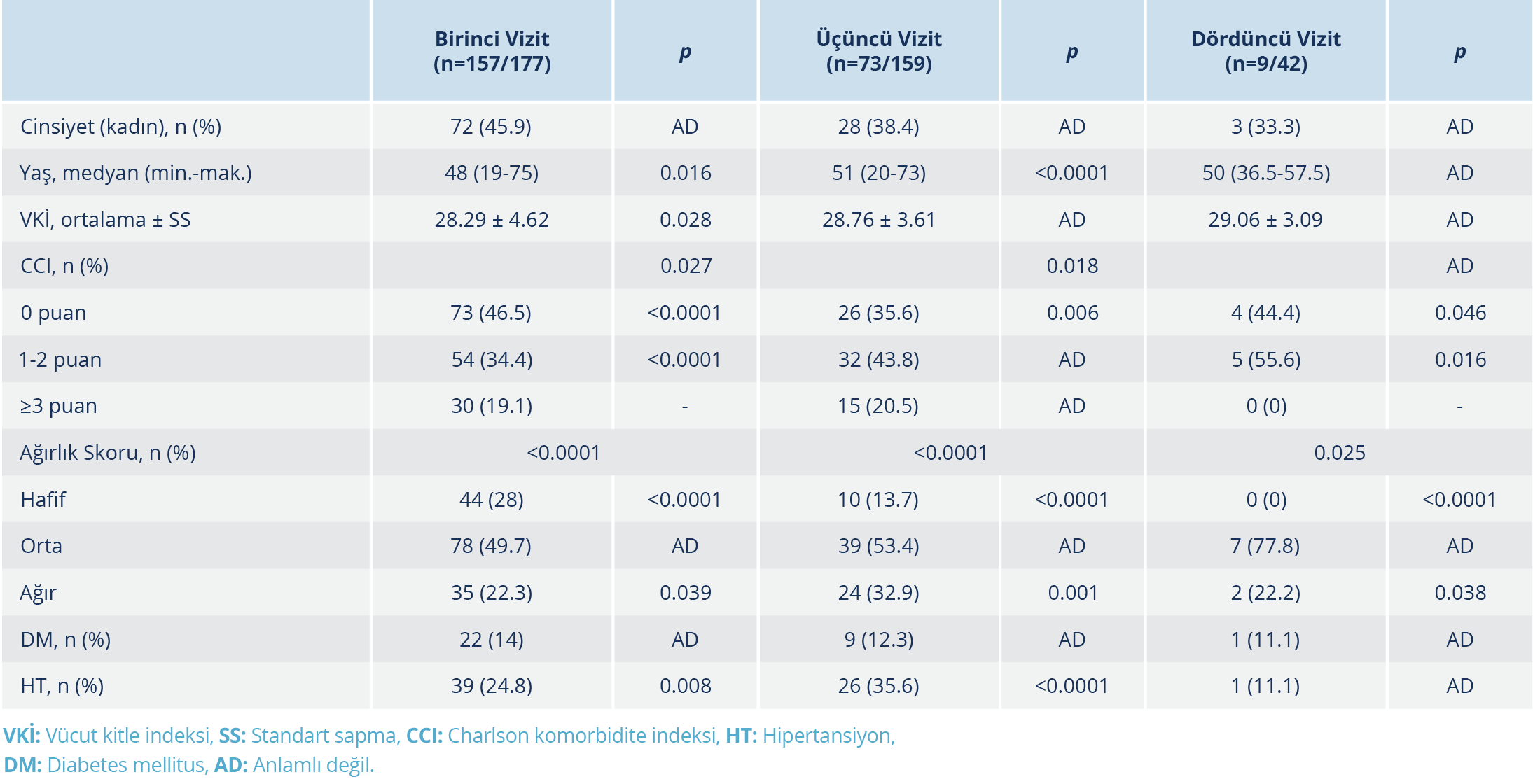
Dördüncü vizitte 177 hastanın 71’inin antikor titre ölçümleri yapıldı ve bunların %40.85 (29/71)’inde aşılama sonrası serum örneği alındı. Dördüncü vizitte aşı olmamış olan hasta grubunda (n=42) tek değişkenli analizler yapıldı. Aşılanmış olan hastalar, daha sonra aşının antikor yanıtı üzerine etkisini görmek amacıyla ayrıca değerlendirildi. Dördüncü vizitte antikor titresi ile pozitif yönde korelasyon gösteren tek parametre hastalığın ağırlık skoru idi (r=0.392, p=0.01). Birinci, üçüncü ve dördüncü vizitlerde antikor testi pozitifliğini etkileyen faktörler Tablo 2’de verildi.
Birinci ve üçüncü vizitte antikor pozitifliği üzerine etkisini değerlendirmek amacıyla yaş, VKİ, CCI, HT ve ağırlık skoru parametrelerinin dâhil edildiği lojistik regresyon modelinde, ağırlık skorunda her bir birim artış, birinci ve üçüncü vizitte antikor testinin pozitif olma oranını sırasıyla 6.453 ve 3.169 katı kadar artırmaktaydı. Charlson komorbidite indeksi skorunda her bir birim artış, üçüncü vizitte antikor testinin pozitif olma oranını 0.537 katı kadar azalttı. Yaşın bir birim artması, üçüncü vizitte antikor testinin pozitif olma oranını 1.078 katı kadar artırmıştı (Tablo 3).
Dördüncü vizite katılmış olan aşılı hastaların 22’sine inaktif tam virus aşısı olan CoronaVac (Sinovac Life Sciences, Çin) ve yedisine mRNA aşısı olan Comirnaty (BioNTech, Almanya-Pfizer, ABD) aşısı uygulanmıştı. Aşının ilk dozundan örnek alımına kadar geçen süre medyan (IQR) olarak 64 (25-84) gün idi; aşı olan grupta antikor titresi üçüncü vizitte 2.57 (1.92-4.31) ve dördüncü vizitte 3.81 (2.51-5.83) gün idi. Aşı olmayan grupta ise antikor titresi üçüncü vizitte 2.30 (1.82-3.97) ve dördüncü vizitte 0.84 (0.38-1.22) gün saptandı. Aşı olanlarda üçüncü ve dördüncü vizitler arasında antikor titrelerindeki artış, aşı olmayanlara kıyasla istatistiksel olarak anlamlı düzeyde bulundu (p=0.002).
Anti-N IgG titresini yükseltmesi beklenen CoronaVac aşısını olan 22 hasta içinde, aşıdan en az dokuz gün ve sonrasında antikor titresi ölçülen 19 hastanın 17’sinde antikor titrelerinde artış olduğu görüldü. Aşı sonrası ilk sekiz günde örnek alınmış olan üç hastada antikor titrelerinde yükselme gözlenmedi; ancak sonraki günlerde tekrar ölçüm yapılmadı. İlginç bir şekilde Comirnaty aşısı olan yedi hastanın üçünde anti-N IgG titrelerinde artış oldu. Çalışmamızda anti-S IgG titresi ölçülmediğinden spike mRNA içeren Comirnaty aşısına karşı antikor yanıtı tam olarak değerlendirilemedi. Bu nedenle iki farklı aşı grubu oluşturdukları antikor yanıtı açısından karşılaştırılamadı.
İRDELEME
Çalışmamızda, COVID-19 geçiren hastalarda bir yıllık süre zarfında antikor düzeylerini takip ederek, SARS-CoV-2’ye karşı gelişen antikor yanıtının seviyesini, kalıcılık süresini ve antikor düzeyine etki eden faktörleri değerlendirmeyi amaçladık. Ayrıca, birinci yıl ölçümlerinde aşı olan ve olmayan iki grubu karşılaştırarak, aşılama sonrası gelişen antikor cevabını değerlendirdik.
Dan ve arkadaşlarının (15) ABD’de yaptığı ve COVID-19 sonrası sekiz ay boyunca antikor yanıtlarını takip ettiği çalışmada, hastaların medyan yaşı 40 olup %57’si kadın ve %90’ı hafif hastalık derecesine sahipti. Gallais ve arkadaşlarının (8) Fransa’da yaptıkları çalışmada ise hasta popülasyonunun medyan yaşı 39, %76.8’i kadın, VKİ medyan (IQR) değeri 23.6 (21.3-26.9) idi. Hastaların %4.1’inin hastaneye yatış gereksinimi olduğu buna karşılık ağır hastalık derecesinde olgu saptanmadığı bildirilmiştir. Ülkemizde 135 hasta ile yapılan çalışmada ise hastaların %42.2’si kadın, yaş ortalamaları 52.5±16.1, VKİ medyan (IQR) değeri 27.7 (24.1-31.2) olup hastalık ağırlık skorlamasına göre yaklaşık %11’i ağır hastalık olarak bildirilmiştir (22). Çalışmamızda da benzer şekilde hastalarımızın medyan yaşı 47 (33.5-55) yıl, %46.9’u kadın ve VKİ medyanı 27.74 (24.97-30.89) idi; %33.3’ü hastalığı hafif, %46.9’u orta, %15.8’i ağır olarak geçirmişti. Çalışmamızın yaş ve VKİ değerleri benzer çalışmalara göre daha yüksek olmakla birlikte ülkemizin demografik verileri ile uyumludur. Ancak orta ve ağır kliniklere sahip hastaların oranı, diğer çalışmalara göre daha yüksek olup bu grup hastalardaki antikor düzeyinin ve antikor seviyesini etkileyen faktörlerin ortaya konulması adına çalışmamızın değerli olduğunu düşünüyoruz.
Literatüre bakıldığında, SARS-CoV-2 infeksiyonundan sonra antikor yanıtlarının takibinde pozitiflik süresi ve antikor titre değerleri değişkenlik arz etmektedir. Çalışmalarda IgG titre ölçümü için farklı antikorlar (anti-N, anti-S) ve farklı test kitleri kullanıldığından sonuçların oldukça farklı olduğu görülmüştür. Fransa’da yapılan bir çalışmada, 393 COVID-19 hastası semptom başlangıç tarihinden bir ay, 3-6 ay, 7-9 ay ve 11-13 ay sonra örnek alınarak takip edilmiş olup ELISA ile ölçülen anti-N IgG pozitifliği oranı birinci ayda %85 iken 11.-13. aylardaki ölçümlerde
%20.1’e gerilediği bildirilmiştir. Söz konusu çalışmada, “lateral flow immunoassay” (LFIA) kullanılarak ölçülen anti-RBD IgG pozitiflik oranı birinci ayda %83.7, 11-13. ayda ise %5.8; “carbonyl metallo immunoassay” (CMIA) kullanılarak ölçülen anti-RBD IgG ise hem birinci ayda hem de 11.-13. aylarda hastaların %97.1’inde pozitif saptanmıştır (8). Dan ve arkadaşlarının (15) 188 hasta ile yaptığı çalışmada, sekiz aya kadar antikor titreleri takip edilmiş ve anti-S IgG seropozitiflik oranı 20.-50. günde %98 (54/55), 6.-8. ayda (≥178 gün) %90 (36/40) olarak bildirilmiştir.
Kayalı ve arkadaşlarının (23), COVID-19 geçiren sağlık çalışanları ile yaptıkları çalışmada, altıncı ayda anti-N IgG seropozitiflik oranı %88.6 saptanmıştır. Çalışmamızda CMIA yöntemi ile anti-N IgG titreleri bir yıl boyunca takip edildi ve antikor pozitiflik oranı birinci vizitte (medyan 56 gün) %88.7, ikinci vizitte (medyan 92 gün) %80.8, üçüncü vizitte (medyan 193 gün) %45.9 ve dördüncü vizitte (medyan 371 gün) %21.4 bulundu. Klinik ağırlık skorundan bağımsız şekilde, özellikle üçüncü vizitte (medyan 193 gün) antikor titrelerinde görülen düşüş, COVID-19 aşılarının hatırlatma dozlarının altı ay sonrasında yapılması için destekleyici bir veri olabilir.
Literatürde COVID-19 hastalarında antikor yanıtlarının ve pozitiflik sürelerinin hastalığın ağırlık skoruyla korele olduğunu gösteren pek çok yayın mevcuttur. Ibarrondo ve arkadaşlarının (5) çalışmasında, 34 COVID-19 hastası, yaklaşık dört ay boyunca anti-S IgG titre takibi ile değerlendirilmiş ve hafif kliniğe sahip hasta grubunda hızlı bir antikor kaybı bildirilmiştir. Tan ve arkadaşlarının (9) 67 COVID-19 hastası ile yaptıkları çalışmada, hastalığın ağırlık skoru arttıkça antikor titresinde de anlamlı düzeyde artış olduğu gösterilmiştir. Röltgen ve arkadaşlarının (24) 254 COVID-19 hastasını, infeksiyon sonrası yaklaşık beş ay kadar takip ettikleri çalışmada, hafif hastalarda daha düşük antikor titreleri ve antikor titrelerinde daha hızlı düşüş gözlenmiştir. Türkiye’de yapılan ve COVID-19 hastalarında antikor yanıtlarının altı ay boyunca takip edildiği çalışmada (25), akciğer tutulumu olan olgularda antikor titreleri anlamlı düzeyde daha yüksek bildirilmiştir. Çalışmamızda 177 hastanın antikor titre değerleri bir yıl boyunca dört kez değerlendirildi. Literatüre benzer olarak, takiplerde ölçülen ortalama antikor titreleri kliniği hafif hastalarda, orta ve ağır hastalara göre anlamlı düzeyde daha düşük saptandı. Antikor titresinin klinik ağırlık skoru ile orta derecede korele olduğu gösterildi. Çok değişkenli analizle değerlendirildiğinde, hastalığın ağırlık skoru arttıkça birinci ve üçüncü vizitlerde antikor pozitifliği oranının yaklaşık üç ila altı kat arttığı gösterildi. Üçüncü vizit ve sonrasında, özellikle hastalığı hafif geçiren hastalarda, anlamlı düzeyde titre düşüşü olduğu görüldü. Çalışmamızda, literatüre benzer şekilde hastalığın ağırlık derecesi daha yüksek antikor titresi ve seropozitiflik oranı ile ilişkili bulundu.
Literatürde antikor pozitifliği üzerine etki eden diğer faktörleri araştıran pek çok çalışma mevcuttur. Daha önce doğrulanmış SARS-CoV-2 infeksiyonu olan 2547 hastada yapılan bir çalışmada, immünsüpresif tedavi alan olgularda seronegatiflik oranı daha fazla iken VKİ’si yüksek, obez hastalarda daha düşük oranda bildirilmiştir (26). Staines ve arkadaşlarının (27) çalışmasında, yaşlılarda, HT öyküsü olanlarda ve VKİ’si yüksek olanlarda serokonversiyon oranı daha yüksek bulunmuştur. Gallais ve arkadaşlarının (8) 393 COVID-19 hastasını 13 aya kadar takip ettiği çalışmada, çok değişkenli analizle; yaş, cinsiyet, VKİ, kan grubu, Rh durumu, hastaneye yatış ve ilk alınan PCR testinin döngü eşik değerinin (cycle threshold – Ct) 3.-6. ay ile 7.-9. ay arasında antikor titresindeki düşüş hızı üzerine etkisi araştırılmıştır. Anti-RBD IgG antikorlarının düşüş hızı erkeklerde ve Rh (-) hastalarda daha yüksek; anti-N IgG antikor düşüş hızı erkeklerde ve yaşlılarda daha yavaş bulunmuştur. Ülkemizde yapılan benzer bir çalışmada, IgG antikor titreleri yaşla pozitif korelasyon göstermiştir (28). Bizim çalışmamızda tek değişkenli analizde; yaş, HT öyküsü, VKİ ve CCI değerleri birinci vizitte antikor pozitifliği üzerine etkili bulundu. Altıncı ayda antikor pozitifliği üzerine etki eden faktörler ise yaş, HT öyküsü ve CCI skorunun yüksek olmasıdır. Birinci ve üçüncü vizitte, yaş antikor pozitifliği ile orta derecede korelasyon göstermişken, CCI skoru birinci vizitte orta, üçüncü vizitte zayıf korelasyon gösterdi. Çok değişkenli analizde; üçüncü vizitte antikor testinin pozitif olma olasılığı, yaşlılarda ve CCI skoru düşük olan hastalarda daha yüksek bulundu. Charlson komorbidite indeksi skorunun hesaplanmasında, 50 yaşın altında olan hastalar sıfır puan alırken, sonraki her 10 yıl için bir puan eklenmektedir. Çalışmamızda hastaların medyan yaşı 47 (33.5-55) yıl idi; 70 yaşın üzerinde yalnızca iki olgu vardı. Bu nedenle CCI skoru, hastalarımızın yaşlarından ziyade komorbiditelerini değerlendirmiş olabilir. Lojistik regresyon analizinde yaş arttıkça antikor pozitifliği artarken; CCI skoru azaldıkça antikor pozitifliğinin artması komorbiditesi fazla olan hastalarda antikor yanıtının daha zayıf olabileceğini düşündürdü. İleri yaşta hastalığın daha ağır geçiriliyor olması daha güçlü antikor yanıtı oluşması ile ilişkili olabilir. Ancak bu durumu açıklamak için daha fazla çalışmaya ihtiyaç vardır. Obez hastalarda ise immün yanıtın daha zayıf olduğu bilinmektedir. Ancak çalışmamızda, özellikle erken dönemde (ilk vizitte), yüksek VKİ değeri antikor pozitifliği ile ilişkili bulundu. Bu durum VKİ’si yüksek hastaların hastalığı daha ağır geçirmesi ve ağır hastalarda antikor pozitifliğinin daha yüksek olması nedeniyle açıklanabilir. Nitekim ilerleyen aylarda VKİ değerinin antikor pozitifliği üzerinde etkisi saptanmadı. Obez hastalarda antikor yanıtının erken dönemde hastalığın ağırlığı ile ilişkili olarak daha yüksek olduğu ancak takip sırasında düştüğü söylenebilir. Özetle, çalışmamızda antikor pozitifliği üzerine etkili en önemli faktör hastalığın ağırlık skoru oldu. Güçlü antikor yanıtını etkileyebilecek diğer faktörler ise ileri yaş, düşük CCI skoru, yüksek VKİ ve HT öyküsü idi. Sonuçlarımız genel olarak literatürle benzer olup cinsiyet ve DM öyküsünün antikor pozitifliği üzerine anlamlı bir etkisi bulunmadı.
Geçirilmiş COVID-19 sonrası antikor seviyelerinin takip edildiği çalışmalarda kullanılan antikor tipi, analiz yöntemi ve test kiti farklılıkları nedeniyle heterojenite oldukça yüksektir. Kullanımda olan antikor testlerinin pozitif eşik değerleri de değişkenlik göstermektedir. Ayrıca bizim çalışmamızda olduğu gibi bu çalışmaların birçoğunda asemptomatik veya semptomatik re-infeksiyonu tespit edebilmek için objektif bir değerlendirme (rutin rt-PCR testi gibi) yapılmamış sadece semptomlara dayalı tarama yapılmıştır. COVID-19 nekahet döneminde anti-N ve anti-S IgG titrelerinin uzun dönem takip edildiği çeşitli çalışmalarda anti-N antikorlarının daha hızlı azaldığı gözlenmiştir (14,15). Bizim çalışmamızda anti-S antikorlarına bakılmadı; bu nedenle antikor yanıtının kalıcılık süresi daha kısa bulunmuş olabilir. Ancak bulgularımız literatürde anti-N antikorlarının değerlendirildiği çalışmaların sonuçları ile benzerdir. İki antikor alt tipinin birlikte ölçülmemiş olması ve re-infeksiyonun objektif bir şekilde değerlendirilmemiş olması çalışmamızın sınırlıklarıdır.
Sonuç olarak; SARS-CoV-2’ye karşı gelişen antikorların kalıcılık süresinin yanı sıra, seropozitiflik ile re-infeksiyona karşı koruyucu bağışıklık arasındaki ilişkiyi aydınlatmak ve koruyucu antikor titre düzeylerini belirleyebilmek için daha fazla çalışmaya ihtiyaç vardır.
Hasta Onamı
Çalışmaya katılan hastalardan onam alınmıştır.
Etik Kurul Kararı
Çalışma, Bezmialem Vakıf Üniversitesi Tıp Fakültesi İlaç Dışı Klinik Araştırmalar Etik Kurulu tarafından 22 Haziran 2020 tarihinde 7208 karar numarasıyla onaylanmıştır.
Danışman Değerlendirmesi
Bağımsız dış danışman.
Yazar Katkıları
Fikir/Kavram – M.M.K.; Tasarım – M.M.K., S.B.; Denetleme – M.M.K., S.B., A.B.U.E.; Kaynak ve Fon Sağlama – M.M.K., A.B.U.E.; Malzemeler/Hastalar – A.B.U.E., B.S.; Veri Toplama ve/veya İşleme – A.B.U.E., S.B., B.S.; Analiz ve/veya Yorum – B.S., S.B., A.B.U.E., M.M.K.; Literatür Taraması – S.B., A.B.U.E.; Makale Yazımı – A.B.U.E., S.B.; Eleştirel İnceleme – S.B., M.M.K.
Çıkar Çatışması
Yazarlar herhangi bir çıkar çatışması bildirmemiştir.
Finansal Destek
Yazar finansal destek beyan etmemiştir.
Bilimsel Etkinlik
Çalışma, 13-16 Mart 2023 tarihinde gerçekleştirilen 23. Uluslararası Türk Klinik Mikrobiyoloji ve İnfeksiyon Hastalıkları Kongresi’nde bildiri olarak sunulmuştur.
Değişiklik Geçmişi
29 Aralık 2024
Bu makaleye ilişkin bir düzeltme yayınlandı:
https://doi.org/10.36519/kd.2024.5190
Referanslar
- Boechat JL, Chora I, Morais A, Delgado L. The immune response to SARS-CoV-2 and COVID-19 immunopathology – Current perspectives. Pulmonology. 2021;27(5):423-37. [CrossRef]
- Wölfel R, Corman VM, Guggemos W, et al. Virological assessment of hospitalized patients with COVID-2019. Nature. 2020;581(7809):465-9. Erratum in: Nature. 2020;588(7839):E35. [CrossRef]
- Okba NMA, Müller MA, Li W, et al. Severe acute respiratory syndrome coronavirus 2-specific antibody responses in coronavirus disease patients. Emerg Infect Dis. 2020;26(7):1478-88. [CrossRef]
- Guo L, Ren L, Yang S, et al. Profiling early humoral response to diagnose novel coronavirus disease (COVID-19). Clin Infect Dis. 2020;71(15):778-85. [CrossRef]
- Ibarrondo FJ, Fulcher JA, Goodman-Meza D, et al. Rapid decay of anti-SARS-CoV-2 antibodies in persons with mild COVID-19. N Engl J Med. 2020;383(11):1085-7. Erratum in: N Engl J Med. 2020;383(11):e74. [CrossRef]
- Long QX, Liu BZ, Deng HJ, et al. Antibody responses to SARS-CoV-2 in patients with COVID-19. Nat Med. 2020;26(6):845-8. [CrossRef]
- Yang C, Jiang M, Wang X, et al. Viral RNA level, serum antibody responses, and transmission risk in recovered COVID-19 patients with recurrent positive SARS-CoV-2 RNA test results: a population-based observational cohort study. Emerg Microbes Infect. 2020;9(1):2368-78. [CrossRef]
- Gallais F, Gantner P, Bruel T, et al. Evolution of antibody responses up to 13 months after SARS-CoV-2 infection and risk of reinfection. EBioMedicine. 2021;71:103561. [CrossRef]
- Tan W, Lu Y, Zhang J, et al. Viral kinetics and antibody responses in patients with COVID-19. medRxiv, 2020.03.24.20042382. [CrossRef]
- Long QX, Tang XJ, Shi QL, et al. Clinical and immunological assessment of asymptomatic SARS-CoV-2 infections. Nat Med. 2020;26(8):1200-4. [CrossRef]
- Zhao J, Yuan Q, Wang H, et al. Antibody responses to SARS-CoV-2 in patients with novel coronavirus disease 2019. Clin Infect Dis. 2020;71(16):2027-34. [CrossRef]
- Ren L, Zhang L, Chang D, et al. The kinetics of humoral response and its relationship with the disease severity in COVID-19. Commun Biol. 2020;3(1):780. [CrossRef]
- Hasöksüz M, Kiliç S, Saraç F. Coronaviruses and SARS-COV-2. Turk J Med Sci. 2020;50(SI-1):549-56. [CrossRef]
- Röltgen K, Boyd SD. Antibody and B cell responses to SARS-CoV-2 infection and vaccination. Cell Host Microbe. 2021;29(7):1063-75. [CrossRef]
- Dan JM, Mateus J, Kato Y, et al. Immunological memory to SARS-CoV-2 assessed for up to 8 months after infection. Science. 2021;371(6529):eabf4063. [CrossRef]
- Wajnberg A, Amanat F, Firpo A, et al. Robust neutralizing antibodies to SARS-CoV-2 infection persist for months. Science. 2020;370(6521):1227-30. [CrossRef]
- Lumley SF, O’Donnell D, Stoesser NE, et al; Oxford University Hospitals Staff Testing Group. Antibody status and incidence of SARS-CoV-2 infection in health care workers. N Engl J Med. 2021;384(6):533-40. [CrossRef]
- Ni L, Ye F, Cheng ML, et al. Detection of SARS-CoV-2-specific humoral and cellular immunity in COVID-19 convalescent individuals. Immunity. 2020;52(6):971-7.e3. [CrossRef]
- Ong DSY, Fragkou PC, Schweitzer VA, Chemaly RF, Moschopoulos CD, Skevaki C; European Society of Clinical Microbiology and Infectious Diseases (ESCMID) Study Group for Respiratory Viruses (ESGREV). How to interpret and use COVID-19 serology and immunology tests. Clin Microbiol Infect. 2021;27(7):981-6. [CrossRef]
- COVID-19 Rehberi: Genel Bilgiler, Epidemiyoloji ve Tanı [Internet]. Ankara: T.C. Sağlık Bakanlığı. [erişim 18 Ekim 2023]. https://covid19.saglik.gov.tr/TR-66301/covid-19-rehberi.html
- Final NIH Coronavirus Disease (COVID-19) Treatment Guidelines (February 29, 2024) [Internet]. Bethesda: US National Institutes of Health (NIH). [erişim 18 Ekim 2023]. https://www.covid19treatmentguidelines.nih.gov/
- Bolukcu S, Ozmen ME, Eksi C, et al. Investigation the relationship between body mass index and mortality in COVID-19 patients. Bezmialem Science. 2021;9(1):9-12. [CrossRef]
- Kayalı GA, Durmaz S, Şahin İN, et al. COVID-19 infection, vaccination, and antibody levels: Investigating correlations through a cohort study. Vaccines (Basel). 2023;11(7):1258. [CrossRef]
- Röltgen K, Powell AE, Wirz OF, et al. Defining the features and duration of antibody responses to SARS-CoV-2 infection associated with disease severity and outcome. Sci Immunol. 2020;5(54):eabe0240. [CrossRef]
- Eray A, Murat K, Abdullah G, et al. Follow-up study of anti-SARS-CoV-2 IgG antibody response in COVID-19 patients up to 6 months after infection. Future Microbiol. 2022;17:1043-9. [CrossRef]
- Petersen LR, Sami S, Vuong N, et al. Lack of antibodies to severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) in a large cohort of previously infected persons. Clin Infect Dis. 2021;73(9):e3066-73. [CrossRef]
- Staines HM, Kirwan DE, Clark DJ, et al. IgG seroconversion and pathophysiology in severe acute respiratory syndrome coronavirus 2 infection. Emerg Infect Dis. 2021;27(1):85-91. [CrossRef]
- Uysal BB, Yavuzer S, Islamoglu MS, Cengiz M. Measurement of antibody levels in patients with COVID-19 over time by immunofluorescence assay: a longitudinal observational study. J Int Med Res. 2022;50(1):3000605211069279. [CrossRef]